Перейти к:
Динамическая обструкция выводного тракта левого желудочка как возможное осложнение кардиомиопатии такоцубо
https://doi.org/10.21886/2712-8156-2021-2-3-94-105
Аннотация
Кардиомиопатия такоцубо — относительно доброкачественное состояние, характеризующееся стресс-индуцированным гипо- и акинезом верхушечных сегментов миокарда на фоне сохранной функции базальных сегментов. При присоединении обструкции выводного тракта левого желудочка за счёт гиперкинеза базальных сегментов состояние и прогноз пациента существенно ухудшаются. Данное состояние по гемодинамическим параметрам сходно с обструкцией выводного тракта левого желудочка у пациентов с гипертрофической кардиомиопатией, однако за счёт быстрого развития способно приводить к формированию острой сердечной недостаточности на фоне синдрома малого выброса и острой митральной недостаточности. В данной статье представлен литературный обзор, содержащий информацию об эпидемиологии, патофизиологии и диагностике данного заболевания, а также клинический случай развития острой сердечной недостаточности с обструкцией выводного тракта левого желудочка у пациентки с синдромом такоцубо.
Ключевые слова
Для цитирования:
Донец Е.К., Намитоков А.М., Кручинова С.В., Космачева Е.Д. Динамическая обструкция выводного тракта левого желудочка как возможное осложнение кардиомиопатии такоцубо. Южно-Российский журнал терапевтической практики. 2021;2(3):94-105. https://doi.org/10.21886/2712-8156-2021-2-3-94-105
For citation:
Donets E.K., Namitokov A.M., Kruchinova S.V., Kosmacheva H.D. Dynamic obstruction of the left ventricular outflow tract as a possible complication of takotsubo cardiomyopathy. South Russian Journal of Therapeutic Practice. 2021;2(3):94-105. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-3-94-105
Введение
Стресс-индуцированная кардиомиопатия (кардиомиопатия такоцубо) — острая транзиторная систолическая дисфункции миокарда левого желудочка c дилатацией и акинезией апикальных и/или средних сегментов сердца (синдром апикального баллонирования), а также гиперкинезией базальных сегментов левого желудочка, развившиеся на фоне эмоционального или физического стресса [1].
Различают два клинических подтипа синдрома такоцубо. При первичном синдроме такоцубо главной причиной обращения за медицинской помощью являются острые кардиальные симптомы (внезапная загрудинная боль сжимающего или давящего характера с иррадиацией в плечо, лопатку, сопровождающаяся тревожностью, повышенной потливостью, головокружением, чувством нехватки воздуха, обмороком).
Пациенты обычно в экстренном порядке госпитализируются в кардиологическое отделение. Наличие сопутствующей патологии в таких случаях может предрасполагать к развитию синдрома такоцубо, но не является основной причиной повышения концентрации катехоламинов в крови.
Вторичный синдром такоцубо возникает у пациентов, госпитализированных по поводу другого медицинского состояния (хирургического, анестезиологического, акушерского или психиатрического). У этих больных внезапная активация симпатической нервной системы или повышение уровня катехоламинов приводят к возникновению острого синдрома такоцубо как осложнения первичного состояния или его лечения [2].
Эпидемиология
В последние годы увеличение числа пациентов, направленных на коронароангиографию (КАГ) с подозрением на инфаркт миокарда, позволило лучше оценить истинную частоту кардиомиопатии такоцубо (КМТ). В настоящее время распространённость КМТ составляет около 1 – 3% от общего числа пациентов и 5 – 6% среди женщин, которые госпитализируются с подозрением на острый коронарный синдром (ОКС) [3][4].
Международный регистр такоцубо (www.takotsubo-registry.com) был основан Университетской клиникой Цюриха при сотрудничестве с 25 сердечно-сосудистыми центрами в девяти странах, таких как Австрия, Финляндия, Франция, Германия, Италия, Польша, Швейцария, Великобритания и США. На основании диагностических критерий Мейо в период с 1998 – 2014 гг. в регистр было включено 1750 пациентов, из которых 89,8% были женщины 66 – 67 лет в периоде постменопаузы [5].
Пациенты с диагнозом КМТ, вошедшие в этот регистр в период с 2011 по 2017 гг., стратифицированы по возрасту (молодые пациенты — ≤50 лет, средний возраст — от 51 до 74 лет, пожилые — ≥75 лет). Из 2098 пациентов с КМТ 242 (11,5%) были в возрасте ≤50 лет, 1194 (56,9%) — от 51 до 74 лет и 662 (31,6%) — ≥75 лет. У молодых пациентов кардиогенный шок развивался чаще по сравнению с пациентами средней и пожилой возрастных категорий (15,3%, 9,1% и 8,1% соответственно, p = 0,004), и они имели более высокую внутрибольничную летальность (6,6%, 3,6% и 5,1% соответственно, p = 0,07) [6].
В целом, во всех крупных когортных исследованиях смертность была выше у пациентов мужского пола по сравнению с женщинами (8,4 и 3,6% соответственно, p < 0,0001), что, возможно, отражает более высокую частоту сопутствующих тяжёлых заболеваний и вторичного генеза КМТ (у женщин и мужчин — в 36,6 и 26,8% случаев соответственно, p < 0,0001) [7][2].
На сегодняшний день актуальным остаётся вопрос о распространённости кардиомиопатии такоцубо в период пандемии COVID-19. Коронавирусная инфекция оказала сильное социальное и экономическое влияние на все страны мира, в связи с чем постоянный стресс мог спровоцировать увеличение случаев КМТ. Ретроспективное когортное исследование выполнялось по данным катетеризационных лабораторий двух госпиталей Кливлендской клиники. В исследование включено 1914 пациентов с острым коронарным синдромом, среди них 1656 пациентов (средний возраст — 67 лет) госпитализированы в период до пандемии COVID-19 (390 пациентов — в марте-апреле 2018 г., 309 пациентов — в январе-феврале 2019 г., 679 пациентов — в марте-апреле 2019 г., 278 пациентов — в январефеврале 2020 г.) и 258 пациентов (средний возраст — 67 лет), поступивших в стационар в период пандемии COVID-19 (то есть с марта по апрель 2020 г.).
Все пациенты во время пандемии имели отрицательные результаты теста полимеразной цепной реакции на COVID-19. По результатам исследования наблюдалось значительное увеличение частоты развития стрессовой кардиомиопатии в период COVID-19, в общей сложности зарегистрировано 20 случаев стрессовой кардиомиопатии (доля заболеваемости — 7,8%), по сравнению с периодом до пандемии, когда КМТ диагностирована у 5 – 12 пациентов (1,5 – 1,8%) [8].
Международные диагностические критерии синдрома такоцубо (InterTAK Diagnostic Criteria, Ghadri JR et al. EurHeart J. (2018) [9])
1. Транзиторные признаки дисфункции левого желудочка (дискинезия, гипокинезия или акинезия), проявляющиеся как баллонирование верхушки левого желудочка или нарушение движения стенок (среднежелудочковые, базальные или фокальные). Возможно вовлечение правого желудочка. Возможны все типы нарушений движений стенок одновременно. Региональное нарушение движения стенок обычно выходит за пределы кровоснабжения одной коронарной артерии, реже находится в пределах одной коронарной артерии.
2. Предшествующий физический, эмоциональный или комбинированный триггер (однако это необязательно).
3. Неврологические нарушения (ишемический инсульт/транзиторная ишемическая атака или судороги, субарахноидальное кровоизлияние) и феохромоцитома могут быть триггерами.
4. Вновь развившиеся изменения ЭКГ (депрессия сегмента ST, элевация сегмента ST, инверсия зубца T и удлинение QTc).
5. Уровни кардиоспецифических маркеров (тропонин и креатинкиназа) умеренно повышены; типично существенное повышение уровня мозгового натрийуретического пептида.
6. Обструктивное поражение коронарного русла не исключает синдром такоцубо.
7. Отсутствие признаков инфекционного миокардита (для исключения миокардита необходима магнитно-резонансная томография (МРТ) сердца).
8. Заболевают преимущественно женщины в постменопаузе.
В целом, изменения на электрокардиограмме у пациентов с синдромом такоцубо аналогичны характерным для лиц с ОКС, напоминая «динамику» инфаркта миокарда.
Согласно регистру InterTAK, элевация сегмента ST была выявлена у 44% лиц с подтвержденным синдромом такоцубо, депрессия сегмента ST — у 8%, инверсия зубца T — у 41%, блокада левой ножки пучка Гиса — у 5% пациентов.
Пациентам с элевацией сегмента ST необходимо выполнить экстренную коронарографию с левой вентрикулографией, чтобы исключить острый инфаркт миокарда. Для пациентов с ОКС без подъёма сегмента ST можно рассмотреть диагностическую шкалу InterTAK .
При расчёте InterTAKScore ≤70 баллов указывает на низкую или промежуточную вероятность синдрома такоуцбо, InterTAKScore ≥70 баллов — это высокая вероятность наличия кардиомиопатии такоцубо.
Пациентам с низкой вероятностью следует рассмотреть возможность проведения КАГ с левой вентрикулографией, а пациентам с высоким баллом рекомендовано выполнение трансторакальной эхокардиографии (ЭхоКГ). При отсутствии эффекта циркулярного баллонирования левого желудочка, показано проведение КАГ.
У стабильных пациентов с паттерном кругового баллонирования левого желудочка предпочтительным является проведение компьютерной томографии с ангиографией коронарных артерий с целью исключения ишемической болезни сердца.
Магнитно-резонансная томография сердца — метод, который обладает большей диагностической ценностью по сравнению с ЭхоКГ у пациентов с подозрением на поражение правого желудочка [9,10].
Выполнение ЭхоКГ с использованием цветового и тканевого допплеровского исследования должно быть одним из первых неинвазивных методов, который применяется для подтверждения предполагаемого диагноза КМТ. С помощью трансторакальной ЭхоКГ можно оценить морфологию и функцию левого желудочка, установить анатомический вариант кардиомиопатии, а также выявить такие осложнения, как митральная регургитация, обструкция выносящего тракта левого желудочка, образование тромба, вовлечение правого желудочка и разрыв сердца [2].
Для лиц молодого возраста с сопутствующими неврологическими расстройствами более характерны нетипичные формы синдрома такоцубо. У трети пациентов может присутствовать вовлечение в патологический процесс правого желудочка, что будет являться прогностически более неблагоприятным критерием [11][12].
Таблица 1
Шкала стратификации риска синдрома такоцубо InterTAK
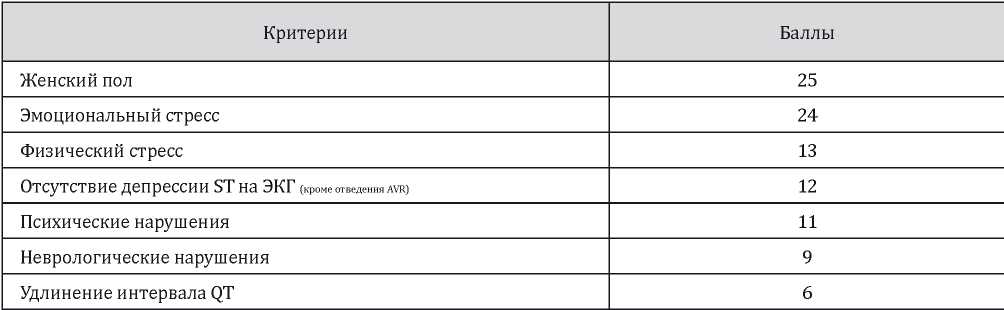
Таблица 2
Анатомические варианты синдрома такоцубо

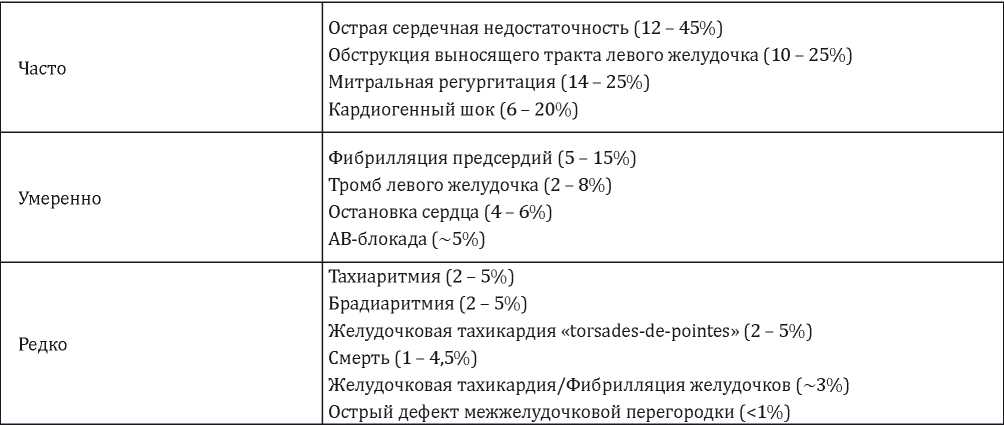
Таблица 3
Внутригоспитальные осложнения (Ghadri JR et al. EurHeart J., 2018 [9])
Патофизиология
В настоящее время нет единого мнения относительно механизмов возникновения кардиомиопатии такоцубо, но есть убедительные доказательства того, что симпатическая стимуляция играет центральную роль в её патогенезе. Прежде всего, это влияние катехоламинов и продуктов их окисления, которые продуцируются в избыточном количестве у определенных групп лиц и оказывают токсическое влияние на миокард [13][9][14]. Катехоламины в концентрации выше физиологической стимулируют β-адренорецепторы кардиомиоцитов, что приводит к активации аденилатциклазы путём стимуляции синтеза Gs-белка. Далее АТФ преобразуется в цАМФ, активируется протеинкиназа, фосфорилирующая кальциевые каналы, что приводит к их открытию. Как следствие, в кардиомиоцитах повышается концентрация Са2+. Вследствие перегрузки кардиомиоцитов ионами Са2+ происходит активация Ca2+-зависимых протеаз и Na+-Ca2+- обменных каналов, приводящих к ускорению окислительных процессов и накоплению активных форм кислорода, что может привести к некрозу кардиомиоцитов и их апоптозу через активацию каспазы и снижению способности клетки к сокращению [15].
Согласно существующей гипотезе, данная патология чаще возникает у женщин в климактерическом периоде, когда в крови значительно понижается уровень эстрогенов. Стресс стимулирует преждевременную экспрессию генов как в центральной нервной системе, так и в миокарде желудочков, что доказано на грызунах. Изменения в миокарде осуществляются за счёт активации α- и β-адренорецепторов. Эстрогены в свою очередь снижают патологическую экспрессию генов, тем самым уменьшая выраженность дисфункции верхушки желудочков у грызунов. Таким образом, эстрогены в ответ на резкий подъем уровня катехоламинов влияют на соотношение β1-β2-адрено-рецепторов, оказывая своё защитное действие за счёт увеличения количества комплексов β2-АР-Gi-белков и активности связанных с ними сигнальных систем. При гормональной дисфункции в постменопаузе этот защитный механизм не срабатывает и токсическое действие надфизиологической концентрации катехоламинов проявляется в области наибольшей плотности β-адренорецепторов ― в апикальном отделе миокарда [16][17].
В последнее время большое внимание ученые уделяют оксидативному стрессу, наличию эндотелиальной дисфункции, спазму коронарных артерий, а также нарушениям микроциркуляторного русла как факторам, способствующим развитию синдрома такоцубо [17][18][19][20][21].
Согласно консенсусу по синдрому такоцубо 2018 г., подтвердились данные о том, что важную роль в этой патологии играет состояние эндотелия. Известно, что тест эндотелийзависимой вазодилатации (ЭЗВД) снижен у пациентов с острым инфарктом миокарда по сравнению со здоровыми людьми, что указывает на снижение выброса NO эндотелием при остром коронарном синдроме с элевацией сегмента ST. При синдроме такоцубо этот показатель становится отрицательным: в ответ на напряжение сдвига происходит не вазодилатация, как в норме, а, напротив, вазоконстрикция. Таким образом, выраженная эндотелиальная дисфункции приводит к снижению коронарного резерва, что в целом и ведет к нарушению сократимости сердца [22].
Также в данном консенсусе обсуждается ещё один патофизиологический механизм — активация путей сохранения жизнеспособности миокарда.
Выраженные нарушения сократительной способности, наблюдаемые при синдроме такоцубо, являются временными. Это позволяет предположить, что таким образом гибернация миокарда может действовать как защитный механизм для сохранения жизнеспособности миокарда. Первый способ связан с адренорецепторами: супрафизиологические уровни адреналина вызывают переключение β2-адренорецептора с Gs на Gi, вызывая тем самым отрицательный инотропный ответ, который ограничивает степень острого повреждения миокарда в ответ на выброс катехоламинов.
Второй механизм представлен временной активацией фосфоинозитид-3-киназы/протеинкиназы B, которые, как было обнаружено, временно активируются во время острой фазы синдрома такоцубо. Эти ферменты имеют решающее значение для постнатального сердечного роста и коронарного ангиогенеза. Кроме того, их нижележащие мишени (особенно механистическая мишень рапамицина (mTOR) и киназы гликогенсинтазы 3 (GSK3)), являются хорошо известными регуляторами метаболизма, пролиферации и выживаемости клеток. Увеличение жизнеспособности клеток достигается с помощью различных механизмов, таких как прямое ингибирование апоптоза и проапоптотических факторов транскрипции, усиление антиапоптотических факторов транскрипции и клеточного метаболизма путём ингибирования GSK3.
Подавление функции миокарда является защитным механизмом, вызванным резким снижением перфузии, что подтверждается несколькими клиническими исследованиями, показывающими «обратное несоответствие перфузии и метаболизма», которое обычно наблюдается во время оглушения миокарда [22][23][24].
Осложнения
Длительное время синдром такоцубо рассматривался как достаточно доброкачественное состояние, однако, когда были получены сведения о высоком риске неблагоприятных осложнений и даже возможности летального исхода у пациентов с синдромом такоцубо, отношение к заболеванию изменилось. Частота развития острой сердечной недостаточности различной степени тяжести, а также летального исхода у лиц с данной нозологией зачастую сопоставимы с таковой у пациентов с острым коронарным синдромом.
В 10 – 20% случаев синдрома такоцубо возможна выраженная гемодинамическая нестабильность [25]. При этом очень важно знать ведущий механизм, так как гипотония может развиваться в остром периоде синдрома такоцубо вследствие систолической дисфункции и динамической обструкции выносящего тракта левого желудочка, вторичной митральной регургитации, а также при сочетании этих факторов [26].
Все рекомендации по ведению больных синдромом такоцубо имеют класс доказательности С и основаны на клиническом опыте врачей и мнении экспертов в связи с тем, что в настоящее время нет рандомизированных клинических исследований пациентов с данной патологией.
Из медикаментозной терапии будет оправдано назначение β-адреноблокаторов (при отсутствии противопоказаний к их назначению), ингибиторов ангиотензинпревращающего фермента или сартанов с целью восстановления функции левого желудочка, диуретиков и нитратов при наличии показаний (развитие острой сердечной недостаточности). В настоящее время открытым остается вопрос назначения антикоагулянтных препаратов. Учитывая высокую вероятность тромбообразования в полости левого желудочка, данная проблема должна решаться индивидуально [27].
У пациентов с систолической дисфункцией левого желудочка возможно использование инотропных средств и внутриаортальной контрпульсации. Напротив, для больных с гемодинамически значимой обструкцией выносящего тракта левого желудочка может быть оправдано дозированное введение жидкости (в отсутствие отека легких) и β-адреноблокаторов для увеличения времени диастолического наполнения левого желудочка и его конечного диастолического объема [28][29].
Клинический случай
В региональный сердечно-сосудистый центр доставлена женщина 73 лет с жалобами на давящие боли за грудиной, иррадиирующие в шею, чувство нехватки воздуха, выраженную слабость, продолжительностью около двух часов.
Из анамнеза известно, что уровень артериального давления (АД) ранее не контролировала, ангинозные боли не беспокоили, физическую нагрузку переносила удовлетворительно, регулярную медикаментозную терапию по поводу сердечно-сосудистых заболеваний не получает.
За несколько дней до госпитализации пациентка перенесла сильный психоэмоциональный стресс. В день поступления отмечает появление дискомфорта за грудиной, сопровождающегося одышкой, выраженной слабостью. На догоспитальном этапе бригадой скорой медицинской помощи на ЭКГ зарегистрированы ишемические изменения нижне-боковой стенки левого желудочка. На момент осмотра АД — 80/40 мм рт.ст., пульс — 74 уд/мин. В экстренном порядке транспортирована в сосудистый центр для проведения коронароангиографии.
Объективный статус: Состояние пациентки тяжёлое. Телосложение — нормостеническое, вес — 72 кг, рост — 172 см. В сознании, контакту доступна. Кожные покровы — бледные, прохладные на ощупь. Тоны сердца приглушены, определяется систолический шум в т.БоткинаЭрба с иррадиацией на сосуды шеи. АД — 96/65 мм рт.ст. В лёгких дыхание ослабленное, единичные влажные хрипы в нижних отделах, ЧДД — 19 в мин. Сатурация на воздухе — 88%, на инсуфляции кислорода — 92%. В условиях приемного отделения введен фуросемид 40 мг внутривенно. Патологии со стороны органов брюшной полости, мочевыделительной системы не выявлено.
Из анамнеза жизни установлено, что пациентка перенесла тиреоидэктомию по поводу рака щитовидной железы, принимает регулярно эутирокс 75 мкг в сутки. Наблюдается у эндокринолога по месту жительства с диагнозом «Послеоперационный гипотиреоз, средней степени тяжести, компенсированный». Наследственный анамнез не отягощён, вредные привычки, другие сопутствующие заболевания отрицает.
На ЭКГ при поступлении — ритм синусовый, ЧСС — 76 в мин., нарушение внутрижелудочковой проводимости, депрессия сегмента ST с инверсией зубца «Т» в отведениях I, II, V4 – V6 (рис.2).
Согласно шкале стратификации риска синдрома такоцубо InterTAK, набрано 49 баллов (психоэмоциональный стресс, женский пол), в связи с чем для оценки состояния коронарного русла в день поступления пациентке была выполнена коронароангиография, по результатам которой данных об атеросклеротическом поражении коронарных артерий не получено (рис. 3.)
При компьютерной томографии органов грудной клетки выявлены признаки интерстициального отека лёгких.
При проведении эхокардиографии установлены признаки баллонирования левого желудочка, в выносящем тракте левого желудочка (ВТЛЖ) регистрируется ускоренный систолический поток с максимальным градиентом давления около 60 – 70 мм рт.ст., регистрируется митрально-септальный контакт в диастолу.
Межжелудочковая перегородка (МЖП) неравномерно утолщена, в базальном сегменте — 14 – 15мм. Конечно-диастоличский размер левого желудочка — 48 мм. Фракция выброса левого желудочка — 47% (рис. 4).
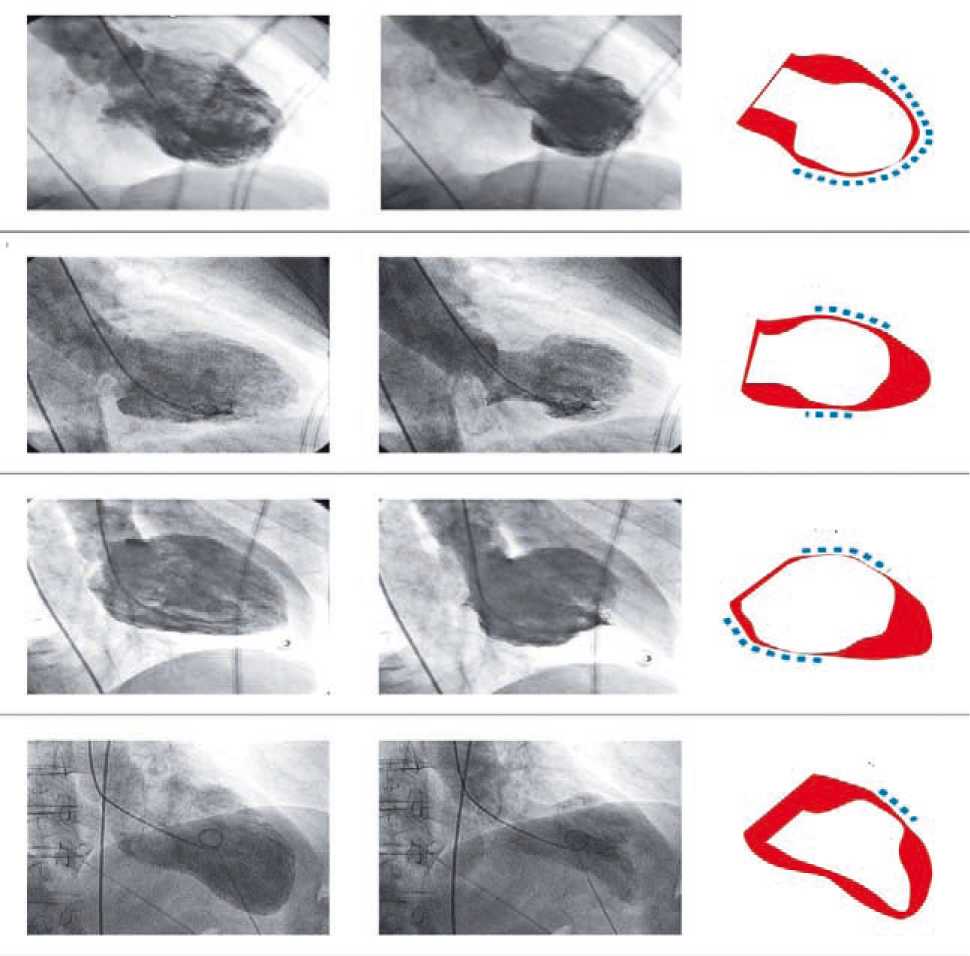
Рисунок 1. Четыре различных типа синдрома такоцубо во время диастолы (левый столбец) и систолы (средний столбец). В правом столбце изображены диастола (красным) и систола (белым). Синими пунктирными линиями обозначена область аномалии движения стенки (переведено из Ghadri JR et al. EurHeart J., 2018).
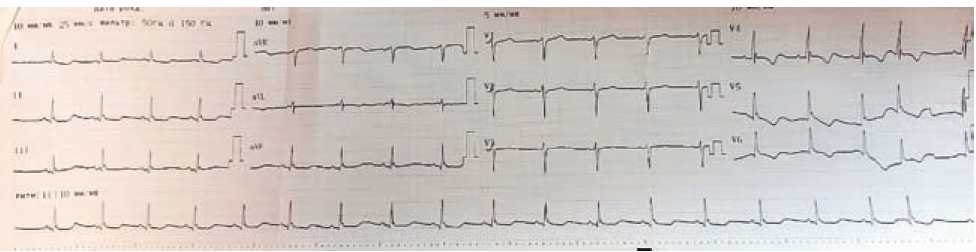
Рисунок 2. Электрокардиограмма при поступлении.
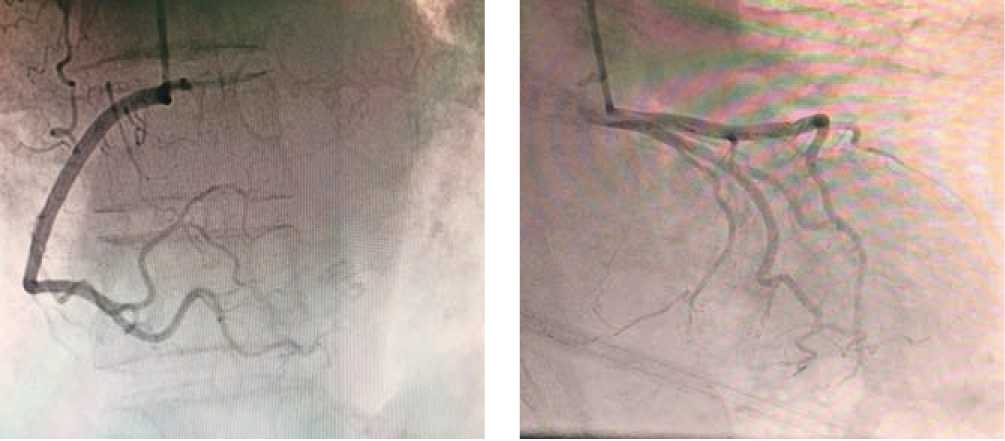
Рисунок 3. Ангиография. Бассейн правой и левой коронарной артерий.
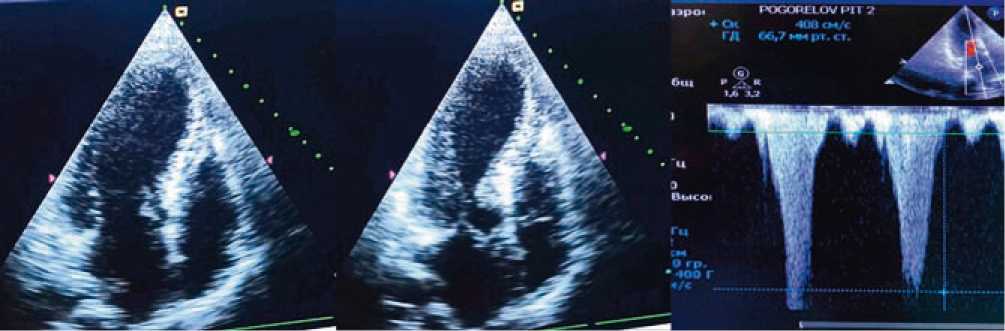
Рисунок 4. ЭхоКГ в первый день госпитализация. Верхушечный доступ, четырехкамерная позиция.
Слева направо изображены диастола и систола левого желудочка, постоянно-волновая доплерография в ВТЛЖ.
Обструкция выносящего тракта левого желудочка является следствием гиперкинезии базальных отделов левого желудочка при классическом апикальном варианте синдрома такоцубо. Предрасполагающими факторами могут быть маленькая полость левого желудочка и сигмовидная межжелудочковая перегородка, которые нередко встречаются у женщин в постменопаузальном периоде. Эхокардиографические признаки повышения внутрижелудочкового градиента давления (≥25 мм рт. ст.) имеют большое клиническое значение для ведения таких пациентов, особенно для больных с острой систолической сердечной недостаточностью [28][29]. Описаны жизнеугрожающие аритмии и фатальные разрывы свободной стенки левого желудочка у больных синдромом такоцубо с динамической обструкцией выносящего тракта левого желудочка [30][31]. Выраженность обструкции варьируется и зависит от условий преднагрузки, нередко обструкция выносящего тракта левого желудочка ассоциирована с передним систолическим движением створок митрального клапана и функциональной митральной регургитацией [26].
В лабораторной диагностике — коагулограмма, биохимический и общий анализы крови без значимых изменений, уровень гормонов щитовидной железы в норме.
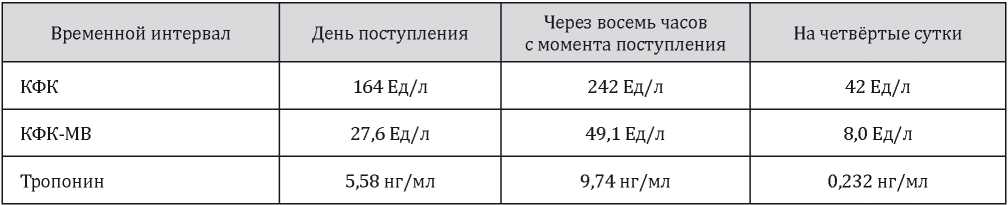
Закономерным является умеренное повышение кардиоспецифических ферментов с полной нормализацией показателей на четвёртые сутки заболевания (табл. 5).
Таблица 5
Учитывая клинику сердечной недостаточности, осложнившейся интерстициальным отеком легких, в течение трёх дней пациентка находилась под наблюдением в палате интенсивной терапии отделения неотложной кардиологии.
На фоне проводимой медикаментозной терапии (инфузия фуросемида с последующим переходом на торасемид (5 мг), спиронолактон (50 мг), бисопролол (1,25 мг), ацетилсалициловая кислота (75 мг), омепразол (20 мг), L-тироксин (75 мкг), эноксапарин (60 мг) два раза в сутки) состояние пациентки имело положительную динамику, явления сердечной недостаточности регрессировали.
При ЭхоКГ на пятые сутки пребывания в стационаре диагностировано восстановление сократимости миокарда ЛЖ. Фракция выброса — 55 – 56%, КДР ЛЖ — 43 мм, небольшой дискинез верхушечных сегментов ЛЖ. Скорость систолического потока в ВТЛЖ — в пределах нормы. МЖП — 14 – 15 мм. Толщина верхушечнобоковой и передне-верхушечной области левого желудочка — 12 мм (рис. 6).
Представлен клинический случай развития стрессовой кардиомиопатии, осложнившейся обструкцией выносящего тракта левого желудочка и сердечной недостаточностью. Диагноз стрессовой кардиомиопатии был установлен в соответствии с международными диагностическими критериями синдрома такоцубо (InterTAK Diagnostic Criteria) на основании сочетания таких признаков, как женский пол, период постменопаузы, преходящие признаки дисфункции ЛЖ, предшествующий эмоциональный триггер, динамические изменения на ЭКГ, умеренное повышение кардиоспецифических ферментов.
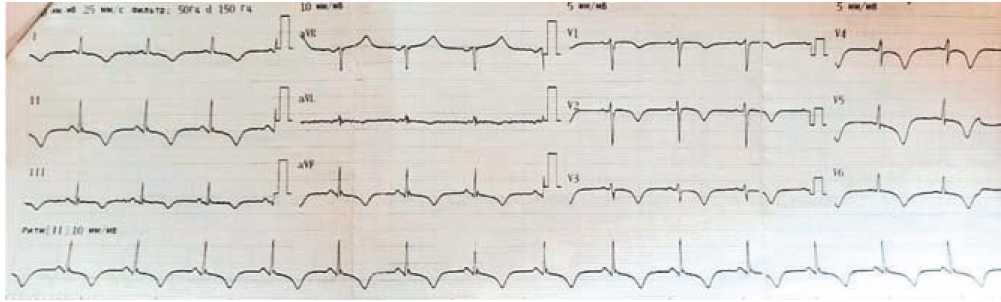
Рисунок 5. ЭКГ на третьи сутки с момента госпитализации. Удлинение интервала QTc (530 мсек).
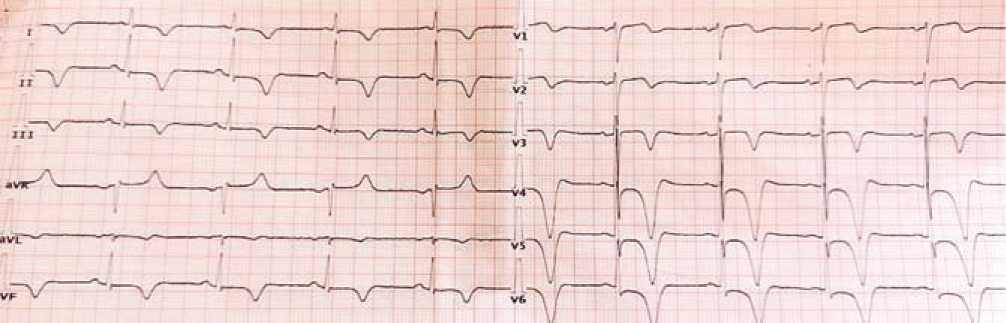
Рисунок 6. ЭКГ при выписке. Несмотря на клиническое улучшение, отмечается отрицательная динамика за счёт инверсии зубцов «Т» V1 – V6, I, II, III, aVF отведениях.
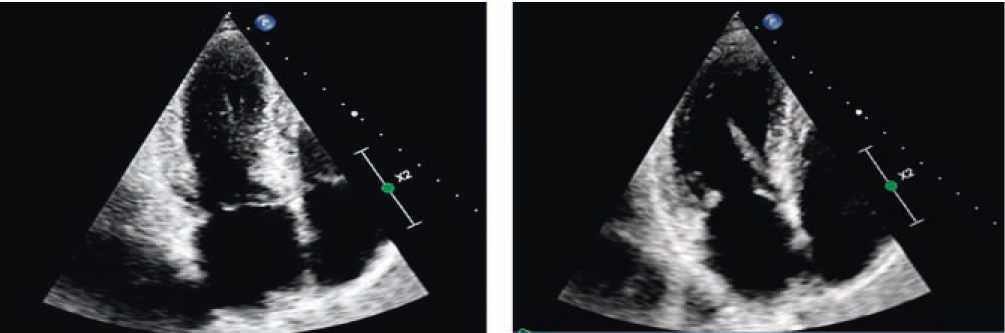
Рисунок 6. УЗИ сердца на пятые сутки от момента госпитализации. Верхушечный доступ, чётырехкамерная позиция. Представлены систола и диастола ЛЖ.
Заключение
На сегодняшний день кардиомиопатия такоцубо представляет довольно сложную проблему в плане диагностики и лечения таких пациентов. Во-первых, это обусловлено разнообразием этиологических факторов и отсутствием достоверной теории патофизиологических механизмов, что в дальнейшем затрудняет проведение патогенетической терапии. Во-вторых, вероятнее всего, редкое выявление данного заболевания в практике обусловлено малой информированностью врачей о возможных клинических и диагностических проявлениях синдрома такоцубо, в связи с чем часть пациентов остается недообследованными.
Несмотря на предполагаемую доброкачественность течения заболевания, не стоит забывать о возможных осложнениях, которые могут быть для пациента фатальными.
Список литературы
1. Sato H., Tateishi H., Uchida T. Takotsubo-type cardiomyopathy due to multivessel spasm, in: K. Kodama, K. Haze, M. Hon (Eds.) Clinical aspect of myocardial injury: from ischemia to heart failure. Kagakuhyouronsha, Tokyo, Japan; 1990.
2. Lyon AR, Bossone E, Schneider B, Sechtem U, Citro R, Underwood SR, et al. Current state of knowledge on Takotsubo syndrome: a Position Statement from the Taskforce on Takotsubo Syndrome of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2016;18(1):8-27. DOI: 10.1002/ejhf.424.
3. Prasad A, Dangas G, Srinivasan M, Yu J, Gersh BJ, Mehran R et al. Incidence and angiographic characteristics of patients with apical ballooning syndrome (takotsubo/stress cardiomyopathy) in the HORIZONS-AMI trial: An analysis from a multicenter, international study of ST-elevation myocardial infarction. Catheterization and Cardiovascular Interventions. 2014;83(3):343–8. DOI: 10.1002/ccd.23441
4. Redfors B, Vedad R, Angerås O, Råmunddal T, Petursson P, Haraldsson I et al. Mortality in takotsubo syndrome is similar to mortality in myocardial infarction — A report from the SWEDEHEART registry. International Journal of Cardiology. 2015;185:282–9. DOI: 10.1016/j.ijcard.2015.03.162
5. Templin C, Ghadri JR, Diekmann J, Napp LC, Bataiosu DR, Jaguszewski M, Cet al. Clinical features and outcomes of Takotsubo (Stress) cardiomyopathy. N Engl J Med. 2015; 373:929–938. doi: 10.1056/NEJMoa1406761.
6. Cammann VL, Szawan KA, Stähli BE, Kato K, Budnik M, Wischnewsky M, et al. Age-Related Variations in Takotsubo Syndrome. J Am Coll Cardiol. 2020;75(16):1869-1877. doi: 10.1016/j.jacc.2020.02.057. PMID: 32327096.
7. Brinjikji W, El-Sayed AM, Salka S. In-hospital mortality among patients with takotsubo cardiomyopathy: a study of the National Inpatient Sample 2008 to 2009. Am Heart J. 2012;164(2):215-21. doi: 10.1016/j.ahj.2012.04.010. PMID: 22877807.
8. Jabri A, Kalra A, Kumar A, Alameh A, Adroja S, Bashir H, et al. Incidence of Stress Cardiomyopathy During the Coronavirus Disease 2019 Pandemic. JAMA Netw Open. 2020;3(7):e2014780. doi: 10.1001/jamanetworkopen.2020.14780. PMID: 32644140; PMCID: PMC7348683.
9. Ghadri J-R, Wittstein IS, Prasad A, Sharkey S, Dote K, Akashi YJ et al. International Expert Consensus Document on Takotsubo Syndrome (Part II): Diagnostic Workup, Outcome, and Management. European Heart Journal. 2018;39(22):2047–62. DOI: 10.1093/ eurheartj/ehy077
10. Suspitsyna IN, Sukmanova IA. [Takotsubo syndrome. Clinical and pathogenetic aspects. Basics of diagnosis and treatment]. Kardiologiia. 2019;60(2):96-103. (In Russ.) doi: 10.18087/cardio.2020.2.n521. PMID: 32345205.
11. Eitel I, von Knobelsdorff-Brenkenhoff F, Bernhardt P, Carbone I, Muellerleile K, Aldrovandi A et al. Clinical Characteristics and Cardiovascular Magnetic Resonance Findings in Stress (Takotsubo) Cardiomyopathy. JAMA. 2011;306(3):277–286. DOI: 10.1001/jama.2011.992
12. Шилова А.С., Шмоткина А. О., Яфарова А. А., Гиляров М.Ю. Синдром такоцубо: современные представления о патогенезе, распространенности и прогнозе. Рациональная Фармакотерапия в Кардиологии. 2018;14(4):598-604]. DOI: 10.20996/1819-6446-2018-14-4598-604…...
13. Suzuki H, Matsumoto Y, Kaneta T, Sugimura K, Takahashi J, Fukumoto Y et al. Evidence for Brain Activation in Patients with Takotsubo Cardiomyopathy. Circulation Journal. 2014;78:256–8. DOI: 10.1253/circj.CJ-13-1276
14. Wittstein IS. Stress Cardiomyopathy: A Syndrome of Catecholamine Mediated Myocardial Stunning? Cellular and Molecular Neurobiology. 2012;32(5):847–57. DOI: 10.1007/s10571-012-9804-8
15. Kassim TA, Clarke DD, Mai VQ, Clyde PW, Mohamed Shakir KM. Catecholamine-induced cardiomyopathy. Endocr Pract. 2008;14(9):1137-49. doi: 10.4158/EP.14.9.1137. PMID: 19158054.
16. Пак Э.В. Стресс-индуцированная кардиомиопатия (синдром такотцубо): учебное пособие для врачей. ― Казань, 2014. ― 31 с.
17. Lyon AR, Rees PS, Prasad S, Poole-Wilson PA, Harding SE. Stress (Takotsubo) cardiomyopathy--a novel pathophysiological hypothesis to explain catecholamine-induced acute myocardial stunning. Nat Clin Pract Cardiovasc Med. 2008;5(1):22-9. doi: 10.1038/ncpcardio1066. PMID: 18094670.
18. Zhang Z, Jin S, Teng X, Duan X, Chen Y, Wu Y. Hydrogen sulfide attenuates cardiac injury in takotsubo cardiomyopathy by alleviating oxidative stress. Nitric Oxide. 2017; 67:10–25. DOI: 10.1016/j.niox.2017.04.010
19. Ghadri JR, Dougoud S, Maier W, Kaufmann PA, Gaemperli O, Prasad A et al. A PET/CT-follow-up imaging study to differentiate takotsubo cardiomyopathy from acute myocardial infarction. The International Journal of Cardiovascular Imaging. 2014;30(1):207–9. DOI: 10.1007/s10554-013-0311-x
20. Galiuto L, De Caterina AR, Porfidia A, Paraggio L, Barchetta S, Locorotondo G et al. Reversible coronary microvascular dysfunction: a common pathogenetic mechanism in Apical Ballooning or Takotsubo Syndrome. European Heart Journal. 2010;31(11):1319–27. DOI: 10.1093/eurheartj/ehq039
21. Алехин М.Н. Синдром такоцубо: значение эхокардиографии. Кардиология. 2017;57(7):80-89. DOI: 10.18087/cardio.2017.7.10009
22. Васильева Е.Ю. Синдром такоцубо – Консенсус 2018. Креативная кардиология. 2018; 12 (4): 301–3. DOI: 10.24022/1997-3187-2018-12-4-301-303
23. Heubach JF, Ravens U, Kaumann AJ. Epinephrine activates both Gs and Gi pathways, but norepinephrine activates only the Gs pathway through human beta2-adrenoceptors overexpressed in mouse heart. Mol Pharmacol. 2004;65(5):1313-22. doi: 10.1124/mol.65.5.1313. PMID: 15102960.
24. El Mahmoud R, Mansencal N, Pilliére R, Leyer F, Abbou N, Michaud P, et al. Prevalence and characteristics of left ventricular outflow tract obstruction in Tako-Tsubo syndrome. Am Heart J. 2008;156(3):543-8. doi: 10.1016/j.ahj.2008.05.002. Epub 2008 Jul 7. PMID: 18760139.
25. Shah B.N., Curzen N.P. Reversible systolic anterior motion of the mitral valve and left ventricular outflow tract obstruction in association with Takotsubo syndrome. Echocardiography. 2011;28 (8):921–924. doi: 10.1111/j.1540–8175.2011.01446.x.
26. Kyuma M, Tsuchihashi K, Shinshi Y, Hase M, Nakata T, Ooiwa H, et al. Effect of intravenous propranolol on left ventricular apical ballooning without coronary artery stenosis (ampulla cardiomyopathy): three cases. Circ J. 2002;66(12):1181-4. doi: 10.1253/circj.66.1181. PMID: 12499630.
27. Ghadri J-R, Wittstein IS, Prasad A, Sharkey S, Dote K, Akashi YJ et al. International Expert Consensus Document on Takotsubo Syndrome (Part I): Clinical Characteristics, Diagnostic Criteria, and Pathophysiology. European Heart Journal. 2018;39(22):2032–46. DOI: 10.1093/eurheartj/ehy076
28. Citro R, Pontone G, Pace L, Zito C, Silverio A, Bossone E, et al. Contemporary Imaging in Takotsubo Syndrome. Heart Fail Clin. 2016;12(4):559-75. doi: 10.1016/j.hfc.2016.06.005. PMID: 27638026.
29. Chockalingam A., Xie G.Y., Dellsperger K.C. Echocardiography in stress cardiomyopathy and acute LVOT obstruction. Int J Cardiovasc Imaging 2010;26 (5):527–535. doi: 10.1007/s10554-010-9590-7
30. Merli E, Sutcliffe S, Gori M, Sutherland GG. Tako-Tsubo cardiomyopathy: new insights into the possible underlying pathophysiology. Eur J Echocardiogr. 2006;7(1):53-61. doi: 10.1016/j.euje.2005.08.003.
31. Parodi G, Bellandi B, Del Pace S, Barchielli A, Zampini L, Velluzzi S, et al. Natural history of tako-tsubo cardiomyopathy. Chest. 2011;139(4):887-892. doi: 10.1378/chest.10-1041.
Об авторах
Е. К. ДонецРоссия
Екатерина Константиновна Донец, кардиолог отделения экстренной кардиологии № 2
Краснодар
А. М. Намитоков
Россия
Алим Муратович Намитоков, к.м.н., заведующий отделением экстренной кардиологии № 2
Краснодар
С. В. Кручинова
Россия
София Владимировна Кручинова, кардиолог кардиологического отделения № 1
Краснодар
Е. Д. Космачева
Россия
Елена Дмитриевна Космачева, д.м.н., проф., заместитель главного врача по медицинской части
Краснодар
Рецензия
Для цитирования:
Донец Е.К., Намитоков А.М., Кручинова С.В., Космачева Е.Д. Динамическая обструкция выводного тракта левого желудочка как возможное осложнение кардиомиопатии такоцубо. Южно-Российский журнал терапевтической практики. 2021;2(3):94-105. https://doi.org/10.21886/2712-8156-2021-2-3-94-105
For citation:
Donets E.K., Namitokov A.M., Kruchinova S.V., Kosmacheva H.D. Dynamic obstruction of the left ventricular outflow tract as a possible complication of takotsubo cardiomyopathy. South Russian Journal of Therapeutic Practice. 2021;2(3):94-105. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-3-94-105


























