Перейти к:
Коморбидность в реальной клинической практике – на приеме больной с подагрой, сердечно-сосудистой патологией и поражением почек
https://doi.org/10.21886/2712-8156-2021-2-3-112-117
Аннотация
В реальной клинической практике всё чаще врачи встречаются с коморбидной патологией. Сочетание широкой распространенности сердечно-сосудистых заболеваний с патологией других внутренних органов диктует необходимость назначения множества препаратов. При полипрагмазии сложно избежать взаимодействия лекарств, местных и системных побочных эффектов, предугадать эффективность терапии, повысить приверженность к лечению. Коморбидный пациент — это всегда определенный вызов для врача, требующий знаний не только в области терапии, но и в узкоспециализированных сферах. В представленном клиническом наблюдении пациент поступил в кардиологическое отделение, однако у него имелась также ревматологическая патология (подагра), поражение почек (в рамках кардиоренального континуума), что потребовало назначения многих препаратов, смены терапии в динамике.
Для цитирования:
Кошелева Н.А., Магдеева Н.А. Коморбидность в реальной клинической практике – на приеме больной с подагрой, сердечно-сосудистой патологией и поражением почек. Южно-Российский журнал терапевтической практики. 2021;2(3):112-117. https://doi.org/10.21886/2712-8156-2021-2-3-112-117
For citation:
Kosheleva N.A., Magdeeva N.A. Comorbidity in real clinical practice - the patient with gout, cardiovascular disease and kidney damage. South Russian Journal of Therapeutic Practice. 2021;2(3):112-117. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-3-112-117
Коморбидность оказывает влияние на прогноз для жизни, увеличивает вероятность летального исхода. Однако большинство проведённых клинических исследований включает пациентов с отдельной патологией, делая коморбидность критерием исключения. Отсутствие единого комплексного научного подхода к оценке коморбидности влечёт за собой пробелы в клинической практике.
Сочетанная патология создает новую клиническую ситуацию, требующую учёта её особенностей при выборе оптимального лекарственного препарата и, самое главное, отсутствия противопоказаний к назначению этого средства со стороны конкурирующего заболевания. Коморбидный пациент представляет собой серьезную проблему для любого клинициста, поскольку в данном случае необходимо учитывать несколько составляющих терапии, что затрудняет контроль эффективности проводимого лечения, способствует увеличению полипрагмазии, вероятности развития местных и системных побочных эффектов лекарственных препаратов, а также снижает приверженность терапии. Лечение коморбидных расстройств диктует необходимость тщательного соблюдения требований рациональной фармакотерапии, высокого клинического профессионализма и широкого круга знаний в области смежных специальностей.
В статье представлено обсуждение клинического случая коморбидного пациента, который потребовал широкого кругозора терапевта в области не только кардиологических аспектов диагностики и лечения, но и нефрологических, ревматологических. Приведены этапы выполненного диагностического поиска с верификацией клинического диагноза и тактика назначенной фармакотерапии. На основании представленных данных показано, что в условиях коморбидности врачу трудно избежать полипрагмазии. В реальной клинической практике всё чаще идет обсуждение кардиоренального и других континуумов.
Как правило, все клинические рекомендации, стандарты оказания медицинской помощи определяют порядок диагностического поиска, назначения оптимальной терапии у пациента с конкретным заболеванием. В реальной клинической практике в условиях стационара мы сталкиваемся с проблемой назначения лечения у пациентов с коморбидностью. Иногда при сочетании заболеваний возникает необходимость назначения противоположных по механизму действия препаратов, а полипрагмазия отражается на состоянии почек. Доктор оказывается в сложной ситуации, когда требуется сохранить баланс между назначением лекарств, оказывающих благоприятный эффект на течение одних болезней и не вызывающих негативных последствий, побочных эффектов по отношению к другим имеющимся состояниям, предотвращением поражения почек.
Представляем Вашему вниманию клиническое наблюдение, в котором сочетанные самостоятельные клинические состояния приобретают характер коморбидных процессов, определяя сложную ситуацию выбора рациональной терапии.
Больной З., 73 года, поступил в отделение кардиологии областной клинической больницы г. Саратова с жалобами на одышку с затрудненным вдохом, доходящую до степени удушья, уменьшающуюся в вертикальном положении (последние сутки перед госпитализацией спал сидя), отёки нижних конечностей, увеличение в объёме живота, головную боль при повышении артериального давления (максимально до 180/100 мм рт. ст.), уменьшение количества отделяемой мочи в последние трое суток до 500 мл. Одновременно пациент испытывал интенсивные боли в первом плюсне-фаланговом суставе левой стопы с его припухлостью, гиперемией, гипертермией, что затрудняло возможность самостоятельного передвижения (рис. 1).
Из анамнеза известно, что в течение многих лет отмечал эпизодическое повышение артериального давления (АД) до 180/100 мм рт. ст. Регулярно антигипертензивные препараты не принимал. С нагрузками справлялся, коронарные боли не возникали. Сахарный диабет диагностирован около 10 лет назад, постоянно принимает метформин 2000 мг/ сутки. Известно, что длительное время страдает тофусной формой подагры с формированием массивных тофусов в кистях, локтевом суставе и рецидивами приступов болей и покраснения суставов, по поводу которых принимал нестероидные противовоспалительные препараты (НПВП), специальной терапии не получал, обследование не проводилось. В течение последних семи лет отмечал появление одышки при физической нагрузке, постепенно толерантность к нагрузкам уменьшалась, периодически появлялись отеки нижних конечностей до средней трети голеней. За медицинской помощью не обращался, периодически принимал мочегонные средства. Настоящее ухудшение в течение последнего месяца, когда на фоне повышения АД до 180 и 100 мм рт. ст. больной отметил постепенно усиливающуюся одышку с затрудненным вдохом, отеки нижних конечностей, увеличение в объеме живота. На амбулаторном этапе самостоятельно принимал мочегонные препараты (фуросемид 2 – 3 таблетки в день, верошпирон). Около трёх дней беспокоит приступ артрита мелких суставов стоп и особенно в первом плюснефаланговом суставе левой стопы с его покраснением и отеком, из-за чего не может ходить. Последние сутки спал сидя. Родственниками доставлен в приемное отделение. Состояние расценено как тяжёлое, пациент госпитализирован в палату интенсивной терапии. На ЭКГ — ритм синусовый 70 в мин., электрическая ось сердца отклонена влево, инверсия Т в V2-5. ИМТ 38,7 кг/м2. Окружность талии — 110,0 см. Положение в постели — с приподнятым изголовьем. Кожные покровы — бледные, чистые, сухие. Отёчность и покраснение первого плюснефалангового сустава слева с нарушением его пассивных и активных движений (рис. 1). Подкожные тофусы в области кистей, локтевых суставов (рис. 2, 3). Отёки до уровня середины бёдер. Число дыханий — 26 в 1 мин. При аускультации дыхание жёсткое, мелкопузырчатые влажные хрипы до угла лопаток в обоих легких. Без инсуфляции кислорода SaO2 — 87%. При аускультации тоны сердца приглушены, ритмичные, акцент II тона на легочной артерии. Живот мягкий, безболезненный при пальпации. Область почек визуально не изменена. Почки не пальпируются. Мочеточниковые точки при пальпации безболезненные. Поколачивание по пояснице безболезненное с обеих сторон. В последние три дня отмечает уменьшение количества отделяемой мочи (около 500 мл в сутки). Определено снижение уровня гемоглобина до 115 г/л, эритроцитов — до 3,8 × 1012/л, повышение уровня аланинаминотрансферазы — до 68 ед/л, аспартатаминотрансферазы — до 48 ед/л, С-реактивного белка — до 156 мг/л, мочевой кислоты — до 521 мкмоль/л. Выявлены гиперкалиемия с повышением уровня калия до 6,06 ммоль/л и увеличение концентрации азотистых шлаков (мочевины — до 31 ммоль/л, креатинина — до 245 мкмоль/л, расчётная скорость клубочковой фильтрации (СКФ) — 22 мл/мин/1,73м2), в общем анализе мочи выявлялась эритроцитурия до 70 – 80 в поле зрения, снижение удельного веса мочи. При проведении эхокардиографии установлено наличие гипертрофии левого желудочка с индексом массы миокарда 111 г/м2, фракция выброса ЛЖ — 55% (при норме свыше 70%), нарушений локальной сократимости не выявлено, систолическое давление в легочной артерии — 80 мм рт. ст., умеренная дилатация предсердий и правого желудочка. Неспецифические дегенеративные изменения стенок аорты (Ао), створок аортального клапана. По данным рентгенографии лёгких имеется увеличение размеров сердца, двусторонний гидроторакс. При ультразвуковом исследовании (УЗИ) органов брюшной полости выявлено увеличение размеров печени, при УЗИ почек размеры их не изменены: правая почка — 119 × 51 мм, толщина паренхимы — 16 мм, левая почка — 114 × 56 мм толщина паренхимы — 16 мм, структура чашечек с обеих сторон однородная, лоханки не расширены, конкрементов нет.
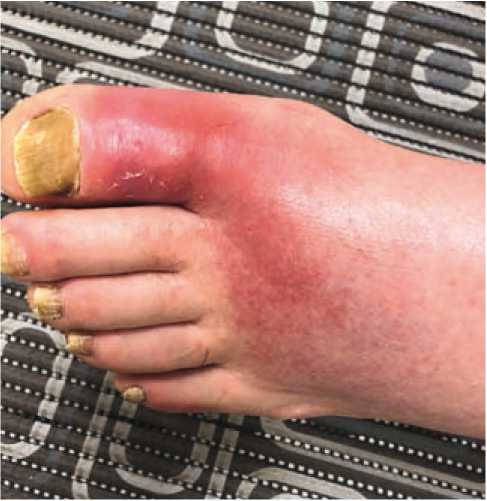
Рисунок 1
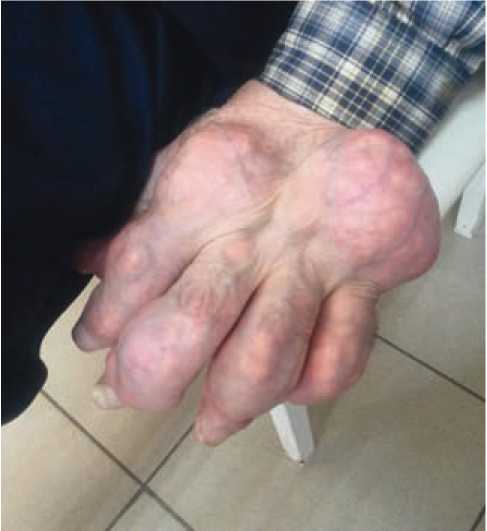
Рисунок 2
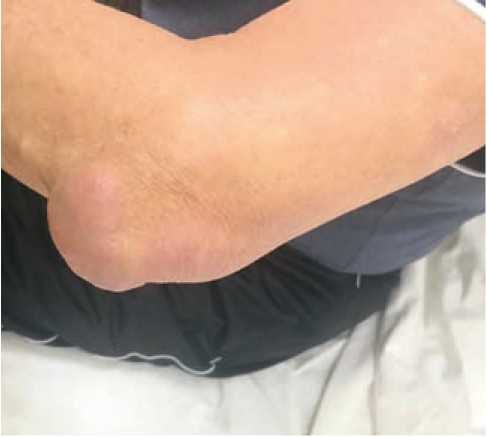
Рисунок 3
С учётом полученных данных установлен клинический диагноз — основное заболевание (Гипертоническая болезнь 3-й стадии, артериальная гипертензия 3-й степени, риск 4. ИБС. Атеросклеротическая болезнь сердца: дегенеративное поражение аорты и клапанов аорты), осложнения основного заболевания (ХСН IIБ ст, ФК 4 по NYHA. Гипертонический криз, осложнённый острой левожелудочковой недостаточностью. Острое повреждение почек AKI I), сопутствующие заболевания (Подагра, тофусная форма, рецидивирующее течение. Подагрический артрит первого плюсне-фалангового сустава левой стопы), фоновое заболевание (Сахарный диабет 2-го типа, целевой уровень гликированного гемоглобина до 7 ммоль/л. Ожирение 2-й степени (ИМТ — 38,7кг/м2).
Учитывая высокие уровни азотемии и калия на фоне снижения темпа диуреза, нарастание их в динамике, начата вспомогательная терапия с протезированием функции почек методом ургентного гемодиализа. Кроме сеансов гемодиализа, проводилась оксигенотерапия, назначались нитраты внутривенно, антиагреганты (Тромбо Асс 100 мг), ИАПФ (Зокардис 30 мг), статины (Роксера 40 мг), пациент переведён на инсулинотерапию. Для купирования проявлений артрита и выраженного болевого синдрома был назначен преднизолон внутривенно 120 мг в сутки в течение 3-х дней, с последующим приемом внутрь 20 мг/сутки и постепенным снижением дозы до отмены в условиях поликлинического наблюдения.
На фоне терапии наблюдалась положительная динамика в клинической картине в виде значительного уменьшения признаков декомпенсации сердечной недостаточности (СН), гипергидратации (уменьшение одышки и отеков, увеличение объема выделяемой мочи до 2 литров), а также снижение уровня К до 4,67 ммоль/л, креатинина — до 151,1 мкмоль/л, мочевины — до 24,9 ммоль/л. В течение 10 дней показатели азотемии практически нормализовались: мочевина — 13,1 ммоль/л, креатинин — 113 мкмоль/л. Скорость клубочковой фильтрации по формуле CKD-EPI — 55 мл/мин/1,73м2. Сохранялась гиперурикемия (уровень мочевой кислоты — 489 мкмоль/л). Пациент был выписан с улучшением состояния в виде значительного уменьшения одышки (в покое одышка не появлялась), отсутствия отёков, купирования явлений подагрического артрита, восстановления диуреза и функции почек. На амбулаторном этапе было рекомендовано продолжить комплексную терапию. Через четыре недели после полного купирования приступа стало возможным приступить к титрации дозы аллопуринола, начиная с 25 мг
до определения минимальной дозы, поддерживающей целевые значения мочевой кислоты сыворотки крови, на фоне чего прием диуретиков (абсолютно показанный данной категории пациентов) будет относительно безопасным. В дальнейшем терапия сердечной недостаточности, стабилизация артериального давления, адекватный уровень гликемии, урикемии позволят предотвратить рецидив острого почечного повреждения, уменьшить экономические расходы на проведение заместительных методов терапии патологии почек.
Таким образом, в представленном клиническом случае у пациента с длительным анамнезом плохо курируемой артериальной гипертензии в сочетании с такими сопутствующими заболеваниями, как сахарный диабет, подагра, ожирение возникли условия для патогенетического объединения этих болезней в коморбидный комплекс, осложняющий и ограничивающий выбор лекарственной терапии. С одной стороны, декомпенсация сердечной недостаточности требовала проведения активной диуретической терапии [1], с другой стороны — наличие острого приступа подагры и острого повреждения почек ограничивало возможность их применения. Поэтому с учётом наличия гиперкалиемии, повышения азотистых шлаков и олигурии использован метод заместительной терапии в виде гемодиализа [2], что позволило протезировать почечную функцию и безопасно использовать жизненно необходимые диуретики [3] и глюкокортикостероиды с противовоспалительной и анальгетической целью для купирования артрита. Согласно современным рекомендациям, при наличии подагрического артрита возможно назначение НПВП, колхицина либо глюкокортикоидов [4]. В данном случае использование НПВП и колхицина было абсолютно противопоказано из-за нарушения функции почек, азотемии, декомпенсации ХСН. Поэтому препаратом выбора явился преднизолон, который также должен назначаться с осторожностью и на минимально короткое время из-за возможного негативного воздействия на углеводный обмен у пациента с сахарным диабетом и ожирением. Применение аллопуринола для снижения уровня мочевой кислоты должно быть отсрочено не менее, чем на четыре недели после купирования приступа артрита, и для профилактики обострения подагры рекомендуется постепенный подбор оптимальной дозы, начиная с минимальной.
Обсуждение
У данного пациента мы видим наличие нескольких синдромов, в том числе кардиоренального. Как известно, кардиоренальный синдром представляет собой одновременное сочетание дисфункции либо недостаточности почечной и сердечной. Выделяют пять типов кардиоренального синдрома в зависимости от первичности поражения сердца либо почек, причин, темпов развития [5]. Так, в настоящем клиническом случае кардиоренальный синдром был первого типа — острое повреждение почек при острых коронарных событиях, острой сердечной недостаточности либо выраженной декомпенсации хронической. Причём механизм развития патологического процесса связан не только со снижением сердечного выброса, но в большей степени, вероятно, с повышением центрального венозного давления, которое обусловливает снижение фильтрационного давления в капиллярах клубочков и снижение клубочковой фильтрации.
Для уменьшения центрального венозного давления, застоя в стационаре мы использовали диуретические препараты, несмотря на риск усугубления явлений артрита.
Другим механизмом поражения почек при ХСН является нейроэндокринный, а именно активация РААС, симпатоадреналовой системы, избыточная продукция эндотелина, вазопрессина и т.д. Для нивелирования этих воздействий мы использовали ИАПФ, верошпирон.
Можно отметить, что, несмотря на выраженное острое поражение почек, у пациента с сочетанием тяжелых патологий удалось достичь практически полного восстановления почечных функций.
Выводы
В реальной клинической практике в условиях стационара встречаются пациенты, имеющие сочетание нескольких патологий, для которых выбор адекватной терапии является чрезвычайно сложным процессом, требующим оценки риска и пользы каждой группы препаратов, предпочтения метаболически нейтральных лекарств, а иногда и приёма относительно противопоказанных средств в отношении определённой патологии, но жизненно показанных в отношении другого заболевания. Необходимо учитывать возникающие синдромы, обусловливающие мультиорганные поражения, возможный патогенетический механизм недостаточности различных органов, что позволит назначать адекватную терапию и достигать улучшения прогноза заболевания.
Список литературы
1. Мареев В.Ю., Выгодин В.А., Беленков Ю.Н. ДиУретическая терапия Эффективными дозами перораЛЬных диуретиков торасемида (Диувер®) и фуросемида в лечении больных с обострением Хронической Сердечной Недостаточности (ДУЭЛЬ-ХСН). Журнал Сердечная Недостаточность. 2011;12 (1):3–10. eLIBRARY ID: 17782759
2. Kidney Disease: Improving Global Outcomes (KDIGO) CKDMBD Work Group. KDIGO clinical practice guideline for the diagnosis, evaluation, prevention, and treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD). Kidney Int Suppl. 2009;(113):S1-130. doi: 10.1038/ki.2009.188. PMID: 19644521.
3. Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JGF, Coats AJS, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardio- logy (ESC) Developed with the special contribution of the Heart Fail- ure Association (HFA) of the ESC. European Journal of Heart Failure. 2016;18 (8):891–975. DOI: 10.1002/ejhf. 592
4. Bardin T. Hyperuricemia starts at 360 micromoles (6 mg/ dL). Joint Bone Spine. 2015;82(3):141-3. DOI: 10.1016/j.jbspin.2015.01.002
5. Резник Е.В., Никитин И.Г. Кардиоренальный синдром у больных с сердечной недостаточностью как этап кардиоренального континуума (часть i): определение, классификация, патогенез, диагностика, эпидемиология (обзор литературы). Архивъ внутренней медицины. 2019;9(1):5-22. DOI: 10.20514/2226-6704-2019-9-1-5-22
Об авторах
Н. А. КошелеваРоссия
Наталья Анатольевна Кошелева, профессор кафедры госпитальной терапии лечебного факультета
Саратов
Н. А. Магдеева
Россия
Надежда Анатольевна Магдеева, доцент кафедры госпитальной терапии лечебного факультета
Саратов
Дополнительные файлы
Рецензия
Для цитирования:
Кошелева Н.А., Магдеева Н.А. Коморбидность в реальной клинической практике – на приеме больной с подагрой, сердечно-сосудистой патологией и поражением почек. Южно-Российский журнал терапевтической практики. 2021;2(3):112-117. https://doi.org/10.21886/2712-8156-2021-2-3-112-117
For citation:
Kosheleva N.A., Magdeeva N.A. Comorbidity in real clinical practice - the patient with gout, cardiovascular disease and kidney damage. South Russian Journal of Therapeutic Practice. 2021;2(3):112-117. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-3-112-117
JATS XML


























