Перейти к:
Влияние тестостерона на функцию эндотелия у мужчин с сахарным диабетом 2 типа
https://doi.org/10.21886/2712-8156-2021-2-3-78-85
Аннотация
Цель: изучить влияние уровня тестостерона (Т) на лабораторные и инструментальные маркеры эндотелиальной дисфункции (ЭД). Материалы и методы: исследование включало 276 больных сахарным диабетом (СД) 2 типа мужского пола. Были проведены общеклинические исследования, изучение параметров углеводного обмена, содержания гормонов (общего Т, ГСПГ, свободного Т, эстрадиола, ЛГ, ФСГ, пролактина, ТТГ, ДГЭА). Секреторную функцию эндотелия оценивали при помощи маркеров оксида азота (NO), эндотелиальной синтазы NO 3 типа, эндотелина, ICAM-1, VCAM-1, p- и е-селектинов, кадгерина, PAI-1, VEGF-1. Дополнительно изучали содержание биологически активных веществ, влияющих на функцию эндотелия: гомоцистеина В, С-реактивного белка (СРБ), остеопротегерина, лептина, резистина, адипонектина. Сосудодвигательную функцию эндотелия оценивали ультразвуковым исследованием эндотелий-зависимой вазодилатации (ЭЗВД) плечевой артерии (ПА) в ходе теста реактивной гиперемии, кроме того, измеряли толщину комплекса интима медиа (КИМ) сонных артерий. Корреляционный анализ проводили с использованием метода Спирмена. Результаты: уровень общего Т взаимосвязан с инструментальными параметрами функции эндотелия: толщиной КИМ сонных артерий (r = -0,26; p = 0,009), временем развития максимальной вазодилатации ПА (r = -0,41; p < 0,001), ЭЗВД (r = 0,28; p = 0,004), а также лабораторными маркерами ЭД, такими как ICAM-1 (r = -0,45; p <0,001), VCAM-1 (r = -0,29; p < 0,001), кадгерином (r = -0,36; p < 0,001), NO (r = 0,32; p = 0,002), VEGF (r = -0,23; p = 0,001), СРБ (r = -0,29; p < 0,001) и адипогормонами, такими как лептин (r=-0,26; p=0,01), резистин (r=-0,24; p<0,001) и адипонектин (r = 0,28; p = 0,007). Заключение: дефицит Т ассоциирован с ухудшением сосудодвигательной функции эндотелия, снижением ЭЗВД наряду с увеличением времени развития максимальной вазодилатации ПА и нарушением секреторной функции эндотелия, увеличением концентраций VCAM-1, ICAM-1, кадгерина, VEGF и, напротив, уменьшением уровня NO. Снижение уровня Т сопровождается увеличением содержания СРБ, резистина, лептина и уменьшением адипонектина, что усугубляет нарушение функции эндотелия.
Ключевые слова
Для цитирования:
Хрипун И.А., Воробьев С.В. Влияние тестостерона на функцию эндотелия у мужчин с сахарным диабетом 2 типа. Южно-Российский журнал терапевтической практики. 2021;2(3):78-85. https://doi.org/10.21886/2712-8156-2021-2-3-78-85
For citation:
Khripun I.A., Vorobyev S.V. Effect of testosterone on endothelial function in men with type 2 diabetes mellitus. South Russian Journal of Therapeutic Practice. 2021;2(3):78-85. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-3-78-85
Введение
На сегодняшний день в мире насчитывается более 463 млн больных сахарным диабетом (СД), причем 90% случаев составляет СД 2 типа [1]. Несмотря на это, заболеваемость СД продолжает неуклонно расти, опережая все прогнозы ВОЗ. Известно, что сердечно-сосудистые риски у больных с СД в 2 раза выше, чем в популяции [2]. При этом особый интерес приобретают гендерные отличия в заболеваемости СД и распространённости диабетических осложнений. Совокупность генетических, метаболических, гормональных, социальных и психологических факторов обеспечивает эти отличия. Несмотря на то, что ожирение, являющееся ведущим фактором риска нарушений углеводного обмена, чаще встречается у женщин, СД 2 типа диагностируется чаще и в более молодом возрасте у мужчин. В целом, мужчины имеют более высокий риск диабетических микрососудистых осложнений, тогда как для женщин с СД 2 типа повышается риск макрососудистых осложнений [3]. Несмотря на многофакторность половых отличий в развитии СД 2 типа и его осложнений, ведущую роль играют половые гормоны, в частности избыток андрогенов у женщин и их дефицит у мужчин [3][4]. В последние годы всё больше исследований направлены на изучение проблемы дефицита тестостерона (Т) у мужчин, поскольку его распространённость среди больных СД 2 типа и ожирением составляет 30 – 50% [5][6]. Установлено, что смертность от кардиоваскулярных заболеваний у мужчин с гипогонадизмом вдвое выше, чем у эугонадных больных СД 2 типа [7]. На сегодняшний день механизмы, обусловливающие негативное влияние дефицита Т на сердечно-сосудистую систему до конца не изучены, однако имеются доказательства того, что одной из внегонадных мишеней его действия является эндотелий сосудов [8]. Экспрессия андрогеновых рецепторов обнаружена в эндотелиоцитах, что и обусловливает реализацию биологических эффектов Т [9][10]. С этим связано то, что низкая чувствительность к андрогенам ассоциирована с нарушением функции эндотелия у мужчин [11].
Поскольку повреждение эндотелия является стартовым механизмом любых сердечнососудистых заболеваний, а также микро- и макрососудистых осложнений СД, возникающим задолго до их клинической манифестации, особую значимость приобретают вопросы диагностики эндотелиальной дисфункции (ЭД) на самых ранних этапах [12][13][14].
Одним из ранних признаков ЭД является нарушение секреторной активности клеток эндотелия [15][16]. Каждый год исследователи открывают все новые и новые биологически активные вещества, вырабатываемые эндотелием или влияющие на его функционирование.
Однако взаимосвязь маркеров ЭД с уровнем Т у мужчин до сих пор не установлена и представляет интерес для изучения.
Цель исследования — изучить влияние уровня Т на лабораторные и инструментальные маркеры ЭД.
Материал и методы
В исследование вошли 276 больных СД 2 типа мужского пола. Медиана возраста больных в исследовании составила 54 года, интерквартильный размах — 11 лет, тогда как стаж СД 2 типа — 6,0 [2,0; 10,0] лет. Все пациенты до начала исследования подписали формы информированного согласия, одобренные на заседании ЛНЭК ФГБОУ ВО «РостГМУ» Минздрава России № 13/14 от 11.09.2014 г.
Больным проводили общеклинические обследования, изучение параметров углеводного обмена и уровней гормонов крови, иммуноферментный анализ биохимических показателей ЭД и ультразвуковое исследование артериальной вазореактивности. Забор венозной крови пациентам осуществляли натощак после 12-часового голодания, кровь центрифугировали, сыворотку замораживали при температуре -200С. Изучение гормонального спектра крови включало определение уровней общего Т, глобулина, связывающего половые гормоны (ГСПГ), эстрадиола, пролактина, тиреотропного гормона (ТТГ), лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), дегидроэпиандростерона (ДГЭА). Секреторную функцию эндотелия осуществляли путем оценки содержания оксида азота (NO), эндотелиальной синтазы оксида азота 3 типа (eNOS3), эндотелина; молекул адгезии ICAM-1, VCAM-1, p- селектина, е-селектина, кадгерина, ингибитора активации плазминогена 1 типа (PAI-1), сосудистого эндотелиального фактора роста 1 типа (VEGF-1). Помимо этого, оценивали содержание молекул, непосредственно не выделяемых эндотелием, но оказывающих значимое влияние на его функцию, — гомоцистеина В, С-реактивного белка (СРБ), остеопротегерина, лептина, резистина, адипонектина. Для проведения иммуноферментных анализов использовали анализатор Zenyth 340. Исследование уровней общего Т, ГСПГ, эстрадиола проводили с использованием тест систем «DRG Elisa» (Germany), пролактина, ТТГ, ЛГ, ФСГ, ДГЭА - «Алкор-Био» (Россия). Для анализа концентраций молекул адгезии и VEGF-1 применяли наборы «Бендер Медсистемс Гмбх» (Австрия); eNOS3 — «BCM Diagnostics» (США), NO — «R&D» (США), гомоцистеина В — «Axis-shield diagnostics ltd» (Великобритания), эндотелина и остеопротегерина — «Биомедика Медицин продукте ГмбХ & Ко КГ» (Австрия), СРБ — «Биомерика Инк» (США), лептина «Mediagnost» (Германия), резистина — «Биовендер Лабораторни» (Чешская республика), адипонектина — «eBioscience» (Австрия). Ультразвуковое исследование артериальной вазореактивности проводили с помощью теста реактивной гиперемии согласно методике D. Celermajer с использованием аппарата Philips HD 11.
Статистический анализ данных проводили при помощи пакета прикладных программ Statistica 10.0 (StatSoft Inc., США). Переменные были проверены на нормальность распределения с помощью критерия Колмогорова–Смирнова. Поскольку все изучаемые параметры были непараметрическими, данные представлены в виде медиан, нижнего и верхнего квартилей Me [Q1; Q3]. Корреляционный анализ проводили по методу Спирмена. Статистически значимыми считали различия при р < 0,05.
Результаты
Медиана индекса массы тела пациентов в исследовании составила 32,1 [ 29,6; 35 ] кг/м2, окружности талии — 109 [ 102; 117 ] см, окружности бедер — 110 [ 104; 116 ] см. Медианы уровней гликемии натощак составили 7,9 [ 6,4; 10] ммоль/л, HbA1c — 7,8 [ 6,7; 9,0 ] %. Уровень систолического артериального давления у обследованных больных был 140 [ 130; 160 ] мм рт.ст., диастолического — 87 [ 80; 95 ] мм рт. ст., частоты сердечных сокращений — 75 [ 70; 82 ] ударов в минуту.
При проведении ультразвуковых исследований медиана толщины комплекса интима-медиа составила 1 [ 0,8; 1,1 ] мм, а ЭЗВД плечевой артерии 11,1 [ 8,5; 15,4 ] %, при этом исходный диаметр плечевой артерии был 4,7 [4,2; 5,0] мм, а её максимальный диаметр при проведении теста реактивной гиперемии — 5,3 [ 4,9; 5,5 ] мм. То есть фактически на основании медианы ЭЗВД, можно считать, что в обследованные пациенты имели нормальную сосудодвигательную функцию эндотелия. Однако ЭД, согласно данным теста с реактивной гиперемией, была диагностирована у 42,4% пациентов (n = 117). Особое внимание нужно обратить на временные характеристики ЭЗВД: время её развития составило 90 [60; 120] секунд, что соответствует референсному диапазону для больных СД 2 типа.
Состояние секреторной функции эндотелия можно оценить по содержанию биохимических маркеров ЭД (табл. 1).
Таблица 1
Содержание молекул, ассоциированных с развитием дисфункции эндотелия

На основании анализа биохимических маркеров дисфункции эндотелия можно судить о большем числе случаев нарушения функции эндотелия: за пределы референсных значений показатели выходили у 61,9% (n = 171) больных. Это потребовало проведения поиска взаимосвязей между инструментальными и лабораторными параметрами дисфункции эндотелия. Корреляционный анализ выявил статистически значимые (р < 0,05) связи между ЭЗВД ПА и уровнями маркеров ЭД: СРБ (r = -0,397), NO (r = 0,577), ICAM-1 (r = -0,424), а также адипогормона резистина (r = -0,396). Это дает основания полагать, что данные показатели наиболее информативны в оценке функции эндотелия.
Содержание гормонов сыворотки представлено в табл. 2.
Таблица 2
Содержание гормонов в сыворотке крови

На основании данных медиан концентраций гормонов сыворотки можно заключить, что все изучаемые показатели в исследуемой когорте пациентов находились в пределах референсных значений. С учётом гомогенный половой состав группы больных это позволило бы считать данную выборку репрезентативной. Но поскольку все больные имели СД 2 типа и ожирение, представлял интерес детальный анализ содержания половых гормонов. Было установлено, что 124 пациента (44,9%) имели лабораторные критерии гипогонадизма, что при клиническом обследовании нашло подтверждение в наличии характерных жалоб. При этом проведенные обследования позволили исключить у пациентов в исследовании первичные и вторичные формы гипогонадизма, а также наличие нарушений функции щитовидной железы, гиперпролактинемии. Значения ЛГ свидетельствуют о нормогонадотропном типе гипогонадизма у всех обследованных, что характерно для больных ожирением и СД 2 типа.
Итак, в связи с выявлением случаев гипогонадизма в исследуемой когорте, для определения наличия взаимосвязей между уровнями Т с инструментальными и лабораторными показателями дисфункции эндотелия, был проведен корреляционный анализ (табл. 3).
Таблица 3
Взаимосвязи уровня тестостерона, ключевых ультразвуковых характеристик функции эндотелия и содержания сывороточных маркеров эндотелиальной дисфункции
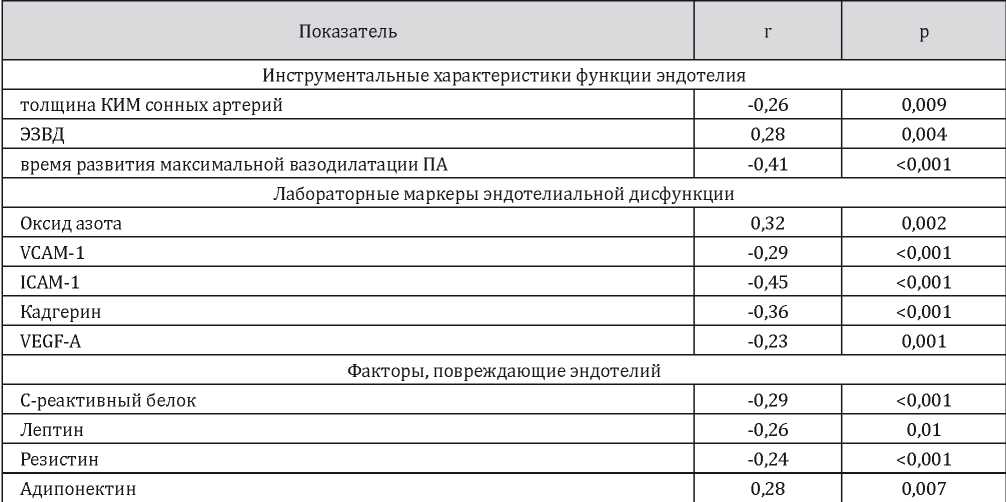
Существенных различий в статистической значимости корреляций уровней общего и свободного Т не было выявлено, в связи с чем представлены результаты анализа взаимосвязей наиболее широко используемого в клинической практике общего Т.
Выявлены отрицательная связь между уровнем общего Т и толщиной КИМ сонных артерий (r = –0,26; p = 0,009), временем развития максимальной вазодилатации ПА в ходе теста реактивной гиперемии (r = –0,41; p < 0,001), а также положительная связь с ЭЗВД (r = 0,28; p = 0,004).
Наиболее сильными были связи содержания общего Т и ICAM-1 (r = –0,45; p < 0,001), NO (r = 0,32; p = 0,002) и СРБ (r = –0,29; p < 0,001). При этом нужно отметить, что именно эти молекулы имеют наибольшее диагностическое значение среди протеомных маркеров ЭД. Кроме того, статистически значимыми были отрицательные связи уровня эндогенного Т с молекулами адгезии VCAM-1 (r = –0,29; p < 0,001) и кадгерином (r = –0,36; p < 0,001), а также фактором роста эндотелия VEGF (r = –0,23; p = 0,001).
В отношении зависимости секреторной активности жировой ткани от содержания эндогенного Т были выявлены следующие закономерности. Уровни общего Т имели отрицательную корреляционную связь с концентрацией лептина (r = –0,26; p = 0,01), резистина (r = –0,24; p < 0,001) и положительную — с содержанием адипонектина (r = 0,28; p = 0,007).
Статистически значимых взаимосвязей уровня Т и содержанием синтетазы NO 3 типа, эндотелина, остепротегерина, гомоцистеина В, PAI-1, р- и е- селектинов не выявлено.
Обсуждение
Хорошо известно, что нарушения углеводного и липидного обменов ассоциированы с дисфункцией эндотелия, которая лежит в основе любых сосудистых поражений, в том числе и осложнений СД. Проведя обследование пациентов при помощи общепринятой инструментальной диагностической методики ЭД – оценки ЭЗВД в ходе теста с реактивной гиперемией – у 42,4% больных была установлена дисфункция эндотелия. В то же время, лабораторные маркеры ЭД продемонстрировали нарушение функции эндотелия в большем числе случаев – у 61,9% больных. Учитывая гомогенный гендерный состав обследованной выборки больных (все пациенты в исследовании были мужского пола), представлял интерес анализ содержания половых гормонов. Медианы уровней как общего, так и свободного Т в группах соответствовали нормативным значениям, что могло дать основания для заключения об эугонадном статусе мужчин. Однако, при детальном обследовании оказалось, что 44,9% пациентов имели лабораторные и клинические признаки гипогонадизма, что и послужило поводом для оценки взаимосвязи между уровнем Т и маркерами ЭД у мужчин с СД 2 типа.
Среди изученных инструментальных параметров функции эндотелия обращает на себя внимание отрицательная корреляционная связь между уровнем общего Т и толщиной КИМ сонных артерий, которая отражает структурные изменения медии сонной артерии, а её увеличение рассматривается как фактор прогрессии дисфункции эндотелия [17].
Помимо этого, снижение концентрации Т ассоциировано не только с уменьшением ЭЗВД, но и увеличением времени развития максимальной вазодилатации ПА в ходе теста реактивной гиперемии. То есть дефицит Т приводит к ослаблению и замедлению ЭЗВД. Нужно отметить, что увеличение времени развития максимальной вазодилатации является более ранним диагностическим признаком, чем уменьшение выраженности ЭЗВД, и опережает клиническую манифестацию кардиоваскулярных заболеваний [14][18]. Таким образом, снижение уровня Т сопровождается структурными изменениями медии сонной артерии и ухудшением сосудодвигательной функции эндотелия.
Одной из первых в ходе развития ЭД нарушается секреторная функция эндотелия. Было установлено, что наиболее тесно снижение уровня Т взаимосвязано с сокращением синтеза эндотелиоцитами NO — мощнейшего вазодилататора и маркера благополучия эндотелия [12][19]. Это отражает ослабление механизмов эндотелиальной защиты и способствует нарушению ЭЗВД, регистрируемому при проведении вышеописанных инструментальных методик. Не менее важной составляющей нормального функционирования эндотелия является неадгезиваность сосудистой стенки, обязательным условием которой является продукция молекул адгезии на минимальном уровне. Исследование продемонстрировало, что снижение уровня Т сопровождается нарастанием экспрессии молекул сосудистой (VCAM-1) и межклеточной (ICAM -1) адгезии и кадгерина. Известно, что увеличение синтеза данных молекул приводит к адгезии лейкоцитов с последующим проникновением липопротеидов под эндотелий, что и приводит к формированию атеросклеротической бляшки [12][20]. Более того, показана тесная связь данных маркеров ЭД с клиническими проявлениями как СД, так и андрогенного дефицита [21]. Таким образом, повышение адгезивности эндотелия на фоне снижения уровня Т, способствует развитию и прогрессии сосудистых осложнений диабета и атерогенезу.
Наконец, нужно отметить, что функционирование эндотелия неразрывно связано с содержанием биологически активных веществ, продуцируемых другими органами и тканями, такими как СРБ, гормоны жировой ткани, остеопротегерин, гомоцистеи В и многие другие. Нами было установлено, что снижение уровня Т сопровождается увеличением продукции СРБ, рассматриваемого как независимый фактор сердечно-сосудистого риска. Так, СРБ играет важную роль в функционировании эндотелия, запуская апоптоз эндотелиоцитов и блокируя дифференцировку эндотелиальных прогениторных клеток [22][23][24].
Не менее важна и связь ЭД с дисфункцией жировой ткани. Было установлено, что снижение Т сопровождается нарастанием концентраций лептина, резистина и снижением адипонектина.
Исследования показали, что лептин стимулирует оксидативный стресс, воспаление, тромбоз, атерогенез, нарушая функцию эндотелия [25], а резистин вызывает продукцию молекул адгезии эндотелиоцитами, активирует эндотелий, оказывает провоспалительное действие [26][27][28]. В то же время снижение уровня адипонектина свидетельствует об инсулинорезистентности, глюкозо- и липотоксичности, способствующих в свою очередь повреждению эндотелия [29][30].
Таким образом, можно утверждать, что дефицит Т приводит к дисфункции эндотелия, ухудшая его сосудодвигательную и секреторную функции, а также за счёт усиления продукции СРБ, лептина, резистина и снижения синтеза адипонектина, в совокупности повреждающих эндотелиоциты.
Заключение
Уровень Т у мужчин тесно взаимосвязан с функцией эндотелия. Дефицит Т ассоциирован с ухудшением сосудодвигательной функции эндотелия, снижением ЭЗВД наряду с увеличением времени развития максимальной вазодилатации ПА и нарушением секреторной функции эндотелия, увеличением концентраций VCAM-1, ICAM-1, кадгерина, VEGF и, напротив, уменьшением уровня NO. Снижение уровня Т сопровождается увеличением содержания СРБ, резистина, лептина и снижением адипонектина, что усугубляет нарушение функции эндотелия.
Список литературы
1. IDF diabetes atlas, 9th edition 2019. International Diabetes Federation. IDF, 2020.
2. Аметов А.С. Сахарный диабет 2 типа. Проблемы и решения. 3-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2015.
3. Maric-Bilkan C. Sex differences in micro- and macro-vascular complications of diabetes mellitus. Clin Sci (Lond). 2017;131(9):833-846. doi:10.1042/CS20160998
4. Kautzky-Willer A, Harreiter J, Pacini G. Sex and Gender Differences in Risk, Pathophysiology and Complications of Type 2 Diabetes Mellitus. Endocr Rev. 2016;37(3):278-316. doi:10.1210/er.2015-1137
5. Zhang J, Li X, Cai Z, Li H, Yang B. Association between testosterone with type 2 diabetes in adult males, a meta-analysis and trial sequential analysis. Aging Male. 2020;23(5):607-618. doi: 10.1080/13685538.2018.1557139
6. Мельниченко Г.А., Шестакова М.В., Роживанов Р.В. Распространенность синдрома гипогонадизма у мужчин с сахарным диабетом типа 2 в условиях рутинной клинической практики. Сахарный диабет. 2019;22(2):127-130. doi: 10.14341/DM9944.
7. Jones TH, Kelly DM. Randomized controlled trials - mechanistic studies of testosterone and the cardiovascular system. Asian J Androl. 2018;20(2):120-130. doi: 10.4103/aja.aja_6_18
8. Lucas-Herald AK, Alves-Lopes R, Montezano AC, Ahmed SF, Touyz RM. Genomic and non-genomic effects of androgens in the cardiovascular system: clinical implications. Clin Sci (Lond). 2017;131(13):1405-1418. doi: 10.1042/CS20170090
9. Chistiakov DA, Myasoedova VA, Melnichenko AA, Grechko AV, Orekhov AN. Role of androgens in cardiovascular pathology. Vasc Health Risk Manag. 2018;14:283-290. doi: 10.2147/VHRM.S173259
10. Torres-Estay V, Carreño DV, San Francisco IF, Sotomayor P, Godoy AS, Smith GJ. Androgen receptor in human endothelial cells. J Endocrinol. 2015;224(3):R131-7. doi: 10.1530/JOE-14-0611
11. Хрипун И.А., Воробьев С.В., Коган М.И. Взаимосвязь полиморфизма гена рецептора андрогенов и функции эндотелия у мужчин с сахарным диабетом 2 типа. Сахарный диабет. 2015;4:28-33. Doi: 10.14341/DM7622.
12. Godo S, Shimokawa H. Endothelial Functions. Arterioscler Thromb Vasc Biol. 2017;37(9):e108-e114. doi: 10.1161/ATVBAHA.117.309813
13. Triggle CR, Ding H, Marei I, Anderson TJ, Hollenberg MD. Why the endothelium? The endothelium as a target to reduce diabetes-associated vascular disease. Can J Physiol Pharmacol. 2020;98(7):415-430. doi: 10.1139/cjpp-2019-0677.
14. Хрипун И.А., Воробьев С.В., Моргунов М.Н., Коган М.И. Функция эндотелия у мужчин с сахарным диабетом 2 типа, не имеющих клинических признаков сердечно-сосудистых заболеваний. Сахарный диабет. 2016;19(5):383-387. doi: 10.14341/DM8017.
15. Polovina MM, Potpara TS. Endothelial dysfunction in metabolic and vascular disorders. Postgrad Med. 2014;126(2):38-53. doi: 10.3810/pgm.2014.03.2739
16. Bonetti PO, Lerman LO, Lerman A. Endothelial dysfunction: a marker of atherosclerotic risk. Arterioscler Thromb Vasc Biol. 2003;23(2):168-75. doi: 10.1161/01.atv.0000051384.43104.fc
17. Nambi V, Chambless L, He M, Folsom AR, Mosley T, Boerwinkle E, et al. Common carotid artery intima-media thickness is as good as carotid intima-media thickness of all carotid artery segments in improving prediction of coronary heart disease risk in the Atherosclerosis Risk in Communities (ARIC) study. Eur Heart J. 2012;33(2):183-90. doi: 10.1093/eurheartj/ehr192
18. Хрипун И.А., Моргунов М.Н., Воробьев С.В., Терентьев В.П., Коган М.И. Эндотелиальная дисфункция и сахарный диабет 2 типа: новые маркеры ранней диагностики. Кардиоваскулярная терапия и профилактика. 2016;15(5):59-63. Doi: 10.15829/1728-8800-2016-5-59-63.
19. Lei J, Vodovotz Y, Tzeng E, Billiar TR. Nitric oxide, a protective molecule in the cardiovascular system. Nitric Oxide. 2013;35:175-85. doi: 10.1016/j.niox.2013.09.004
20. Степанова Т.В., Иванов А.Н., Терешкина Н.Е., Попыхова Э.Б., Лагутина Д.Д. Маркеры эндотелиальной дисфункции: патогенетическая роль и диагностическое значение (обзор литературы). Клиническая и лабораторная диагностика. 2019;64(1):34-41. DOI: 10.18821/0869-2084-2019-64-1-34-41
21. Хрипун И.А., Дзантиева Е.О., Воробьев С.В., Гусова З.Р., Моргунов М.Н., Белоусов И.И., и др. Маркеры эндотелиальной дисфункции у мужчин с сахарным диабетом 2 типа и их клиническое значение. Медицинский вестник Северного Кавказа. 2016;11(3):470-472. DOI 10.14300/mnnc.2016.11108.
22. Руководство по кардиологии в четырех томах. Том 2: Методы диагностики сердечно-сосудистых заболеваний. Под ред. Е.И. Чазова. М.: Практика, 2014.
23. Jabeen F, Fawwad A, Rizvi HA, Alvi F. Role of platelet indices, glycemic control and hs-CRP in pathogenesis of vascular complications in type-2 diabetic patients. Pak J Med Sci. 2013;29(1):152-6. doi: 10.12669/pjms.291.2592.
24. Стрюк Р.И., Свиридова М.И., Мкртумян А.М., Голикова А.А. С-реактивный белок как показатель риска сердечнососудистых осложнений у больных сахарным диабетом 2-го типа и его коррекция. Клиническая медицина. 2016;94(9):683-687. DOI: 10.18821/0023-2149-2016094-9-683-687
25. Katsiki N, Mikhailidis DP, Banach M. Leptin, cardiovascular diseases and type 2 diabetes mellitus. Acta Pharmacol Sin. 2018;39(7):1176-1188. doi:10.1038/aps.2018.40
26. Вербовой А.Ф., Цанава И.А., Вербовая Н.И., Галкин Р.А. Резистин – маркер сердечно-сосудистых заболеваний. Ожирение и метаболизм. 2017;14(4):5-9. doi: 10.14341/omet201745-9
27. Acquarone E, Monacelli F, Borghi R, Nencioni A, Odetti P. Resistin: A reappraisal. Mech Ageing Dev. 2019;178:46-63. doi:10.1016/j.mad.2019.01.004
28. Park HK, Kwak MK, Kim HJ, Ahima RS. Linking resistin, inflammation, and cardiometabolic diseases. Korean J Intern Med. 2017;32(2):239-247. doi: 10.3904/kjim.2016.229
29. Achari AE, Jain SK. Adiponectin, a Therapeutic Target for Obesity, Diabetes, and Endothelial Dysfunction. Int J Mol Sci. 2017;18(6):1321. doi: 10.3390/ijms18061321
30. Аметов А.С., Камынина Л.Л., Литвиненко В.М. Гипоадипонектинемия – маркер глюкозо- и липотоксичности у пациентов с сахарным диабетом 2 типа и висцеральным ожирением. Эндокринология: Новости, Мнения, Обучение. 2018;7(2):35-45.
Об авторах
И. А. ХрипунРоссия
Хрипун ирина алексеевна, д.м.н., доцент кафедры эндокринологии (с курсом детской эндокринологии)
Ростов-на-Дону
eLibrary SPIN: 8630-4828
С. В. Воробьев
Россия
Воробьев Сергей Владиславович, д.м.н., проф., заведующий кафедрой эндокринологии (с курсом детской эндокринологии)
Ростов-на-Дону
eLibrary SPIN: 9773-6100
Рецензия
Для цитирования:
Хрипун И.А., Воробьев С.В. Влияние тестостерона на функцию эндотелия у мужчин с сахарным диабетом 2 типа. Южно-Российский журнал терапевтической практики. 2021;2(3):78-85. https://doi.org/10.21886/2712-8156-2021-2-3-78-85
For citation:
Khripun I.A., Vorobyev S.V. Effect of testosterone on endothelial function in men with type 2 diabetes mellitus. South Russian Journal of Therapeutic Practice. 2021;2(3):78-85. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-3-78-85


























