Перейти к:
Распространённость бессимптомной гиперурикемии у больных с хронической болезнью почек и её влияние на течение и прогноз (опыт одного центра)
https://doi.org/10.21886/2712-8156-2022-3-1-74-82
Аннотация
Цель: анализ распространённости бессимптомной гиперурикемии (ГУ), а также оценки её взаимосвязей с метаболическими расстройствами, патологическими состояниями и осложнениями при хронической болезни почек (ХБП). Материал и методы: проведено ретроспективное когортное исследование в виде тотального среза пациентов, госпитализированных на круглосуточную койку нефрологического отделения. В исследование включён 261 пациент, средний возраст составил 50,9±17,2 (M±SD), 261 мужчина, 99 женщина. Структура ХБП госпитализированных больных была следующей: ХБП С1 — 53 пациента, С2 — 70 пациентов, С3А — 46, С3Б — 46, С4 — 36, С5 — 7 пациентов. В исследование не включались пациенты с диагнозом подагры. Результаты: уровень мочевой кислоты в обследованной когорте составил 369,8±109,7 мкмоль/л, колебания от 157 до 768 мкмоль/л. По мере снижения скорости клубочковой фильтрации (СКФ) возрастала вероятность ГУ. По мере развития и прогрессирования дислипидемии происходило повышение вероятности выявления ГУ. У больных с ХБП нарастание уровня суточной протеинурии также сопровождалось повышением вероятности обнаружения ГУ. Риск прогрессирования ХБП до терминальных стадий, а также ГЛЖ, аритмий, АГ связан с высокими значениями мочевой кислоты в крови. Выводы: высокая распространенность ГУ у больных с ХБП наравне с данными о ее негативном влиянии на течение ХБП является важным аргументом в пользу её выявления и контроля. Связь ГУ с метаболическими расстройствами на фоне высокой протеинурии объясняет один из механизмов её пагубного воздействия на течение ХБП. Показано влияние ГУ на вероятность выявления АГ, ГЛЖ, аритмий и терминальных стадий ХБП, что определяет важность модифицируемости данного фактора риска в прогнозе течения ХБП.
Для цитирования:
Батюшин М.М. Распространённость бессимптомной гиперурикемии у больных с хронической болезнью почек и её влияние на течение и прогноз (опыт одного центра). Южно-Российский журнал терапевтической практики. 2022;3(1):74-82. https://doi.org/10.21886/2712-8156-2022-3-1-74-82
For citation:
Batiushin M.M. The prevalence of asymptomatic hyperuricemia in patients with chronic kidney disease and its effect on the course and prognosis (experience of one center). South Russian Journal of Therapeutic Practice. 2022;3(1):74-82. (In Russ.) https://doi.org/10.21886/2712-8156-2022-3-1-74-82
Вступление
Гиперурикемия (ГУ) является распространённым фактором риска развития и прогрессирования хронической болезни почек (ХБП). Среди известных вариантов поражения почек при ГУ отмечают уратный уролитиаз, острую (острый тубулоинтерстициальный гиперурикемическаий нефрит) и хроническую уратную нефропатию (хронический тубулоинтерстициальный гиперурикемический нефрит) [1]. Причём данное поражение может реализовываться как в условиях развития подагры, так и при её отсутствии (бессимптомная гиперурикемия) [2]. ГУ является важным фактором риска прогрессирования ХБП, как диабетической, так и недиабетической, неотъемлемой частью метаболического синдрома и фактором риска развития осложнений при артериальной гипертензии [3–6]. Мочевая кислота является конечным продуктом экзогенного пула и эндогенного обмена пуринов. Экзогенный пуриновый пул варьируется в зависимости от присутствия преимущественно животных белков в пище, тогда как эндогенный синтез мочевой кислоты происходит в основном в печени, кишечнике, мышечной ткани, почках и эндотелии сосудов [7]. Развитие ГУ может быть обусловлено как гиперпродукцией её в организме, так и понижением экскреции уратов с мочой. Транспортер уратов URAT1 является доминирующим апикальным обменником уратов в проксимальных почечных канальцах [8]. В случае развития ХБП повреждение механизмов фильтрации, секреции и реабсорбции уратов сопровождается их ретенцией в организме с развитием ГУ. Таким образом, формируется порочный круг, в котором ГУ может выступать как причиной, так и следствием ХБП, и по мере прогрессирования ХБП происходит усиление выраженности ГУ и нарастание ее повреждающего потенциала на почечную ткань [9][10].
Цель исследования — анализ распространённости бессимптомной гиперурикемии, а также оценки её взаимосвязей с метаболическими расстройствами, патологическими состояниями и осложнениями при хронической болезни почек.
Материал и методы
С целью анализа распространённости бессимптомной ГУ, а также оценки её взаимосвязей с метаболическими расстройствами, патологическими состояниями и осложнениями при ХБП нами было проведено ретроспективное когортное исследование в виде тотального среза пациентов, госпитализированных на круглосуточную койку нефрологического отделения клиники Ростовского государственного медицинского университета в 2021 году с июня по декабрь. В исследование включён 261 пациент, средний возраст составил 50,9±17,2 (М±SD), лиц мужского пола было 261, женского — 99. Структура ХБП госпитализированных больных была следующей: ХБП С1 — 53 пациента, С2 — 70 пациентов, С3А — 46, С3Б — 46, С4 — 36, С5 — 7 пациентов.
В исследование не были включены пациенты с диагнозом подагры. В числе коморбидных заболеваний и патологических состояний артериальная гипертензия отмечалась у 196 пациентов (75,1%), сахарный диабет — у 43 пациентов (16,5%), избыточный вес — у 93 (35,6%), ожирение — у 83 (31,8%), гиперхолестеринемия — у 153 пациентов (58,6%). Ожирение I степени наблюдалось у 47 пациентов (56,6%), II степени — у 23 (27,7%), III степени — у 13 пациентов (15,7%). В исследовании фиксировались случаи гипертрофии левого желудочка (ГЛЖ) методом ЭКГ (140 пациентов, 53,6%), аритмий (16 пациентов, 6,1%) в том числе фибрилляции предсердий (ФП, 7 пациентов, 2,7%), хронической сердечной недостаточности (ХСН, 25 пациентов, 9,6%), инфаркта миокарда в анамнезе (ИМ, 3 пациента, 1,1%), стенокардии (13 пациентов, 4,9%) или острого нарушения мозгового кровообращения в анамнезе (ОНМК, 9 пациентов, 3,4%).
Значения количественных показателей исследованной когорты представлены в табл. 1.
Таблица 1
Средние значения количественных показателей
|
|
Среднее (М) |
Максимальное |
Минимальное |
SD |
|
Возраст, лет |
59,9 |
19 |
86 |
17,2 |
|
САД, мм рт ст |
140,9 |
90 |
230 |
19,8 |
|
ДАД, мм рт ст |
85,8 |
60 |
140 |
9,7 |
|
ИМТ, кг/м2 |
28,1 |
16,0 |
54,2 |
6,2 |
|
Калий, ммоль/л |
4,5 |
1,5 |
6,9 |
0,6 |
|
Натрий, ммоль/л |
139 |
127 |
146 |
2,3 |
|
Кальций общий, ммоль/л |
2,3 |
1,89 |
4,7 |
0,24 |
|
Кальций ионизированный, ммоль/л |
1,03 |
0,83 |
1,50 |
0,09 |
|
Фосфат, ммоль/л |
1,16 |
0,77 |
3,02 |
0,39 |
|
Глюкоза тощаковая, ммоль/л |
5,7 |
3,4 |
17,7 |
1,9 |
|
ОХС, ммоль/л |
5,8 |
2,3 |
13,4 |
2,0 |
|
ХС-ЛПНП, ммоль/л |
4,4 |
1,3 |
11,4 |
1,8 |
|
ХС-ЛПВП, ммоль/л |
1,4 |
0,9 |
1,9 |
0,25 |
|
ТАГ, ммоль/л |
1,88 |
0,36 |
11,5 |
1,2 |
|
Креатинин, мкмоль/л |
134,7 |
80,0 |
1055 |
104,8 |
|
СКФ, мл/мин |
62,3 |
5,0 |
133 |
31,1 |
|
Мочевина, ммоль/л |
8,1 |
2,0 |
31,3 |
4,5 |
|
СП, г/л |
1,28 |
0,00 |
40,4 |
3,47 |
Уратснижающую терапию получало 143 пациента (54,7%), и это были аллопуринол (55,5%) или фубуксостат (44,5%). Аллопуринол назначался в дозах 100, 150, 200 и 300 мг/сут 34, 7, 24 и 13 пациентам соответственно. Фебуксостат назначался в дозах 40, 60, 80 и 120 мг/сут 4, 10, 22 и 30 пациентам соответственно.
Статистический анализ включал в себя оценку нормальности распределения количественных показателей с последующим определением средних значений и стандартного отклонения или медиан и квартилей в зависимости от характера распределения. Также проводился логит-регрессионный анализ для оценки вероятности развития события. Значимыми различиями считались те, при которых р было менее 0,05, при этом в зависимости от вида анализа применялись различные коэффициенты: t, χ2.
Результаты
Уровень мочевой кислоты в обследованной когорте составил 369,8±109,7 мкмоль/л, колеблясь от 157 до 768 мкмоль/л. Распределение уровней мочевой кислоты представлено на рис. 1.
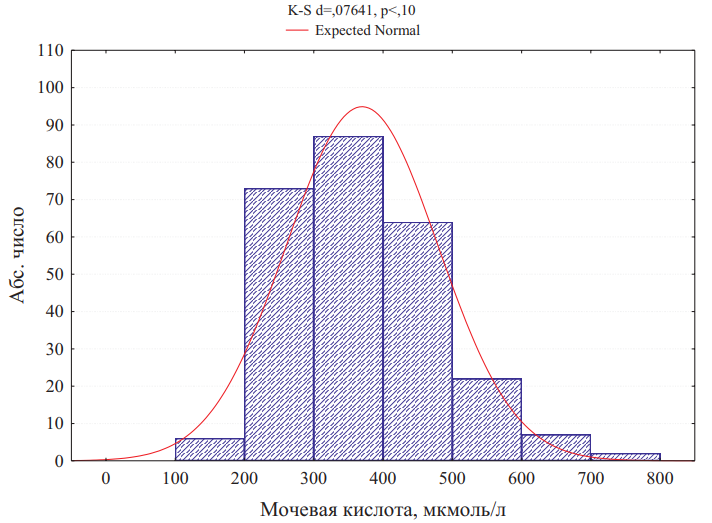
Рисунок 1. Распределение уровней мочевой кислоты в когорте.
При этом максимальные значения мочевой кислоты, которые регистрировались у больных, составили 565,4±87,9, колеблясь от 394 до 712 мкмоль/л. Данные по максимальным значениям были получены у 151 пациента (57,9%). У 32 больных были выявлены сведения об уровне мочевой кислоты, зарегистрированные до развития болезни. Уровень мочевой кислоты составил 395,2±77,9 мкмоль/л. Во всех случаях это были пациенты, у которых и далее регистрировалась ГУ. На рис. 2 представлены соответствующие распределения уровней мочевой кислоты.

Рисунок 2. Распределение уровней мочевой кислоты до развития ХБП и максимально зарегистрированных значений
Следует заметить, что около 13% пациентов получали уратснижающую терапию ещё до госпитализации. В случае её назначения в период госпитализации удалось у 84 больных отследить динамику уровня мочевой кислоты в крови к концу госпитализации. На фоне применения уратснижающей терапии уровень мочевой кислоты снизился в среднем за 7 дней на 62,4 мкмоль/л до 307,4±57,9 мкмоль/л.
Очевидным является связь ГУ с состоянием почечной функции. В нашем исследовании также было показано, что по мере снижения СКФ возрастала вероятность ГУ (табл. 2). ГУ относится к факторам, тесно связанным с целым рядом гемодинамических и метаболических расстройств. Нашей задачей являлась оценка наличия таких связей у больных с ХБП. Также по мере роста уровней ОХС, ХС-ЛПНП, ТАГ, снижения ХС-ЛПВП происходило повышение вероятности выявления ГУ. У больных с ХБП нарастание уровня суточной протеинурии также сопровождалось повышением вероятности обнаружения ГУ.
Таблица 2
Формулы оценки вероятности ГУ у больных с ХБП


Рисунок 3. Вероятность ГУ в спектре значений СКФ (а), ОХС (б), ХС-ЛПНП (в), ХС-ЛПВП (г), ТАГ (д), СПБ (е)
Далее нами была проанализирована взаимосвязь уровня мочевой кислоты с вероятностью выявления ряда осложнений и патологических состояний (табл. 3).
Таблица 3
Вероятность выявления различных патологических состояний в зависимости от уровня мочевой кислоты у больных с ХБП
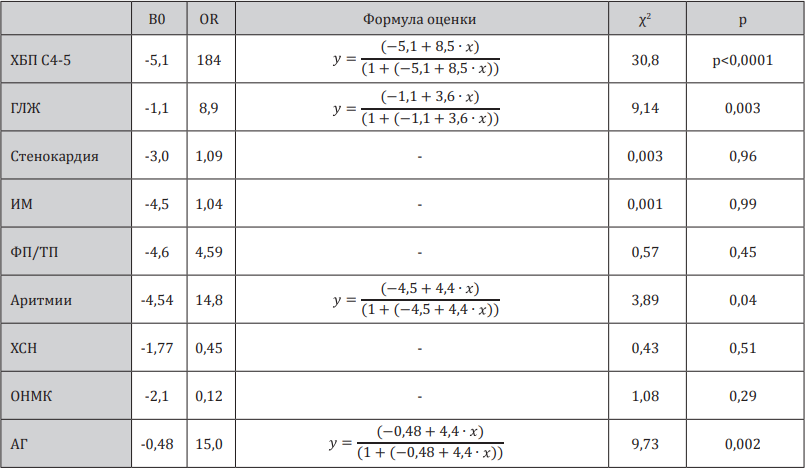
Примечание: ГЛЖ — гипертрофия левого желудочка по данным ЭКГ, ИМ — инфаркт миокарда, ФП/ТП — фибрилляция предсердий/трепетание предсердий, ХСН — хроническая сердечная недостаточность, ОНМК — острое нарушение мозгового кровообращения
Было показано, что риск прогрессирования ХБП до терминальных стадий, а также ГЛЖ, аритмий, АГ связан с высокими значениями мочевой кислоты в крови. Данная зависимость представлена на рис. 4 в виде графиков и отчетливо демонстрирует характер данной зависимости.

Рисунок 4. Вероятность ХБП С4-5 (а), ГЛЖ (б), аритмии (в), АГ (г) в спектре значений мочевой кислоты крови
Обсуждение
В исследовании было показано, что в когорте больных с ХБП, потребовавших госпитализации, распространённость ГУ составила 59,6%, что соотносится с данными литературы [11]. Нами также было показано, что по мере прогрессирования ХБП происходит нарастание уровня мочевой кислоты. Это убедительно показано как на примере связи уровня мочевой кислоты с СКФ, так и выявлением ХБП С4-5. По данным Srivastava A. и соавт. (2018), такая связь является устойчивой и определяет неблагоприятный прогноз течения ХБП в случае наличия персистирующей бессимптомной ГУ [12].
Нами было также показана связь ГУ с такими метаболическими расстройствами при ХБП, как дислипидемия, протеинурия. Оба расстройства, возникающие при ХБП, связаны с расстройством белкового обмена (потеря белка с мочой, снижение синтеза ряда транспортных форм белка для липопротеидов), соответственно, рассматриваются как вторичные по отношению к ХБП расстройства. Нарушение белкового обмена очевидно коррелирует с тяжестью течения нефротических форм нефропатий, что в свою очередь взаимосвязано с потерей почечной функции, которая влечет за собой ретенцию экскреции мочевой кислоты с развитием гиперурикемии. Подобная взаимосвязь была выявлена, в частности, в китайском исследовании у детей с нефротическим синдромом [13].
Следует заметить, что уратснижающую терапию получало 54,7%, и это были аллопуринол или фубуксостат. Такая высокая распространённость уратснижающей терапии свидетельствует о понимании проблемы ГУ при ХБП и необходимости контроля пуринового обмена. Оба препарата относятся к категории урикозстатиков. Применение урикозуриков ограничено у больных с ХБП, с одной стороны, по причине вероятной нефротоксичности и литогенности гиперикозурии при ХБП, с другой стороны, низкой изученностью урикозуриков. Большинство исследований об эффективном применении уратснижающей терапии при ХБП касается урикозстатиков — аллопуринола и фебуксостата [14].
В исследовании нами выявлена взаимосвязь уровня мочевой кислоты с развитием ряда патологических состояний (АГ, ГЛЖ, ХБП С4-5, аритмии), однако не установлено связи с ИМ, стенокардией, ОНМК или ХСН. Это объясняется методологическими особенностями исследования. В частности, на наш взгляд, количество данных событий не было достаточным для получения статистически значимой связи.
Выводы
Высокая распространённость ГУ у больных с ХБП наравне с данными о её негативном влиянии на течение ХБП является важным аргументом в пользу ее выявления и контроля.
Связь ГУ с метаболическими расстройствами на фоне высокой протеинурии объясняет один из механизмов её пагубного влияния на течение ХБП.
Показано влияние ГУ на вероятность выявления АГ, ГЛЖ, аритмий и терминальных стадий ХБП, что определяет важность модифицируемости данного фактора риска в прогнозе течения ХБП.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Кошелева Н.А., Магдеева Н.А. Коморбидность в реальной клинической практике - на приеме больной с подагрой, сердечно-сосудистой патологией и поражением почек. Южно-Российский журнал терапевтической практики. 2021;2(3):112-117. DOI: 10.21886/2712-81562021-2-3-112-117.
2. Крючкова О.Н., Ицкова Е.А., Лутай Ю.А., Турна Э.Ю., Костюкова Е.А., Жукова Н.В. Гиперурикемия как фактор сердечно-сосудистого риска, актуальность коррекции бессимптомной гиперурикемии. Крымский терапевтический журнал. 2020;(4):434-437. eLIBRARY ID: 45569673.
3. Мазуров В.И., Гайдукова И.З., Башкинов Р.А., Фонтуренко А.Ю., Петрова М.С., Инамова О.В. Влияние бессимптомной гиперурикемии на течение коморбидной патологии у пациентов с остеоартритом и возможности ее коррекции. Русский медицинский журнал. 2021;29(6):56-62. eLIBRARY ID: 46433904.
4. Saito Y, Tanaka A, Node K, Kobayashi Y. Uric acid and cardiovascular disease: A clinical review. J Cardiol. 2021;78(1):51-57. DOI: 10.1016/j.jjcc.2020.12.013.
5. Hisatome I., Li P., Miake J., Taufiq F., Mahati E., Maharani N. et al. Uric Acid as a Risk Factor for Chronic Kidney Disease and Cardiovascular Disease - Japanese Guideline on the Management of Asymptomatic Hyperuricemia. Circ J. 2021;85(2):130-138. DOI: 10.1253/circj.CJ-20-0406.
6. Albrecht E., Waldenberger M., Krumsiek J., Evans A.M., Jeratsch U., Breier M. et al. Metabolite profiling reveals new insights into the regulation of serum urate in humans. Metabolomics, 2014;10:141-151. DOI: 10.1007/s11306-013-0565-2.
7. Chaudhary K., Malhotra K., Sowers J., Aroor A. Uric acid — key ingredient in the recipe for cardiorenal metabolic syndrome Cardiorenal Med. 2013;3208-220. DOI: 10.1159/000355405.
8. Maiuolo J., Oppedisano F., Gratteri S., Muscoli C., Mollace V. Regulation of uric acid metabolism and excretion. Int J Cardiol. 2016;213:8-14. DOI: 10.1016/j.ijcard.2015.08.109.
9. Wu N., Xia J., Chen S., Yu C., Xu Y., Xu C. et al. Serum uric acid and risk of incident chronic kidney disease: a national cohort study and updated meta-analysis. Nutr Metab (Lond). 2021;18(1):94. DOI: 10.1186/s12986-021-00618-4.
10. Zhang J., Lu X., Li H., Wang S. Serum Uric Acid and Mortality in Patients with Chronic Kidney Disease: A Systematic Review and Meta-Analysis. Blood Purif. 2021;50(6):758-766. DOI: 10.1159/000513944.
11. Waheed Y., Yang F., Sun D. Role of asymptomatic hyperuricemia in the progression of chronic kidney disease and cardiovascular disease. Korean J Intern Med. 2021;36(6):1281-1293. DOI: 10.3904/kjim.2020.340.
12. Srivastava A., Kaze A.D., McMullan C.J., Isakova T., Waikar S.S. Uric Acid and the Risks of Kidney Failure and Death in Individuals With CKD. Am J Kidney Dis. 2018;71(3):362-370. DOI: 10.1053/j.ajkd.2017.08.017
13. Xiao H., Li Q., Wang F., Yao Y., Zhong X. [Relationship between hyperuricemia and primary nephrotic syndrome in children]. Zhonghua Er Ke Za Zhi. 2014;52(11):859-862. (In Chinese). PMID: 25582475.
14. Premachandra K.H., Day R.O., Roberts D.M. Managing hyperuricemia and gout in chronic kidney disease: a clinical conundrum. Curr Opin Nephrol Hypertens. 2021;30(2):245-251. DOI: 10.1097/MNH.0000000000000691.
Об авторе
М. М. БатюшинРоссия
Батюшин Михаил Михайлович – доктор медицинских наук, профессор, профессор кафедры внутренних болезней №2, заведующий нефрологическим отделением клиники.
Ростов-на-Дону.
Дополнительные файлы
Рецензия
Для цитирования:
Батюшин М.М. Распространённость бессимптомной гиперурикемии у больных с хронической болезнью почек и её влияние на течение и прогноз (опыт одного центра). Южно-Российский журнал терапевтической практики. 2022;3(1):74-82. https://doi.org/10.21886/2712-8156-2022-3-1-74-82
For citation:
Batiushin M.M. The prevalence of asymptomatic hyperuricemia in patients with chronic kidney disease and its effect on the course and prognosis (experience of one center). South Russian Journal of Therapeutic Practice. 2022;3(1):74-82. (In Russ.) https://doi.org/10.21886/2712-8156-2022-3-1-74-82


























