Перейти к:
Влияние хронической болезни почек на метаболизм мышечной ткани у пациентов на гемодиализе
https://doi.org/10.21886/2712-8156-2022-3-1-83-88
Аннотация
Цель: изучить распространённость саркопении и оценить вклад миостатина и mTOR в развитие потери мышечной массы и силы у пациентов с терминальной почечной недостаточностью, получающих лечение программным гемодиализом. Материалы и методы: в исследование было включено 80 больных с ХБП5Д, средний возраст участников исследования составил 51,7±11,6 лет. У всех пациентов были проанализированы анамнестические данные, оценены результаты лабораторно-инструментального обследования, выполнено определение уровней миостатина и mTOR в сыворотке крови, проведены кистевая динамометрия, биоимпедансометрия и проба с поднятием ноги. Результаты: средний объём мышечной массы в подгруппе с саркопенией был 20,5±0,7 кг и достоверно отличался от такового показателя в подгруппе без саркопении — 25,23±0,8 кг (p<0,05). Распространённость саркопении в общей группе составила 38,75%. У мужчин сниженная мышечная масса встречалась статистически значимо чаще, чем среди женщин (p <0,05). Содержание mTOR в сыворотке крови больных с саркопенией было достоверно ниже, чем аналогичный показатель в подгруппе без саркопении (6,61±0,4 нг/мл и 9,4±0,3 нг/мл соответственно (p <0,001)). Уровень миостатина был достоверно выше в подгруппе пациентов с саркопенией, чем без неё (12,2±0,6 нг/мл против 8,1±0,3 нг/мл соответственно (p <0,001)). Прирост миостатина сопровождался снижением mTOR как в общей группе (r=-0,57), так и в подгруппе пациентов с саркопенией (r=-0,55). Заключение: выявлена высокая распространённость саркопении у пациентов с ХБП, получающих заместительную почечную терапию. Миостатин и mTOR продемонстрировали свой диагностический потенциал и могут быть использованы в качестве перспективных маркеров верификации саркопении.
Ключевые слова
Для цитирования:
Гасанов М.З., Батюшин М.М., Терентьев В.П., Хатламаджиян В.В., Кузнецова Ю.В., Рябоконева Т.Ю. Влияние хронической болезни почек на метаболизм мышечной ткани у пациентов на гемодиализе. Южно-Российский журнал терапевтической практики. 2022;3(1):83-88. https://doi.org/10.21886/2712-8156-2022-3-1-83-88
For citation:
Gasanov M.Z., Batyushin M.M., Terentyev V.P., Khatlamadzhiyan V.V., Kuznetsova Yu.V., Ryabokoneva T.Yu. The impact of chronic kidney disease on muscle tissue metabolism in patients undergoing hemodialysis. South Russian Journal of Therapeutic Practice. 2022;3(1):83-88. (In Russ.) https://doi.org/10.21886/2712-8156-2022-3-1-83-88
Введение
Распространённость хронической болезни почек (ХБП) в популяции превышает 13% [1][2]. При этом наблюдается динамичное увеличение этого показателя, что связано с различными факторами и прежде всего с ростом числа пациентов с сахарным диабетом и артериальной гипертензией как основных причин развития ХБП [3][4]. Прогрессирующая потеря функции почек приводит к терминальной почечной недостаточности (ТПН), требующей проведения заместительной почечной терапии. ТПН в свою очередь ассоциирована с рядом осложнений, развивающихся в результате утраты почками фильтрационной способности. Уремия, метаболический ацидоз, оксидативный стресс, системное воспаление — неполный перечень метаболических нарушений, характерных для этой категории пациентов [5][6].
В последние десятилетия в современной литературе всё чаще уделяется внимание ещё одной важной проблеме — потере мышечной массы у больных с ХБП, особенно получающих лечение программным гемодиализом [7][8]. Такое клиническое состояние называется саркопенией и подтверждается различными способами, в том числе биоимпедансометрией, представляющейся наиболее доступным диагностическим методом [9][10]. В последнем пересмотре рекомендаций Европейской рабочей группы по саркопении у пожилых людей (EWGSOP) отмечается, что саркопения — это прогрессирующее генерализованное заболевание скелетных мышц, которое связано с повышенным риском неблагоприятных исходов, включая падения, переломы, физическую нетрудоспособность и смерть [11]. Показатель распространённости саркопении у пациентов с ХБП варьируется в зависимости от стадии и составляет от 5,9 до 65,5%, достигая своего максимума у пациентов с ТПН [12][13]. Её развитие представляется мультифакторным процессом и зависит от пола, возраста, стадии заболевания, особенностей питания, применения программного гемодиализа, применяемых методов верификации и др. [14][15]. Вместе с тем саркопению следует отличать от старческой астении и динапении. В перечень критериев этих клинических состояний входит снижение мышечной производительности и др., но не уменьшение мышечной массы [16][17].
У больных с ХБП обсуждаемые выше факторы вносят наиболее значимый кумулятивный вклад в ее формирование. Но как это происходит? Один из центральных механизмов развития саркопении при ХБП заключается во влиянии уремической интоксикации посредствам молекулярных мессенджеров на мышечную массу [18][19]. Так, при нарушении функции почек отмечается повышение уровня миостатина, который через внутриклеточный киназный каскад усиливает распад белка и замедляет его сборку, являясь отрицательным регулятором метаболизма мышечной ткани [20][21]. При этом ключевая роль в этом сигнальном пути отводится белку мишени рапамицина млекопитающих mTOR, который выполняет интегративные функции и является важным связующим звеном в этом процессе [22]. Таким образом, миостатин реализует свои катаболические эффекты в клетке через mTOR, подавляя активность последнего и приводя к дисбалансу системы катаболизма-анаболизма в пользу деградации белка [23][24].
Нарушения метаболизма мышечной ткани снижают не только качество жизни, но и её продолжительность. В ряде исследований было продемонстрировано повышение как общей смертности, так и смертности от сердечно-сосудистых заболеваний, которые составляют более половины всех случаев смерти в группе больных с ХБП5Д и саркопенией [25][26].
Несмотря на пристальное внимание ученых к этой проблеме, молекулярные аспекты патогенеза потери мышечной массы у пациентов с ХБП всё ещё до конца не изучены, что представляет исследовательский интерес.
Цель исследования — изучение распространённости саркопении и оценки вклада миостатина и mTOR в развитие потери мышечной массы и силы у пациентов с ТПН, получающих лечение программным гемодиализом.
Материалы и методы
В исследование было включено 80 больных с ХБП5Д (47 мужчин (58,7%) и 33 женщины (41,3%)). Средний возраст участников исследования составил 51,7±11,6 лет (женщины — 53,1±1,9 лет, мужчины — 50,8±1,8 лет). Все пациенты получали лечение программным гемодиализом: средняя продолжительность его применения составила 50,1±5,7 месяцев. У всех пациентов были проанализированы анамнестические данные, оценены результаты лабораторно-инструментального обследования и применяемые схемы терапии и программы гемодиализа. С целью оценки мышечной силы была выполнена кистевая динамометрия аппаратом ДМЭР-120-0,5 (Россия); критерием снижения мышечной силы считали для мужчин ˂27 кг, для женщин — ˂16 кг [9][11]. Для оценки объёма скелетно-мышечной массы (СММ) была использована биоимпедансометрия (анализатор МЕДАСС АВС-02, Россия). С целью оценки мышечной производительности (выносливости) была проведена проба с поднятием ноги (считается выполненной, если пациент в положении лёжа на спине, удерживал ногу под углом 45 градусов в течение 60 секунд). Всем пациентам было выполнено определение уровней миостатина и mTOR (ELISA Kit, США) в сыворотке крови с использованием иммуноферментного анализа (аппарат «Luminex MAGPIX», США). Все полученные данные занесены в электронную таблицу для последующей статистической обработки. Статистический анализ осуществлялся при помощи пакета прикладных программ Statistica 10.0. Статистическая значимость различий двух средних определялась с помощью критерия Манна-Уитни. Оценка силы взаимодействия между количественными признаками при нормальном распределении производилась с помощью коэффициента Пирсона, при ненормальном — коэффициента Спирмена. Для анализа связей между различными показателями использовался критерий χ2-квадрат для категориальных признаков. Нулевую статистическую гипотезу об отсутствии различий и связей опровергали при p <0,05.
Результаты
Средняя мышечная масса, определённая с помощью биоимпедансометрии, в общей группе составила 23,4±0,6 кг (у мужчин — 26,5±0,7 кг, у женщин — 18,9±0,4 кг (p ˂0,05)). При этом средний объём мышечной массы в подгруппе с саркопенией был 20,5±0,7 кг (среди мужчин — 22,5±2,7 кг, среди женщин — 16,4±0,9 кг (p ˂0,05)) и достоверно отличался от такового показателя в подгруппе без саркопении - 25,23±0,8 кг (среди мужчин — 29,8±3,1, кг среди женщин — 20,1±2,9 кг (p ˂0,05)). Распространённость саркопении, выявляемой при значениях скелетно-мышечной массы (СММ), ниже пороговых в популяции (рассчитанных индивидуально соответственно полу и возрасту) составила 38,75% в общей выборке (44,7% у мужчин и 30,3% у женщин).
При проведении корреляционного анализа связи между возрастом и объемом СММ как в общей когорте пациентов (r=0,17), так и в подгруппе больных с саркопенией (r=0,09) обнаружено не было.
Выполнение кистевой динамометрии на бесфистульной руке продемонстрировало следующие результаты: средняя мышечная сила в общей когорте больных была 34,8 кг (у мужчин — 42,5±1,6 кг, у женщин — 23,9±0,9 кг (p ˂0,05), в подгруппе пациентов с саркопенией — 39,1 кг и 23,3 кг соответственно (p ˂0,05)). Вместе с тем статистически значимых различий как в общих подгруппах с саркопенией и без нее, так и при дополнительном включении пола пациентов в качестве критерия в этих подгруппах получено не было. При использовании порога отсечения мышечной силы для мужчин и женщин [9][11], являющегося одним из критериев оценки степени выраженности саркопении, было обнаружено снижение мышечной силы у 8,8% (n=7) участников исследования (мужчины — 6,4% (n=3), женщины — 12,1% (n=4)).
При проведении пробы с поднятием ноги, оценивающей мышечную производительность, была установлена средняя величина — 44,9±1 с (48,6±2,1с у мужчин, 39,8±2,7 с у женщин). Пробу не смогли выполнить 57,5% пациентов (46,8% мужчин и 27,3% женщин). Среди пациентов со сниженной СММ этот параметр составил 47,8±1,3 с (36,4±1,5 с у мужчин и 60 с у женщин (p ˂0,05)). Среди пациентов с саркопенией пробу не прошло 51,6% больных.
Медиана уровня mTOR в общей группе составила 8,32±0,3 нг/мл (у мужчин — 8,42±0,4 нг/мл, у женщин — 8,18±0,4 нг/мл (p=0,6)). У пациентов с саркопенией его уровень был 6,61±0,4 нг/мл (у мужчин — 6,53±2,1 нг/мл, у женщин — 6,79±2 нг/мл (p=0,7)); без саркопении — 9,4±0,3 нг/мл (у мужчин — 9,95±2,5 нг/мл, у женщин — 8,78±2,1 нг/мл (p=0,08)).
Медиана уровня миостатина в общей группе составила 9,68±0,4 нг/мл (у мужчин — 10,25±0,5 нг/мл, у женщин — 8,89±0,4 нг/мл (p=0,05)). У пациентов с саркопенией его уровень был 12,2±0,6 нг/мл (у мужчин — 12,74±3,3 нг/мл, у женщин — 11±3,2 нг/мл (p=0,17)); без саркопении он составил 8,1±0,3 нг/мл (у мужчин — 8,24±2,2 нг/мл, у женщин — 7,95±1,2 нг/мл (p=0,5)).
При сравнении показателей mTOR и миостатина у пациентов с саркопенией и без таковой (без учёта гендерного признака) было установлено, что уровень обозначенных маркеров статистически значимо различались в этих подгруппах. Содержание mTOR в сыворотке крови больных с саркопенией было ниже, чем аналогичный показатель в подгруппе без саркопении (6,61±0,4 нг/мл и 9,4±0,3 нг/мл соответственно (p ˂0,001)). В то же время с миостатином наблюдалась обратная ситуация: его уровень был статистически значимо выше в подгруппе пациентов с саркопенией (12,2±0,6 нг/мл против 8,1±0,3 нг/мл соответственно (p ˂0,001)).
Корреляционный анализ продемонстрировал умеренную отрицательную связь уровней обсуждаемых молекулярных маркеров. Так, в общей группе прирост миостатина сопровождался снижением mTOR (r=-0,57) (рис. 1). В подгруппе пациентов с саркопенией сохранилась та же тенденция и сила корреляционной связи (r=-0,55) (рис. 2).
При оценке взаимосвязей объёма скелетно-мышечной массы пациентов общей когорты с изучаемыми биомаркерами была установлена умеренная корреляционная связь СММ с уровнями миостатина (r=-0,31) и mTOR (r=0,47) (рис. 3, 4). Среди пациентов с саркопенией отмечалась та же направленность корреляционной связи СММ с миостатином и mTOR, но её сила была значительно слабее (r=-0,2 и r=0,21 соответственно).
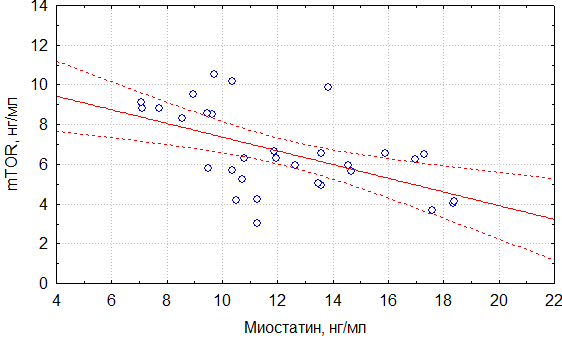
Рисунок 1. Корреляционная зависимость уровня миостатина и mTOR в общей когорте пациентов
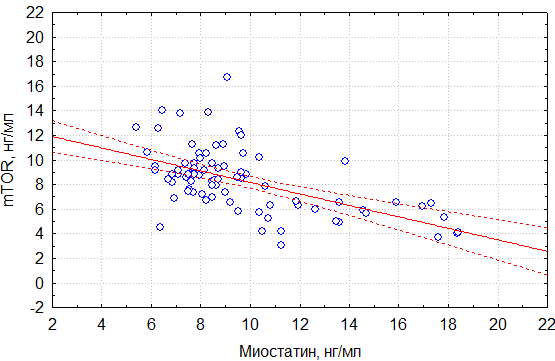
Рисунок 2. Корреляционная зависимость уровня миостатина и mTOR в подгруппе пациентов с саркопенией

Рисунок 3. Корреляционная зависимость уровня миостатина и скелетно-мышечной массы в общей когорте пациентов

Рисунок 4. Корреляционная зависимость уровня mTOR и скелетно-мышечной массы в общей когорте пациентов
В результате поиска взаимосвязей миостатина и mTOR с показателями кистевой динамометрии и пробой с поднятием ноги информативного результата получено не было, корреляций не установлено.
Обсуждение
Обнаружена высокая распространённость саркопении среди диализных пациентов, которая, по данным настоящего исследования, составила 38,75%. Были выявлены гендерные различия этого показателя, в частности среди мужчин сниженная мышечная масса встречалась статистически значимо чаще, чем среди женщин, что, вероятно, связано не только с гормональным фоном, но и большей распространённостью других факторов, связанных с основным заболеванием, а также с большим ограничением физической активности после развития ТПН и потребности в проведении ЗПТ, чем у женщин и др. В то же время стоит отметить, что во всех подгруппах объём СММ мужчин был статистически значимо выше, чем у женщин.
Мышечная сила, оцениваемая по результатам кистевой динамометрии, не выявила значимого снижения этого параметра (отклонения от нормы составили 8,8%), что, очевидно, было связано, с возрастными особенностями выборки (средний возраст в общей группе — 51,7±11,6 лет), а также, вероятно, индивидуальными адаптивными возможностями организма пациентов. Несмотря на то, что кистевая динамометрия не обладает высокой чувствительностью и специфичностью в отношении характеристики мышечной силы, она является валидизированным методом, применяемым с этой целью. Для повышения информативности методики её следует применять в комплексе с другими тестами.
Проба с поднятием ноги не продемонстрировала значимых различий между группами с саркопенией и без неё. Однако её не смогло пройти большее число участников исследования по сравнению с количеством тех, у кого на кистевой динамометрии была выявлена сниженная мышечная сила. Результат пробы также зависит от многих факторов, в том числе от психологического статуса больного, уровня тренированности и др. В этой связи использование данной методики имеет своё практическое значение только при комплексном подходе к обследованию пациента.
Стоит отметить, что продолжительность применения программного гемодиализа не влияли на такие показатели, как объём СММ, мышечная сила, мышечная производительность. Однако этот фактор может внести свой вклад при построении прогностической модели вероятности развития саркопении у пациентов, получающих лечение гемодиализом.
Прогностически важным можно считать статистически значимые различия в уровнях mTOR и миостатина в подгруппах пациентов с саркопенией и без неё. Очевидно, что связанные с наличием ТПН уремия, оксидативный стресс, системный воспалительный процесс, метаболический ацидоз, гипоксия и другие процессы потенцируют образование миостатина. Он играет роль стартового маркера для запуска внутриклеточного каскада, приводящего к торможению другой сигнальной молекулы mTOR, которая в итоге индуцирует аутофагию и распад белка, замедляя его синтез. В результате этих взаимодействий происходит потеря мышечной ткани и развивается саркопения.
Выводы
Проведённое исследование было призвано поднять проблему распространённости такой важной медико-социальной проблемы, как саркопения у пациентов с ХБП, получающих заместительную почечную терапию. В настоящее время единые подходы к поддержанию мышечной массы, а также клинические рекомендации по коррекции саркопении в этой группе больных не разработаны. В этой связи полученные данные могут иметь не только научное, но и практическое значение. Молекулярные показатели обмена мышечной ткани миостатин и mTOR продемонстрировали свой диагностический потенциал и могут быть использованы в качестве перспективных маркеров саркопении для построения прогностической модели оценки вероятности развития этого клинического состояния.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Клинические рекомендации. Хроническая болезнь почек (ХБП). Нефрология. 2021;25(5):10-82.
2. Есаян А.М., Арутюнов Г.П., Мелихов О.Г. Распространенность хронической болезни почек среди пациентов, обратившихся в учреждения первичной медико-санитарной помощи. Результаты проспективного наблюдательного исследования в 12 регионах России. Клиническая нефрология. 2021;3:6-16. DOI: 10.18565/nephrology.2021.3.6-16.
3. Kidney Disease: Improving Global Outcomes (KDIGO) Diabetes Work Group. KDIGO 2020 Clinical Practice Guideline for Diabetes Management in Chronic Kidney Disease. Kidney Int. 2020;98(4S):S1-S115. DOI: 10.1016/j.kint.2020.06.019.
4. Kidney Disease: Improving Global Outcomes (KDIGO) Blood Pressure Work Group. KDIGO 2021 Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease. Kidney Int. 2021;99(3S):S1-S87. DOI: 10.1016/j.kint.2020.11.003.
5. Томилина Н.А., Андрусев А.М., Перегудова Н.Г., Шинкарев М.Б. Заместительная терапия терминальной хронической почечной недостаточности в Российской Федерации в 20102015 гг. Отчет по данным Общероссийского Регистра заместительной почечной терапии Российского диализного общества, Часть первая. Нефрология и диализ. 2017;19(4):1-95. DOI: 10.28996/1680-4422-2017-4suppl-1-95.
6. Котенко О.Н., Васина Н.В., Марченкова Л.В., Лысенко М.А. Состояние заместительной терапии хронической почечной недостаточности в Москве в 2015-2020 гг. Клиническая нефрология. 2021;13(1):13-19. DOI: 10.18565/nephrology.2021.1.13-19.
7. Sabatino A, Cuppari L, Stenvinkel P, Lindholm B, Avesani CM. Sarcopenia in chronic kidney disease: what have we learned so far? J Nephrol. 2021;34(4):1347-1372. DOI: 10.1007/s40620-020-00840-y.
8. Соколова А.В., Драгунов Д.О., Арутюнов Г.П., Митрохин В.М. Прогностическое значение саркопении у пациентов с ХБП. Клиническая нефрология. 2019;1:48-55. DOI: 10.18565/nephrology.2019.1.48-55.
9. Cruz-Jentoft AJ, Sayer AA. Sarcopenia. Lancet. 2019;393(10191):2636-2646. DOI: 10.1016/S0140-6736(19)31138-9. Epub 2019 Jun 3. Erratum in: Lancet. 2019;393(10191):2590. PMID: 31171417.
10. Carvalho do Nascimento PR, Poitras S, Bilodeau M. How do we define and measure sarcopenia? Protocol for a systematic review. Syst Rev. 2018;7(1):51. DOI: 10.1186/s13643-018-0712-y.
11. Cruz-Jentoft AJ, Bahat G, Bauer J, Boirie Y, Bruyere O, Cederholm T, et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 2019;48(1):16-31. DOI: 10.1093/ageing/afy169. Erratum in: Age Ageing. 2019;48(4):601. PMID: 30312372; PMCID: PMC6322506.
12. Souza VA, Oliveira D, Barbosa SR, Correa JODA, Colugnati FAB, Mansur HN, et al. Sarcopenia in patients with chronic kidney disease not yet on dialysis: Analysis of the prevalence and associated factors. PLoS One. 2017;12(4):e0176230. DOI: 10.1371/journal.pone.0176230.
13. Лаврищева Ю.В., Румянцев А.Ш., Захаров М.В., Кулаева Н.Н., Сомова В.М. Саркопения - актуальная проблема при хронической болезни почек 5д стадии. Нефрология. 2020;24(1):60-66. DOI: 10.36485/1561-6274-2020-24-1-60-66.
14. Смирнов А.В., Голубев Р.В., Коростелева Н.Ю., Румянцев А.Ш. Снижение физической работоспособности у больных, получающих заместительную почечную терапию: фокус на саркопению. Нефрология. 2017;21(4):9-29. DOI: 10.24884/1561-6274-2017-21-4-9-29
15. Борханова Э.Г., Исламова Г.М., Максудова А.Н. Частота нарушений питания у пациентов пожилого и старческого возраста с хронической болезнью почек. Практическая медицина. 2021;19(4):89-92. eLIBRARY ID: 47311783.
16. Moorthi RN, Avin KG. Clinical relevance of sarcopenia in chronic kidney disease. Curr Opin Nephrol Hypertens. 2017;26(3):219-228. DOI: 10.1097/MNH.0000000000000318.
17. Сафроненко В.А., Чесникова А.И., Сафроненко А.В., Скаржин-ская Н.С., Кузнецов И.И., Насытко А.Д. Клинические особенности хронической сердечной недостаточности у пациентов с артериальной гипертензией и синдромом старческой астении: наблюдательное кросс-секционное исследование. Кубанский научный медицинский вестник. 2021;28(4):25-40. DOI: 10.25207/1608-6228-2021-28-4-25-40.
18. Sato E, Mori T, Mishima E, Suzuki A, Sugawara S, Kurasawa N, et al. Metabolic alterations by indoxyl sulfate in skeletal muscle induce uremic sarcopenia in chronic kidney disease. Sci Rep. 2016;6:36618. DOI: 10.1038/srep36618.
19. Асанбек А.К., Сезер С. Две стороны одной медали: роль недостаточного и избыточного веса в патогенезе хронической болезни почек. Нефрология и диализ. 2019;21(3):292-300. DOI: 10.28996/2618-9801-2019-3-292-300.
20. Wang DT, Yang YJ, Huang RH, Zhang ZH, Lin X. Myostatin Activates the Ubiquitin-Proteasome and Autophagy-Lysosome Systems Contributing to Muscle Wasting in Chronic Kidney Disease. Oxid Med Cell Longev. 2015;2015:684965. DOI: 10.1155/2015/684965.
21. Bataille S, Chauveau P, Fouque D, Aparicio M, Koppe L. Myostatin and muscle atrophy during chronic kidney disease. Nephrol Dial Transplant. 2021;36(11):1986-1993. DOI: 10.1093/ndt/gfaa129.
22. Tan KT, Ang SJ, Tsai SY. Sarcopenia: Tilting the Balance of Protein Homeostasis. Proteomics. 2020;20(5-6):e1800411. DOI: 10.1002/pmic.201800411.
23. Liu J, Pan M, Huang D, Guo Y, Yang M, Zhang W, et al. Myostatin-1 Inhibits Cell Proliferation by Inhibiting the mTOR Signal Pathway and MRFs, and Activating the Ubiquitin-Proteasomal System in Skeletal Muscle Cells of Japanese Flounder Paralichthys olivaceus. Cells. 2020;9(11):2376. DOI: 10.3390/cells9112376.
24. Zhang YY, Gu LJ, Huang J, Cai MC, Yu HL, Zhang W, et al. CKD autophagy activation and skeletal muscle atrophy-a preliminary study of mitophagy and inflammation. Eur J Clin Nutr. 2019;73(6):950-960. DOI: 10.1038/s41430-018-0381-x
25. Hirai K, Ookawara S, Morishita Y. Sarcopenia and Physical Inactivity in Patients With Chronic Kidney Disease. Nephrourol Mon. 2016;8(3):e37443. DOI: 10.5812/numonthly.37443.
26. Honda H, Qureshi AR, Axelsson J, Heimburger O, Suliman ME, Barany P, et al. Obese sarcopenia in patients with end-stage renal disease is associated with inflammation and increased mortality. Am J Clin Nutr. 2007;86(3):633-8. DOI: 10.1093/ajcn/86.3.633.
Об авторах
М. З. ГасановРоссия
Гасанов Митхат Зульфугарович – кандидат медицинских наук, доцент кафедры внутренних болезней №1.
Ростов-на-Дону.
М. М. Батюшин
Россия
Батюшин Михаил Михайлович – доктор медицинских наук, профессор, профессор кафедры внутренних болезней №2.
Ростов-на-Дону.
В. П. Терентьев
Россия
Терентьев Владимир Петрович - доктор медицинских наук, профессор, заведующий кафедрой внутренних болезней №1.
Ростов-на-Дону.
В. В. Хатламаджиян
Россия
Хатламаджиян Вячеслав Владимирович – студент.
Ростов-на-Дону.
Ю. В. Кузнецова
Россия
Кузнецова Юлия Витальевна – студентка.
Ростов-на-Дону.
Т. Ю. Рябоконева
Россия
Рябоконева Татьяна Юрьевна – студентка.
Ростов-на-Дону.
Дополнительные файлы
Рецензия
Для цитирования:
Гасанов М.З., Батюшин М.М., Терентьев В.П., Хатламаджиян В.В., Кузнецова Ю.В., Рябоконева Т.Ю. Влияние хронической болезни почек на метаболизм мышечной ткани у пациентов на гемодиализе. Южно-Российский журнал терапевтической практики. 2022;3(1):83-88. https://doi.org/10.21886/2712-8156-2022-3-1-83-88
For citation:
Gasanov M.Z., Batyushin M.M., Terentyev V.P., Khatlamadzhiyan V.V., Kuznetsova Yu.V., Ryabokoneva T.Yu. The impact of chronic kidney disease on muscle tissue metabolism in patients undergoing hemodialysis. South Russian Journal of Therapeutic Practice. 2022;3(1):83-88. (In Russ.) https://doi.org/10.21886/2712-8156-2022-3-1-83-88
JATS XML


























