Перейти к:
Микроциркуляторные изменения у пациентов с хронической обструктивной болезнью легких и артериальной гипертензией
https://doi.org/10.21886/2712-8156-2022-3-1-34-41
Аннотация
Цель: изучить динамику показателей микроциркуляторного русла у пациентов с артериальной гипертензией, хронической обструктивной болезнью легких, и при их сочетании. Материал и методы: в исследование было включено 226 человек (66 пациентов с хронической обструктивной болезнью легких, 54 — с артериальной гипертензией, 74 пациента — с сочетанием хронической обструктивной болезни лёгких и артериальной гипертензии, 32 относительно здоровых добровольца). С целью оценки мироциркуляторного русла использовали ультразвуковой компьютеризированный допплерограф Минимакс-допплер-К, ООО СП «Минимакс». Результаты: у пациентов с ХОБЛ и АГ наблюдается дезадаптация микроциркуляторного русла, проявляющаяся парадоксальной реакцией на раздражители в виде непрямого окклюзионного воздействия. При изучении корреляционных взаимосвязей между показателями микроциркуляторного русла и клинико-инструментальными данными было установлено, что возраст, индекс курящего человека, систолическое артериальное давление, пульсовое артериальное давление имеют взаимосвязь с линейными скоростями кровотока в микроциркуляторном русле. Также установлена корреляционная взаимосвязь между ОФВ1 и линейной скоростью кровотока у пациентов с ХОБЛ и ХОБЛ и АГ. Заключение: ХОБЛ и АГ, являясь коморбидными состояниями, приводят к более выраженным микроциркуляторным изменениям, что может оказывать взаимное влияние на течение данных заболеваний.
Ключевые слова
Для цитирования:
Глова С.Е., Хаишева Л.А., Разумовский И.В., Шлык С.В. Микроциркуляторные изменения у пациентов с хронической обструктивной болезнью легких и артериальной гипертензией. Южно-Российский журнал терапевтической практики. 2022;3(1):34-41. https://doi.org/10.21886/2712-8156-2022-3-1-34-41
For citation:
Glova S.E., Khaisheva L.A., Razumovsky I.V., Shlyk S.V. Microcirculatory changes in patients with chronic obstructive pulmonary disease and arterial hypertension. South Russian Journal of Therapeutic Practice. 2022;3(1):34-41. (In Russ.) https://doi.org/10.21886/2712-8156-2022-3-1-34-41
Введение
Сочетание сердечно-сосудистой патологии и хронической обструктивной болезни легких (ХОБЛ) — частая клиническая ситуация, которая встречается в терапевтической практике [1][2]. Результаты клинических наблюдений показывают, что сердечно-сосудистые заболевания (ССЗ) у больных ХОБЛ встречаются в 2 раза чаще, чем у пациентов, которые не страдают ХОБЛ [3]. При прогрессировании ХОБЛ нарастают дыхательные нарушения, ухудшается прогноз пациентов, при этом установлено, что снижение объёма форсированного выдоха за первую секунду манёвра форсированного выдоха (ОФВ1) является фактором сердечно-сосудистой смертности у данной когорты пациентов [4][5].
Среди сердечно-сосудистой патологии у больных ХОБЛ наиболее часто встречается артериальная гипертензия (АГ), составляя в среднем 34,3% [6][7][8][9]. У мужчин с АГ ХОБЛ выявляется в 1,9 раза чаще, чем у женщин, и частота диагностики ХОБЛ у них прогрессивно увеличивается с возрастом, достигая максимальных значений в возрасте 80–89 лет (12,8%) [10].
Установлено, что по мере нарастания распространённости АГ и сердечно-сосудистых осложнений увеличивается тяжесть ХОБЛ. У пациентов с ХОБЛ АГ ухудшает прогноз и увеличивает частоту госпитализаций. Выявлены общие патогенетические механизмы развития ХОБЛ и АГ, такие как эндотелиальное повреждение, системное воспаление, нарушение баланса оксидативных и антиоксидантных систем, которые оказывают как аддитивный, так и синергетический эффекты [11].
Табачный дым является одним из раздражающих механизмов, который в результате длительного воздействия вызывает патологически усиленный воспалительной ответ дыхательных путей и способствует развитию ХОБЛ. Генетическая предрасположенность может способствовать активизации аутоиммунных процессов в легких, что обусловливает продолжение воспалительной реакции в бронхолегочной системе даже после отказа пациента от курения. Патологически персистирующее воспаление в лёгких у пациентов с ХОБЛ способствует выбросу в кровоток провоспалительных цитокинов, оксидантов, что ведёт к прогрессированию системного воспаления, инициации процессов атерогенеза, приводящих к поражению сосудов, сердца, почек [12].
Микроциркуляторные нарушения проявляются нарушением тканевой перфузии в результате изменения тромбоцитарного гемостаза и реологии крови. При сочетании АГ с ХОБЛ регистрируются патологические типы микроциркуляции, возникающие в результате нарушений реологических свойств крови, внутрисосудистой агрегацией эритроцитов и тромбоцитов, а также локальным стазом в микроциркуляторном русле. Эти процессы тесно связаны с развитием гипоксии, гиперкапнии в результате вентиляционно-перфузионных нарушений [13].
Увеличение распространённости сочетания ХОБЛ и ССЗ, изучение данных об их взаимном влиянии определяет необходимость дальнейшего исследования данной сочетанной патологии с целью разработки новых терапевтических подходов [14][15][16][17][18][19]. Поэтому представляет интерес изучение микроциркуляторных изменений как дополнительного фактора, влияющего на течение заболевания у пациентов с ХОБЛ и АГ.
Цель исследования — изучение динамики показателей микроциркуляторного русла у пациентов с АГ, ХОБЛ и при их сочетании.
Материал и методы
Для достижения целей исследования было проведено комплексное клинико-инструментальное обследование 226 пациентов, которые были разделены на четыре основные группы: первая группа — пациенты с ХОБЛ (66 человек, 29,20%), средний возраст — 63,70±5,88 лет; вторая группа — пациенты с АГ (54 человека, 23,89%), средний возраст — 63,09±5,46 лет; третья группа — пациенты с ХОБЛ и сопутствующей АГ (74 человека, 32,74%), средний возраст — 65,38±7,26 лет; четвёртая группа (контрольная) — 32 относительно здоровых добровольца (14,16%), средний возраст — 62,43±4,27 лет.
Проведение данного исследования было одобрено локальным этическим комитетом.
Диагноз ХОБЛ устанавливали в соответствии с клиническими рекомендациями МЗ РФ «Хроническая обструктивная болезнь лёгких» (пересмотр 2018 г.), АГ в соответствии с клиническими рекомендациями МЗ РФ «Артериальная гипертензия у взрослых» (2020 г.) [20][21].
Измерение уровня артериального давления на этапе скрининга осуществлялось с помощью прибора тонометр на плечо Omron M2 Eco/HEM-7051.
Анализ статуса курения проводили в соответствии с методическими рекомендациям «Практическое руководство по лечению табачной зависимости» (под редакцией Чучалина А.Г., 2001 г.), проводили расчёт индекса курящего человека (ИКЧ) по формуле количество выкуренных в день сигарет × 12 месяцев в году, которые человек курил.
Спирометрическое исследование проводили на аппарате Manual Calibration Syringe, серийный номер 720252 – 95104661, с максимальной погрешностью ± 12,0 мл.
Для изучения микроциркуляторного русла использовали ультразвуковой компьютеризированный допплерограф Минимакс-допплер-К, ООО СП «Минимакс», Санкт-Петербург (удостоверение о регистрации прибора от 18.09.2007 № ФСР 2007/00810), применяли транскутанный датчик общего применения 20 МГц в области ногтевого валика третьего пальца кисти.
Рассчитывали линейные скорости по кривой максимальной (см/с): VS — максимальную линейную систолическую скорость по кривой максимальной скорости, VM — среднюю линейную скорость по кривой максимальной скорости, VD — конечную диастолическую скорость по кривой максимальной скорости; линейные скорости по кривой средней скорости (см/с): Vas — максимальную линейную систолическую скорость по кривой средней скорости, Vam — среднюю линейную скорость по кривой средней скорости, Vakd — конечную линейную диастолическая скорость по кривой средней скорости. Оценивали индекс резистентности (RI), который отражает состояние сопротивления кровотоку дистальнее места измерения в условных единицах. Также оценивали пульсаторный индекс (PI), который отражает упруго-эластические свойства исследуемых артерий в условных единицах.
С целью исследования вазодилататорных реакций микроциркуляторного русла использовали функциональную пробу для оценки вазомоторной функции эндотелия (окклюзионную (манжеточную) пробу).
Для статистической обработки результатов исследования использовали пакет прикладных программ STATISTICA 10.0 и стандартный пакет программ Microsoft Excel 2016. Данные представлены в виде среднего значения с указанием стандартного отклонения. Статистически значимым считали сравнение различий между значениями соответствующих показателей в сравниваемых группах с помощью критерия Стьюдента с поправкой Бонферрони с уровнем значимости р <0,05, однофакторного дисперсионного анализа (ANOVA) с определением уровня значимости р <0,05.
Результаты
Анализ полученных данных (табл. 1) продемонстрировал, что пациенты всех групп были сопоставимы по возрасту (p ³0,05). ОФВ1 и индекс Тиффно у пациентов с коморбидной бронхолёгочной и сердечно-сосудистой патологиями был статистически значимо меньше, чем у пациентов, страдающих ХОБЛ, а также был статистически значимо меньше, чем у практически здоровых пациентов и пациентов, страдающих АГ (p <0,05). ИКЧ статистически значимо не различался в группах ХОБЛ и ХОБЛ и АГ (p ³0,05) и был статистически значимо выше в данных группах по сравнению с показателями у пациентов второй и четвёртой групп (p <0,05).
Таблица 1
Исходные значения показателей микроциркуляторного русла
|
Показатель
|
I ГРУППА ХОБЛ, n=66 |
II ГРУППА АГ, n=54
|
III ГРУППА ХОБЛ и АГ, n=74 |
IV ГРУППА Практически здоровые, n=32 |
|
Возраст, годы |
63,70±5,88 |
63,09±5,46 |
65,38±7,26 |
62,43±4,27 |
|
ИКЧ, пачка/лет |
37,25±10,82* |
6,86±2,44@ Ƚ |
36,40±9,8 ₡ |
1,17±2,67 Ψ |
|
ОФВ 1, % |
50,41±9,3* |
85,25±5,82@ Ƚ |
48,68±8,72₡ |
89,35±5,36 Ψ |
|
ОФВ1/ФЖЕЛ, %
|
58,68±5,53* |
88,59±3,98@ Ƚ |
56,32±7,69₡ |
92,74±4,51 Ψ |
|
Линейные скорости кровотока по кривой средней скорости |
||||
|
Vаs, см/с |
0,63±0,15*# |
0,75±0,11@ Ƚ |
0,89±0,18₡ |
0,46±0,16 Ψ |
|
Vаm, см/с |
0,02±0,004# |
0,03±0,006@ Ƚ |
0,05±0,008₡ |
0,01±0,002 Ψ |
|
Vаkd, см/с |
0,02±0,01*# |
0,07±0,01@ Ƚ |
0,09±0,0₡ |
0,01±0,01 Ψ |
|
Линейные скорости кровотока по кривой максимальной скорости |
||||
|
Vs, см/с |
6,71±1,18*# |
10,14±2,15@ Ƚ |
12,78±2,35₡ |
6,39±1,42 |
|
Vm, см/с |
2,36±0,24*# |
3,14±0,47@ Ƚ |
4,83±0,09₡ |
1,24±0,71 Ψ |
|
Vd, см/с |
0,79±0,19*# |
1,04±0,15 Ƚ |
1,08±0,17₡ |
0,53±0,11 Ψ |
|
Индексы |
||||
|
PI |
4,71±1,14# |
4,49±1,12@ Ƚ |
3,16±1,0₡ |
6,26±1,13 Ψ |
|
RI |
0,83±0,04*# |
0,62±0,02@ Ƚ |
0,46±0,02₡ |
0,94±0,03 Ψ |
Измерение линейных скоростей кровотока в микроциркуляторном русле показало, что максимальная линейная систолическая скорость кровотока по кривой средней скорости (Vas) среди пациентов первой группы (ХОБЛ) изменялась от 0,472 до 0,727 см/с и составила в среднем 0,63±0,15 см/с, у пациентов второй группы (АГ) — от 0,573 до 0,810 см/с, в среднем составив 0,75±0,11см/с, у пациентов третьей группы (ХОБЛ и АГ) — от 0,676 до 1,047 см/с, в среднем 0,89±0,18 см/с. Статистически значимо более высокие скорости наблюдались у пациентов, страдающих сочетанной сердечно-сосудистой и бронхолёгочной патологией, чем среди пациентов, страдающих ХОБЛ и практически здоровых, у которых Vas варьировалась от 0,31 до 0,57 см/с, составила в среднем 0,46±0,16 см/с (р <0,05).
При изучении максимальной линейной систолической скорости по кривой максимальной скорости (Vs) выявлено, что пациенты первой группы имели статистически значимо меньшие значения чем пациенты второй и третьей групп — 10,14±2,15 см/с и 12,78±2,35 см/с, соответственно (р <0,05). Пациенты, страдающие ХОБЛ, имели сопоставимые значения максимальной линейной систолической скорости в сравнении со здоровыми лицами — 6,71±1,18 см/с и 6,39±1,42 см/с.
Средняя линейная скорость кровотока по кривой средней скорости (Vam) была минимальна у здоровых пациентов (0,01±0,002 см/с) и статистически значимо отличалась от показателей пациентов первой, второй и третьей групп (р <0,05). Статистически значимо большие показатели регистрировались у пациентов первой (ХОБЛ) (0,02±0,004 см/с) и второй групп (АГ) (0,03±0,006 см/с), достигая максимальных значений у пациентов третьей группы (ХОБЛ и АГ) (0,05±0,008 см/с) (р <0,05).
Средняя линейная скорость по кривой максимальной скорости (Vm) у пациентов, страдающих ХОБЛ, не отличалась от средней линейной скорости у здоровых лиц (2,36±0,24 см/с и 2,24±0,71 см/с). Средние линейные скорости пациентов с АГ, а также больных с ХОБЛ и АГ были статистически значимо выше — 3,14±0,47 см/с (2,373–3,79 см/с) и 4,83±0,09 см/с (3,796–5,19 см/с) соответственно (р <0,05).
Схожая картина наблюдалась и при анализе конечной линейной скорости по кривой огибающей средней скорости (Vakd). Vakd не отличалась у пациентов, страдающих ХОБЛ и здоровых лиц, средние значения составили 0,021±0,01 см/с и 0,01±0,01 см/с. Vakd среди пациентов с АГ была сопоставима с Vakd пациентов с сочетанной патологией и статистически значимо превышала скорости пациентов первой и четвёртой групп (0,07±0,01 см/с (от 0,042 до 0,085 см/с) и 0,09±0,02 (0,041 до 0,132) соответственно (р<0,05)).
Не установлено статистически значимых отличий конечной линейной скорости по кривой максимальной скорости (Vd) у пациентов с ХОБЛ и практически здоровых лиц, в среднем 0,69±0,11 см/с и 0,53±0,19 см/с. Хотя Vd была статистически значимо меньше у пациентов с АГ и у пациентов, страдающих сочетанной патологией, — от 0,861 до 1,254 см/с (в среднем 1,04±0,15 см/с) и от 0,711 до 1,321 см/с (в среднем 1,08±0,17 см/с) (р <0,05).
Количественный анализ допплеровских кривых включал в себя также расчёт пульсационного индекса Горслинга (PI) и индекса периферического сопротивления Пурсело (RI). Индекс PI у здоровых добровольцев был статистически значимо выше, чем среди всех исследуемых групп пациентов, и составил в среднем 6,26±1,13 (р <0,05). Для индекса RI минимальные значения были установлены в группе ХОБЛ и АГ, также индекс RI имел статистически значимые отличия между группами (р <0,05).
Проанализировав полученные данные, можно заключить, что по большинству показателей наблюдались изменения в характеристиках микроциркуляторного русла, но в связи с разной вариацией значений не все являлись статистически значимыми.
Результаты проведения окклюзионной пробы представлены на рисунке 1.
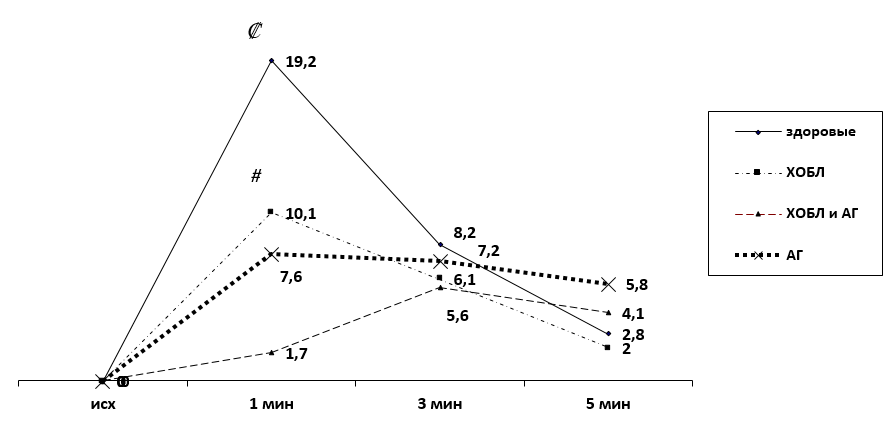
Рисунок 1. Динамика средней линейной скорости кровотока по кривой средней скорости в ответ на окклюзионную пробу.
Примечание Сравнение различий между значениями соответствующих показателей в группах с определением уровня значимости р <0,05: * — у пациентов с ХОБЛ по сравнению с пациентами с АГ; # — у пациентов с ХОБЛ по сравнению с пациентами с ХОБЛ и АГ; @ — у пациентов с ХОБЛ и АГ по сравнению с пациентами с АГ; Ƚ — у пациентов с АГ по сравнению со здоровыми добровольцами; Ψ — у пациентов с ХОБЛ по сравнению со здоровыми добровольцами; ₡ — у пациентов с ХОБЛ и АГ по сравнению со здоровыми добровольцами.
Практически здоровые лица должным образом реагировали на окклюзию сосудов, прирост кровотока составил 19,2%, что статистически значимо выше по сравнению с пациентами с ХОБЛ и АГ (p ˂0,05). К третьей минуте скорость кровотока в микроциркуляторном русле начинала снижаться до 8,2% (более чем на 10%), а уже к пятой минуте была сопоставима с исходной — 2,8%.
Среди пациентов, страдающих АГ, с первой минуты наблюдалась вазодилатация до 7,6%, схожая с реакцией здоровых лиц, однако должного прироста кровотока не наблюдалось. К пятой минуте прирост кровотока в среднем превышал исходный показатель на 5,8%, отличия статистически не значимы (p ³0,05).
У пациентов, страдающих ХОБЛ и АГ, на первой минуте после окклюзионного воздействия прирост кровотока был минимальным, сопоставимым с исходным значением (1,7%). К третьей минуте прирост кровотока увеличился, составив 5,6%, и наблюдалась вазодилатация, снижение кровотока к пятой минуте было замедлено и составило 4,1%. В отличие от пациентов с сочетанной патологией, у пациентов, страдающих только ХОБЛ, уже на первой минуте увеличился кровоток до 10,1% (p ˂0,05), затем наблюдалось снижение показателя до 6,1% на третьей минуте и до 2,0% на пятой минуте.
Анализируя представленные выше данные, можно прийти к выводу, что пациенты, страдающие АГ и ХОБЛ или одним из этих заболеваний, неадекватно реагируют на раздражители в виде непрямого окклюзионного воздействия, особенно пациенты с сочетанием ХОБЛ и АГ, у которых реакции парадоксальны.
При изучении корреляционных взаимосвязей между показателями микроциркуляторного русла и клинико-лабораторными данными были выявлены следующие результаты (таблица 3).
Таблица 2
Корреляционные показатели микроциркуляторного русла с клинико-лабораторными данными пациентов, страдающих ХОБЛ
|
Показатель |
Vas |
Vam |
Vakd |
Vs |
Vm |
Vd |
PI |
RI |
|
|
Возраст |
r |
0,4071 |
-0,4213 |
0,4840 |
0,5756 |
0,4490 |
0,5231 |
0,2945 |
-0,4636 |
|
p |
0,0449 |
0,0643 |
0,0306 |
0,0000 |
0,0670 |
0,0180 |
0,2075 |
0,0395 |
|
|
ИКЧ |
r |
0,0332 |
-0,0463 |
-0,0922 |
0,5141 |
0,4634 |
0,3963 |
0,3216 |
-0,4808 |
|
p |
0,0895 |
0,8462 |
0,6991 |
0,00003 |
0,0396 |
0,0836 |
0,1668 |
0,0319 |
|
|
САД |
r |
0,0641 |
0,0418 |
0,1427 |
0,4397 |
0,6217 |
0,4161 |
0,0699 |
-0,0443 |
|
p |
0,0211 |
0,7417 |
0,2844 |
0,0064 |
0,0022 |
0,0648 |
0,7415 |
0,9796 |
|
|
ДАД |
r |
0,0522 |
-0,0224 |
-0,2731 |
0,5127 |
0,4778 |
0,3120 |
0,1634 |
0,1466 |
|
p |
0,7493 |
0,9477 |
0,0892 |
0,1221 |
0,1146 |
0,0467 |
0,3772 |
0,4776 |
|
|
ПАД
ЧСС |
r |
-0,3410 |
-0,4693 |
-0,0450 |
0,4277 |
0,2651 |
0,0760 |
-0,2462 |
-0,2746 |
|
p |
0,0743 |
0,0766 |
0,6743 |
0,0073 |
0,1133 |
0,6671 |
0,0911 |
0,0948 |
|
|
r |
0,0472 |
0,1664 |
0,0319 |
0,3393 |
0,4155 |
0,1465 |
0,3344 |
-0,2314 |
|
|
p |
0,9194 |
0,3517 |
0,8604 |
0,1276 |
0,1447 |
0,2731 |
0,1211 |
0,0706 |
|
Как видно из представленной таблицы, возраст и ИКЧ имеет статистически значимую взаимосвязь средней силы с максимальной линейной систолической скоростью по кривой максимальной скорости (рисунок 2, 3).
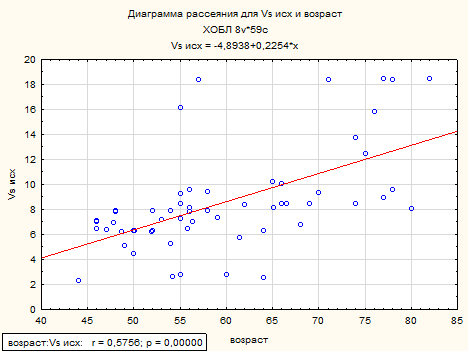
Рисунок 2. Корреляционная взаимосвязь между возрастом и максимальной линейной скоростью кровотока у пациентов с ХОБЛ.
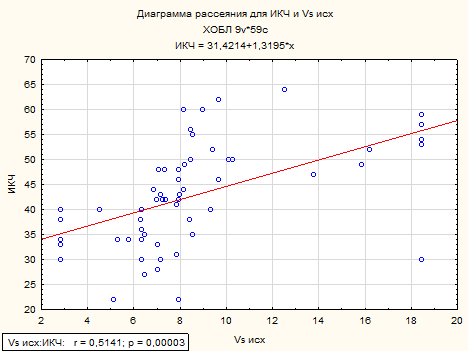
Рисунок 3. Корреляционная взаимосвязь между индексом курящего человека и максимальной линейной систолической скоростью по кривой максимальной скорости у пациентов с ХОБЛ.
Полученные результаты подтверждают литературные данные о том, что основные спирометрические показатели пациентов, страдающих ХОБЛ, находятся в корреляционной взаимосвязи с показателями микроциркуляторного русла пациентов. Так, жизненная и функциональная жизненная ёмкости лёгких имеет отрицательную взаимосвязь с максимальной линейной скоростью кровотока (р <0,05), установлена отрицательная корреляционная взаимосвязь между ОФВ1 и Vs (рисунок 4).
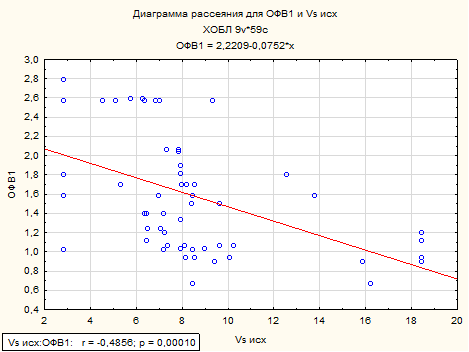
Рисунок 4. Корреляционная взаимосвязь между ОФВ1 и максимальной линейной систолической скоростью по кривой максимальной скорости у пациентов с ХОБЛ.
Анализ спирометрических показателей пациентов третьей группы страдающих ХОБЛ и АГ установил, что ОФВ1 также имеет статистически значимую отрицательную взаимосвязь с линейными скоростями кровотока в микроциркуляторном русле (рисунок 5).
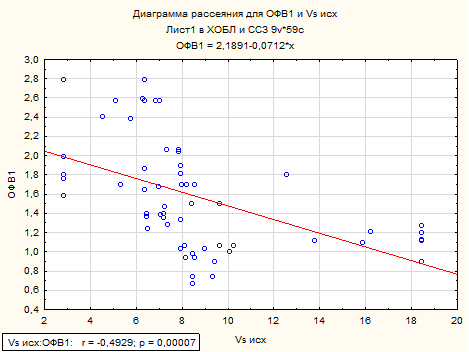
Рисунок 5. Корреляционная связь между ОФВ 1 и максимальной линейной систолической скоростью по кривой максимальной скорости у пациентов с ХОБЛ и АГ.
Обсуждение
Микроциркуляторные нарушения являются важным маркером прогрессирования сосудистых нарушений у пациентов с ХОБЛ и АГ [3]. Ранее, по данным лазерной допплеровской флоуметрии, были выявлены отличия микроциркуляторных нарушений у пациентов с разными стадиями течения ХОБЛ и определены типы микроциркуляции, которые наблюдаются по мере прогрессирования ХОБЛ.
Проведенное нами исследование позволило выявить особенности микроциркуляторных нарушений у пациентов с ХОБЛ и АГ и сравнить их с пациентами с ХОБЛ и практически здоровыми испытуемыми. Анализ изменений микроциркуляторного русла по данным ультразвуковой допплерографии позволил определить, что группа пациентов с ХОБЛ и АГ имеет наиболее выраженные микроциркудяторные нарушения, что, возможно, связано со взаимным потенциированием механизмов, которые могут оказывать стимулирующее влияние на прогрессирование данных заболеваний.
Компоненты сигаретного дыма могут усиливать вазоконстрикцию в моделях кратковременного воздействия сигаретного дыма. Хроническое воспаление на фоне разрушенного лёгкого с измененным микробиомом и повышенной восприимчивостью к инфекциям и аутоиммунитету может дополнительно усилить/спровоцировать поражение сосудов у пациентов со значительной гипоксемией [12].
Эти патогенетические процессы могут взаимно влиять друг друга и усугублять микроцируляторные нарушения. Подтверждением этого служит наличие выявленной взаимосвязи между ОФВ1, определяющим степень выраженности изменений функции внешнего дыхания при ХОБЛ, и скоростными микроциркуляторными характеристиками у пациентов с ХОБЛ и ХОБЛ и АГ.
Выводы
У пациентов с сочетанием ХОБЛ и АГ наблюдается дезадаптация микроциркуляторного русла, проявляющаяся парадоксальной реакцией на раздражители в виде непрямого окклюзионного воздействия.
При изучении корреляционных взаимосвязей между показателями микроциркуляторного русла и клинико-инструментальными данными было установлено, что возраст, ИКЧ, систолическое артериальное давление, пульсовое артериальное давление имеют взаимосвязь с линейными скоростями кровотока в микроциркуляторном русле. Также установлена корреляционная взаимосвязь между ОФВ1 и линейной скоростью кровотока у пациентов с ХОБЛ и ХОБЛ и АГ.
Таким образом, ХОБЛ и АГ, являясь коморбидными состояниями, приводят к более выраженным микроциркуляторным изменениям, что может быть объяснено взаимным усилением тканевой гипоксии, гипоксемии, оксидативного стресса, системным воспалением, ускорением процессов сосудистого повреждения.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Greulich T, Weist BJD, Koczulla AR, Janciauskiene S, Klemmer A, Lux W, et al. Prevalence of comorbidities in COPD patients by disease severity in a German population. Respir Med. 2017;132:132-138. DOI: 10.1016/j.rmed.2017.10.007.
2. Finks SW, Rumbak MJ, Self TH. Treating Hypertension in Chronic Obstructive Pulmonary Disease. N Engl J Med. 2020;382(4):353-363. DOI: 10.1056/NEJMra1805377.
3. Australian Institute of Health and Welfare. Chronic obstructive pulmonary disease (COPD), associated comorbidities and risk factors. Canberra: Australian Institute of Health and Welfare; 2020.
4. Beaty TH, Newill CA, Cohen BH, Tockman MS, Bryant SH, Spurgeon HA. Effects of pulmonary function on mortality. J Chronic Dis. 1985;38(8):703-10. DOI: 10.1016/0021-9681(85)90024-4.
5. Antonelli Incalzi R, Fuso L, De Rosa M, Forastiere F, Rapiti E, Nardecchia B, et al. Co-morbidity contributes to predict mortality of patients with chronic obstructive pulmonary disease. Eur Respir J. 1997;10(12):2794-800. DOI: 10.1183/09031936.97.10122794.
6. Задионченко В.С., Волкова Н.В., Копалова С.М. Системная и легочная гипертония при хронических неспецифических заболеваниях легких. Русский медицинский журнал. 1996;4(12):28-37.
7. Задионченко В.С., Адашева Т.В., Шилова Е.В. и др. Клиникофункциональные особенности артериальной гипертонии у больных хроническими обструктивными болезнями легких. Русский медицинский журнал. 2003;11(9):535-8.
8. Кубышкин В.Ф., Солдатченко С.С., Коновалов В.И. Особенности течения хронических обструктивных заболеваний легких в сочетании с системной артериальной гипертензией. Терапевтический архив. 1985;57(2):114-6.
9. Dart RA, Gollub S, Lazar J, Nair C, Schroeder D, Woolf SH. Treatment of systemic hypertension in patients with pulmonary disease: COPD and asthma. Chest. 2003;123(1):222-43. DOI: 10.1378/chest.123.1.222.
10. Chazova I.E., Lazareva N.V., Oshchepkova E.V. Arterial hypertension and chronic obstructive pulmonary disease: clinical characteristics and treatment efficasy (according to the national register of arterial hypertension). Therapeutic Archive. 2019;91(3):4-10. DOI: 10.26442/00403660.2019.03.000110.
11. Aliverti A, Macklem PT. How and why exercise is impaired in COPD. Respiration. 2001;68(3):229-39. DOI: 10.1159/000050502.
12. Figueira Goncalves JM, Dorta Sanchez R, Rodri Guez Perez MDC, Vina Manrique P, D^az Perez D, Guzman Saenz C, et al. Cardiovascular comorbidity in patients with chronic obstructive pulmonary disease in the Canary Islands (CCECAN study). Clin Investig Arterioscler. 2017;29(4):149-156. (In English, Spanish). DOI: 10.1016/j.arteri.2017.01.003.
13. Andreas S, Anker SD, Scanlon PD, Somers VK. Neurohumoral activation as a link to systemic manifestations of chronic lung disease. Chest. 2005;128(5):3618-24. DOI: 10.1378/chest.128.5.3618.
14. Magalhaes GS, Rodrigues-Machado MG, Motta-Santos D, Silva AR, Caliari MV, Prata LO, et al. Angiotensin-(1-7) attenuates airway remodelling and hyperresponsiveness in a model of chronic allergic lung inflammation. Br J Pharmacol. 2015;172(9):2330-42. DOI: 10.1111/bph.13057.
15. Vasileiadis IE, Goudis CA, Giannakopoulou PT, Liu T. Angiotensin Converting Enzyme Inhibitors and Angiotensin Receptor Blockers: A Promising Medication for Chronic Obstructive Pulmonary Disease? COPD. 2018;15(2):148-156. DOI: 10.1080/15412555.2018.1432034.
16. Young RP, Hopkins R, Eaton TE. Pharmacological actions of statins: potential utility in COPD. Eur Respir Rev. 2009;18(114):222-32. DOI: 10.1183/09059180.00005309.
17. Адашева Т.В., Саморукова Е.И., Долбин С.С., Ли В.В., Зади-онченко В.С., Высоцкая Н.В. Хроническая обструктивная болезнь легких и артериальная гипертензия: существуют ли особенности ведения пациентов? РМЖ. 2020;3:32-38. eLIBRARY ID: 42666140.
18. Овчаренко С.И. Сердечно-сосудистая патология у больных хронической обструктивной болезнью легких: как мы лечим? РМЖ. 2018;10(I):36-39. eLIBRARY ID: 36152068.
19. Овчаренко С. И., Нерсесян З. Н., Морозова Т. Е. Хроническая обструктивная болезнь легких в сочетании с артериальной гипертонией: оценка системного воспаления и эндотелиальной дисфункции. Пульмонология. 2015;(5):561-567. eLIBRARY ID: 25140026.
20. Клинические рекомендации. Хроническая обструктивная болезнь легких МКБ-10: J44 Год утверждения (частота пересмотра): 2018 (пересмотр каждые 3 года). ID: КР603 Российское респираторное общество.
21. Артериальная гипертензия у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(3):3786. DOI: 10.15829/1560-4071-2020-3-3786.
Об авторах
С. Е. ГловаРоссия
Глова Светлана Евгеньевна – кандидат медицинских наук, доцент кафедры терапии.
Ростов-на-Дону.
Л. А. Хаишева
Россия
Хаишева Лариса Анатольевна – доктор медицинских наук, профессор кафедры терапии.
Ростов-на-Дону.
И. В. Разумовский
Россия
Разумовский Игорь Валерьевич - аспирант кафедры терапии.
Ростов-на-Дону.
С. В. Шлык
Россия
Шлык Сергей Владимирович – доктор медицинских наук, профессор, заведующий кафедрой терапии, ректор.
Ростов-на-Дону.
Рецензия
Для цитирования:
Глова С.Е., Хаишева Л.А., Разумовский И.В., Шлык С.В. Микроциркуляторные изменения у пациентов с хронической обструктивной болезнью легких и артериальной гипертензией. Южно-Российский журнал терапевтической практики. 2022;3(1):34-41. https://doi.org/10.21886/2712-8156-2022-3-1-34-41
For citation:
Glova S.E., Khaisheva L.A., Razumovsky I.V., Shlyk S.V. Microcirculatory changes in patients with chronic obstructive pulmonary disease and arterial hypertension. South Russian Journal of Therapeutic Practice. 2022;3(1):34-41. (In Russ.) https://doi.org/10.21886/2712-8156-2022-3-1-34-41
JATS XML


























