Перейти к:
Степень ишемии-реперфузии как возможный фактор риска развития фибрилляции предсердий у пациентов с синдромом обструктивного апноэ сна
https://doi.org/10.21886/2712-8156-2023-4-4-41-50
Аннотация
Цель: выявление возможных факторов возникновения фибрилляции предсердий (ФП) у пациентов с синдромом обструктивного апноэ сна (СОАС). Материалы и методы: в ретроспективное исследование было включено 50 пациентов (38 мужчин и 12 женщин, средний возраст 53 (13) года), поступивших в центр медицины сна МНОЦ МГУ им. М.В. Ломоносова с жалобами на храп и остановки дыхания во время сна и прошедших полисомнографическое исследование. В исследование включались пациенты только со средней и тяжёлой степенью СОАС. Для всех пациентов, включённых в исследование, оценивалось наличие сопутствующей патологии (артериальной гипертензии (АГ), сахарного диабета 2 типа (СД), ишемической болезни сердца (ИБС) и синдрома беспокойных ног (СБН)). Результаты: 11 пациентов имели фибрилляцию предсердий ФП в анамнезе и/или по данным полисомнографического исследования. При оценке сердечного ритма во время полисомнографического исследования ФП имели 5 пациентов (10%), из них 1 пациент ранее не сообщал о наличии аритмии. Была разработана прогностическая модель для определения вероятности ФП в зависимости от возраста, показателя «Средняя десатурация, %» методом бинарной логистической регрессии. Полученная регрессионная модель является статистически значимой (p<0,001). При увеличении возраста на 1 шансы ФП увеличивались в 1,211 раза. При увеличении показателя «Средняя десатурация, %» на 1 шансы ФП увеличивались в 1,448 раза. Заключение: впервые показано, что наряду с таким известным фактором риска ФП, как возраст, параметры дыхательных нарушений во время сна, а именно средняя десатурация может играть роль в развитии ФП через механизмы ишемии-реперфузии миокарда. Средняя десатурация, отражающая степень ишемии-реперфузии, может стать фактором риска развития ФП.
Ключевые слова
Для цитирования:
Васюкова А.А., Калинкин А.Л. Степень ишемии-реперфузии как возможный фактор риска развития фибрилляции предсердий у пациентов с синдромом обструктивного апноэ сна. Южно-Российский журнал терапевтической практики. 2023;4(4):41-50. https://doi.org/10.21886/2712-8156-2023-4-4-41-50
For citation:
Vasiukova A.A., Kalinkin A.L. The degree of ischemia-reperfusion as a possible risk factor for the development of atrial fibrillation in patients with obstructive sleep apnea syndrome. South Russian Journal of Therapeutic Practice. 2023;4(4):41-50. (In Russ.) https://doi.org/10.21886/2712-8156-2023-4-4-41-50
Введение
Синдром обструктивного апноэ сна (СОАС) — нарушение дыхания, связанное со сном, характеризующееся повторяющимися эпизодами прекращения дыхания или существенного уменьшения дыхательного потока, несмотря на сохранение дыхательных усилий, сопровождаемое клинической симптоматикой в виде храпа, избыточной дневной сонливости, частыми ночными мочеиспусканиями и ряда других симптомов. Большинство дыхательных пауз длятся от 10 до 30 секунд, но могут продолжаться в течение одной минуты и дольше. Это может привести к резкому снижению насыщения гемоглобина крови кислородом [1].
СОАС широко распространён среди пациентов с сердечно-сосудистыми заболеваниями (ССЗ). Встречаемость СОАС у пациентов с ССЗ варьируется от 47 до 83% в зависимости от особенностей конкретного ССЗ. Наиболее часто СОАС сочетается с резистентной артериальной гипертензией (АГ), ишемической болезнью сердца (ИБС), инсультом и хронической сердечной недостаточностью1.
В настоящее время предложено рассматривать СОАС как независимый фактор риска развития сердечно-сосудистых осложнений. Этому способствует снижение насыщения гемоглобина крови кислородом, фрагментация сна и ряд других факторов.
Распространённость несмертельных сердечно-сосудистых событий у пациентов с нелеченым тяжёлым СОАС значительно выше, чем у здоровых, равно как и частота сердечно-сосудистой смерти вследствие инфаркта миокарда или инсульта [2]. Наличие СОАС связано со значительно более высоким риском сердечно-сосудистых осложнений у пациентов с острым коронарным синдромом [3]. Предшествующий инсульт повышает вероятность сердечно-сосудистых осложнений при сочетании с СОАС в 2 раза [4]. К повышению риска ССЗ также приводит сочетание СОАС и метаболического синдрома [5].
Одним из значительных аспектов взаимосвязи СОАС с сердечно-сосудистыми заболеваниями является изучение его влияния на развитие АГ. У половины пациентов, страдающих СОАС, наблюдается АГ. Люди с неизлеченным СОАС имеют от 2 до 3 раз более высокий риск развития АГ. Синдром обструктивного апноэ сна был определён как значимый фактор, в особенности связанный с резистентной АГ, что может иметь важное значение в популяциях с высокой распространённостью недиагностированного СОАС, плохо контролируемой АГ и сопутствующей ей осложнениями [6].
Физиологически и нормальное, и повышенное артериальное давление (АД) в ночное время снижается. У пациентов с СОАС во время сна АД зачастую снижается недостаточно (non-dipper) или даже превышает дневные значения (night peaker). Такой паттерн АД в течение суток увеличивает риск сердечно-сосудистых событий в ночные и ранние утренние часы. В связи с этим была предложена относительно новая классификация АГ, связанной со сном: устойчивый тип (АГ сохраняется и в дневное, и в ночное время) и тип перенапряжения (только утренняя АГ, без ночных эпизодов повышения АД) [7].
Пациенты с нарушением дыхания во сне имеют предрасположенность к аритмиям из-за изменений в активности вегетативной нервной системы со смещением в сторону преобладания тонуса симпатической нервной системы и других факторов. Механизм аритмогенеза связан с возникновением эктопических очагов, триггерной активностью водителя ритма и повторным входом возбуждения (механизм re-entry). Кроме того, связанные с нарушениями дыхания во сне механические воздействия отрицательного внутригрудного давления на свободные стенки предсердий и желудочков способствуют растяжению сердца, что может предрасполагать к аритмиям через механизмы механико-электрической обратной связи. У лиц с нарушением дыхания во сне в четыре раза выше вероятность фибрилляции предсердий (ФП), в три раза выше вероятность возникновения желудочковой тахикардии и почти в два раза выше вероятность сложной желудочковой экстрасистолии. Кроме того, у трети испытуемых с ФП наблюдается пароксизмальная форма ФП, возникающая эпизодически только во время сна [8].
Наиболее распространённой аритмией у пациентов СОАС является ФП. В настоящее время распространённость ФП (2% мировой популяции) вдвое превышает показатели, зарегистрированные за последнее десятилетие [9]. Сосуществование ФП и СОАС может быть частично объяснено общими факторами риска, включая пожилой возраст, АГ, ожирение, сахарный диабет и структурные заболевания сердца, а также взаимовлияющими патофизиологическими механизмами. К ним относят гипоксемию, повышенную активность симпатической нервной системы, окислительный стресс, системное воспаление и отрицательное внутригрудное давление.
Циклическая (интермиттирующая) гипоксия (рис. 1), связанная с апноэ во сне, сопоставима с ишемическим и реперфузионным повреждением при нарушении кровотока. Интермиттирующая гипоксия способствует индуцированию факторов транскрипции: ядерного фактора «каппа би» (NF-kB) и ядерного фактора для экспрессии интерлейкина-6 (NF-IL6). Выработка этих факторов сопровождается увеличением синтеза воспалительных цитокинов, таких как фактор некроза опухоли-альфа и интерлейкин-6. Провоспалительное состояние способствуют нарушению функции эндотелия, увеличению агрегационной активности тромбоцитов, повышению резистентности к инсулину, ремоделированию миокарда [10].
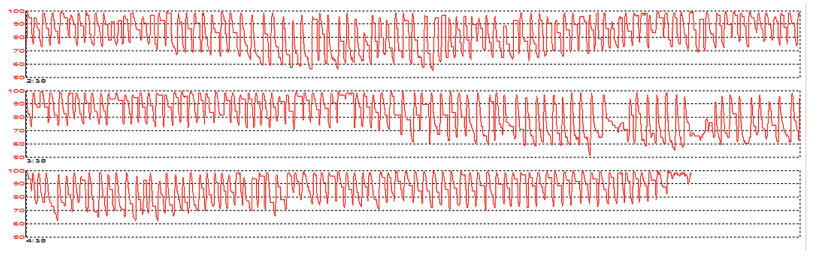
Рисунок 1. Циклическая (интермиттирующая) гипоксия во время сна у больного СОАС тяжелой степени. Минимальное значение SpO2 — 51%. Мужчина, 28 лет.
При СОАС неэффективные дыхательные движения (дыхательные экскурсии грудной клетки и брюшной стенки при закрытых верхних дыхательных путях) увеличивают отрицательное внутригрудное давление и повышают разницу между внутрисердечным и внесердечным давлениями, а также постнагрузку на левый желудочек. Отрицательное внутригрудное давление приводит к засасыванию крови в правый желудочек, что ведёт к повышению преднагрузки.
Вследствие хронически повторяющихся эпизодов обструкции во время сна происходит ремоделирование сердца. Колебания внутригрудного давления приводят к перегрузке предсердий объёмом, их растяжению и изменениям структуры миокарда в устьях лёгочных вен, что также способствует развитию ФП. Фиброз стенки предсердий способствует перераспределению коннексина, что ведёт к увеличению времени предсердной проводимости [11]. Уменьшенная рефрактерность и увеличение времени проводимости лежат в основе инициации и поддержания механизма re-entry при повторяющихся эпизодах СОАС.
Материалы и методы
Ретроспективное исследование проведено в центре медицины сна Медицинского научно-образовательного центра МГУ им. М.В. Ломоносова. В исследовании принимало участие 50 пациентов (38 мужчин и 12 женщин, средний возраст — 53 (13) года) с СОАС средней и тяжелой степени.
У всех пациентов, включённых в исследование, оценивалось наличие сопутствующей патологии: АГ, сахарного диабета 2 типа, ИБС и синдрома беспокойных ног.
Критерии включения пациентов в исследование:
- Пациенты мужского и женского пола в возрасте от 18 лет и старше.
- Жалобы на храп, остановки дыхания во сне.
- Наличие результатов полисомнографического исследования.
Критерии невключения пациентов в исследование:
- Хронические формы ринитов и риносинуситов.
- Хронический тонзиллит.
- Центральное апноэ сна.
- Нарушения ритма сердца, кроме ФП.
Методы обследования включали оценку жалоб больных, оценку клинического состояния и состояния ЛОР-органов. Полисомнографическое исследование проводилось на диагностической системе Embla N7000 с помощью программного обеспечения RemLogic 4.0. Запись данных проводилась с регистрацией: электроэнцефалограммы (ЭЭГ), субментальной электромиограммы (ЭМГ), электроокулограммы (ЭОГ), электрокардиограммы (ЭКГ), электромиограммы m.tibialis anterior обеих ног, дыхательных движений грудной клетки и брюшной стенки, уровня насыщения гемоглобина крови кислородом посредством пульсоксиметрии, наличия храпа и оценки назофарингеального воздушного потока. Диагноз ФП устанавливался на основании клинических рекомендаций 2020 [12]. У 6 пациентов отмечалась пароксизмальная форма ФП, у 2 — персистирующая форма, у 2 — постоянная и у 1 пациента отмечался впервые возникший пароксизм. Данные эхокардиографической оценки не были представлены у всех пациентов, поэтому на данном этапе исследования данные эхокардиографической диагностики не включались в исследование.
Исследование проводилось в соответствии с принципами Хельсинской Декларации.
Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро-Уилка. Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95% доверительного интервала (95% ДИ). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Сравнение двух групп по количественному показателю, имеющему нормальное распределение, при условии равенства дисперсий выполнялось с помощью t-критерия Стьюдента. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна-Уитни. Категориальные данные описывались с указанием абсолютных значений и процентных долей. Сравнение процентных долей при анализе четырехпольных таблиц сопряжённости выполнялось с помощью точного критерия Фишера (при значениях ожидаемого явления менее 10). Сравнение процентных долей при анализе многопольных таблиц сопряжённости выполнялось с помощью критерия хи-квадрат Пирсона. Построение прогностической модели вероятности определенного исхода выполнялось при помощи метода логистической регрессии. Отбор предикторов осуществлялся методом пошагового исключения. Мерой определённости, указывающей на ту часть дисперсии, которая может быть объяснена с помощью логистической регрессии, служил коэффициент R² Найджелкерка. Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода, применялся метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определялось по наивысшему значению индекса Юдена.
Анализ данных представлял собой разработку прогностической модели для определения вероятности ФП в зависимости от клинико-демографических показателей и данных полисомнографического исследования.
Результаты
11 пациентов имели фибрилляцию предсердий в анамнезе и/или по данным полисомнографического исследования. При оценке сердечного ритма во время полисомнографического исследования ФП имели 5 пациентов (10%), из них 1 пациент ранее не сообщал о наличии аритмии.
Клинико-демографические данные и основные параметры дыхательных нарушений во время сна при проведении полисомнографического исследования представлены в таблицах 1 и 2.
Таблица 1
Описательная статистика категориальных переменных
|
Показатели |
Категории |
Абс. |
% |
95% ДИ |
|
Пол |
Ж |
12 |
24,0 |
13,1 – 38,2 |
|
М |
38 |
76,0 |
61,8 – 86,9 |
|
|
Ритм |
синусовый ритм |
39 |
78,0 |
64,0 – 88,5 |
|
ФП |
11 |
22,0 |
11,5 – 36,0 |
|
|
Артериальная гипертензия |
есть |
34 |
68,0 |
53,3 – 80,5 |
|
нет |
16 |
32,0 |
19,5 – 46,7 |
|
|
Сахарный диабет 2 типа |
есть |
6 |
12,0 |
4,5 – 24,3 |
|
нет |
44 |
88,0 |
75,7 – 95,5 |
|
|
ИБС |
есть |
6 |
12,0 |
4,5 – 24,3 |
|
нет |
44 |
88,0 |
75,7 – 95,5 |
|
|
Синдром беспокойных ног |
есть |
8 |
16,0 |
7,2 – 29,1 |
|
нет |
42 |
84,0 |
70,9 – 92,8 |
|
|
3 |
4 |
8,0 |
2,2 – 19,2 |
Таблица 2
Описательная статистика количественных переменных
|
Показатели |
M ± SD / Me |
95% ДИ / Q₁ – Q₃ |
n |
min |
max |
|
Возраст, M ± SD |
53 ± 13 |
49 – 57 |
50 |
30 |
76 |
|
ИМТ, Me |
30,49 |
27,59 – 34,32 |
50 |
20,20 |
50,48 |
|
ИАГ, M ± SD |
46,5 ± 25,4 |
39,3 – 53,8 |
50 |
16,8 |
128,9 |
|
Min сатурация, Me |
81,0 |
76,0 – 85,8 |
50 |
51,0 |
89,0 |
|
Кол-во эпизодов десатураций (ИД), Me |
214,5 |
98,5 – 290,8 |
46 |
59,0 |
632,0 |
|
ИД в час, Me |
39,0 |
21,6 – 55,6 |
46 |
11,6 |
98,4 |
|
Средняя сатурация, Me |
92,9 |
91,8 – 93,8 |
50 |
77,0 |
96,1 |
|
Средняя десатурация, %, Me |
5,7 |
4,7 – 6,8 |
48 |
3,4 |
18,0 |
|
Сатурация <90, мин., Me |
21,6 |
4,0 – 67,1 |
50 |
0,2 |
253,1 |
|
ЧСС средн., M ± SD |
68,7 ± 8,3 |
66,3 – 71,1 |
48 |
52,6 |
90,5 |
Нами был выполнен анализ групп по количественным признакам в зависимости от показателя «Ритм». Результаты представлены в таблице 3.
Таблица 3
Анализ групп в зависимости от показателя «Ритм»
|
Показатели |
Категории |
Ритм |
p |
||
|
M ± SD / Me |
95% ДИ / Q₁ – Q₃ |
n |
|||
|
Возраст |
синусовый ритм |
50 |
43 – 58 |
39 |
0,006* |
|
ФП |
71 |
56 – 72 |
11 |
||
|
ИМТ |
синусовый ритм |
30,25 |
27,35 – 33,66 |
39 |
0,157 |
|
ФП |
33,25 |
28,92 – 38,14 |
11 |
||
|
Индекс апноэ-гипопноэ |
синусовый ритм |
41,1 |
25,9 – 62,5 |
39 |
0,907 |
|
ФП |
45,2 |
29,4 – 55,3 |
11 |
||
|
Минимальная SpO2 |
синусовый ритм |
81,0 |
77,0 – 85,5 |
39 |
0,647 |
|
ФП |
81,0 |
73,5 – 85,5 |
11 |
||
|
Кол-во эпизодов десатураций |
синусовый ритм |
214,0 |
112,0 – 292,0 |
37 |
0,533 |
|
ФП |
256,0 |
76,0 – 271,0 |
9 |
||
|
Индекс десатураций, в час |
синусовый ритм |
38,9 |
21,7 – 53,5 |
37 |
0,978 |
|
ФП |
46,3 |
17,9 – 57,0 |
9 |
||
|
Средняя SpO2 |
синусовый ритм |
92,9 |
92,0 – 94,0 |
39 |
0,302 |
|
ФП |
92,7 |
91,5 – 93,1 |
11 |
||
|
Средняя десатурация, % |
синусовый ритм |
5,6 |
4,4 – 6,7 |
37 |
0,432 |
|
ФП |
5,7 |
5,3 – 7,8 |
11 |
||
|
SpO2 ≤ 90, мин |
синусовый ритм |
19,7 |
3,9 – 61,4 |
39 |
0,833 |
|
ФП |
23,6 |
4,5 – 60,6 |
11 |
||
|
ЧСС средн. |
синусовый ритм |
69,6 ± 8,0 |
67,0 – 72,2 |
38 |
0,135 |
|
ФП |
65,2 ± 8,8 |
58,8 – 71,5 |
10 |
||
Примечание: * — различия показателей статистически значимы (p < 0,05), SpO2 — насыщение гемоглобина крови кислородом.
В результате сравнения возраста в зависимости от показателя «Ритм» нами были выявлены статистически значимые различия (p = 0,006) (используемый метод: U–критерий Манна–Уитни). По остальным показателям статистически значимых различий получено не было.
Нами был выполнен анализ категориальных показателей в зависимости от групп «Ритм» (табл. 4).
Таблица 4
Анализ категориальных показателей в зависимости от групп «Ритм»
|
Показатели |
Категории |
Ритм |
p |
|
|
Синусовый ритм |
ФП |
|||
|
Пол |
Ж |
9 (75,0) |
3 (25,0) |
1,000 |
|
М |
30 (78,9) |
8 (21,1) |
||
|
Артериальная гипертензия |
есть |
25 (73,5) |
9 (26,5) |
0,466 |
|
нет |
14 (87,5) |
2 (12,5) |
||
|
Сахарный диабет 2 типа |
есть |
5 (83,3) |
1 (16,7) |
1,000 |
|
нет |
34 (77,3) |
10 (22,7) |
||
|
ИБС |
есть |
5 (83,3) |
1 (16,7) |
1,000 |
|
нет |
34 (77,3) |
10 (22,7) |
||
|
Синдром беспокойных ног |
есть |
6 (75,0) |
2 (25,0) |
1,000 |
|
нет |
33 (78,6) |
9 (21,4) |
||
При сравнении показателя «Ритм» в зависимости от пола, показателя «АГ», показателя «СД», показателя «ИБС», показателя «Синдром беспокойных ног» не удалось выявить статистически значимых различий.
Таким образом, группы с синусовым ритмом и ФП статистически значимо не различались ни по одному показателю за исключением возраста, что, естественно, было предположить.
Была разработана прогностическая модель для определения вероятности ФП в зависимости от возраста, показателя «Средняя десатурация, %» методом бинарной логистической регрессии. Число наблюдений составило 46. Наблюдаемая зависимость описывается следующим уравнением:
P = 1 / (1 + e-z) × 100%
z = -15,279 + 0,191XВозраст + 0,370XСредняя десатурация, %,
где P — вероятность ФП, XВозраст — Возраст, XСредняя десатурация, % — Средняя десатурация, %.
Полученная регрессионная модель является статистически значимой (p<0,001). Исходя из значения коэффициента детерминации Найджелкерка, модель объясняет 50,6% наблюдаемой дисперсии показателя «ФП» (табл. 5).
При увеличении возраста на 1 шансы ФП увеличивались в 1,211 раза. При увеличении показателя «Средняя десатурация, %» на 1 шансы ФП увеличивались в 1,448 раза (рис.2).
Таблица 5
Характеристики связи предикторов модели с вероятностью выявления ФП
|
Предикторы |
Unadjusted |
Adjusted |
||
|
COR; 95% ДИ |
p |
AOR; 95% ДИ |
p |
|
|
Возраст |
1,140; 1,041 – 1,249 |
0,005* |
1,211; 1,063 – 1,380 |
0,004* |
|
Средняя десатурация, % |
1,136; 0,908 – 1,419 |
0,265 |
1,448; 1,020 – 2,056 |
0,038* |
Примечание: * — влияние предиктора статистически значимо (p < 0,05).

Рисунок 2. Оценки отношения шансов с 95% ДИ для изучаемых предикторов ФП.
При оценке зависимости вероятности ФП от значения логистической функции P с помощью ROC-анализа была получена следующая кривая (рис.3).

Рисунок 3. ROC-кривая, характеризующая зависимость вероятности ФП от значения логистической функции P.
Площадь под ROC-кривой составила 0,889±0,075 с 95% ДИ: 0,743–1,000. Полученная модель была статистически значимой (p<0,001).
Пороговое значение логистической функции P в точке cut-off, которому соответствовало наивысшее значение индекса Юдена, составило 0,292. ФП прогнозировалось при значении логистической функции P выше данной величины или равном ей. Чувствительность и специфичность модели составили 88,9% и 86,5%, соответственно (рис. 4).

Рисунок 4. Анализ чувствительности и специфичности модели в зависимости от пороговых значений логистической функции P.
Обсуждение
Обструктивное апноэ сна (ОАС) является сопутствующим состоянием у 21–74% пациентов с ФП и связано с 88% увеличением риска развития ФП [13]. Эта связь частично поддерживается общими факторами риска, такими как возраст, АГ и другими сердечно-сосудистыми заболеваниями, следовательно, независимый добавочный риск ОАС составляет 21% [14]. Учитывая, что влияние ОАС на морфологическую структуру правых отделов сердца, как один из возможных механизмов развития ФП, весьма противоречиво, а в нашем исследовании были только пациенты с СОАС, мы сфокусировались на факторах риска, обусловленных самими дыхательными нарушениями во время сна.
Нами продемонстрировано, что наряду с таким известным фактором риска ФП, как возраст, параметры дыхательных нарушений во время сна, а именно средняя десатурация, могут играть роль в развитии ФП.
В исследование включались пациенты со средней и тяжёлой степенью СОАС в связи с тем, что данные степени считаются клинически значимыми в отличии от лёгкой степени СОАС и, прежде всего, это связано с более выраженными эпизодами десатураций. Механизмы, которые влекут за собой развитие различных патологических процессов в сердечно-сосудистой системе у больных СОАС, включают циклическую гипоксию, гипер- и гипокапнию, колебания внутригрудного давления, фрагментацию сна, нестабильность вегетативного контроля с выраженной симпатической активацией. Однако ведущим патофизиологическим механизмом является циклическая гипоксия.
Резкое снижение насыщения гемоглобина крови кислородом с последующей реоксигенацией является отражением процесса ишемии-реперфузии, при котором происходит повышенная выработка активных форм кислорода с соответствующим развитием различных патологических процессов вследствие повреждения клеточных структур, тканей и формирования хронического воспаления.
Все перечисленные механизмы повреждающего воздействия на сердечно-сосудистую систему влияют и на развитие ФП. В связи с этим представляется очень важным выделение наиболее значимых факторов риска ФП у больных СОАС с целью стратификации риска и разработки методов профилактики и лечения.
В настоящее время основным методом лечения СОАС являются различные виды респираторной поддержки, среди которых доминирующую роль выполняет «сипап»-терапия — метод создания постоянного положительного давления в дыхательных путях пациента во время сна. «Сипап»-терапия не только нивелирует клиническую симптоматику СОАС, но и существенным образом способствует смягчению течения различных сердечно-сосудистых заболеваний. «Сипап»-терапия снижает и частоту рецидивов фибрилляции предсердий [15].
Ограничением исследования является небольшая выборка, что будет учтено в дальнейших наших исследованиях. Требуется проведение крупных когортных, а также проспективных исследований для определения новых факторов риска развития ФП у больных СОАС.
Заключение
Наряду с таким известным фактором риска ФП, как возраст, параметры дыхательных нарушений во время сна, а именно средняя десатурация, могут стать фактором риска развития ФП у больных СОАС. Средняя десатурация отражает степень снижения насыщения гемоглобина кислородом и, соответственно, реоксигенации (степень ишемии-реперфузии) и является косвенным отражением степени тяжести СОАС, если брать во внимание индекс апноэ-гипопноэ, по которому в настоящее время оценивается его тяжесть. Однако ни индекс апноэ-гипопноэ, ни другие показатели дыхательных нарушений во время сна, кроме средней десатурации, не продемонстрировали связи с наличием ФП в нашем исследовании.
Финансирование. Работа выполнена в рамках государственного задания МГУ им. М.В. Ломоносова с использованием оборудования, закупленного по Программе развития МГУ.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
1. Черкасова С. А. Клинико-диагностическое значение синдрома обструктивного апноэ сна у пациентов с фибрилляцией предсердий в сочетании с артериальной гипертонией и хронической сердечной недостаточностью: Дисс. …к-та мед. наук / Саратов, 2018. – 125 с.
Список литературы
1. The American Academy of Sleep Medicine. The International Classification of Sleep Disorders 3-TR. 2023.
2. Тюрин В.П., Савчук О.В., Проскурнова В.В., Добриков Е.А., Кулагина А.М. Синдром обтруктивного апноэ сна, как независимый предиктор сердечно-сосудистой смертности. Вестник НМХЦ им. Н.И. Пирогова. 2020;15(2):126-128. Doi: 10.25881/BPNMSC.2020.95.30.022
3. Wang X, Fan J, Guo R, Hao W, Gong W, Yan Y, et al. Association of obstructive sleep apnoea with cardiovascular events in women and men with acute coronary syndrome. Eur Respir J. 2023;61(1):2201110. DOI: 10.1183/13993003.01110-2022
4. Wang B, Hao W, Fan J, Yan Y, Gong W, Zheng W, et al. Clinical significance of obstructive sleep apnea in patients with acute coronary syndrome with or without prior stroke: a prospective cohort study. Eur J Med Res. 2023;28(1):107. DOI: 10.1186/s40001-023-01071-0
5. Liu L, Su X, Zhao Z, Han J, Li J, Xu W, et al. Association of Metabolic Syndrome With Long-Term Cardiovascular Risks and All-Cause Mortality in Elderly Patients With Obstructive Sleep Apnea. Front Cardiovasc Med. 2022;8:813280. DOI: 10.3389/fcvm.2021.813280
6. Михайлова О.О., Гогиберидзе К.О., Елфимова Е.М., Литвин А.Ю., Чазова И.Е. Неконтролируемая артериальная гипертензия и синдром обструктивного апноэ сна: комплексный подход к лечению. Системные гипертензии. 2022;19(3):41-47. DOI: 10.38109/2075-082X-2022-3-41-47
7. Marrone O, Bonsignore MR. Blood-pressure variability in patients with obstructive sleep apnea: current perspectives. Nat Sci Sleep. 2018;10:229-242. DOI: 10.2147/NSS.S148543
8. Mehra R, Benjamin EJ, Shahar E, Gottlieb DJ, Nawabit R, Kirchner HL, et al. Association of nocturnal arrhythmias with sleep-disordered breathing: The Sleep Heart Health Study. Am J Respir Crit Care Med. 2006;173(8):910-6. DOI: 10.1164/rccm.200509-1442OC
9. Zoni-Berisso M, Lercari F, Carazza T, Domenicucci S. Epidemiology of atrial fibrillation: European perspective. Clin Epidemiol. 2014;6:213-20. DOI: 10.2147/CLEP.S47385
10. Большакова С.Е., Мадаева И.М., Бердина О.Н., Бугун О.В., Рычкова Л.В. Биомаркеры эндотелиальной дисфункции как фактора риска развития сердечно-сосудистых заболеваний при синдроме обструктивного апноэ сна. Профилактическая медицина. 2022;25(8):114‑119. DOI: 10.17116/profmed202225081114
11. Iwasaki YK, Kato T, Xiong F, Shi YF, Naud P, Maguy A, et al. Atrial fibrillation promotion with long-term repetitive obstructive sleep apnea in a rat model. J Am Coll Cardiol. 2014;64(19):2013-23. DOI: 10.1016/j.jacc.2014.05.077
12. Аракелян М.Г., Бокерия Л.А., Васильева Е.Ю., Голицын С.П., Голухова Е.З., Горев М.В., и др. Фибрилляция и трепетание предсердий. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4594. DOI: 10.15829/1560-4071-2021-4594
13. Linz D, McEvoy RD, Cowie MR, Somers VK, Nattel S, Lévy P, et al. Associations of Obstructive Sleep Apnea With Atrial Fibrillation and Continuous Positive Airway Pressure Treatment: A Review. JAMA Cardiol. 2018;3(6):532-540. DOI: 10.1001/jamacardio.2018.0095
14. Chen W, Cai X, Yan H, Pan Y. Causal Effect of Obstructive Sleep Apnea on Atrial Fibrillation: A Mendelian Randomization Study. J Am Heart Assoc. 2021;10(23):e022560. DOI: 10.1161/JAHA.121.022560
15. Wang YX, Luo JM, Huang R, Xiao Y. [Continuous positive airway pressure therapy affects the recurrence of atrial fibrillation in patients with obstructive sleep apnea: a systematic review and meta-analysis]. Zhonghua Jie He He Hu Xi Za Zhi. 2023;46(8):751-759. (In Chinese). DOI: 10.3760/cma.j.cn112147-20230213-00064
Об авторах
А. А. ВасюковаРоссия
Васюкова Александра Алексеевна - студентка факультета фундаментальной медицины.
Москва
А. Л. Калинкин
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»
Россия
Калинкин Александр Леонидович - руководитель центра медицины сна МНОЦ.
Москва
Рецензия
Для цитирования:
Васюкова А.А., Калинкин А.Л. Степень ишемии-реперфузии как возможный фактор риска развития фибрилляции предсердий у пациентов с синдромом обструктивного апноэ сна. Южно-Российский журнал терапевтической практики. 2023;4(4):41-50. https://doi.org/10.21886/2712-8156-2023-4-4-41-50
For citation:
Vasiukova A.A., Kalinkin A.L. The degree of ischemia-reperfusion as a possible risk factor for the development of atrial fibrillation in patients with obstructive sleep apnea syndrome. South Russian Journal of Therapeutic Practice. 2023;4(4):41-50. (In Russ.) https://doi.org/10.21886/2712-8156-2023-4-4-41-50
JATS XML


























