Перейти к:
Патогенез и клинические формы листериоза человека
https://doi.org/10.21886/2712-8156-2024-5-1-99-111
Аннотация
Листериоз — это сапрозоонозная инфекция, вызываемая у человека преимущественно видом Listeria monocytogenes. Источником её могут быть объекты внешней среды (почва и вода открытых водоёмов с большим содержанием органических соединений, растения) и более 90 видов животных. Высокая метаболическая активность листерий и устойчивость к неблагоприятным факторам создают возможность лёгкого перехода от сапрафитического к паразитическому типу метаболизма при попадании в организм хозяина. Множество путей передачи и «входных ворот» обусловливают возникновение разнообразных первично-локализованных форм инфекции, наиболее частой из которых является гастроинтестинальная. Инвазивные формы листериоза развиваются в основном у лиц с иммунологической недостаточностью. «Группами риска» являются беременные, новорождённые, лица с коморбидными состояниями, старше 60 лет, наркоманы и др. Для инвазивных форм характерен полиморфизм симптоматики и отсутствие специфических проявлений. В патогенезе инфекции важное значение имеют факторы патогенности L. monocytogenes, обеспечивающие их незавершённый фагоцитоз, внутриклеточный паразитизм, высокую скорость заселений соседних здоровых клеток, формирование антибиотикорезистентности. Патологоанатомическим выражением изменений, вызываемых листериями в клетках, становится формирование мелких гранулем — листериом. «Многоликость» листериоза, высокий уровень летальности (до 50% и более) и малая настороженность врачей в отношении этой инфекции создают трудности при постановке диагноза, в связи с чем особое значение приобретает совершенствование методов микробиологической диагностики.
Для цитирования:
Тюкавкина С.Ю., Котиева И.М., Додохова М.А., Гречина Д.А., Бабиев С.А., Харсеева Г.Г. Патогенез и клинические формы листериоза человека. Южно-Российский журнал терапевтической практики. 2024;5(1):99-111. https://doi.org/10.21886/2712-8156-2024-5-1-99-111
For citation:
Tyukavkina S.Yu., Kotieva I.M., Dodokhova M.A., Grechina D.A., Babiev S.A., Kharseeva G.G. Pathogenesis and clinical forms of human listeriosis. South Russian Journal of Therapeutic Practice. 2024;5(1):99-111. (In Russ.) https://doi.org/10.21886/2712-8156-2024-5-1-99-111
Введение
Листериоз — это повсеместно распространённая сапрозоонозная инфекционная болезнь человека и животных, вызываемая патогенными представителями рода Listeria.
В представлении многих врачей листериоз человека является новой и редкой инфекцией. Действительно, в течение первой половины XX в. листерии рассматривались как типичные возбудители зоонозов. Впервые подобные бактерии описаны в 1911 г. шведским исследователем G. Hulphers, который выделил их из гнойного узелка подопытного кролика. Первая лабораторная культура дифтероидоподобных палочек, изолированная от человека (из спинномозговой жидкости солдата, больного менингитом), получена и сохранена J. Dumont, L. Cotoni в 1918 году. Детальное описание листерий было сделано позднее двумя учеными: в 1923 г. Эверетом Мюрреем (Everitt George Dunne Murray), выделившим в питомнике Кембриджского университета от больных кроликов и морских свинок неизвестную ранее палочку, названную им Bacterium monocytogenes, и на год позднее — шотландским врачом Джеймсом Хантером Харви Пири (James Hunter Harvey Pirie), работавшим в колониальной Кении. В 1940 г. Пири дал «новому» возбудителю название Listeria monocytogenes, утверждённое Международной Классификационной комиссией. Род получил название в честь английского хирурга, основателя хирургической антисептики лорда Джозефа Листера, имя которого не было увековечено до этого времени в бактериологической номенклатуре, а вид — по способности данной бактерии вызывать моноцитарную реакцию крови у животных. В современной таксономии сохранилось данное обозначение вида [1][2].
Листериоз в человеческой популяции не имеет давней истории. До 50-х гг. прошлого столетия в мире было выявлено не более 70 случаев листериоза у людей, непосредственно контактировавших с заражёнными животными (работники скотобоен, фермеры-животноводы, доярки и др.). В период с 50-го по 70-й гг. число случаев, по данным мировой статистики, достигло нескольких тысяч. Практически все они по-прежнему были обусловлены контактом с больными животными, в том числе с грызунами, а также употреблением сырого молока. Однако с учётом возросшей актуальности проблемы с 1957 г. регулярно проводились Международные Симпозиумы по листериозу (ISOPOL) (к настоящему времени их состоялось 15). Начиная с 80-х гг. стали характерными эпидемические вспышки этой инфекции, связанные с употреблением уже готовых пищевых продуктов, контаминированных листериями. Так, описаны крупные вспышки в индустриально развитых странах Западной Европы (Франция, Великобритания, Швейцария, Финляндия) и Северной Америки (США, Канада) с числом пострадавших от нескольких десятков до 300. В настоящее время листериоз расценивается как опасная пищевая инфекция и, хотя по уровню заболеваемости (ежегодно в мире регистрируется около тысячи заболевших) он уступает сальмонеллёзу, кампилобактериозу и некоторым другим известным инфекциям с пищевым путем передачи, значительно превосходит их по тяжести течения, отличается беспрецедентно высокой летальностью (до 21%) [3][4].
Сейчас листериоз является серьёзной не только медико-социальной, но и экономической проблемой. Вынужденная утилизация больших партий инфицированных пищевых продуктов (прежде всего, мясных и молочных) наносит огромный экономический ущерб многим странам. Следует отметить, что некоторые аспекты листериозной инфекции требуют дальнейшего изучения: до сих пор не установлено полное видовое различие листерий на генетическом уровне, не полностью расшифрован механизм патогенеза болезни. Учитывая чрезвычайный полиморфизм клинических проявлений и увеличение удельного веса атипичных форм этой инфекции на современном этапе взаимодействия представителей рода Listeria с человеческой популяцией, актуальным направлением является совершенствование методов лабораторной диагностики и специфической иммунопрофилактики листериоза [5][6].
Биологические свойства листерий
Листерии являются представителями рода Listeria. Результаты секвенирования рРНК 16S позволили выделить эти бактерии в самостоятельное семейство Listeriaceae (ранее относились к Corynebacteriaceae, позже к Lactobacillaceae).
В настоящее время насчитывается более 20 видов листерий. Наиболее часто встречаются шесть из них: L. monocytogenes, L. innocua, L. ivanovii, L. seeligeri, L. welshimeri, L. grayi. L. monocytogenes является основным возбудителем заболеваний человека и животных. Потенциально патогенны для людей еще два вида — L. ivanovii (назван в 1985 г. в честь болгарского микробиолога Ивана Иванова) и L. seeligeri (описан в 1983 г. немецким бактериологом H. P. R. Seeliger) [2][7].
Листерии представляют собой Грам+ тонкие палочки правильной формы, небольших размеров. Отличаются полиморфизмом: в мазках из клинических образцов и при росте на плотных питательных средах могут иметь форму кокков и располагаться цепочками, сходными по форме с энтеро- и стрептококками; могут образовывать V- и Y-образные структуры и напоминать дифтероиды; также листерии необходимо дифференцировать от бактерий Erysipelothrix. В старых культурах они часто становятся грамотрицательными и ошибочно принимаются за Haemophilus. Под воздействием антибиотиков бактерии вида L.monocytogenes обычно переходят в L-формы. Имеют немногочисленные перитирихиально расположенные жгутики, которые образуются при 20–30°C и обеспечивают кувыркательное или вращательное перемещение бактерий в препаратах «висячая капля», однако при 37°C листерии практически неподвижны. Они не образуют спор и капсул. Неприхотливы к питательным средам, являются микроаэрофилами. В отличие от многих патогенных бактерий, растут и размножаются в широком диапазоне температур (1–40°С), при колебании pH от 4,8 до 9,0, в присутствии высокой концентрации хлорида натрия и углекислоты. Каталаза-положительны и оксидаза-отрицательны. Листерии могут жить в бескислородной среде, паразитировать внутриклеточно [1].
По специфичности 15 О-соматических (обозначаются цифрами) и 5 флагеллярных антигенов (имеют буквенные символы) листерии разделены на 16 сероваров, которые не являются видоспецифическими. Кроме того, обнаружены гетероантигены листерий со стафилококками, а также некоторыми серовариантами сальмонелл. Для вида L. monocytogenes описаны 12 серовариантов. Достоверной взаимосвязи между сероварами листерий и типом хозяина, а также тяжестью заболевания не установлено. У людей наиболее часто заболевания вызывают сероварианты 4b (до 50% случаев листериоза в мире),1/2a и 1/2b; при этом, как правило, штаммы 4b и 1/2b связанны с эпидемическими вспышками, а 1/2a — со спорадической заболеваемостью. Штаммы 1/2a, 1/2b, 1/2c, 1/2c и 3а часто выделяют из зараженных продуктов [8].
В организме хозяина бактерии начинают синтезировать достаточно большое количество факторов патогенности, основными из которых являются:
- белки мультигенного семейства интерналинов, преимущественно InlA и InlB — факторы инвазии, обеспечивающие проникновение листерий в эукариотические клетки (InlA — в эпителиальные клетки, InlB — в гепатоциты; их экспрессия отражает специфику клеточного тропизма листерий);
- мембранолитические ферменты: листериолизин-О и специфические фосфолипазы-С (PlcA и PlcB) вызывают лизис фагосом (первичной и вторичной вакуолей), обеспечивая свободное деление листерий в цитоплазме и развитие незавершённого фагоцитоза;
- внеклеточный белок Р 60-муреингидролаза способствует проникновению через гематоэнцефалический барьер;
- поверхностный белок ActA, вызывающий полимеризацию актина, обеспечивает активные движения листерий по цитоплазме клетки хозяина и проникновение в соседние клетки;
- лецитиназа (лизис вторичной фагосомы);
- металлопротеаза (посттрансляционная модификация лецитиназы) [9][10].
В настоящее время в геноме L. monocytogenes детектированы многочисленные острова патогенности и стрессоустойчивости: гены островов патогенности LIPI1, LIPI2, LIPI-3 и LIPI4 (наличие LIPI-3 и LIPI4 характерно для гипервирулентных штаммов L. monocytogenes); гены кластера интерналинов (inlE, inlI, inlK, inlP, inlF, inlG, inlH), острова стрессоустойчивости (SSI1, ассоциированный с устойчивостью к кислотам, солям и обеспечивающий рост в пищевых продуктах, а также SSI2, обеспечивающий L. monocytogenes выживание в щелочных условиях и в условиях окислительного стресса). Существуют и другие гены, кодирующие факторы вирулентности листерий (oatA, ami, gtcA, vip, lisK) [11][12].
Важным фактором выживаемости листерий в человеческой популяции стало распространение штаммов со множественной устойчивостью к антимикробным препаратам (АМП). Полногеномное секвенирование L. monocytogenes позволило идентифицировать гены антибиотикорезистентности, за счёт которых этот вид бактерий часто приобретает устойчивость к трём и более классам АМП (MDR-штаммы). Примерами являются ген fosX (lmo1702) — кодирующий белок резистентности к фосфомицину, pbplike (lmo0441) — кодирующий пенициллин-связывающий белок и, соответственно, определяющий устойчивость к β-лактамам, lin (lmo0919) — определяющий устойчивость к макролидам-линкозамидам-стрептограминам, norB — кодирующий NO-редуктазу, ассоциированную с устойчивостью к фторхинолонам, sul (lmo0224) — детерминирующий устойчивость к сульфаниламидам.
Наличие в геномах штаммов L. monocytogenes генетических детерминант островов патогенности, стрессоустойчивости и антибиотикорезистентности свидетельствует о наличии у них высокого патогенного потенциала [11][13][14].
Эпидемиология листериоза
Поскольку листерии чрезвычайно устойчивы к действию неблагоприятных факторов и обладают уникальной пластичностью, источником и резервуаром возбудителя могут являться не только живые организмы, но и объекты внешней среды, в которых они способны сохраняться и размножаться длительное время. В связи с этим листериоз в настоящее время рассматривают как сапрозоонозную инфекцию.
Во внешней среде наиболее часто листерии концентрируются и размножаются во влажной почве и водоемах с высоким содержанием органических веществ, могут проникать в корневую систему и даже листья растений. Хорошо сохраняются как зимой при отрицательных температурах (даже в промерзших почвах), так и в летнюю жару, образуя при этом R-формы. Высокая метаболическая активность листерий создаёт возможность легкого перехода от сапрофитического к паразитическому типу метаболизма при попадании в организм хозяина. Так, L. monocytogenes выделены более чем от 90 видов теплокровных и холоднокровных животных, домашних и диких, проживающих на самых различных территориях, а также от насекомых. Основным природным резервуаром листерий являются грызуны, но они могут обнаруживаться также у лисиц, норок, песцов, диких копытных, птиц, рыб, лягушек, моллюсков, креветок и некоторых видов клещей. Из сельскохозяйственных животных наиболее часто болеют свиньи, рогатый скот (с формированием стабильных антропургических очагов инфекции), лошади, в городских условиях — бродячие собаки и кошки, а также декоративные птицы. Редким источником заражения является человек [7][15].
Листериоз характеризуется не только разнообразием источников и резервуаров возбудителя инфекции, но и множеством механизмов, путей и факторов передачи возбудителя. Основным механизмом передачи от больных животных человеку является фекально-оральный с пищевым (через инфицированные пищевые продукты) и контактно-бытовым (при уходе за больными животными) путями.
Дополнительные механизмы передачи от животных:
- аэрогенный, с воздушно-пылевым путём (при обработке животного сырья — шерсти, щетины, кожи, шкур, пера, пуха);
- контактный (через порезы и ссадины на коже, слизистые оболочки глаз при попадании в них различных выделений больных животных);
- трансмиссивный (при укусе насекомых-переносчиков).
Особым механизмом инфицирования «человек-человек», который приобретает на сегодняшний день особую актуальность, является вертикальная передача от матери к плоду и новорождённому при герминативном, гематогенно-трансплацентарном, околоплодно-контаминационном и интранатальном путях, а также передача при лактации. Редким механизмом передачи от человека к человеку является контактный, в том числе контактно-половой путь. Описан и артифициальный механизм, приводящий к развитию ИСМП (инфекций, связанных с оказанием медицинской помощи) в результате контакта новорождённых с инфицированными медицинскими изделиями и предметами ухода в родильных домах [16][17].
При листериозе человека превалирует пищевой путь передачи. Из крупных пищевых вспышек листериоза, имеющих бактериологическое подтверждение, хорошо известны случаи в Канаде в результате употребления шинкованной капусты (1981 г.), Лос-Анджелесе — мягкого сычужного мексиканского сыра (1985 г.) с летальностью 33%, а в Бостоне впервые фактором передачи стало пастеризованное молоко (2007 г.). Актуальность данного пути объясняется наличием множества антропогенных факторов. Основным из них стало формирование многочисленных антропургических очагов листериоза. Так, внедрение новых технологий возделывания почвы, создание крупных животноводческих и агропромышленных комплексов, стоки и выбросы которых контаминируют почвы и водные объекты, а также частое использование органических удобрений, полученных от инфицированных животных, способствует заражению листериями сельскохозяйственных животных, птиц, различных частей растений. Другим важным антропогенным фактором является широкая, постоянно растущая сеть пунктов общественного питания и гастрономов, где дополнительными факторами передачи могут быть поверхности, оборудование (особенно столешницы, автоматические слайсеры) а также руки персонала и др. [15][18].
Наиболее вероятными факторами передачи являются инфицированные продукты питания (готовые к употреблению и полуфабрикаты, особенно «быстрого приготовления») и сырьё, не подвергающиеся в процессе изготовления достаточной термической обработке, и даже термически обработанные продукты с последующим длительным хранением в холодильнике. В их числе мясные продукты, включая мясо птиц: вареные сосиски, главным образом хот-доги; сыровяленые и сырокопченые изделия, чаще в нарезках и вакуумной упаковке; ветчина, паштеты и консервированные мясопродукты. Например, тушки цыплят могут быть контаминированы в 61 % случаев, креветки — в 18%. В мясных продуктах, полученных от больных листериозом животных и подвергшихся термической обработке, бактерии выживают при прогревании до 85°C: при варке в мясных фрикадельках в течение 15 минут, в крупных кусках мяса — до 60 минут. Они сохраняют жизнеспособность в присутствии 6% NaCl от 2 месяцев до 1 года. Также листерии активно обсеменяют сыры (особенно мягкие, сычужные, с голубой плесенью, твердые ноздреватые сыры с красной оболочкой), сливочное масло, морепродукты (рыбная продукция холодного копчения и маринованная, замороженные креветки и лобстеры, крабовое мясо), вареные яйца. Источником могут быть свежие овощи, особенно корнеплоды (за исключением моркови, поскольку в ней находятся ферменты антилистериолизины), овощные салаты. Особую опасность представляют ранние сорта овощей (редис, огурцы, салат, лук, помидоры), выращенные на удобряемых навозом или сточными водами полях. Следует помнить, что листерии способны не только сохраняться, но и размножаться в инфицированных продуктах даже при строгом соблюдении «холодовой цепи» [7][19].
Патогенез и клиническая картина листериоза
Листериоз человека протекает в виде разнообразных клинических форм со множеством симптомов, не являющихся специфическими для данной болезни. Согласно МКБ-XI, данной инфекции присвоен шифр 1C1A (1C1A.0 кожный листериоз; 1C1A.1 листериозный менингит или менингоэнцефалит; 1C1A.Y другой уточненный листериоз; 1C1A.Z листериоз неуточнённый). В России официальная регистрация листериоза человека как нозологической единицы началась с 1992 г. [17][20].
«Группами риска» развития листериоза являются, прежде всего, люди с иммунологической недостаточностью. Наиболее уязвимые группы
среди них — беременные женщины и новорождённые. Беременные, особенно при многоплодной беременности, заболевают листериозом в 20 раз чаще, чем другие здоровые люди. 35% всех статистически зарегистрированных подтверждённых случаев листериоза приходится именно на них. Это обусловлено, по-видимому, выраженным тропизмом листерий к эпителию урогенитального тракта женщин и тканям эмбрионов. Среди других групп — ВИЧ-инфицированные, люди с онкопатологией, а также длительное время получавшие антибактериальные, кортикостероидные препараты, иммунодепрессанты, перенёсшие трансплантацию органов, лица старше 60 лет и др. У них, как правило, болезнь протекает в тяжёлой форме. В настоящее время к кругу иммунокомпрометированных лиц присоединилась многочисленная группа «внутривенных» наркоманов, у которых листериоз часто приводит к смертельному исходу [21][22].
Инкубационный период в среднем составляет от нескольких дней до двух недель, однако описаны и очень длительные сроки (до 90 дней). То, какая клиническая форма листериоза возникнет, и длительность его течения зависят, прежде всего, от пути передачи возбудителя и, следовательно, от «входных ворот» инфекции, а также от наиболее вероятных путей миграции возбудителя в организме и состояния иммунной системы человека. С учётом того, что листерии являются факультативными внутриклеточными паразитами, болезнь часто принимает хронический характер течения, что требует применения длительных курсов антибиотикотерапии. В то же время такой тип паразитизма может приводить к формированию бактерионосительства в 5–20% случаев инфицирования, чему также способствует возможность длительного пребывания листерий в пристеночном пространстве просвета тонкого кишечника. Основные клинико-патогенетические формы листериоза представлены на рисунке 1 [20][23].
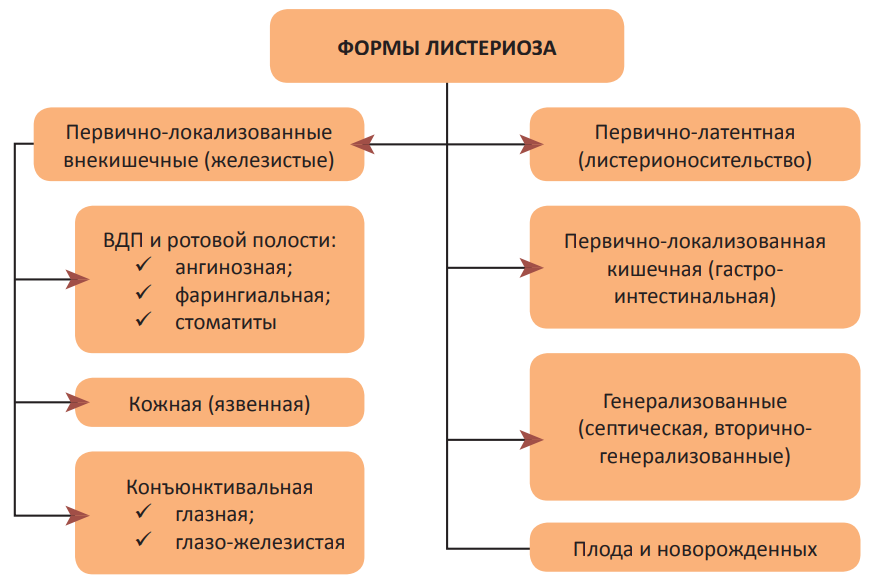
Рисунок 1. Клинико-патогенетические формы листериоза.
Все певично-локализованные формы листериоза (кишечная, железистая, кожная) относят к неинвазивным. Наиболее частая из них — гастроинтестинальная, связанная с пищевым путём передачи. Она развивается в результате преодоления L. monocytogenes желудочного барьера и последующего прикрепления к эпителию тонкого кишечника. Далее происходит интернализация — проникновение бактерий в макрофаги, энтероциты и микроскладчатые М-клетки (фагоцитирующие эпителиальные клетки кишечника, концентрирующиеся вокруг пейеровых бляшек и солитарных фолликулов). Интернализация опосредуется листериальным белком интерналином, который взаимодействует с рецепторами фагоцитов и обеспечивает поглощение ими листерий. В результате формируются первичные фагосомы, окружённые однослойной мембраной. Однако последующие этапы фагоцитоза «выпадают»: попав во внутреннюю среду клетки хозяина, листерии начинают размножаться, выделяют листериолизин-О, фосфолипазы, внеклеточный белок Р 60-муреингидролаза. Благодаря действию этих факторов патогенности происходит лизис мембран фагосом и выход бактерий в цитоплазму, где они продолжают интенсивно размножаться и выделять токсические продукты. Таким образом, имея уникальный набор факторов патогенности, листерии не подвергаются внутриклеточному киллингу и остаются жизнеспособными (незавершенный фагоцитоз). В цитоплазме листерии «обволакиваются» нитями клеточного белка актина. В ответ на этот механизм защиты клеток хозяина листериальный поверхностный белок ActA полимеризует актин с образованием длинных актиновых «хвостов», которые располагаются только на одном полюсе бактерии и продвигают её вперед. В результате листерии активно перемещаются по цитоплазме эукариотической клетки. Выйдя в межклеточную среду, они продолжают двигаться вперед. Когда бактерии сталкиваются с цитоплазматической мембраной соседних здоровых клеток, у них образуются структуры, сходные с псевдоподиями простейших, которыми они «продавливают» оболочки («пальцеобразная» инвагинация) и инфицируют их. Образующаяся вторичная вакуоль, окруженная двойной мембраной, подвергается лизису, и листерии начинают новый цикл своего развития. В целом протекающие процессы приводят к некротической гибели клеток, способствуют прохождению листерий через кишечную стенку и миграции их в регионарные лимфоузлы [20].
Аналогичная ситуация складывается и в месте размножения листерий в других «входных воротах». Способность листерий перемещаться из клетки в клетку, минуя внеклеточные пространства, позволяет им «ускользать» от действия факторов врождённого иммунитета (комплемента, нейтрофилов) и антителозависимого адаптивного иммунного ответа. При адекватной работе иммунной системы, особенно полноценности Т-лимфоцитзависимых форм адаптивного иммунитета и активации макрофагов, дальнейшего перемещения листерий в организме человека не происходит. Однако у лиц с иммунодефицитами, особенно у беременных и новорождённых, а также людей с сопутствующими заболеваниями возможно проникновение листерий из первичного очага в ретикулоэндотелиальную систему (печень, селезёнку, лимфатические узлы), где часть листерий погибает, но также вызывает и гибель клеток самих лимфоидных органов, индуцируя их апоптоз. Дальнейшее гемато- или лимфогенное распространение листерий приводит к возникновению генерализованных инвазивных форм, протекающих тяжело, с летальностью 20–30%. К ним относятся, прежде всего, сепсис (первично-генерализованная форма) и вторично-генерализованная нервная форма, возникающая при миграции листерий из кровеносного русла в головной мозг после прохождения через гематоэнцефалический барьер (менингоэнцефалит, абсцесс головного мозга). Более редкими вторично-генерализованными формами являются процессы в отдалённых от первичного очага органах: эндокардит, пиелонефрит, перитонит, абсцессы печени, селезёнки, пневмонии, остеомиелит и другие (рис. 2). Уонкологических больных листерии проникают в опухолевые клетки и длительно в них паразитируют [24][25].
В очагах поражения патологоанатомическим выражением изменений, вызываемых листериями на клеточном уровне, становится формирование мелких гранулём — листериом, которые чаще всего возникают через 2–3 дня после инфицирования. Листериомы могут образовываться во всех органах, особенно часто в печени. Они состоят из скопления листерий, окружённых ретикулярными, эпителиоидными клетками, макрофагами, а также клеточного детрита. При прогрессировании процесса в центре листериом возникает некроз, а по периферии появляются полиморфноядерные лейкоциты и лимфоидные клетки; далее происходит организация и рассасывание некротических очагов, возможно рубцевание [1][26].
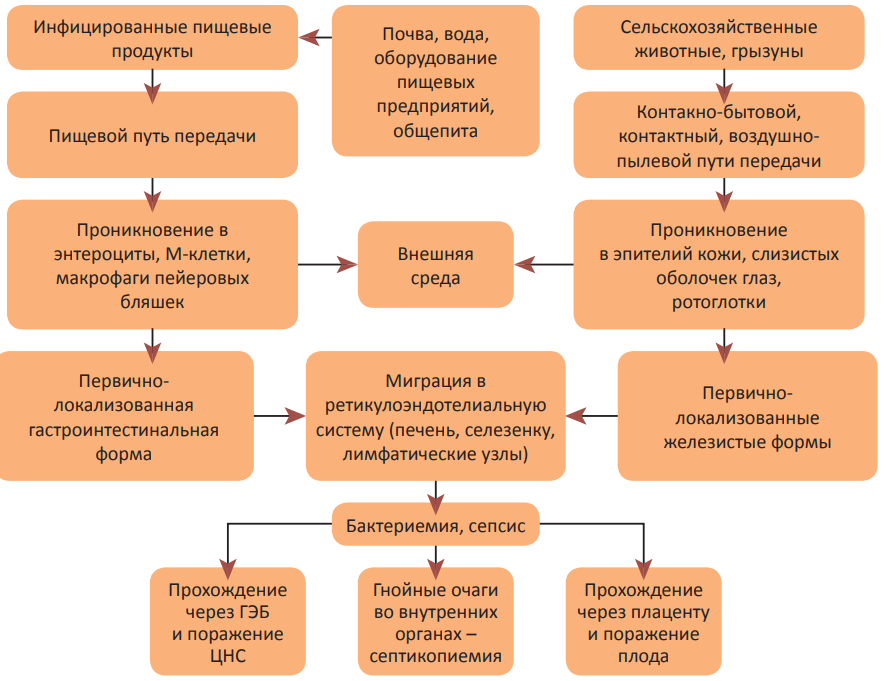
Рисунок 2. Взаимосвязь источников и путей передачи листериоза с патогенезом и клиническими вариантами течения инфекции.
В зависимости от продолжительности заболевания различают острый (1–3 мес.), подострый (3–6 мес.) и хронический (дольше 6 мес.) листериоз. Начало любых форм болезни, как правило, гриппоподобное, сопровождающееся фебрильной лихорадкой, часто длительной, с ознобом и симптомами интоксикации: общая слабость, миалгии, головная боль, потеря аппетита. На 3–5-й дни часто появляется первичный кожный аффект — сыпь в виде красных пятен на инфильтрированном основании, которые позже последовательно превращаются в папулы, везикулы и пустулы. Наиболее типичное расположение сыпи — в области крупных суставов и в форме бабочки на лице. В области первичного кожного аффекта всегда наблюдается болезненность.
При рассмотрении отдельных форм следует отметить, что гастроинтестинальная форма протекает преимущественно с синдромом желудочной (тошнота, необильная рвота) и кишечной диспепсии (диарея с примесью слизи и крови, иногда запоры). Возможно наличие абдоминальной боли), увеличение лимфоузлов и болезненность их при пальпации, гепатоспленомегалия. Лихорадочный период длительный, что является отличительной особенностью листериозных гастроэнтеритов [20].
Железистая ангинозная форма также сопровождается гепатолиенальным синдромом; развиваются ангина средней тяжести (катаральная, дифтеритическая или язвенная), шейный лимфаденит и даже генерализованная лимфаденопатия, регистрируется мононуклеоз. Длительность обычно — 2 недели. Глазо-железистая форма, встречающаяся крайне редко (не более 1 % случаев), характеризуется поражением любого отдела глаза на фоне, как правило, одностороннего конъюнктивита с гнойным отделяемым, отёком век и яркой узелковой сыпью на переходной складке. При этом снижается острота зрения, в процесс вовлекаются околоушные и подчелюстные лимфатические узлы. Длительность составляет 1–2 месяца [26].
Любая первично-локализованная форма может перейти в генерализованную, при которой спустя 3–4 дня от начала клиники состояние больного резко ухудшается.
При септической форме длительная (не менее 3-х недель) лихорадка с резкими подъёмами и спадами температуры сочетается с выраженными симптомами общей интоксикации, с кишечным и гепатолиенальным синдромами, наличием пятнисто-папулезной сыпи, гипотонией. Возможно возникновение паренхиматозного гепатита в желтушной форме, вовлечение в процесс легких, плевры и перикарда, поражение ЦНС. Следствием развивающейся коагулопатии могут быть кровотечения. При этом, как правило, отсутствуют лифаденопатия и ангина [27].
Поражение центральной нервной системы может протекать как менингит, менингоэнцефалит, энцефалит, абсцесс мозга. Неврологическая симптоматика разнообразная: ригидность затылочных мышц, симптомы Кернига, Брудзинского, гипер- и парестезии, клонические судороги, расстройства сознания, симптомы поражения черепно-мозговых нервов (патологические рефлексы, параличи, птоз, анизокория) и др. Характерны осложнения в виде параличей отдельных мышц, невритов, психических расстройств, деменции.
Септическая форма и поражение ЦНС являются тяжёлыми вариантами течения листериоза, при которых смертность достигает 30%. Они могут развиваться без предшествующей первично-очаговой симптоматики [28].
Инфицирование листериями беременных может привести к формированию бактерионосительства или развитию гриппоподобной инфекции, гастроинтестинальной формы, пиелита, редко других форм. Течение листериоза у самих беременных обычно благоприятное. Однако как при клинически выраженном листериозе, так и при листерионосительстве высок риск прохождения листерий через плаценту и возникновения внутриутробной инфекции плода вследствие поглощения ребенком инфицированной амниотической жидкости. Результатом внутриутробного листериоза могут быть спонтанные аборты, внутриутробная смерть, мертворождения, формирование пороков плода. В случае жизнеспособности плода беременность может оканчиваться преждевременными родами, рождением ребенка с врождённым листериозом (главным образом при инфицировании во второй половине беременности), в ряде случаев — здорового новорождённого. Врождённый листериоз протекает очень тяжело, в септико-гранулематозной форме, при которой листерии распространяются через кровь и формируют микроабсцессы и листериомы во всех органах. Наиболее часто врождённый листериоз протекает с развитием сепсиса, менингоэнцефалита, пневмонии, гепатита и характеризуется чрезвычайно высокой летальностью (50–90%) в результате глобального нарушения функций дыхания (респираторный дистресс-синдром) и кровообращения. Симптомы врождённого листериоза соответствуют клинической форме инфекции и обычно выявляются у новорождённых через 1–2 суток после рождения, а в случае интранатального инфицирования позже — на 2–3-й неделях жизни. Патогномоничным является обнаружение при наружном осмотре на коже и в ротоглотке беловато-серых гранулем диаметром 1–2 мм, может наблюдаться папулезная или розеолезная сыпь с геморрагическим венчиком. Следует иметь в виду, что листериоз новорождённых с поздним началом может быть не только результатом интранатального заражения, но и случаем ИСМП (инфекции, связанной с оказанием медицинской помощи), когда инфицирование связано не с передачей возбудителя от матери, а с попаданием листерий из внешней среды медицинского учреждения. В последнем случае характерно возникновение нервных форм болезни [25][29].
Микробиологическая диагностика листериоза человека
«Многоликость» листериоза и малая настороженность врачей в отношении этой инфекции создают трудности в диагностике. В связи с этим особое значение приобретают методы микробиологической диагностики. Принципиально их можно разделить на две группы: прямые методы, направленные на выявление присутствия возбудителя в исследуемых образцах, и косвенные, позволяющие регистрировать уровень и класс специфических антител, синтезирующихся в динамике болезни. К первой группе относятся бактериологический метод (основной, является «золотым стандартом», направлен на выделение и идентификацию живого возбудителя) и не менее актуальная в настоящее время экспресс-индикация L. monocytogenes непосредственно в клинических образцах (обнаружение ДНК листерий с помощью ПЦР для 16S ДНК или генов iap, а также выявление бактериальных антигенов в иммунохроматографическом тесте «РЭД Listeria»). Во вторую группу отнесена серодиагностика, которая рассматривается как вспомогательный метод, имеющий малую достоверность, поскольку листериозные антигены по своей структуре очень схожи с антигенами других микроорганизмов (рис. 3) [30][31].
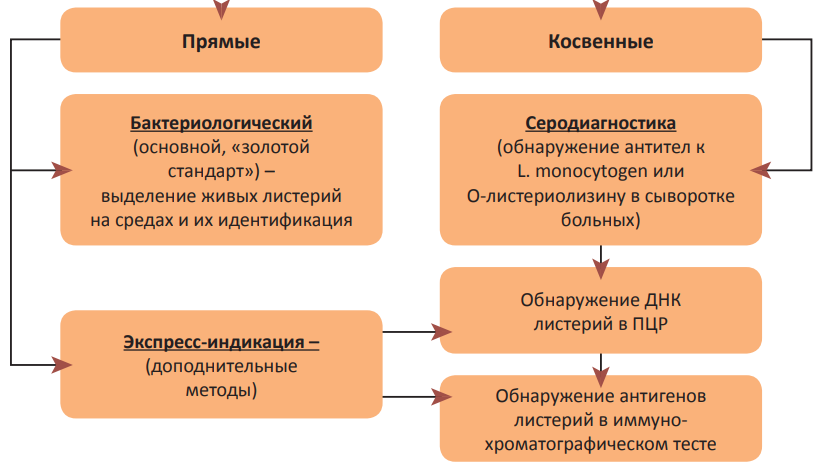
Рисунок 3. Лабораторные методы диагностики листериоза человека.
Для прямых методов исследования возможно использование различных видов материала от больных, что определяется клинической формой инфекции. Наиболее часто забирают мазок с первичного кожного аффекта, кровь на стерильность, ликвор, околоплодные воды, плаценту, мазок из цервикального канала, а также секционный материал: мозг, печень, селезёнку, почки. Выделение L. monocytogenes из фекалий и мочи имеет диагностическую значимость в основном при наличии соответствующего эпидемиологического анамнеза, поскольку этот вид листерий может обнаруживаться и у бактерионосителей. Для серодиагностики используют «парные» сыворотки крови, полученные в начале второй недели заболевания и спустя 7–10 дней, с целью регистрации нарастания титра суммарных противолистериозных антител (IgM/IgG) в 4 и более раз, либо же определение только IgG с помощью ИФА. Разработаны также тест-системы ИФА, позволяющие определить наличие IgG к секретируемому фактору патогенности листерий — листериолизину-О. Эта методика является более специфической, однако рекомендована только для выявления неинвазивных бессимптомных форм болезни при эпидемических вспышках листериоза [3][32].
Бактериологическая диагностика
Основанием для назначения соответствующего антибактериального лечения является постановка окончательного диагноза листериоза, для чего необходимо выделить чистую культуру L. monocytogenes и идентифицировать её.
Листерии имеют скромные питательные потребности, они неприхотливы при культивировании на искусственных питательных средах. Однако лучшее выделение достигается на средах с богатой питательной основой, содержащих такие источники аминного азота и витаминов группы В, как гидролизаты казеина, рыбной муки, дрожжей, например, казеиново-соевые среды («триптон-соевые» и «триптиказо-соевые» бульоны и агары), коммерческие флаконы для гемокультур.
На прозрачных питательных агарах листерии растут в виде мелких полупрозрачных «росинчатых» колоний. В проходящем свете колонии серо-голубые, в косо-проходящем свете при освещении по Генри (освещение чашек снизу под углом 45 и просмотр под углом 90°) они опалесцируют голубым или голубовато-зеленым цветом.
При выделении листерий из нестерильных биотопов человека необходимо использовать селективно-дифференциальные питательные среды с учётом того, что концентрация L. monocytogenes в образцах обычно мала, а скорость роста уступает многим УПМ. В качестве ингибиторов сопутствующей микрофлоры наиболее часто в среды вводят налидиксовую кислоту, хлорид лития, акрифлавин, антибиотики (полимиксин В, цефазидин), циклогексимид. В качестве дифференцирующих индикаторов добавляют эскулин с аммонийным железом (при гидролизе листериями эскулина до глюкозы и эскулетина последний реагирует с ионами железа, образуя комплекс черного или оливкового цвета); реже используют теллурит калия. Примерами плотных сред являются хромогенный агар ALOA (Агар Listeria по Оттавиани и Агости), Оксфорд-агар, Палкам-агар, ПАЛ (питательный агар для листерий), жидких — бульон Фрезера, Палкам-бульон, ПБЛ (питательный бульон для листерий), селективный накопительный бульон «UVM» и др. [1].
Выделение проходит в несколько последовательных этапов:
- Предварительное обогащение путём посева материала на бульон Фрезера или ПБЛ в соотношении 1:9 и инкубация при температуре 30°С в течение 24–48 ч.
- Листерии вырастают в виде помутнения с характерными «муаровыми» волнами при встряхивании флакона и почернением. Пересев культуры с селективного бульона параллельно на две плотные дифференциально-селективные среды: первая среда (обязательная) — ALOA (Агар Listeria по Оттавиани и Агости); вторая среда — Оксфорд агар, или Палкам агар, или ПАЛ. Посевы культивируют при 37°С и просматривают через (24 ± 3) ч.
- Отмечают рост типичных колоний L. monocytogenes: на ALOA сине-зеленые колонии, окружённые непрозрачным ореолом; на Оксфорд-агаре — мелкие сероватые колонии, окружённые черным ореолом; на Палкам агаре — мелкие серовато-зеленые или оливково-зеленые колонии с чёрным ореолом, иногда с чёрным центром; на ПАЛ — мелкие серовато-желтые колонии с черным ореолом. Проводят накопление чистой культуры путём пересева типичных колоний на неселективные плотные питательные среды (триптон-соевый агар с дрожжевым экстрактом или др.).
- Идентифицируют бактерии по морфологическим и биохимическим признакам. Для определения родовой принадлежности выполняют каталазный (+) и оксидазный (-) тесты. Дифференциация видов Listeria проводится с применением следующих тестов: гемолитическая активность и CAMP-тест (реакция Christie-Atkins-Munch-Petersen) (ключевые тесты), образование кислоты из D-ксилозы, L-рамнозы, α-метил-β-маннозида, маннитола и лецитиназная активность на яично-желточном агаре (ЯЖА) в присутствии угля и без него.
- Учёт дифференциальных тестов и заключение об идентификации вида листерий. Необходимо иметь достаточный практический навык для правильного учёта гемолитического и CAMP-тестов. Так, L. monocytogenes и L. seeligeri на кровяном агаре с бараньей или человеческой кровью образуют узкие (не более 1 мм), слегка прозрачные зоны β-гемолиза, L. ivanovii — широкие, чётко очерченные зоны просветления среды, а L. innocua, L. welshimeri, L. grayi не вызывают гемолиз. В САМР-тесте при посеве L. monocytogenes перпендикулярно к двум параллельным штрихам эталонных штаммов Staphylococcus aureus АТСС 25923 и Rhodococcus equi NCTC 1621 наблюдается выраженное расширение зоны гемолиза в соседствующей области роста S. aureus и отсутствие изменений зоны гемолиза рядом с R. еqui [30]. Для дифференциации потенциально-патогенных для человека видов листерий целесообразно использовать таблицу 1.
Таблица 1
Характеристика клинически значимых видов Listeria
|
Виды листерий |
β-гемолиз |
CAMP-тест |
Окисление |
Лецитиназная активность на ЯЖА |
|||
|
S. aureus |
R. equi |
L-рамнозы |
D-ксилозы |
С углём |
Без угля |
||
|
L. monocytogenes |
+ |
+ |
- |
+ |
- |
+ |
- |
|
L. ivanovii |
++ |
- |
+ |
- |
+ |
+ |
+ |
|
L. seeligeri |
+ |
+ |
- |
+ |
+ |
+ |
+ |
Примечание: «+» — наличие признака; «++» — выраженное наличие признака; «-» — отсутствие признака.
Серотипирование листерий
Поскольку L. monocytogenes имеет одну или несколько общих антигенных детерминант с другими видами листерий, независимо от патогенности для человека, сероварианты листерий не являются видоспецифичными. В связи с этим серотипирование листерий на этапах бактериологического исследования не имеет дифференциального значения. Однако оно может быть использовано при поиске эпидемически значимых штаммов L. monocytogenes в целях расшифровки эпидемиологической ситуации для выявления возможных источников инфекции во время вспышек листериозной инфекции в человеческой популяции. Типирование выполняют с помощью серологических реакций — латекс- или слайд-агглютинации. Более достоверным методом типирования, имеющим высокую дискриминационную возможность, является молекулярно-генетический анализ [33]. Его результаты позволяют выявить эпидемиологические и популяционно-генетические взаимосвязи между циркулирующими изолятами в бактериальных популяциях. Для генотипирования используют мультиплексную ПЦР, основанную, согласно международной классификации, на корреляции между серогрупповой принадлежностью штамма листерий и наличием специфических открытых рамок считывания в его геноме. Мультилокусное сиквенс-типирование (Multilocus Sequence Typing — MLST) L. monocytogenes направлено на определение аллельного профиля семи генов: abcZ, bglA, cat, dapE, dat, ldh и lh-kA. Молекулярно-генетический мониторинг является важным инструментом эпиднадзора за листериозной инфекцией [34][35].
Заключение
В течение прошедших 100 лет с момента открытия и описания листерий заболеваемость человека листериозной инфекцией значительно возросла и приобрела особую значимость у отдельных контингентов людей («групп риска»), преимущественно с иммунологической недостаточностью (беременные, новорождённые, лица с коморбидными состояниями, старше 60 лет, наркоманы и др.). В связи с многообразием путей передачи и клинических форм листериоза, полиморфизмом симптоматики и отсутствием её специфичности расшифровка патогенеза, особенностей формирования иммунитета и усовершенствование методов микробиологической диагностики листериозной инфекции приобретают сейчас особое значение. Актуальной проблемой остается разработка эффективных препаратов для специфической иммунопрофилактики листериоза человека.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Бакулов И. А., Васильев Д. А., Ковалева Е. Н., Егорова И. Ю., Селянинов Ю. О. Листерии и листериоз. Монография. 2-е изд., испр. и доп. Ульяновск: НИИЦМиБ; 2016.
2. Зверев В.В., Бойченко М.Н. Медицинская микробиология, вирусология и иммунология: учебник по дисциплине "Микробиология, вирусология и иммунология" для студентов учреждений высшего профессионального образования, обучающихся по специальностям 060101.65 "Лечебное дело", 060103.65 "Педиатрия", 060104.65 "Медико-профилактическое дело" в 2-х томах. Москва: ГЭОТАР-Медиа, 2014.
3. Зайцева Е.А. Листериоз: методы лабораторной диагностики: учебно-методическое пособие. 2-е изд., перераб. и доп. Владивосток: Медицина ДВ, 2017.
4. Al-Mashhadany DA. Occurrence and antibiogram of Listeria monocytogenes Isolates from Retail Meat Shops at Erbil City, Kurdistan Region, Iraq. Ital J Food Saf. 2019;8(4):8451. DOI: 10.4081/ijfs.2019.8451.
5. European Food Safety Authority (EFSA). EU summary report on trends and sources of zoonoses, zoonotic agents and foodborne outbreaks in 2015. EFSA. 2016;14(12):e04634. DOI: 10.2903/j.efsa.2016.4634
6. Schlech WF. Epidemiology and Clinical Manifestations of Listeria monocytogenes Infection. Microbiol Spectr. 2019;7(3). DOI: 10.1128/microbiolspec.GPP3-0014-2018
7. Попова Ю.А., Дятлов И.А. Микробиологический контроль качества пищевой продукции. Монография. Москва: Династия; 2020.
8. Хаптанова Н.М., Андреевская Н.М., Лукьянова C.В., Коновалова Ж.А., Гефан Н.Г., Остяк А.С., и др. Особенности серологической диагностики листериоза (обзор литературы). Acta Biomedica Scientifica. 2019;4(1):43-49. DOI: 10.29413/ABS.2019-4.1.7
9. Chalenko Y, Kalinin E, Marchenkov V, Sysolyatina E, Surin A, Sobyanin K, et al. Phylogenetically Defined Isoforms of Listeria monocytogenes Invasion Factor InlB Differently Activate Intracellular Signaling Pathways and Interact with the Receptor gC1q-R. Int J Mol Sci. 2019;20(17):4138. DOI: 10.3390/ijms20174138
10. Cardenas-Alvarez MX, Townsend Ramsett MK, Malekmohammadi S, Bergholz TM. Evidence of hypervirulence in Listeria monocytogenes clonal complex 14. J Med Microbiol. 2019;68(11):1677-1685. DOI: 10.1099/jmm.0.001076
11. Алексеева Е.А., Полосенко О.В., Фурсова Н.К., Асташкин Е.И., Борзенков В.Н., Кисличкина А.А., и др. Первый случай выявления Listeria monocytogenes сиквенс-типов ST7, ST20, ST425 в сточных водах при обследовании водных объектов Вологодской области. Журнал микробиологии, эпидемиологии и иммунобиологии. 2022;99(4):453-464. DOI: 10.36233/0372-9311-266
12. Wilson A, Gray J, Chandry PS, Fox EM. Phenotypic and Genotypic Analysis of Antimicrobial Resistance among Listeria monocytogenes Isolated from Australian Food Production Chains. Genes (Basel). 2018;9(2):80. DOI: 10.3390/genes9020080
13. Maung AT, Mohammadi TN, Nakashima S, Liu P, Masuda Y, Honjoh KI, et al. Antimicrobial resistance profiles of Listeria monocytogenes isolated from chicken meat in Fukuoka, Japan. Int J Food Microbiol. 2019;304:49-57. DOI: 10.1016/j.ijfoodmicro.2019.05.016
14. Baquero F, F Lanza V, Duval M, Coque TM. Ecogenetics of antibiotic resistance in Listeria monocytogenes. Mol Microbiol. 2020;113(3):570-579. DOI: 10.1111/mmi.14454
15. Maćkiw E, Stasiak M, Kowalska J, Kucharek K, Korsak D, Postupolski J. Occurrence and Characteristics of Listeria monocytogenes in Ready-to-Eat Meat Products in Poland. J Food Prot. 2020;83(6):1002-1009. DOI: 10.4315/JFP-19-525
16. Воронина О.Л., Тартаковский И.С., Ющук Н.Д., Рыжова Н.Н., Аксёнова Е.И., Кунда М.С., и др. Анализ спорадических случаев инвазивного листериоза в мегаполисе. Журнал микробиологии, эпидемиологии и иммунобиологии. 2021;97(6):546-555. DOI: 10.36233/0372-9311-2020-97-6-5
17. Ковалев В.А., Филатов Н.Н., Алешина Е.Н., Симонова Е.Г. Заболеваемость листериозом в Российской Федерации. Наука молодых (Eruditio Juvenium). 2019;7(4):509-517. DOI: 10.23888/HMJ201974509-517
18. Lüth S, Halbedel S, Rosner B, Wilking H, Holzer A, Roedel A, et al. Backtracking and forward checking of human listeriosis clusters identified a multiclonal outbreak linked to Listeria monocytogenes in meat products of a single producer. Emerg Microbes Infect. 2020;9(1):1600-1608. DOI: 10.1080/22221751.2020.1784044
19. Shamloo E, Hosseini H, Abdi Moghadam Z, Halberg Larsen M, Haslberger A, Alebouyeh M. Importance of Listeria monocytogenes in food safety: a review of its prevalence, detection, and antibiotic resistance. Iran J Vet Res. 2019;20(4):241-254. PMID: 32042288; PMCID: PMC6983307.
20. Кладова О.В., Анджель А.Е., Компаниец Ю.В., Гришкевич Н.Л. К вопросу дифференциальной диагностики листериоза. Детские инфекции. 2019;18(3):61-66. DOI: 10.22627/2072-8107-2019-18-3-61-66
21. Еремушкина Я.М., Кускова Т.К., Смирнова Т.Ю. Листериоз как одна из причин неблагоприятных исходов у пациентов с иммуносупрессивными состояниями. Лечащий Врач. 2020;(4):60. DOI: 10.26295/OS.2020.48.47.011
22. Коровкина Е.С., Кажарова С.В. Роль Toll-подобных рецепторов в патогенезе воспалительных заболеваний бронхолегочной системы. Инфекция и иммунитет. 2016;6(2):109–116. DOI: 10.15789/2220-7619-2016-2-109-116
23. Медведева В.В. Современные особенности врожденного листериоза (клинический случай). Университетская Клиника. 2020;34(1):106-109. DOI: 10.26435/uc.v0i1(34).428
24. Fouks Y, Amit S, Many A, Haham A, Mandel D, Shinar S. Listeriosis in pregnancy: under-diagnosis despite over-treatment. J Perinatol. 2018;38(1):26-30. DOI: 10.1038/jp.2017.145
25. Нафеев А.А., Модникова В.И., Попов В.В., Горбикова Н.П., Сайфутдинова Ф.А., Фахрутдинова О.А., и др. К вопросу диагностики внутриутробного листериоза. Детские инфекции. 2022;21(1):66-69. DOI: 10.22627/2072-8107-2022-21-1-66-69
26. Drevets DA, Bronze MS. Listeria monocytogenes: epidemiology, human disease, and mechanisms of brain invasion. FEMS Immunol Med Microbiol. 2008;53(2):151-65. DOI: 10.1111/j.1574-695X.2008.00404.x
27. Sia C, Wilson S, Ananda-Rajah M, Mills J, Aung AK. Listeria monocytogenes peritonitis in an HIV-infected patient. Clin Nephrol. 2017;87(2017)(5):267-270. DOI: 10.5414/CN108897
28. Балыкова Л.А., Грановская М.В., Заславская К.Я., Симакина Е.Н., Агафьина А.С., Иванова А.Ю., и др. Новые возможности направленной противовирусной терапии COVID-19: результаты многоцентрового клинического исследования эффективности и безопасности применения препарата Арепливир. Инфекционные болезни: новости, мнения, обучение. 2020;9(3):16-29. DOI: 10.33029/2305-3496-2020-9-3-16-29
29. Белова А.В., Никонов А.П., Каптильный В.А., Науменко Н.С. Листериоз и беременность: актуальные вопросы диагностики, лечения и профилактики. Архив акушерства и гинекологии им. В.Ф. Снегирева. 2018;5(4):187-192. DOI: 10.18821/2313-8726-2018-5-4-187-192
30. Алексеева Е.А., Миронов А.Ю., Полосенко О.В., Шепелин А.П., Храмов М.В. Выделение и идентификация листерий из клинического материала. Клиническая лабораторная диагностика. 2022;67(6):362-368. DOI: 10.51620/0869-2084-2022-67-6-362-368
31. Smith AM, Tau NP, Smouse SL, Allam M, Ismail A, Ramalwa NR, et al. Outbreak of Listeria monocytogenes in South Africa, 2017-2018: Laboratory Activities and Experiences Associated with Whole-Genome Sequencing Analysis of Isolates. Foodborne Pathog Dis. 2019;16(7):524-530. DOI: 10.1089/fpd.2018.2586
32. Харсеева Г.Г., Тюкавкина С.Ю. Основы вакцинологии. Оценка поствакцинального иммунитета (материал для подготовки лекции). Инфекционные болезни: новости, мнения, обучение. 2020;9(3):106-118. DOI: 10.33029/2305-3496-2020-9-3-106-118
33. Воронина О.Л., Кунда М.С., Рыжова Н.Н., Кутузова А.В., Аксенова Е.И., Карпова Т.И. и др. Листериоз. Генотипирование как ключ к выявлению возможного источника заражения. Клиническая микробиология и антимикробная химиотерапия. 2019;21(4):261–73. DOI: 10.36488/cmac.2019.4.261-273
34. Асташкин Е.И., Алексеева Е.А., Борзенков В.Н., Кисличкина А.А., Мухина Т.Н., Платонов М.Е., и др. Молекулярно-генетическая характеристика полирезистентных штаммов Listeria monocytogenes и идентификация новых сиквенс-типов. Молекулярная генетика, микробиология и вирусология. 2021;39(4):3‑13.DOI: 10.17116/molgen2021390413
35. Kuch A, Goc A, Belkiewicz K, Filipello V, Ronkiewicz P, Gołębiewska A, et al. Molecular diversity and antimicrobial susceptibility of Listeria monocytogenes isolates from invasive infections in Poland (1997-2013). Sci Rep. 2018;8(1):14562. DOI: 10.1038/s41598-018-32574-0
Об авторах
С. Ю. ТюкавкинаРоссия
Тюкавкина Светлана Юрьевна, к.м.н., доцент кафедры микробиологии и вирусологии №2
Ростов-на-Дону
И. М. Котиева
Россия
Котиева Инга Мовлиевна, д.м.н., проф., проф. каф. патологической физиологии, проректор по научной работе
Ростов-на-Дону
М. А. Додохова
Россия
Додохова Маргарита Авдеевна, д.м.н., зав. центральной-научно-исследовательской лабораторией, доцент каф. патологической физиологии
Ростов-на-Дону
Д. А. Гречина
Россия
Гречина Дарья Александровна, обучающийся
Ростов-на-Дону
С. А. Бабиев
Россия
Бабиев Сергей Андреевич, обучающийся
Ростов-на-Дону
Г. Г. Харсеева
Россия
Харсеева Галина Георгиевна, д.м.н., проф., зав. каф. микробиологии и вирусологии №2
Ростов-на-Дону
Рецензия
Для цитирования:
Тюкавкина С.Ю., Котиева И.М., Додохова М.А., Гречина Д.А., Бабиев С.А., Харсеева Г.Г. Патогенез и клинические формы листериоза человека. Южно-Российский журнал терапевтической практики. 2024;5(1):99-111. https://doi.org/10.21886/2712-8156-2024-5-1-99-111
For citation:
Tyukavkina S.Yu., Kotieva I.M., Dodokhova M.A., Grechina D.A., Babiev S.A., Kharseeva G.G. Pathogenesis and clinical forms of human listeriosis. South Russian Journal of Therapeutic Practice. 2024;5(1):99-111. (In Russ.) https://doi.org/10.21886/2712-8156-2024-5-1-99-111


























