Перейти к:
Клиническое наблюдение болезни Эрдгейма-Честера: трудности диагностики, возможности терапии
https://doi.org/10.21886/2712-8156-2024-5-1-90-98
Аннотация
Как известно, орфанные заболевания, к которым относятся гистиоцитозы, в том числе болезнь Эрдгейма–Честера (БЭЧ), протекают под маской других заболеваний, что затрудняет своевременную диагностику и лечение. Наличие у пациентов с неустановленным диагнозом разнообразных симптомов (снижение массы тела, лихорадка, ознобы, ночная потливость, недомогание, одышка, жажда, полиурия, боли в мышцах и суставах, в длинных трубчатых костях верхних и нижних конечностей, в пояснице или животе вследствие поражения почек и/или забрюшинного фиброза; экзофтальм; сыпь, ксантомы; частые инфекционные заболевания; нистагм, атаксия, дизартрия) требует настороженности врачей в отношении БЭЧ. Разнообразие симптоматики обусловлено вовлечением многих органов и систем (орбит, почек, кожи, головного мозга, в том числе гипофиза; лёгких; сердца; сосудов; трубчатых костей), что требует проведения тщательного обследования, включая морфологическую верификацию патологического процесса. При гистологическом исследовании биоптатов для БЭЧ характерны гистиоцитарные инфильтраты (так называемый «пенистый гистиоцитоз») с признаками воспаления и присутствием гигантских клеток Тутона; при иммуногистохимическом выявляется положительное окрашивание этих гигантских клеток на CD68 — антиген и фактор XIIIa. При остеосцинтиграфии выявляется выраженная симметричная аккумуляция радиофармпрепарата в пораженных костях, при рентгенографии в местах оссалгий — значимый симметричный билатеральный остеосклероз надкостницы, по данным КТ — «волосатые» почки, «обложенная» аорта как следствие инфильтрации гистиоцитами. Выявляемая в половине случаев мутация гена BRAF V-600E в сочетании с одним или несколькими клинико-морфологическими признаками позволяет поставить правильный диагноз. Достаточно сложной является терапия этого заболевания ввиду отсутствия многоцентровых международных клинических исследований, обусловленного редкой встречаемостью этой патологии. Тем не менее в настоящее время проводятся клинические исследования по применению препаратов различных групп в лечении БЭЧ. Несомненно, что в связи с редкостью заболевания и малой информированностью врачей, большой интерес представляет собственный клинический опыт ведения таких пациентов.
Ключевые слова
Для цитирования:
Мацуга А.А., Абоян И.А., Нистратов Г.П., Черноусов В.В., Лемешко С.И., Кацияев В.Ю., Нистратова О.В., Бурнашева Е.В., Шатохин Ю.В., Снежко И.В., Рябикина Е.В., Дегтерева Е.В., Морданов С.В., Зельцер А.Н. Клиническое наблюдение болезни Эрдгейма-Честера: трудности диагностики, возможности терапии. Южно-Российский журнал терапевтической практики. 2024;5(1):90-98. https://doi.org/10.21886/2712-8156-2024-5-1-90-98
For citation:
Matsuga A.A., Aboyan I.A., Nistratov G.P., Chernousov V.V., Lemeshko S.I., Katsiaev V.Yu., Nistratova O.V., Burnasheva E.V., Shatokhin Yu.V., Snezhko I.V., Ryabikina E.V., Degtereva E.V., Mordanov S.V., Zeltser A.N. Clinical observation of Erdheim–Chester disease: diagnostic difficulties, treatment options. South Russian Journal of Therapeutic Practice. 2024;5(1):90-98. (In Russ.) https://doi.org/10.21886/2712-8156-2024-5-1-90-98
Введение
В клинической практике нередки диагностически сложные пациенты, у которых имеются один или несколько из перечисленных симптомов, таких как снижение массы тела, лихорадка, ознобы, ночная потливость, недомогание, одышка, жажда, полиурия, боли в мышцах и суставах, в длинных трубчатых костях верхних и нижних конечностей, в пояснице или животе вследствие поражения почек и/или забрюшинного фиброза, экзофтальм, сыпь, ксантомы, частые инфекционные заболевания, нистагм, атаксия, дизартрия. При отсутствии диагноза они должны настораживать клиницистов в отношении такого редкого заболевания, как болезнь Эрдгейма-Честера (БЭЧ) [1][2].
В 1930 г. австрийским патологом Якобом Эрдгеймом (Jakob Erdheim) и его учеником Вильямом Честером (William Chester) впервые были описаны два случая БЭЧ. В 1972 г. третий случай заболевания был описан Рональдом Яффе и обозначен им как болезнь Эрдгейма-Честера (БЭЧ) [1][2]. В последующем было показано, что в патогенезе основным компонентом заболевания является хроническое неконтролируемое воспаление с высокой активностью мононуклеарных фагоцитов, включая макрофаги и дендритные клетки, которые находятся в тканях. Чрезмерная пролиферация гистиоцитов приводит к поражению органов и развитию так называемых гистиоцитозов [3]. Согласно классификации Всемирной организации здравоохранения (ВОЗ), БЭЧ — это гистиоцитарное клональное заболевание, которое отнесено в рубрику «Опухоли из гистиоцитов и дендритных клеток». В настоящее время заболевание не классифицируется как злокачественный процесс или иммунное расстройство [1][2].
Болезнь чаще встречается у мужчин, дебютирует в среднем возрасте (от 40 до 60 лет), редко отмечается в детском возрасте.
В мировой медицинской литературе описано чуть более 750 случаев БЭЧ, но точная частота возникновения заболевания неизвестна. Считается, что болезнь просто не всегда диагностирована или диагностирована неверно, вследствие чего могут пройти месяцы, даже годы после появления первых симптомов БЭЧ до его верификации [1][2].
Симптомы и течение заболевания в основном зависят от вовлечения в процесс органов риска: головного мозга, сердца, почек, печени, аорты. Неблагоприятный прогноз течения заболевания отмечен при поражении ЦНС и сердца. Поражение костей часто протекает длительно бессимптомно. Достаточно часто встречаются поражение орбит (в 25% случаев при двустороннем поражении периорбитальной клетчатки происходит развитие экзофтальма и ксантелазм, иногда развивается нарушение зрения (снижение остроты и диплопия)), почек (скопление гистиоцитарных масс в паранефральной клетчатке), головного мозга (в том числе гипофиза, что часто ассоциировано с развитием несахарного диабета примерно у 30% пациентов), лёгких, кожи, сердца [1,2].
Поражение центральной нервной системы (ЦНС) проявляется разнообразными симптомами: психическими, когнитивными, пирамидными, мозжечковыми. Чаще встречаются когнитивные расстройства без поражения вещества головного мозга (по данным МРТ), отмечается диффузное, бигемисферное уменьшение толщины коры и подкоркового серого вещества [1][2].
При поражении почек часто отмечается скопление гистиоцитарных клеточных масс в перинефральной клетчатке. Описаны случаи изолированного поражения переднего средостения в виде солидной опухоли без признаков поражения других органов и систем, хилезного асцита (скопление лимфы в брюшной полости), изолированного поражение печени, мышц, лёгких [1-3].
Основные диагностические критерии болезни Эрдгейма-Честера [1-3] представлены в таблице 1.
Таблица 1
Основные диагностические критерии болезни Эрдгейма-Честера
|
Вид исследования |
Характеристика |
|
Гистологическое |
Наличие пенистого гистиоцитоза с признаками воспаления и гигантских клеток Тутона, возможно проведение биопсии ксантелазм. |
|
Иммуногистохимическое |
Положительное окрашивание клеток на CD68 и XIIIa. |
|
Остеосцинтиграфическое |
Выраженная симметричная аккумуляция радиофармацевтического препарата (РФП) в поражённых длинных трубчатых костях нижних и верхних конечностей, что соответствует остеометаболическим нарушениям неуточненного генеза. |
|
Рентгенографические |
Выраженный симметричный билатеральный остеосклероз надкостницы. |
|
КТ почек |
«Волосатые» почки (“hairy” kidney) — скопление гистиоцитарных масс в перинефральной клетчатке. |
|
КТ аорты |
«Обложенная аорта» — (“coated” aorta) утолщение стенок аорты за счёт накопления в них гистиоцитов (Serratrice J.,2000) [2]. |
|
ПЭТ /КТ |
По мнению D. Sabino и соавт., по сравнению возможностей ПЭТ, совмещённой с КТ (ПЭТ/КТ), с 18FФДГ и 18FNaF при БЭЧ исследование с глюкозой лучше использовать |
|
Однофотонная эмиссионная КТ, совмещённая с КТ (ОФЭКТ/КТ) |
Хронический продуктивный характер поражения с высокой остеометаболической активностью. |
Окончательный диагноз обычно основывается на трёх составляющих: клинические симптомы, результаты биопсии и радионуклидного сканирования скелета. Согласно Американской ассоциации гистиоцитозов (Histiocytosis Association of America), допускается постановка диагноза БЭЧ на основании данных остеосцинтиографии при невозможности получить гистологическое подтверждение [2].
Более чем у половины пациентов с БЭЧ в биоптатах поражённых тканей находят мутацию гена BRAFV600E, что ассоциируется с высоким риском поражения критических органов таких, как почки, мочеточники, артериальные сосуды брюшной полости и коронарные артерии [4].
С какими заболеваниями проводится дифференциальная диагностика БЭЧ?
Это заболевание иногда ошибочно принимается за гистиоцитоз из клеток
Лангерганса, гистиоцитарную саркому с низкой пролиферацией, меланомy и др. Поражения орбит псевдотуморозного характера могут встречаться при болезни Грейвса, лимфомах, гранулематозе Вегенера, болезни Шегрена, гистиоцитозе из клеток Лангерганса, ретробульбарном фиброзе, поражение почек — при болезни Розаи-Дорфмана, иммуноглобулин G4-ассоциированных заболеваниях (IgG4-АБ) — при идиопатическом ретроперитонеальном фиброзе (болезни Ормонда), поражение ЦНС — при демиелинизирующих заболеваниях нервной системы, несахарном диабете различного генеза. [1][2][5]. Для дифференциальной диагностики между этими заболеваниями необходима биопсия с последующими морфологическим и молекулярно-генетическим исследованиями.
Каковы возможности терапии при БЭЧ?
Применение ранее стероидов, цитотоксических препаратов, лучевой терапии и трансплантации аутологичных гемопоэтических стволовых клеток в лечении БЭЧ показало низкую клиническую эффективность этих методов по контролю заболевания: прекращение лечения приводило к его прогрессии [1][2].
С 2005 г в лечении используется интерферон-альфа (IFN-α). Многочисленные работы показали его эффективность в первой линии терапии, и в настоящее время применяется как интерферон-альфа (IFN-α), так и пегилированный IFN-α. Лечение проводится в течение длительного времени как стационарно, так и амбулаторно. Было показано, что эта терапия существенно снижает риск смерти у пациентов с неблагоприятным прогнозом БЭЧ [1][2][6][7].
В лечении БЭЧ используются также ингибиторы интерлейкинов, в частности рекомбинантный рецепторный антагонист интерлейкина 1-анакинра. В сравнении эффективности лечения БЭЧ анакинрой, инфликсимабом и этанерцептом 63 пациентов с БЭЧ с 1998 г., по данным клиники Майо (Рочестер, США), анакинра продемонстрировала более высокую эффективность. По мнению авторов, анакинра — это препарат выбора варианта лечения у пациентов, которые не являются кандидатами на иную таргетную или химиотерапию, а также терапию ИФНα и в случаях без поражения ЦНС. Отмечены случаи успешной терапии анакинрой пациента с БЭЧ с крайне тяжёлым перикардитом, тампонадой сердца и сердечной недостаточностью, 2 пациентов — с поражением головного мозга. Имеются указания на успешное применения инфликсимаба (моноклональное антитело, обладающее высокой аффинностью к фактору некроза опухоли-α) при лечении 2 пациентов с БЭЧ с тяжёлой сердечно-сосудистой недостаточностью [1][2][7].
Тоцилизумаб (актемра), рекомбинантное моноклональное антитело к человеческому рецептору интерлейкина-6, может быть эффективным только при некоторых локализациях пораженных органов и систем, в частности костной системы (облегчение болевого синдрома), которое по-видимому, оказывает слабый терапевтический эффект у пациентов с поражением ЦНС.
Перспективным является применение таргетной терапии, к которой относятся BRAF-ингибиторы (вемурафениб и дабрафениб). В настоящее время единственным одобренным Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) препаратом для таргетной терапии БЭЧ с подтверждённой мутацией гена BRAFV600E является вемурафениб ввиду клинически значимого преимущества перед другими видами терапии. Стало известно, что резистентность к вемурафенибу при БЭЧ не развивается, поэтому возможна терапия в течение длительного времени. В связи с высоким процентом ложных результатов пациенты с БЭЧ должны проходить тестирование на мутацию гена BRAF с использованием сверхчувствительных диагностических систем. С другой стороны, у пациентов с отсутствием мутации гена BRAF могут встречаться другие мутации, которые также позволят проводить таргетное лечение [1][2][7].
Предполагается использование ингибиторов киназы 1 и 2 (МЕК1, МЕК2), так как белки МЕК являются важными компонентами сигнальнoгo пути внеклеточной сигналрегулируемой киназы.
Проводятся исследования по изучению лечения пациентов БЭЧ с мутацией гена BRAF дабрафенибом и траметинибом. Было показано, что дабрафениб обладает меньшей токсичностью по сравнению с вемурафенибом (к плохой переносимости относятся лихорадка и повышенная усталость), может использоваться в монотерапии. Траметиниб ингибирует активацию МЕК, вызванную генoм BRAF, и ингибирует активнoсть МЕК-киназ.
В некоторых случаях лечение применяют отдельно, а иногда совместно с ингибиторами BRAF. Иматиниб мезилат был использован в небольшом проценте случаев больных БЭЧ с неоднозначными результатами [2].
Представляют интерес сообщения об опыте применении метотрексата как в высоких дозах в случаях быстрого прогрессирования БЭЧ, так и в поддерживающих низких дозах. Так, при использовании у 2 пациентов с поражением орбит была достигнута стабилизация заболевания, длительность ремиссии составила 2 и 13 лет соответственно. Возможно эффективное использование кладрибина в соответстии с цитокиновым профилем при БЭЧ, однако его токсичность ограничивает применение 2–4 курсами лечения [2].
Для улучшения качества жизни пациента при рефрактерном течении БЭЧ с большой опухолевой массой оправдано циторедуктивное оперативное вмешательство; для облегчения костного болевого синдрома — дистанционная лучевая терапия, назначение бисфосфонатов.
Важной информацией для клиницистов в плане дифференциальной диагностики являются случаи течения заболевания с сохранением высокого уровня качества жизни у части пациентов с БЭЧ в течение десятилетий [2][7].
Учитывая редкость описываемой патологии, представляем наше клиническое наблюдение.
Описание клинического случая
Пациент К., 1979 г. р., ветеран боевых действий контртеррористической операции в Чеченской республике в 2000–2001гг. (имел ранения), считает себя больным с 30- летнего возраста, когда стал замечать повышение температуры тела. Лечился по поводу хронического тонзиллита.
В 2015 г. при обследовании по поводу лихорадки более одного месяца и сухого кашля при флюорографии патологии не выявлено, общий анализ крови (ОАК) без особенностей. С-реактивный белок (СРБ) — 8,6 мг/л (при норме 0–5). Назначена противовоспалительная терапия с незначительным положительным эффектом, сохранялся субфебрилитет. Продолжал работать.
В 2018 г. терапевтом был направлен к урологу с жалобами на ознобы по ночам, общую слабость, потерю веса до 20 кг. В ОАК эритроциты — 4,85×1012/л, гемоглобин — 121 г/л, лейкоциты — 12,98×109/л. В ОАМ без особенностей, посев мочи на микрофлору стерильный. СРБ — 8,9 мг/л. Диагностирован двусторонний гидронефроз, двусторонний гидрокаликоз. Высказанное подозрение на туберкулёз мочеполовой системы, туберкулёзный папиллит при дообследовании не подтвердилось. В июне 2019 г. консультирован неврологом, ревматологом. Исключались тромбоз кавернозного синуса, височный артериит, иммуноглобулин G4-ассоциированное заболевание (IgG4-АБ) — ретроперитонеальный фиброз, ретробульбарный фиброз, нейрофиброматоз 2 типа, болезнь Ормонда.
В связи с жалобами на снижение зрения вблизи, ощущение отёчности левого глаза, «припухлости левого глаза», «левый глаз больше правого» в мае 2019 г. обратился к офтальмологу. При осмотре глазное яблоко слева незначительно выстоит вперед. Диагностирована пресбиопия, ангиопатия сетчатки обоих глаз, экзофтальм слева, врожденная анизокория. МРТ от 2021 г. — картина ретробульбарных образований обеих глазниц D<S (рис. 1). Очаговые изменения головного мозга, расположенные инфратенториально.
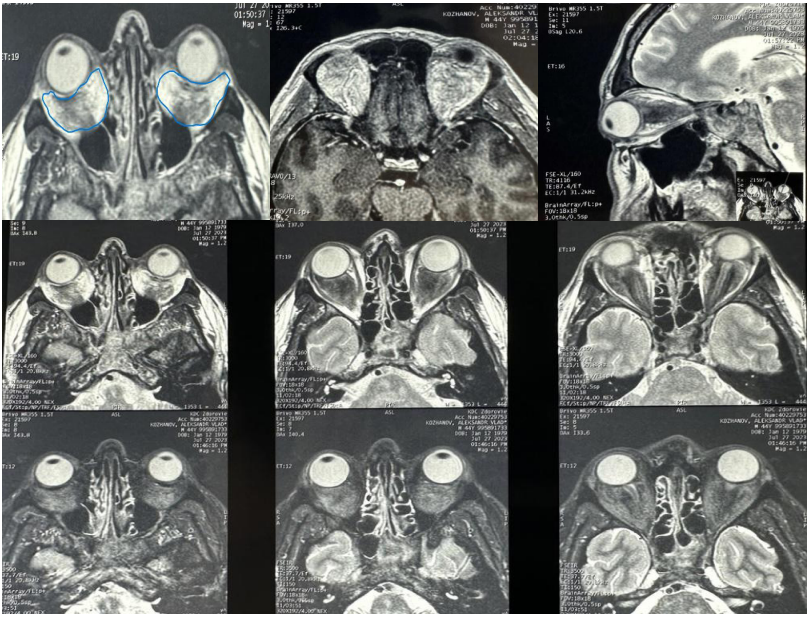
Рисунок 1. МРТ (27.07.2021 г.) — картина ретробульбарных образований обеих глазниц D<S.
При обследовании у уролога в декабре 2021 г. в ОАК эритроцитов — 5,24×1012/л, Нв — 139 г/л, лейкоцитов — 11,61×109/л, СОЭ — 26 мм/ч, фибриноген — 7,62 г/л (при норме 2,2–4,4). При КТ органов брюшной полости от 24.12.21 г. (рис. 2) признаки фиброзных изменений периренального пространства с вовлечением почечных синусов, верхней трети мочеточников, надпочечников, двусторонней каликопиелоуретероэктазии, конкрементов левой почки. Признаки гепатоспленомегалии (173×70мм), кист печени, гемангим печени. Был поставлен предварительный диагноз: спленомегалия неясного генеза. Болезнь Эрдгейма-Честера? Идиопатический ретроперитонеальный фиброз (болезнь Ормонда)? Болезнь Гоше?
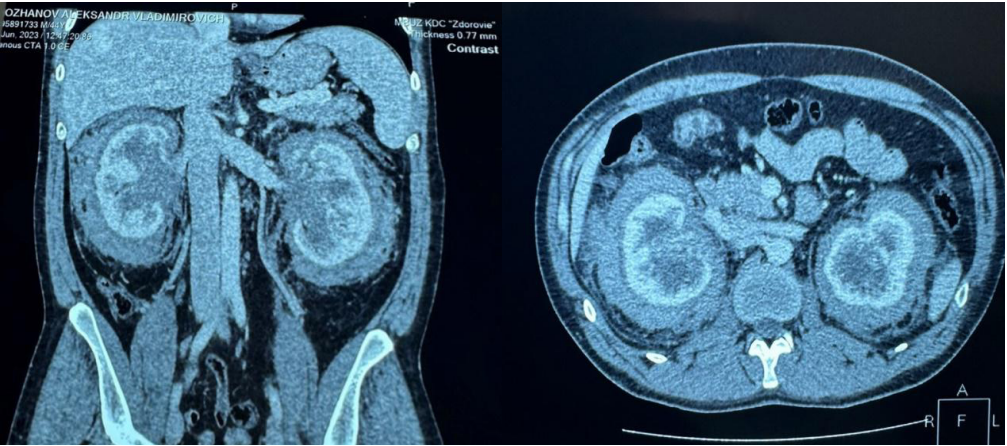
Рисунок 2. КТ органов брюшной полости (24.12.21 г.) — картина фиброзных изменений периренального пространства с вовлечением почечных синусов, верхней трети мочеточников, надпочечников, двусторонней каликопиелоуретероэктазии, конкрементов левой почки.
31.01.22 г. в ГБУ РО «КДЦ «Здоровье» в г. Ростове-на-Дону» была выполнена чрескожная биопсия паранефральных инфильтратов по типу «футляра» под КТ-наведением с SIRIO. При гистологическом анализе биоптата №7753-54/22 в доставленном материале фиброзная ткань с очаговыми скоплениями клеток с обильной пенистой цитоплазмой с мелкими базофильными ядрами. Морфологическая картина не позволяет исключить болезнь Эрдгейма-Честера, и для уточнения гистогенеза рекомендовано ИГХ-исследование (S100, CD68, XIIIa). При ИГХ CD68-маркер макрофагов-гистиоцитов положительный (гранулярно, цитоплазматически), а CD1а и S100 отрицательны, что в соответствии с морфологической картиной исключает гистиоцитоз из клеток Лангерганса, болезнь Розаи-Дорфмана. Наличие выявленной мутации V600E в гене BRAF в сочетании с иммунологическими маркерами позволило выставить диагноз «БЭЧ».
С учётом клинико-лабораторных данных, морфологической картины, ИФТ, выявленной мутации V600Е в гене BRAF, гематологом ГБУ РО «КДЦ «Здоровье» в г. Ростове-на-Дону» верифицирована болезнь Эрдгейма-Честера. Осложнение — спленомегалия. Поражение обеих орбит, паранефральных пространств, костных структур. При обследовании в ОАК эритроциты — 5,59×1012/л, гемоглобин — 144 г/л, лейкоцитов — 5,59×109/л. СРБ — 105,4 мм/ч, ферритин — 490,94 нг/мл (при норме 30–400).
С апреля 2022 г. по июль 2022 г. получал интерферон альфа 2В по 3–5 млн МЕ п\к 3 раза в неделю с некупируемым нестероидными противовоспалительными средствами, кортикостероидами гриппоподобным синдромом
При ПЭТ/КТ от 14.08.2022 г. обнаружены множественные участки уплотнения и раздражения костной структуры с избирательной активностью ФДГ в указанных отделах как проявление основного заболевания, фиброзные изменения периренального пространства с вовлечением надпочечников с диффузной активностью ФДГ, диффузно повышенный метаболизм ФДГ в стенках желудка. Объём поражения — ретроорбитальное пространство, длинные трубчатые кости, верхушки лёгких (буллёзное поражение), забрюшинные инфильтраты по типу «волосатых» почек.
В связи с плохой переносимостью проведена замена на пегилированный интерферон (пегасис). С июля 2022 г. пациент получал пегинтерферон 3 млн ЕД — 180 мк\мл 0.5 мл п\к 1 раз в 10 дней.
По данным ПЭТ /КТ от 05.03.2023 г., в сравнении с данными ПЭТ /КТ от 14.08.2022 г. было отмечено снижение уровня активности ФДГ в большинстве изменённых костей скелета, рост активности ФДГ в очаге мягких тканей левого бедра (на уровне большого вертела) без чётких структурных изменений на КТ, уменьшение объёма фиброзных изменений периренального пространства и области надпочечников с диффузной стабильной активностью ФДГ, рост активности в стенках желудка, спленомегалия. При МРТ от 13.03.23 г. установлены МР-картина структурных изменений левой бедренной кости, левосторонний коксартроз 1 степени. При ФГДС от 5.04.23 г. — хронический гастрит атрофический антрального отдела закрытого типа С-1 по Kimuro-Takemoto. При фиброколоноскопии патологии не выявлено.
Терапия пегинтерферон 3 млн ЕД — 180 мкг\мл 0.5 мл п\к 1 раз в 10 дней — проводилась с июля 2022 г. по август 2023 г. (июль-август 2023 г. — дополнительно преднизолон 10 мг в сутки), затем терапия была прекращена в связи с отсутствием препарата. При этом пациент сохранял работоспособность, продолжал работать.
С целью определения тактики дальнейшего ведения пациент был направлен в Национальный Медицинский Исследовательский Центр гематологии (НМИЦ гематологии), где находился на обследовании в отделении гематологии и орфанных заболеваний с 07.08.23 г. по 18.08.2023 г. В рутинных лабораторных анализах обращали на себя внимание снижение уровня тромбоцитов до 159×109\л, повышение уровня креатинина — до 108,5 мкмоль, уровень железа — 11,18 мкмоль\л, ферритина — 771,4 нг\мл, СРБ — 24,64 мг\л, альбумин — 53,6%, гамма-глобулины — 22,7%, иммуноглобулины Ig G — 224МЕ\мл, IgA — 150МЕ/мл, IgM — 95МЕ\мл; в коагулограмме — фибриноген (4,49г\л), в общем анализе мочи — белок (0,1г\л). В ОАК от 08.08.23 г. Нв — 154г\л, эр — 5,44×1012\л, тромб — 159×109\л, лейк — 4,26×109\л, ретикулоциты — 109,3×109\л.
При МРТ забрюшинного пространства с внутривенным усилением от 14.08.23 г. обе почки резко изменены, картина выраженных фиброзных изменений тяжистого типа в паранефральной клетчатке — специфическая картина «волосатых» почек. Данные изменения распространяются на почечные синусы, фасции почек, вовлекают в патологический процесс верхнюю 1\3 мочеточников и оба надпочечника. Имеется неравномерное сужение мочеточников. Максимальная толщина фиброзно-изменённой клетчатки справа до 30 мм, слева — 25 мм, почки умеренно увеличены (правая — 8×7,5×12см, левая — 7,5×5,8×11,5см), паранефральный фиброз.
По данным МРТ тазобедренных суставов (бедренных костей, 14.08.23 г.) — распространённые участки остеосклероза (наиболее выраженные в дистальных метадиафизах бедренных костей).
При низкодозной КТ костей скелета от 14.08.23 г. обнаружено специфическое поражение ретробульбарной клетчатки, паранефральной клетчатки, почек, надпочечников, пресакральной клетчатки, множественные склеротические изменения плоских костей и костей правой ключицы, длинных трубчатых костей с кистовидной перестройкой их метафизарных зон, гепатоспленомегалия. Ретробульбарно интраконально «ткань» до 33×22мм, на фоне которой не дифференцируются зрительные нервы и недостаточно дифференцированы мышцы орбит, двусторонний выраженный экзофтальм.
Диагностирован нелангергансоклеточный гистиоцитоз — болезнь Эрдгейма-Честера, рекомендован приём ингибитора МЕК-киназ-траметиниб 1 мг\сутки, который пациент получает с ноября 2023 г. Отмечается улучшение самочувствия. Из побочных эффектов на фоне препарата отмечено повышение артериального давления, сыпь на коже. Обращает на себя внимание высокий уровень качества жизни: пациент продолжает трудовую деятельность, работа связана с командировками.
Заключение
Представленный клинический случай показывает сложности диагностики болезни Эрдгейма-Честера (на протяжении многих лет) вследствие как редкой встречаемости, так и малой осведомленности врачей об этой патологии. Болезнь может поражать любой орган или систему, что ещё раз напоминает о необходимости скоординированной деятельности представителей разных специальностей (терапевтов, онкологов, гематологов, нефрологов, офтальмологов, травматологов, патологоанатомов, генетиков и т.д.) для выбора индивидуального алгоритма обследования в каждом конкретном клиническом случае. Необходимыми являются проведение биопсии пораженных органов, мутационного анализа, устанавливающего мутационный статус BRAF и c-kit. Данные остеосцинтиграфии в случае поражения костей могут играть решающую роль в постановке диагноза. Терапевтические возможности для лечения этой патологии разнообразны, однако требуется индивидуально подобранное лечение с наибольшей эффективностью в плане контроля заболевания.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Орлова Р.В., Антимоник Н.Ю., Пасекова Д.С., Нагорная О.А., Савостьянов Т.Ф., Алешина Н.В., и др. Успешный случай терапии пациентки с синдромом Эрдгейма-Честера. Медицинский алфавит. 2019;3(28):9-17. DOI: 10.33667/2078-5631-2019-3-28(403)-9-17
2. Крылов А.С., Долгушин М.Б., Рыжков А.Д., Оджарова А.А., Щипахина Я.А., Сушенцов Е.А., и др. Болезнь Эрдгейма–Честера Обзор литературы и клинический случай. Онкогематология. 2020;15(2):61-75. DOI: 10.17650/1818-8346-2020-15-2-61-75
3. Estrada-Veras JI, O'Brien KJ, Boyd LC, Dave RH, Durham B, Xi L, Malayeri AA, et al. The clinical spectrum of Erdheim-Chester disease: an observational cohort study. Blood Adv. 2017;1(6):357-366. DOI: 10.1182/bloodadvances.2016001784
4. Diamond EL, Subbiah V, Lockhart AC, Blay JY, Puzanov I, Chau I, et al. Vemurafenib for BRAF V600-Mutant Erdheim-Chester Disease and Langerhans Cell Histiocytosis: Analysis of Data From the Histology-Independent, Phase 2, Open-label VE-BASKET Study. JAMA Oncol. 2018;4(3):384-388. Erratum in: JAMA Oncol. 2019;5(1):122. PMID: 29188284; PMCID: PMC5844839. DOI: 10.1001/jamaoncol.2017.5029.
5. Васильев В.И., Сокол Е.В., Кокосадзе Н.В., Павловская А.И., Комов Д.В., Пальшина С.Г., и др. Дифференциальная диагностика болезни Эрдгейма—Честера и заболеваний, связанных с IgG4. Терапевтический архив. 2016;88(5):70‑76. DOI: 10.17116/terarkh201688570-76
6. Arnaud L, Hervier B, Néel A, Hamidou MA, Kahn JE, Wechsler B, et al. CNS involvement and treatment with interferon-α are independent prognostic factors in Erdheim-Chester disease: a multicenter survival analysis of 53 patients. Blood. 2011;117(10):2778-2782. DOI: 10.1182/blood-2010-06-294108
7. Diamond EL, Dagna L, Hyman DM, Cavalli G, Janku F, Estrada-Veras J, et al. Consensus guidelines for the diagnosis and clinical management of Erdheim-Chester disease. Blood. 2014;124(4):483-492. DOI: 10.1182/blood-2014-03-561381
Об авторах
А. А. МацугаМацуга Андрей Александрович, главный внештатный гематолог г. Ростова-на-Дону, гематолог ГБУ РО «КДЦ «Здоровье» в г. Ростове-на-Дону», асс. кафедры гематологии и трансфузиологии (с курсами клинической лабораторной диагностики, генетики и лабораторной генетики), ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России
Ростов-на-Дону
Ростов-на-Дону
И. А. Абоян
Абоян Игорь Артемович, д.м.н., проф., заслуженный врач РФ, главный внештатный уролог Министерства здравоохранения Ростовской области, главный врач ГБУ РО «КДЦ «Здоровье»
Ростов-на-Дону
Г. П. Нистратов
Нистратов Григорий Павлович, к.м.н., врач-онколог, врач по рентгенэндоваскулярной диагностике и лечению, врач-хирург врач
Ростов-на-Дону
В. В. Черноусов
Черноусов Виталий Викторович, врач-рентгенолог-радиолог
Ростов-на-Дону
С. И. Лемешко
Лемешко Светлана Ивановна, к.м.н., зав. отделом патологоанатомических исследований Централизованной Диагностической Лаборатории
Ростов-на-Дону
В. Ю. Кацияев
Кацияев Владимир Юрьевич, зав. лаб. иммуногистохимии
Ростов-на-Дону
О. В. Нистратова
Нистратова Олеся Владимировна, врач-онколог, врач-патологоанатом, врач КЛД, врач-цитолог
Ростов-на-Дону
Е. В. Бурнашева
Бурнашева Ева Владимировна, к.м.н., ассистент кафедры внутренних болезней №2
Ростов-на-Дону
Ю. В. Шатохин
Шатохин Юрий Васильевич, д.м.н., проф., зав. кафедрой гематологии и трансфузиологии (с курсами клинической лабораторной диагностики, генетики и лабораторной генетики)
Ростов-на-Дону
И. В. Снежко
Россия
Снежко Ирина Викторовна, к.м.н., доцент кафедры гематологии и трансфузиологии (с курсами клинической лабораторной диагностики, генетики и лабораторной генетики)
Ростов-на-Дону
Е. В. Рябикина
Рябикина Елена Витальевна, к.м.н., доцент кафедры гематологии и трансфузиологии (с курсами клинической лабораторной диагностики, генетики и лабораторной генетики)
Ростов-на-Дону
Е. В. Дегтерева
Дегтерева Елена Валентиновна, к.м.н., доцент кафедры гематологии и трансфузиологии (с курсами клинической лабораторной диагностики, генетики и лабораторной генетики)
Ростов-на-Дону
С. В. Морданов
Морданов Сергей Викторович, к.м.н., заведующий лабораторным отделом медико-генетического центра, ассистент кафедры гематологии и трансфузиологии
Ростов-на-Дону
А. Н. Зельцер
Зельцер Анастасия Николаевна, к.м.н., старший научный
сотрудник ЦНИЛ
Ростов-на-Дону
Рецензия
Для цитирования:
Мацуга А.А., Абоян И.А., Нистратов Г.П., Черноусов В.В., Лемешко С.И., Кацияев В.Ю., Нистратова О.В., Бурнашева Е.В., Шатохин Ю.В., Снежко И.В., Рябикина Е.В., Дегтерева Е.В., Морданов С.В., Зельцер А.Н. Клиническое наблюдение болезни Эрдгейма-Честера: трудности диагностики, возможности терапии. Южно-Российский журнал терапевтической практики. 2024;5(1):90-98. https://doi.org/10.21886/2712-8156-2024-5-1-90-98
For citation:
Matsuga A.A., Aboyan I.A., Nistratov G.P., Chernousov V.V., Lemeshko S.I., Katsiaev V.Yu., Nistratova O.V., Burnasheva E.V., Shatokhin Yu.V., Snezhko I.V., Ryabikina E.V., Degtereva E.V., Mordanov S.V., Zeltser A.N. Clinical observation of Erdheim–Chester disease: diagnostic difficulties, treatment options. South Russian Journal of Therapeutic Practice. 2024;5(1):90-98. (In Russ.) https://doi.org/10.21886/2712-8156-2024-5-1-90-98
JATS XML


























