Перейти к:
Клиническое наблюдение пациентки с синдромом множественной эндокринной неоплазии типа 2а
https://doi.org/10.21886/2712-8156-2024-5-3-96-101
Аннотация
Статья посвящена клиническому наблюдению пациентки с синдромом множественной эндокринной неоплазии 2А, отличающимся сочетанием феохромоцитомы, медуллярного рака щитовидной железы и гиперплазии паращитовидных желез. Описаны особенности диагностики данного заболевания, предоперационной подготовки, а также принципы наблюдения в течение нескольких лет после оперативного лечения. Кроме того, приведены данные об особенностях диагностического поиска и тактики ведения членов семьи с данным синдромом.
Ключевые слова
Для цитирования:
Кузьменко Н.А., Хрипун И.А., Воробьев С.В., Гемидже Э.Э., Коликова К.М. Клиническое наблюдение пациентки с синдромом множественной эндокринной неоплазии типа 2а. Южно-Российский журнал терапевтической практики. 2024;5(3):96-101. https://doi.org/10.21886/2712-8156-2024-5-3-96-101
For citation:
Kuzmenko N.A., Khripun I.A., Vorobyev S.V., Gemidzhe E.E., Kolikova K.M. Clinical observation of a patient with multiple endocrine neoplasia syndrome type 2a. South Russian Journal of Therapeutic Practice. 2024;5(3):96-101. (In Russ.) https://doi.org/10.21886/2712-8156-2024-5-3-96-101
Введение
К синдрому множественных эндокринных неоплазий относят ряд заболеваний, для которых отличительной особенностью является сочетание новообразований из клеток нейроэктодермы в нескольких эндокринных железах. В данной группе заболеваний выделяют несколько подтипов. К синдрому множественной эндокринной неоплазии 2А (МЭН 2А), представленном в данном клиническом наблюдении, относится сочетание феохромоцитомы (ФХЦ), медуллярного рака щитовидной железы (МРЩЖ) и гиперплазии паращитовидных желез. Известны подтипы данного синдрома, включающие кожный амилоидоз и болезнь Гиршпрунга. Впервые в 1961 г. американский врач Сиппл описал данный синдром как сочетание МРЩЖ и ФХЦ.
Частота встречаемости МЭН 2 составляет 1 случай на 35 000 населения [1]. Синдром МЭН 2А составляет 90% заболеваемости по сравнению с синдромом МЭН 2В, который составляет всего 10% случаев. При этом МЭН 2В является более агрессивным вариантом течения синдрома [2]. Как уже говорилось ранее, в структуру синдрома входят ФХЦ, МРЩЖ и гиперплазия паращитовидных желез, и чаще всего подтверждение диагноза связано с обследованием по поводу МРЩЖ, что делает важным акцент на обследовании пациентов для исключения синдрома МЭН 2 с подтверждённым МРЩЖ. Лишь в 3% случаев дебют заболевания связан с выявлением ФХЦ [3]. На сегодняшний момент методом первичной диагностики данного синдрома является молекулярно-генетическое тестирование, включающее одноуровневый или многоуровневый анализ мутаций RET в экзоне 10 (кодоны 609, 611, 618 и 620), экзоне11 (кодоны 630 и 634) и экзоне 8, 13, 14, 15 и 16 [4]. Ведь семейный характер заболевания обусловлен изменениями по типу рекомбинации в хромосоме 10, в области локуса 10q11.2 [5]. А мутация, обусловливающая развитие синдрома МЭН 2А, в большей части случаев связана с заменой цистеина на другую аминокислоту в одном из следующих кодонов 609, 611, 618, 620, 630 и 634 протоонкогена RET [6]. Мутации кодона 634 RET связаны с высокой пенетрантностью ФХЦ, которая увеличивается с возрастом и составляет 25% к 30 годам, 52% — к 50 годам и 88% — к возрасту 77 лет [7][8].
Мутация в 634 кодоне гена RET обусловливает развитие МРЩЖ в молодом возрасте (минимальный возраст — 3 года, регионарных метастазов — 15 лет, отдалённых метастазов — 30 лет). На сегодняшний день выделено три степени риска агрессивности МРЩЖ, каждая из которых определяет тактику ведения пациентов и возраст превентивной тиреоидэктомии. Детей с мутацией RET в 634 кодоне относят ко II степени риска агрессивности МРЩЖ. В одном из исследований по анализу клинических проявлений синдрома МЭН 2А пациентам с герминальной мутацией в 634 кодоне проведена профилактическая тиреоидэктомия до клинических проявлений МРЩЖ (в 3, 9 и 11 лет). Во всех случаях превентивной тиреоидэктомии выявлены множественные микрофокусы МРЩЖ [9][10].
В другом исследовании из 260 случаев анализ кодонов привел к прогностическим различиям: 81% пациентов с мутацией c634 имели медуллярную карциному или метастатическую медуллярную карциному в отличие от пациентов с мутациями в других кодонах: c804 (44%), c618 (34%) и c620 (7%) соответственно [11].
При этом ФХЦ манифестирует приблизительно у 50% пациентов с МЭН 2A. У 50% пациентов с односторонней ФХЦ в течение 10 лет выявляется ФХЦ контрлатерального надпочечника. Кроме того, важно отметить, что в 26–29% случаев опухоли могут иметь отрицательные биохимические результаты, иногда результаты не достигают диагностических значений и находятся в «серой зоне» поэтому обследование пациентов с генетически детерминированной ФХЦ проводится с учётом генетического анамнеза, и в соответствии с ним определяются показания к оперативному вмешательству [2].
При одновременном выявлении МРЩЖ и ФХЦ оперативное лечение начинают с надпочечников. При одностороннем поражении выполняется адреналэктомия, а при локализации процесса в обоих надпочечниках выполняется тотальная адреналэктомия [12].
Гиперплазия паращитовидных желез в структуре данного синдрома подтверждается примерно в 30% случаев. При установленном диагнозе рассматривается вопрос об оперативном лечении. Превентивное удаление паращитовидных желез не выполняется, так как гиперпаратиреоз при данном синдроме МЭН 2А не отличается агрессивным течением [13].
Описание клинического случая
С 2009 г. пациентку М., 1982 г.р., стали беспокоить ощущения дрожи в теле, особенно в руках. В 2015 г. во время второй беременности стала отмечать эпизоды повышения артериального давления до 190/110 мм рт. ст. В последующие годы до подтверждения диагноза единственным симптомом являлась артериальная гипертензия, плохо поддававшаяся коррекции.
В апреле 2017 г. на УЗИ щитовидной железы были выявлены узловые образования в обеих долях щитовидной железы до 2 см (TI-RADS-5), лимфаденопатия. Уровень кальцитонина при этом составлял 845 пг/мл. В связи с подозрением на синдром МЭН пациентка была направлена на спиральную компьютерную томографию органов забрюшинного пространства. По данным исследования от 29.05.2017 г., выявлено образование правого надпочечника 19,3×17,3×21 мм плотностью до 43 Ед HU (рис. 1). Образование активно и неравномерно накапливало контраст, при этом коэффициент вымывания составлял 74%. Данные гормональных исследований: 16.06.2017г., норметанефрин (суточная моча) — 494,7 мкг/24 часа (до 600,0); метанефрин (суточная моча) — 409,7 мкг/24 часа (норма до 350,0 мкг/24 часа; данное повышение соответствует «серой зоне»); паратгормон — 127,0 пг/мл (12,0–88,0 пг/мл). Молекулярно-генетическое исследование от 06.07.2017 г. подтверждает наличие 2 гетерозиготных мутаций — с. 1883СT p.P628L и с. 1901G p.C634S. В соответствии с результатами молекулярно-генетического тестирования был установлен диагноз «Синдром множественной эндокринной неоплазии 2А типа: медуллярный рак щитовидной железы, феохромоцитома правого надпочечника, симптоматическая артериальная гипертензия». По данным ЭХО-КГ от 26.09.2017 г., было выявлено поражение органов-мишеней: средняя толщина комплекса интима-медиа на уровне бифуркации левой общей сонной артерии превышала 75-й перцентиль популяционных значений для данной возрастно-половой группы. Кардиологом была проведена предоперационная терапия доксазозином (Кардура) 4 мг в сутки и бисопрололом 5 мг в сутки. На фоне терапии достигнуты критерии оптимальности предоперационной подготовки, риск неблагоприятных периоперационных кардиоваскулярных событий был оценен как низкий (1 балл по шкале RCRI, ожидаемая вероятность — 0,9%). 27.09.2017 г. была выполнена эндоскопическая правосторонняя адреналэктомия. По результатам морфологического исследования патогистологическая картина соответствовала ФХЦ надпочечника альвеолярного типа гистологического строения. 11.10.2017 г. были выполнены тиреоидэктомия, центральная лимфаденэктомия. Кальцитонин до оперативного лечения — 845 пг/мл, после оперативного вмешательства от 13.10.2017 г. — 12,6 пг/мл. По результатам морфологического исследования, патогистологическая картина соответствовала МРЩЖ, pmT1bNOMx. Послеоперационный период без особенностей. Пациентке была назначена медикаментозная терапия: левотироксин натрия — по 125 мкг утром за 30 минут до еды, альфакальцидол — по 1 мкг утром и вечером.
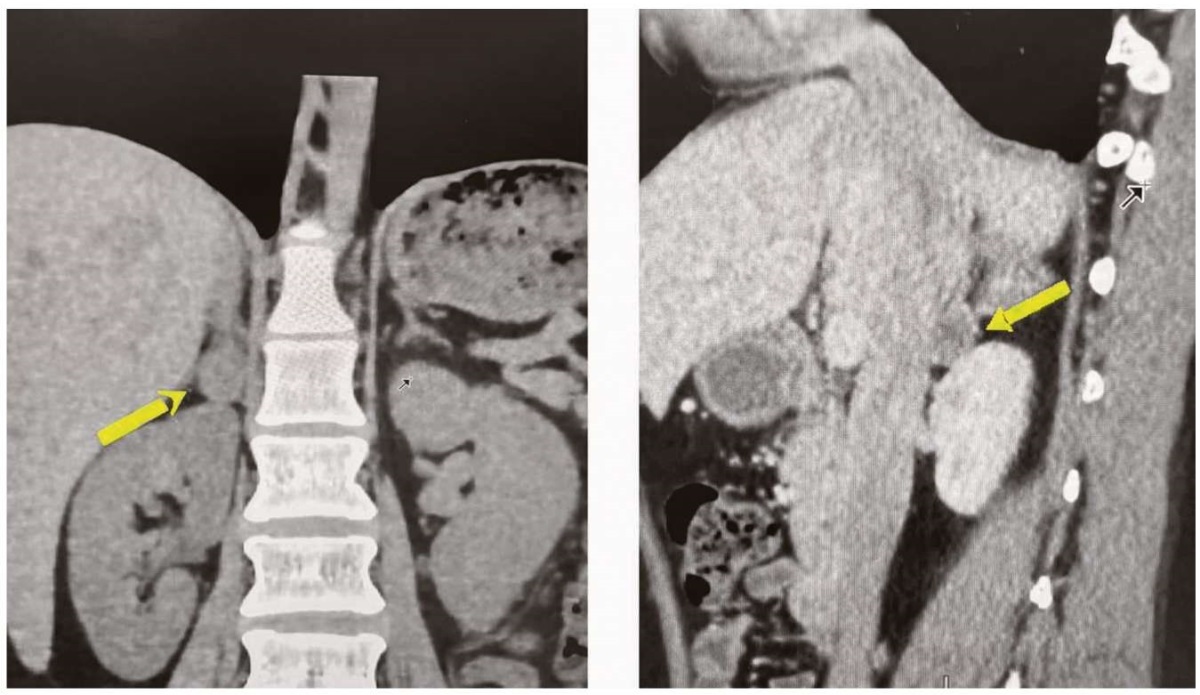
Рисунок 1. КТ-визуализация образования надпочечника до оперативного лечения
Figure 1. CT-visualization of the adrenal mass before surgery
В 2019 г. у матери пациентки, по результатам молекулярно-генетического исследования, также был подтверждён синдром МЭН 2 А. Были даны рекомендации по проведению молекулярно-генетического исследования у всех членов семьи, однако дети пациентки до сих пор не прошли обследование (по решению семьи). Необходимость данных обследований для детей особенно критична и была неоднократно обсуждена.
Пациентка наблюдается в поликлинике по месту жительства, ежегодно проходит диспансерное обследование, включающее методы визуализации. На СКТ органов брюшной полости и забрюшинного пространства с внутривенным контрастированием в январе 2024 г.: состояние после правосторонней адреналэктомии, левый надпочечник типичной конфигурации, паренхима однородной структуры, патологического накопления контрастного вещества не выявлено (рис. 2). Помимо этого, пациентке ежегодно проводят исследование уровня кальцитонина, паратгормона, показателей фосфорно-кальциевого обмена, показателей компенсации тиреоидного обмена, определение уровня метилированных катехоламинов в суточной моче (табл. 1).
Таблица/Table 1
Данные биохимического исследования крови и определения уровня гормонов
Table 1. Data from biochemical blood tests and hormone tests.
Лабораторные показатели | Результат | Референсные значения | Единицы измерения |
Глюкоза | 3,84 | 4,1-6,1 | ммоль/л |
Общий белок | 72,3 | 64-83 | г/л |
Билирубин общий | 10,2 | 0-21 | мкмоль/л |
АЛТ | 8,7 | 0-34 | Ед/л |
АСТ | 12,4 | 0-31 | Ед/л |
Мочевина | 4,7 | 2,8-8,2 | ммоль/л |
Креатинин | 64 | 44-97 | мкмоль/л |
Мочевая кислота | 315 | 142-340 | мкмоль/л |
Щелочная фосфатаза | 47 | 30-150 | Ел/л |
ГГТП | 28 | 0-50 | Ед/л |
А-амилаза | 54 | 25-125 | Ед/л |
Холестерин общий | 4,5 | 0-5,3 | ммоль/л |
Кальций общий | 2,31 | 2,1-2,55 | ммоль/л |
Альбумин | 37 | 35-50 | г/л |
Кальций ионизированный | 1,09 | 1,03-1,23 | ммоль/л |
Фосфор неорганический | 1,2 | 0,81-1,45 | ммоль/л |
Железо | 17,41 | 9-30,4 | мкмоль/л |
Латентная(ненасыщенная) железосвязывающая способность | 46,8 | 21,3-65 | мкмоль/л |
Общая железосвязывающая способность | 64,21 | --- | мкмоль/л |
Ферритин | 7,74 | 15-227 | нг/мл |
СРБ | 1,54 | 0-5 | мг/л |
Гликозилированный гемоглобин | 5,5 | 4-6,2 | % |
ТТГ | 0,984 | 0,27-4,2 | мкМЕ/мл |
Кальцитонин | ˂2,0 | ˂5,0 | пг/мл |
Кортизол | 9,5 | Утро 3,7-19,4 Вечер 2,9-17,3 | мкг/дл |
25-ОН витамин D | 22,9 | Выраженный дефицит 0-10 Дефицит 10-20 Недостаточность 20-30 Норма-30 Возможное проявление токсичности более 150 | нг/мл |
Определение интактного человеческого паратиреоидного гормона | 44,29 | 15-65 | пг/мл |
Норметанефрины общие в моче за сутки | 162 | Менее 600,00 | мкг/сут |
Метанефрины общие в моче за сутки | 110 | Менее 350,00 | мкг/сут |
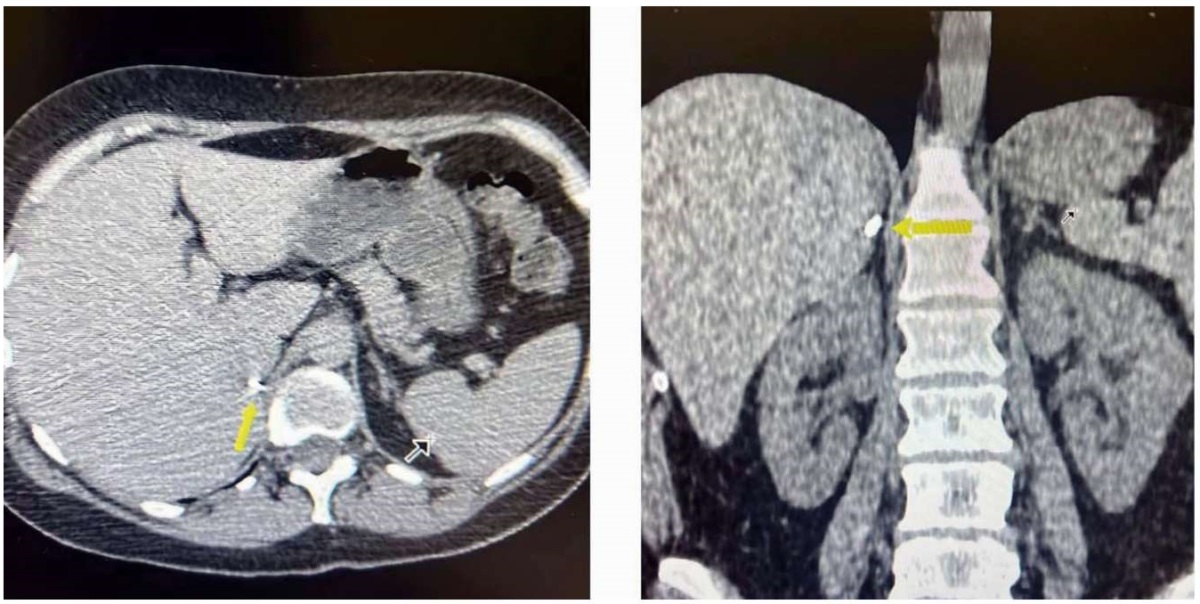
Рисунок 2. КТ-визуализация после оперативного лечения
Figure 2. CT-visualization after surgical treatment
Одним из важных аспектов подтверждения диагноза для данной пациентки являлось своевременное обследование для исключения эндокринной гипертензии, особенно с учётом молодого возраста. В данном случае подъёмы артериального давления были единственным симптомом, беспокоившим пациентку. Важно отметить, что биохимические маркеры ФХЦ не достигли диагностических значений и находились в «серой зоне», в связи с чем показания для оперативного лечения были определены с учётом генетического анамнеза. Выявленная мутация является достаточно благоприятной в отношении клинического прогноза, но семейный характер заболевания требует ответственного отношения для всех членов семьи, которые могли унаследовать данную мутацию. Дети с подтверждённой мутацией RET в 634 кодоне относятся по степени риска агрессивности МРЩЖ к группе II. Превентивная тиреоидэктомия в данной группе детей показана до наступления 5-летнего возраста. Объём оперативного вмешательства предусматривает тотальную тиреоидэктомию. Вопрос о выполнении в данном случае превентивной центральной лимфаденэктомии на сегодняшний момент является дискутабельным [14].
Через несколько лет после выполненных оперативных вмешательств пациентка компенсирована по показателям тиреоидного и фосфорно-кальциевого обмена, дозы препаратов постоянны. За все эти годы не требовалось приёма глюкокортикостероидов и не возникало клинической симптоматики надпочечниковой недостаточности, хотя пациентка информирована о такой возможности и аспектах коррекции данного состояния, в том числе и адреналового криза. Регулярный контроль биохимических и инструментальных методов обследования является важным условием в наблюдении данной пациентки, так как у 50% пациентов с односторонней ФХЦ в течение 10 лет выявляется ФХЦ контралатерального надпочечника, а первичный гиперпаратиреоз выявляется примерно в 20–30 % случаев [2][12][15].
Заключение
Семейные формы МЭН 2 типа — это группа генетически детерминированных эндокринных заболеваний, характерным клиническим проявлением которых является МРЩЖ. Особое внимание при выявлении МРЩЖ необходимо акцентировать на синдромальном подходе и важности обследования пациентов для исключения ФХЦ и гиперфункции паращитовидных желез. При выявлении МРЩЖ целесообразно проведение молекулярно-генетического тестирования RET-мутацию. При подтверждении диагноза очень важно проинформировать пациента о необходимости медико-генетического консультирования и обследования родственников для выявления мутации. Особенное внимание отводится диагностике данного синдрома у детей, так как есть возможность вовремя определить степень риска агрессивности МРЩЖ и провести превентивную тотальную тиреоидэктомию. Биохимические маркеры ФХЦ могут не достигать диагностических значений, что не исключает диагноз, а принятие решения об оперативном вмешательстве в таком случае основывается на генетическом анамнезе. Также не стоит забывать о целесообразности своевременного обследования пациентов для исключения эндокринной гипертензии, особенно в молодом возрасте.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Znaczko A, Donnelly DE, Morrison PJ. Epidemiology, clinical features, and genetics of multiple endocrine neoplasia type 2B in a complete population. Oncologist. 2014;19(12):1284- 1286. DOI: 10.1634/theoncologist.2014-0277
2. Юкина М.Ю., Гончаров Н.П., Бельцевич Д.Г., Трошина Е.А. Множественная эндокринная неоплазия 2-го типа. Проблемы Эндокринологии. 2011;57(6):21-26. DOI: 10.14341/probl201157621-26
3. Brandi ML, Gagel RF, Angeli A, Bilezikian JP, Beck-Peccoz P, Bordi C, et al. Guidelines for diagnosis and therapy of MEN type 1 and type 2. J Clin Endocrinol Metab. 2001;86(12):5658- 5671. DOI: 10.1210/jcem.86.12.8070
4. Wells SA Jr, Asa SL, Dralle H, Elisei R, Evans DB, Gagel RF, et al. Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. Thyroid. 2015;25(6):567-610. DOI: 10.1089/thy.2014.0335
5. Li AY, McCusker MG, Russo A, Scilla KA, Gittens A, Arensmeyer K, et al. RET fusions in solid tumors. Cancer Treat Rev. 2019;81:101911. DOI: 10.1016/j.ctrv.2019.101911
6. Donis-Keller H, Dou S, Chi D, Carlson KM, Toshima K, Lairmore TC, et al. Mutations in the RET proto-oncogene are associated with MEN 2A and FMTC. Hum Mol Genet. 1993;2(7):851- 856. DOI: 10.1093/hmg/2.7.851
7. Imai T, Uchino S, Okamoto T, Suzuki S, Kosugi S, Kikumori T, et al. High penetrance of pheochromocytoma in multiple endocrine neoplasia 2 caused by germ line RET codon 634 mutation in Japanese patients. Eur J Endocrinol. 2013;168(5):683-687. DOI: 10.1530/EJE-12-1106
8. Mathiesen JS, Effraimidis G, Rossing M, Rasmussen ÅK, Hoejberg L, Bastholt L, et al. Multiple endocrine neoplasia type 2: A review. Semin Cancer Biol. 2022;79:163-179. DOI: 10.1016/j.semcancer.2021.03.035
9. Северская Н.В., Ильин А.А., Исаев П.А., Шинкаркина А.П., Чеботарева И.В., Дербугов Д.Н., и др. Синдром МЭН 2а: фокус на мутацию в 634 кодоне. Инновационные технологии в эндокринологии: сборник тезисов III Всероссийского эндокринологического конгресса с международным участием. Москва; 2017. eLIBRARY ID: 32532223 EDN: YQSNIC
10. Диагностика и лечение медуллярного рака щитовидной железы. Национальные клинические рекомендации. Опухоли головы и шеи. 2013;(4):36-45. eLIBRARY ID: 21592535 EDN: SENGFD
11. Szinnai G, Meier C, Komminoth P, Zumsteg UW. Review of multiple endocrine neoplasia type 2A in children: therapeutic results of early thyroidectomy and prognostic value of codon analysis. Pediatrics. 2003;111(2):E132-9. DOI: 10.1542/peds.111.2.e132
12. Эндокринология. Национальное руководство. Под ред.: Дедов И.И., Мельниченко Г.А. ГЕОТАР-Медиа; 2013.
13. American Thyroid Association Guidelines Task Force; Kloos RT, Eng C, Evans DB, Francis GL, Gagel RF, et al. Medullary thyroid cancer: management guidelines of the American Thyroid Association. Thyroid. 2009;19(6):565-612. Erratum in: Thyroid. 2009;19(11):1295. DOI: 10.1089/thy.2008.0403
14. Демидова Т.Ю., Кишкович Ю.С. Синдром множественных эндокринных неоплазий 2-го типа. РМЖ. 2018;11(II):116- 121.
15. Machens A, Dralle H. Multiple endocrine neoplasia type 2: towards a risk-based approach integrating molecular and biomarker results. Curr Opin Oncol. 2024;36(1):1-12. DOI: 10.1097/CCO.0000000000001009
Об авторах
Н. А. КузьменкоРоссия
Кузьменко Наталия Александровна, к.м.н., доцент кафедры эндокринологии (с курсом детской эндокринологии)
Ростов-на-Дону
И. А. Хрипун
Россия
Хрипун Ирина Алексеевна, д.м.н., профессор кафедры эндокринологии (с курсом детской эндокринологии)
Ростов-на-Дону
С. В. Воробьев
Россия
Воробьев Сергей Владиславович, д.м.н., профессор кафедры эндокринологии (с курсом детской эндокринологии)
Ростов-на-Дону
Э. Э. Гемидже
Россия
Гемидже Эвелина Эмильевна, врач-эндокринолог
Ростов-на-Дону
К. М. Коликова
Россия
Коликова Карина Мнацагановна, врач-эндокринолог
Ростов-на-Дону
Рецензия
Для цитирования:
Кузьменко Н.А., Хрипун И.А., Воробьев С.В., Гемидже Э.Э., Коликова К.М. Клиническое наблюдение пациентки с синдромом множественной эндокринной неоплазии типа 2а. Южно-Российский журнал терапевтической практики. 2024;5(3):96-101. https://doi.org/10.21886/2712-8156-2024-5-3-96-101
For citation:
Kuzmenko N.A., Khripun I.A., Vorobyev S.V., Gemidzhe E.E., Kolikova K.M. Clinical observation of a patient with multiple endocrine neoplasia syndrome type 2a. South Russian Journal of Therapeutic Practice. 2024;5(3):96-101. (In Russ.) https://doi.org/10.21886/2712-8156-2024-5-3-96-101
JATS XML


























