Перейти к:
Галектин-3 как независимый предиктор послеоперационной фибрилляции предсердий
https://doi.org/10.21886/2712-8156-2024-5-4-23-31
Аннотация
Цель: оценить значение предоперационных уровней галектина-3 в плазме для прогнозирования послеоперационная фибрилляция предсердий (ПОФП) в когорте пациентов, перенёсших плановую операцию на сердце.
Материалы и методы: это проспективное обсервационное одноцентровое когортное исследование было проведено в Научно-исследовательском институте – Краевой клинической больнице №1 им. проф. С.В. Очаповского (Краснодар). В период с 1 сентября 2023 г. по 1 февраля 2024 г. все пациенты, поступившие для плановой операции аортокоронарного шунтирования и/или операции на клапане (замена или реконструкция клапана), включались в это исследование. В раннем послеоперационном периоде ПОФП развилась у 158 больных, которые составили основную группу А, а из 436 пациентов с синусовым ритмом при помощи генератора случайных чисел была сгенерирована контрольная группа Б, сопоставимая с основной группой по числу наблюдаемых пациентов и составившая 160 больных.
Результаты: дебют от начала операции ПОФП 66,2±41,7 часов (в среднем на 3-и сутки, минимум 1 час, максимум через 166,5 часов, то есть на 7-е сутки). При сравнении лабораторных данных у пациентов до операции (забор крови производился за 12–24 часа до кардиохирургического вмешательства) статистически значимым фактором, связанным с развитием ПОФП, являлся уровень галектина-3 крови (2,1±1,99 нг/мл у пациентов из группы А, 1,87±1,64 нг/мл у пациентов из группы Б, р 0,01). При этом показатель галектина-3 крови у пациентов с ПОФП значимо вырастал в раннем послеоперационном периоде (до 2,75±2,1 нг/мл, р <0,001), что было подтверждено и ROC-кривой (площадь под AUC-кривой составила 0,522 (AUC: 0,522, 95% ДИ: 0,457–0,588; P =0,033)).
Заключение: дооперационные уровни галектина-3 в плазме имеют независимое значение для прогнозирования ПОФП и могут служить полезным прогностическим параметром в мультимодальном подходе к оценке риска в эпоху персонализированного лечения.
Ключевые слова
Для цитирования:
Татаринцева З.Г., Синельникова М.Г., Братова А.В., Барбухатти К.О. Галектин-3 как независимый предиктор послеоперационной фибрилляции предсердий. Южно-Российский журнал терапевтической практики. 2024;5(4):23-31. https://doi.org/10.21886/2712-8156-2024-5-4-23-31
For citation:
Tatarintseva Z.G., Sinelnikova M.G., Bratova A.V., Barbuhatti K.O. Galectin-3 as an independent predictor of postoperative atrial fibrillation. South Russian Journal of Therapeutic Practice. 2024;5(4):23-31. (In Russ.) https://doi.org/10.21886/2712-8156-2024-5-4-23-31
Введение
Аортокоронарное шунтирование (АКШ) — хорошо зарекомендовавшая себя хирургическая процедура, выполняемая во всём мире [1]. Тем не менее осложнения после АКШ широко распространены, и их трудно предсказать [2]. У значительной группы пациентов, перенёсших операцию на сердце, развивается послеоперационная фибрилляция предсердий (ПОФП) [3]: у 40% пациентов — после выполненного изолированного АКШ, у 49% — после АКШ совместно с заменой аортального клапана и у 64% — после АКШ с протезированием митрального клапана [4]. У 70% и 94% пациентов ПОФП развивается до конца четвертого и шестого дней после операции соответственно, и данная ситуация влечёт за собой увеличение количества послеоперационных осложнений, финансовое бремя, а также повышение уровня смертности [5].
Идентификация биомаркеров, которые обеспечивают прогностическую способность, связанную с клиническим исходом ПОФП, сильно повлияла на область медицины. Предыдущие исследования продемонстрировали, что биомаркеры могут быть использованы в качестве предикторов ПОФП у кардиологических пациентов. Их применение широко описано в различных литературных источниках [6]. В этом отчёте мы сопоставили предоперационные и периоперационные данные о биомаркерах, которые, как было показано, предсказывают частоту ПОФП у пациентов, перенёсших операцию АКШ с искусственным кровообращением или без искусственного кровообращения, без предшествующей истории фибрилляции предсердий (ФП).
Альдостерон способствует воспалению и фиброзу миокарда, модуляции ионных токов и вызывает окислительный стресс и, следовательно, может создавать субстрат для развития ПОФП [7]. Сходным образом галектин-3, связывающий галактозид лектин, привлёк большое внимание как новый биомаркер кардиального фиброза и ремоделирования миокарда при ФП [8]. М. Чекель и соавт. представили доказательства того, что ренин-ангиотензин-альдостероновая система и галектин-3 могут быть очень полезными прогностическими биомаркерами ПОФП и потенциально интересными терапевтическими мишенями для предотвращения возникновения ПОФП [9]. Дж Александр и соавт. провели исследование с участием 137 пациентов (109 с АКШ и 28 с АКШ + протезированием аортального клапана), у которых ПОФП развилась в 24,8% случаев [8]. Дооперационные уровни альдостерона были выше в группе ПОФП по сравнению с группой без ПОФП (183 пмоль/л (межквартильный интервал — 138–300) против 143 пмоль/л (межквартильный интервал — 96,5–216,5) с р <0,01) соответственно. При пороговом значении >155 пмоль/л альдостерон показал специфичность 67,0% и чувствительность 79,4% для прогнозирования ПОФП.
Механизмы ПОФП ещё далеки от понимания, и до сих пор трудно выявить пациентов, входящих в группу риска. Предшествующие факторы пациента и интраоперационное повреждение ткани предсердия (вызванное гипоксией, воспалением, окислительным стрессом, хирургическим вмешательством и т.д.) повышают риск ПОФП [10]. Хотя известно, что ремоделирование предсердий и фиброз вызывают нарушения проводимости и способствуют развитию ФП, роль ранее существовавшего фиброза в генезе ПОФП остаётся неопределённой и роль нового биомаркера галектина-3 ещё не оценена [11].
Известно, что галектин-3, плейотропный лектин, связывающий β-галактозид, аномально увеличивается при фиброзных заболеваниях в различных системах органов, включая сердце, печень, почки и лёгкие, и связан с неблагоприятным прогнозом [12]. Галектин-3 активируется в моделях фиброза in vitro и сам по себе способствует активации дополнительных профибротических факторов, пролиферации фибробластов и выработке коллагена [13][12].
В дополнение к его ключевой роли в фиброзе желудочков и сердечной недостаточности, где он сильно предсказывает смертность и прогрессирование заболевания, галектин-3 считается восходящим медиатором ремоделирования предсердий и фиброгенеза предсердий [14]. Кроме того, галектин-3 независимо коррелирует с индексом объёма левого предсердия (ЛП) и степенью фиброза ЛП и предсказывает заболеваемость ФП [15].
Цель исследования — оценить значение предоперационных уровней галектина-3 в плазме для прогнозирования ПОФП в когорте пациентов, перенёсших плановую операцию на сердце.
Материалы и методы
Это проспективное обсервационное одноцентровое когортное исследование было проведено в Научно-исследовательском институте- Краевой клинической больнице №1 им. проф. С.В. Очаповского г. Краснодара. В период с 1 сентября 2023 г. по 1 февраль 2024 г. все пациенты, поступившие для плановой операции аортокоронарного шунтирования (АКШ) и/или операции на клапане (замена или реконструкция клапана) включались в это исследование. Критериями исключения были возраст менее 18 лет, ФП при поступлении в стационар или в анамнезе, неплановая кардиохирургия, плановая чрескожная или трансапикальная имплантация клапана и отказ дать информированное согласие.
За анализируемый период времени был прооперирован 691 пациент, из которых критериям включения/невключения соответствовали 532 человека. В раннем послеоперационном периоде ПОФП развилась у 158 больных (29,7%), которые составили основную группу А, а из 436 пациентов с синусовым ритмом при помощи генератора случайных чисел была сгенерирована контрольная группа Б, сопоставимая с основной группой по числу наблюдаемых пациентов и составившая 160 больных. Дизайн исследования представлен на рисунке 1.
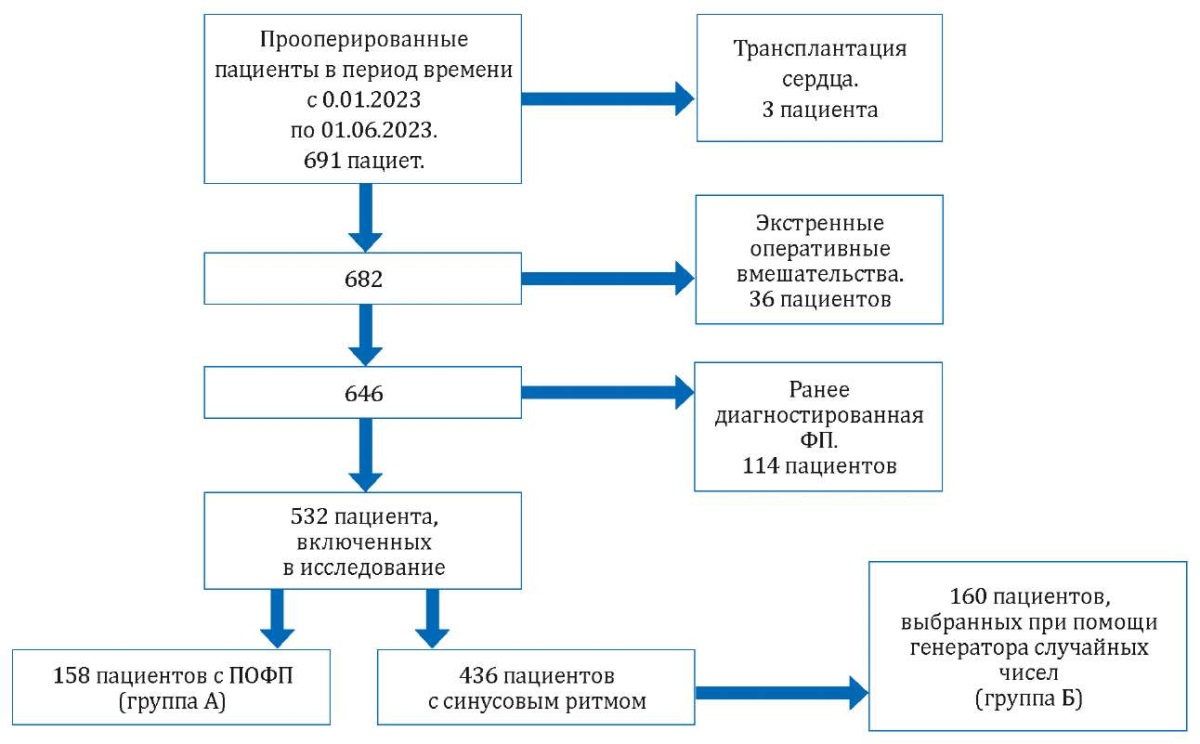
Рисунок 1. Дизайн исследования
Figure 1. Study design
Рутинная предоперационная оценка включала электрокардиограмму (ЭКГ), эхокардиограмму, клинический осмотр, оценку анамнеза и определение стандартных лабораторных показателей. Участие в исследовании не влияло на хирургическое и послеоперационное лечение.
После операции все пациенты первоначально лечились в отделении реанимации, а затем были переведены в отделение интенсивной терапии или обычные кардиологические/кардиоторакальные отделения стационара. Во время пребывания в стационаре у пациентов непрерывно мониторировали ЭКГ с помощью телеметрии ЭКГ для выявления аритмии. Если у пациентов развивалась ФП, выполнялась ЭКГ в 12 отведениях. Сохранённые данные ЭКГ были проанализированы на предмет наличия ФП у всех пациентов обученным медицинским персоналом.
Конечные точки исследования
Первичная конечная точка исследования ПОФП была определена как ФП, возникающая во время послеоперационного пребывания в стационаре. ФП была определена в соответствии с рекомендациями Европейского общества кардиологов [16] как предсердная аритмия с абсолютно неравномерными интервалами RR без различимых отчетливых зубцов P продолжительностью не менее 30 секунд.
Забор крови и лабораторный анализ
Образцы периферической венозной крови собирали за день до операции на сердце. Образцы сразу центрифугировали при 3000 об./мин. (4 °С) в течение 20 минут, а плазму с этилендиаминтетрауксусной кислотой хранили при -80 °С до анализа. Измерения галектина-3 проводились в 1 момент времени после хранения в течение 1,6±1,4 года. Уровни этилендиаминтетрауксусной кислоты в плазме галектина-3 анализировали с помощью твердофазного иммуноферментного анализа (Quantikine, R&D Systems Inc., Миннеаполис, Миннесота). Внутри- и межтестовые коэффициенты вариации для галектина-3 были ≤3,8% и ≤6,3% соответственно. Минимальная обнаруживаемая концентрация составила 0,016 нг/мл. Измерение и анализ галектина-3 проводились лаборантом, который не участвовал в других исследованиях и не имел доступа к клиническим данным. Мы не исключали никаких значений галектина-3 из анализа.
Статистические методы
Категориальные данные представлены в виде количества и процента. Непрерывные данные представлены как среднее значение ± стандартное отклонение. Для оценки корреляции между непрерывными переменными использовали коэффициент корреляции Спирмена ρ. Непрерывные и категориальные переменные сравнивались между группами ПОФП и без ПОФП с использованием U-критерия Манна-Уитни и χ²-тест соответственно. Значение p≤0,05 (двустороннее) считалось статистически значимым. Факторы риска развития ФП после операции на сердце анализировались с помощью регрессионной модели Кокса. Кривая ROC использовалась для оценки прогностической ценности неоптерина крови для эпизода ФП после кардиохирургического лечения.
Результаты
Средний возраст в исследуемой группе составил 65,0±8,2 года. Дебют от начала операции до пароксизма ФП составил 66,2±41,7 часов (в среднем на 3-и сутки, минимум 1 час, максимум через 166,5 часов, то есть на 7-е сутки). Средняя продолжительность ПОФП составила 7 (2,5–18) часов. У 23 пациентов (14,56%) ПОФП длилась дольше, чем 48 часов. 90% пациентов с ПОФП получали амиодарон внутривенно, у 15 пациентов (9,49%) ПОФП разрешилась спонтанно без дополнительного антиаритмического лечения, а 6 больным (3,79%) была выполнена успешная электрическая кардиоверсия. У всех пациентов на момент выписки из больницы был синусовый ритм. Характеристики пациентов всей популяции исследования перечислены в таблице 1.
Таблица / Table 1
Демографические и анамнестические характеристики пациентов из сравниваемых групп
Demographic and anamnestic characteristics of patients from the compared groups
Показатели | Группа А, n=158 | Группа Б, n=160 | р |
Мужской пол, n (%) | 124 (78,5) | 106 (66,3) | 0,02 |
Возраст, лет (M±SD) | 65,0±8,2 | 61,7±8,6 | <0,001 |
Индекс массы тела, кг/м² (M±SD) | 26,1±6,3 | 25,8±8,1 | 0,011 |
Сопутствующие заболевания | |||
Инфаркт миокарда в анамнезе, n (%) | 19 (12) | 16 (10) | 0,57 |
Артериальная гипертензия, n (%) | 113 (71,5) | 102 (64,6) | 0,18 |
Хроническая сердечная недостаточность II–IV кл. по NYHA, n (%) | 145 (91,8) | 148 (92,5) | 0,82 |
Инсульт, n (%) | 19 (12) | 17 (10,6) | 0,69 |
Периферический атеросклероз, n (%) | 77 (48,7) | 67 (41,9) | 0,22 |
Курение в настоящее время, n (%) | 61 (38,6) | 54 (33,8) | 0,37 |
Сахарный диабет, n (%) | 63 (39,9) | 59 (36,9) | 0,58 |
ХБП с СКФ <60 мл/мин., n (%) | 39 (24,7) | 32 (20) | 0,31 |
Группа исследования включала 158 пациентов, из которых 68 (43%) получили АКШ, 77 (48,7%) прооперированы в объёме протезирования внутрисердечного клапана (аортального или митрального, 13 пациентам (8,2%) выполнена сочетанная операция по протезированию внутрисердечного клапана плюс АКШ. Среднее время пережатия аорты и время искусственного кровообращения составили 62,6±23,5 и 90,4±28,4 минуты соответственно.
При сравнении лабораторных данных у пациентов до операции (забор крови производился за 12–24 часа до кардиохирургического вмешательства) статистически значимым фактором, связанным с развитием ПОФП, явился только уровень галектин-3 (табл. 2).
Таблица / Table 2
Лабораторные показатели пациентов из сравниваемых групп до оперативного лечения
Laboratory parameters of patients from the compared groups before surgery
Показатели | Группа А, n=158 | Группа Б, n=160 | р |
Галектин-3, нг/мл, М±SD | 2,1±1,99 | 1,87±1,64 | 0,01 |
Эритроциты, 10Е12/л, М±SD | 3,7±1,1 | 3,6±0,5 | 0,51 |
Гемоглобин, г/л, М±SD | 115,6±18,3 | 111,1±14,5 | 0,13 |
Гематокрит, %, М±SD | 33,1±4,8 | 32,0±4,3 | 0,18 |
Лейкоциты, 10Е9/л, М±SD | 9,4±6,3 | 8,2±5,4 | 0,26 |
Тромбоциты, 10Е9/л, М±SD | 186,5±43,4 | 177,9±57,1 | 0,35 |
Нейтрофилы, 10Е9/л, М±SD | 8,6±5,8 | 7,5±4,5 | 0,24 |
Лимфоциты, 10Е9/л, М±SD | 1,7±0,8 | 1,6±0,6 | 0,43 |
Моноциты, 10Е9/л, М±SD | 1,5±0,6 | 1,5±0,5 | 1,0 |
Креатинин, мкмоль/л, М±SD | 97,3±32,0 | 99,6±43,1 | 0,74 |
Мочевина, ммоль/л, М±SD | 8,9±2,9 | 7,6±5,2 | 0,09 |
Аспартатаминотрансфераза, Ед/л, М±SD | 34,7±12,1 | 30,9±9,5 | 0,06 |
Аланинаминотрансфераза, Ед/л, М±SD | 38,4±19,5 | 34,5±9,9 | 0,16 |
Билирубин, мкмоль/л, М±SD | 18,1±3,2 | 21,9±15,2 | 0,06 |
С-реактивный белок, г/л, М±SD | 3,8±0,5 | 4,0±0,7 | 0,07 |
КФК, Ед/л, М±SD | 50,5±7,2 | 48,2±6,9 | 0,07 |
КФК-МВ, Ед/л, М±SD | 13,3±4,0 | 12,8±3,2 | 0,44 |
Фибриноген, г/л, М±SD | 5,0±1,6 | 4,6±1,4 | 0,14 |
При сравнении лабораторных данных у пациентов в раннем послеоперационном периоде (первый час после кардиохирургического вмешательства) выяснилось, что статистически значимыми факторами, связанными с ПОФП, явились показатели красной крови (сниженный уровень эритроцитов, гемоглобина, гематокрита), маркеры печёночной дисфункции (повышенные значения общего билирубина, аспартатаминотранферазы и аланинаминотрансферазы) и маркеры воспаления (С-реактивный белок) (табл. 3).
Таблица / Table 3
Лабораторные показатели крови в раннем послеоперационном периоде
Laboratory blood parameters in the early postoperative period
Показатели | Группа А, n=158 | Группа Б, n=160 | р |
Показатели общего анализа крови | |||
Лейкоциты, 10Е9/л, М±SD | 19,4±16,9 | 16,1±6,3 | 0,02* |
Эритроциты, 10Е12/л, М±SD | 3,2±3,1 | 3,7±0,6 | 0,046* |
Гемоглобин, г/л, М±SD | 98,6±16,4 | 113,7±19,7 | <0,001* |
Гематокрит, %, М±SD | 28,9±4,5 | 32,8±5,9 | <0,001* |
Тромбоциты, 10Е9/л, М±SD | 120,5±53,8 | 121,3±33,0 | 0,87 |
Нейтрофилы, 10Е9/л, М±SD | 15,6±5,9 | 14,2±6,1 | 0,38 |
Моноциты, 10Е9/л, М±SD | 1,4±0,6 | 1,4±0,5 | 1,0 |
Лимфоциты, 10Е9/л, М±SD | 1,5±0,8 | 1,3±0,4 | 0,005* |
Биохимические показатели крови | |||
Общий билирубин, мкмоль/л, М±SD | 40,6±20,9 | 28,0±13,3 | <0,001* |
Креатинин, мкмоль/л, М±SD | 97,3±35,3 | 85,8±16,8 | <0,001* |
Мочевина, ммоль/л, М±SD | 8,9±2,9 | 6,6±2,0 | <0,001* |
Аспартатаминотрансфераза, ед/л, М±SD | 144,7±99,3 | 75,7±30,5 | <0,001* |
Аланинаминотрансфераза, ед/л, М±SD | 89,4±65,3 | 25,2±17,8 | <0,001* |
С-реактивный белок, г/л, М±SD | 101,8±54,0 | 71,6±19,6 | <0,001* |
Фибриноген, г/л, М±SD | 8,0±1,6 | 8,2±1,4 | 0,24 |
Глюкоза, ммоль/л, М±SD | 9,8±3,6 | 10,2±2,4 | 0,24 |
При этом показатель галектин-3 крови у пациентов с ПОФП значимо вырастал в раннем послеоперационном периоде (табл. 4).
Таблица / Table 4
Показатели галектина-3 крови у пациентов из группы А до операции и после
Blood galectin-3 levels in patients from group A before and After surgery
Параметр | Группа А, n=158 До операции | Группа А, n=158 После операции | р |
Галектин-3, нг/мл, М±SD | 2,1±1,99 | 2,75±2,1 | <0,001 |
Статистически значимое повышение галектина-3 крови у пациентов с ПОФП подтвердил график ROC-кривой. Площадь под AUC-кривой составила 0,522 (AUC: 0,522, 95% ДИ: 0,457– 0,588; P=0,033) (рис. 2).
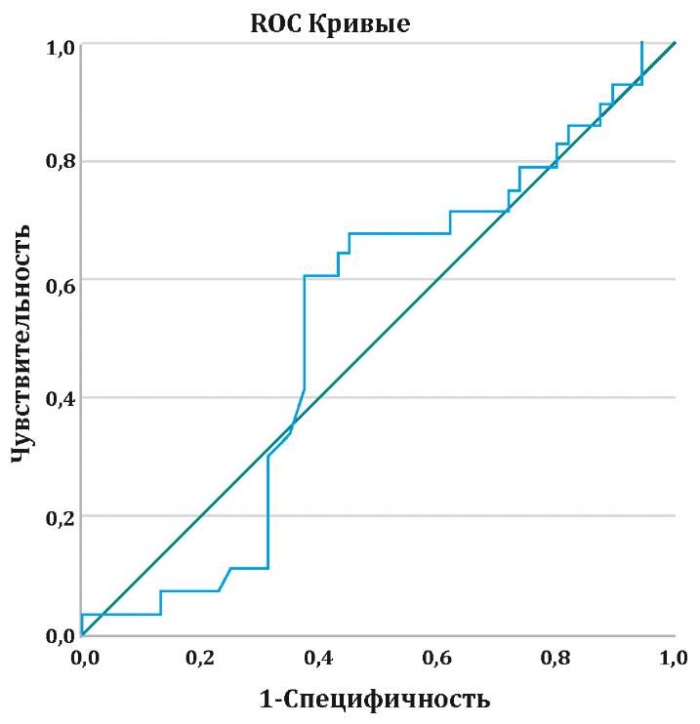
Рисунок 2. ROC-кривая для галектина-3 крови в прогнозировании ПОФП
Figure 2. ROC curve for blood galectin-3 in prognosis postoperative atrial fibrillation
Обсуждение
Настоящее исследование расширяет современные знания о галектине-3 и ФП, а также о патогенезе ПОФП в целом. Известно, что уровни галектина-3 повышены у пациентов с ФП по сравнению с контрольной группой и особенно высоки у пациентов с персистирующей ФП [17]. Данный маркер высоко экспрессируется фибробластами, макрофагами, другими воспалительными клетками, а также кардиомиоцитами в поражённом или нагруженном сердце [18]. Хотя галектин-3 изначально даже оказывает защитное антиапоптотическое и антинекротическое действие, в долгосрочной перспективе он служит восходящим медиатором ремоделирования предсердий и желудочков, потенцируя фиброз посредством множества механизмов. Длительная экспрессия галектина-3 индуцирует пролиферацию сердечных фибробластов, активацию и трансформацию покоящихся фибробластов в продуцирующие матрикс миофибробласты [19]. Кроме того, галектин-3 способствует инфильтрации макрофагов и тучных клеток и высвобождению провоспалительных и профибротических медиаторов, таких как трансформирующий фактор роста β1 и интерлейкины 1 и 2, а также участвует в активации сигнального пути трансформирующего фактора роста β1/SMAD, который является ключевым в формировании фиброза. Кроме того, галектин-3 способствует ядерной транслокации факторов транскрипции для транскрипции коллагена, таких как β-катенин. Все эти действия приводят к синтезу и отложению коллагена типа I и других компонентов фиброзного внеклеточного матрикса, нарушая гомеостаз между коллагеном типа I и типа III и, следовательно, угнетая функцию миокарда. Галектин-3 также способствует электрическому ремоделированию предсердий, нарушениям проводимости и другим неблагоприятным электрическими процессами, способствующими возникновению и поддержанию ФП [20].
Сильная ассоциация галектина-3 с ПОФП подчёркивает важность предсуществующего предсердного проаритмогенного субстрата в многофакторном генезе ПОФП. Эта гипотеза также подтверждается предыдущими исследованиями, связывающими ПОФП с увеличением ЛП, степенью фиброза и плохой функцией ЛП — всё это также связано с повышенным уровнем галектина-3 [21].
Хотя уровни галектина-3 могут быть легко измеримым биомаркером фиброза предсердий и риска ПОФП, галектин-3 не отражает исключительно фиброз в камерах предсердий. Он также отражает фиброз в камерах желудочков как при хронической СН, так и во внесердечных органах, таких как почки, печень и лёгкие [12]. Несмотря на отсутствие специфичности в отношении тканей предсердий, галектин-3 предсказывал ПОФП в настоящем исследовании.
Галектин-3 также может быть мишенью для вмешательства с целью предотвращения предсердного или желудочкового фиброгенеза и ремоделирования. В связи с этим Yu L. с соавт. продемонстрировал способность ослаблять фиброз желудочков, дисфункцию левого желудочка и последующее развитие СН у мышей путём фармакологического ингибирования галектина-3 [22]. Фармакологическое ингибирование галектина-3 в модели овец снижало пролиферацию фибробластов предсердий и благотворно влияло на электрическое ремоделирование, что приводило к снижению ФП [23]. Несмотря на эти многообещающие предварительные результаты исследований на животных, крупных интервенционных испытаний на людях, оценивающих терапевтический потенциал модуляции галектина-3 для лечения фиброза, не проводилось.
Что наиболее важно, в эпоху персонализированной медицины измерение галектина-3 может также улучшить предоперационную оценку риска и помочь выявить пациентов, нуждающихся в более тщательном наблюдении в послеоперационном периоде с точки зрения индивидуального ухода за пациентом.
Заключение
Дооперационные уровни галектина-3 в плазме имеют независимое значение для прогнозирования ПОФП и могут служить полезным прогностическим параметром в мультимодальном подходе к оценке риска в эпоху персонализированного лечения. Настоящее исследование расширяет знания о патогенезе ПОФП и может помочь в разработке будущих исследований, направленных на предотвращение ПОФП и сопутствующих неблагоприятных исходов для здоровья.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Гринштейн Ю.И., Косинова А.А., Монгуш Т.С., Гончаров М.Д. Коронарное шунтирование: исходы и эффективность антитромбоцитарной терапии. Креативная кардиология. 2020;14(2):138–49. DOI: 10.24022/1997-3187- 2020-14-2-138-149
2. Ho CH, Chen YC, Chu CC, Wang JJ, Liao KM. Postoperative Complications After Coronary Artery Bypass Grafting in Patients With Chronic Obstructive Pulmonary Disease. Medicine (Baltimore). 2016;95(8):e2926. DOI: 10.1097/MD.0000000000002926
3. Канаметов Т.Н., Пасхалов И.Д., Бокерия Л.А. Послеоперационная фибрилляция предсердий при внесердечных и кардиохирургических вмешательствах. Анналы аритмологии. 2022;19(1):4-13. DOI: 10.15275/annaritmol.2022.1.1
4. Ломиворотов В.В., Ефремов С.М., Покушалов Е.А., Бобошко В.А. Фибрилляция предсердий после кардиохирургических операций: патофизиология и методы профилактики. Вестник анестезиологии и реаниматологии. 2017;14(1):58-66. DOI: 10.21292/2078-5658-2017-14-1-58-66
5. O'Brien B, Burrage PS, Ngai JY, Prutkin JM, Huang CC, Xu X, et al. Society of Cardiovascular Anesthesiologists/European Association of Cardiothoracic Anaesthetists Practice Advisory for the Management of Perioperative Atrial Fibrillation in Patients Undergoing Cardiac Surgery. J Cardiothorac Vasc Anesth. 2019;33(1):12-26. DOI: 10.1053/j.jvca.2018.09.039
6. Мингалимова А.Р., Нефедова Г.А., Драпкина О.М. Предикторы фибрилляции предсердий, развившейся на госпитальном этапе после операции коронарного шунтирования. Кардиология. 2023;63(11):21-28. DOI: 10.18087/cardio.2023.11.n2559
7. Brown NJ. Contribution of aldosterone to cardiovascular and renal inflammation and fibrosis. Nat Rev Nephrol. 2013;9(8):459-469. DOI: 10.1038/nrneph.2013.110
8. Alexandre J, Saloux E, Chequel M, Allouche S, Ollitrault P, Plane AF, et al. Preoperative plasma aldosterone and the risk of atrial fibrillation after coronary artery bypass surgery: a prospective cohort study. J Hypertens. 2016;34(12):2449-2457. DOI: 10.1097/HJH.0000000000001105
9. Chequel M, Ollitrault P, Saloux E, Parienti JJ, Fischer MO, Desgué J, et al. Preoperative Plasma Aldosterone Levels and Postoperative Atrial Fibrillation Occurrence Following Cardiac Surgery: A Review of Literature and Design of the ALDO-POAF Study (ALDOsterone for Prediction of Post-Operative Atrial Fibrillation). Curr Clin Pharmacol. 2016;11(3):150-158. DOI: 10.2174/1574884711666160714162128
10. Bidar E, Maesen B, Nieman F, Verheule S, Schotten U, Maessen JG. A prospective randomized controlled trial on the incidence and predictors of late-phase postoperative atrial fibrillation up to 30 days and the preventive value of biatrial pacing. Heart Rhythm. 2014;11(7):1156-1162. DOI: 10.1016/j.hrthm.2014.03.040
11. Ozben B, Akaslan D, Sunbul M, Filinte D, Ak K, Sari İ, et al. Postoperative Atrial Fibrillation after Coronary Artery Bypass Grafting Surgery: A Two-dimensional Speckle Tracking Echocardiography Study. Heart Lung Circ. 2016;25(10):993-999. DOI: 10.1016/j.hlc.2016.02.003
12. Sciacchitano S, Lavra L, Morgante A, Ulivieri A, Magi F, De Francesco GP, et al. Galectin-3: One Molecule for an Alphabet of Diseases, from A to Z. Int J Mol Sci. 2018;19(2):379. DOI: 10.3390/ijms19020379
13. Ионин В.А., Соболева А.В., Листопад О.В., Нифонтов С.Е., Баженова Е.А., Васильева Е.Ю., и др. Галектин 3 и альдостерон у пациентов с фибрилляцией предсердий и метаболическим синдромом. Российский кардиологический журнал. 2015;(4):79-83. DOI: 10.15829/1560-4071-2015-4-79-83
14. Clementy N, Piver E, Bisson A, Andre C, Bernard A, Pierre B, et al. Galectin-3 in Atrial Fibrillation: Mechanisms and Therapeutic Implications. Int J Mol Sci. 2018;19(4):976. DOI: 10.3390/ijms19040976
15. Yalcin MU, Gurses KM, Kocyigit D, Canpinar H, Canpolat U, Evranos B, et al. The Association of Serum Galectin-3 Levels with Atrial Electrical and Structural Remodeling. J Cardiovasc Electrophysiol. 2015;26(6):635-640. DOI: 10.1111/jce.12637
16. Hindricks G, Potpara T, Dagres N, Arbelo E, Bax JJ, Blomström-Lundqvist C, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021;42(5):373-498. Erratum in: Eur Heart J. 2021;42(5):507. Erratum in: Eur Heart J. 2021;42(5):546-547. Erratum in: Eur Heart J. 2021;42(40):4194. DOI: 10.1093/eurheartj/ehaa612.
17. Gurses KM, Yalcin MU, Kocyigit D, Canpinar H, Evranos B, Yorgun H, et al. Effects of persistent atrial fibrillation on serum galectin-3 levels. Am J Cardiol. 2015;115(5):647-651. DOI: 10.1016/j.amjcard.2014.12.021
18. Bivona G, Bellia C, Lo Sasso B, Agnello L, Scazzone C, Novo G, et al. Short-term Changes in Gal 3 Circulating Levels After Acute Myocardial Infarction. Arch Med Res. 2016;47(7):521-525. DOI: 10.1016/j.arcmed.2016.12.009
19. Blanda V, Bracale UM, Di Taranto MD, Fortunato G. Galectin-3 in Cardiovascular Diseases. Int J Mol Sci. 2020;21(23):9232. DOI: 10.3390/ijms21239232
20. Olsen FJ, Bertelsen L, de Knegt MC, Christensen TE, Vejlstrup N, Svendsen JH, et al. Multimodality Cardiac Imaging for the Assessment of Left Atrial Function and the Association With Atrial Arrhythmias. Circ Cardiovasc Imaging. 2016;9(10):e004947. DOI: 10.1161/CIRCIMAGING.116.004947
21. Kim SH, Behnes M, Natale M, Hamed S, Hoffmann J, Hoffmann U, et al. Galectin-3 Reflects Left Atrial Function being Assessed by Cardiac Magnetic Resonance Imaging. Clin Lab. 2017;63(10):1701-1710. DOI: 10.7754/Clin.Lab.2017.170507
22. Yu L, Ruifrok WP, Meissner M, Bos EM, van Goor H, Sanjabi B,et al. Genetic and pharmacological inhibition of galectin-3 prevents cardiac remodeling by interfering with myocardial fibrogenesis. Circ Heart Fail. 2013;6(1):107-117. DOI: 10.1161/CIRCHEARTFAILURE.112.971168
23. Takemoto Y, Ramirez RJ, Yokokawa M, Kaur K, Ponce-Balbuena D, Sinno MC, et al. Galectin-3 Regulates Atrial Fibrillation Remodeling and Predicts Catheter Ablation Outcomes. JACC Basic Transl Sci. 2016;1(3):143-154. DOI: 10.1016/j.jacbts.2016.03.003
Об авторах
З. Г. ТатаринцеваРоссия
Татаринцева Зоя Геннадьевна, к.м.н., заведующая кардиологическим отделением; ассистент кафедры кардиохирургии и кардиологии ФПК и ППС
Краснодар
М. Г. Синельникова
Россия
Синельникова Мария Геннадьевна, ординатор кафедры кардиохирургии и кардиологии
Краснодар
А. В. Братова
Алла Витальевна Братова, заведующая клинико-диагностической лаборатории
Краснодар
К. О. Барбухатти
Россия
Кирилл Олегович Барбухатти, д.м.н., профессор, заведующий отделением кардиохирургии №2; заведующий кафедрой кардиохирургии и кардиологии ФПК и ППС
Краснодар
Дополнительные файлы
Рецензия
Для цитирования:
Татаринцева З.Г., Синельникова М.Г., Братова А.В., Барбухатти К.О. Галектин-3 как независимый предиктор послеоперационной фибрилляции предсердий. Южно-Российский журнал терапевтической практики. 2024;5(4):23-31. https://doi.org/10.21886/2712-8156-2024-5-4-23-31
For citation:
Tatarintseva Z.G., Sinelnikova M.G., Bratova A.V., Barbuhatti K.O. Galectin-3 as an independent predictor of postoperative atrial fibrillation. South Russian Journal of Therapeutic Practice. 2024;5(4):23-31. (In Russ.) https://doi.org/10.21886/2712-8156-2024-5-4-23-31
JATS XML


























