Перейти к:
Грибковый микробиом толстой кишки — новые возможности оценки предикции ремиссии и эффективности терапии язвенного колита
https://doi.org/10.21886/2712-8156-2025-6-2-58-64
Аннотация
Цель: изучение таксономического состава толстокишечной грибковой микробиоты у пациентов с ЯК и разработка модели предикции эффективности терапии на основании представленности грибковых микроорганизмов. Материалы и методы: в исследование включены 128 пациентов с язвенным колитом (ЯК) (86 пациентов в фазе рецидива ЯК и 42 пациента в фазе ремиссии). Больные ранжированы на группы в зависимости от клинической фазы, активности и степени тяжести заболевания. У пациентов проведено исследование копрофильтрата методом NGS–секвенирования 18S рибосомальной РНК с целью определения таксономического состава грибковой микробиоты толстой кишки. Результаты: микобиотический ландшафт толстой кишки пациентов с ЯК характеризовался наличием как классических представителей грибковой флоры (Candida, Malassezia, Saccharomyces, Penicillium), так и одноклеточных простейших Blastocystis, в частности видов Blastocystis_hominis и Dientamoeba_fragilis — колонизаторов кишечного микробиома, обладающих патогенными свойствами и ассоциированных с воспалительными заболеваниями кишечника. На основании данных о процентном соотношении обнаруженных родов грибов выполнена разработка модели эффективности консервативной терапии ЯК. Заключение: грибковый профиль микробиоты толстой кишки у пациентов с ЯК может рассматриваться как потенциальный диагностический инструмент, а модель прогнозирования ремиссии на основании представленности микроорганизмов — как перспективный метод контроля за течением заболевания.
Для цитирования:
Тарасова Г.Н., Зубова А.Д. Грибковый микробиом толстой кишки — новые возможности оценки предикции ремиссии и эффективности терапии язвенного колита. Южно-Российский журнал терапевтической практики. 2025;6(2):58-64. https://doi.org/10.21886/2712-8156-2025-6-2-58-64
For citation:
Tarasova G.N., Zubova A.D. The fungal microbiome of the colon provides new opportunities for assessing the prediction of remission and the effectiveness of ulcerative colitis therapy. South Russian Journal of Therapeutic Practice. 2025;6(2):58-64. (In Russ.) https://doi.org/10.21886/2712-8156-2025-6-2-58-64
Введение
Воспалительные заболевания кишечника (ВЗК) определяются как гетерогенные и полиэтиологичные заболевания, являющееся результатом конвергенции экологических, микробных, иммунологических и генетических факторов [1].
Микробный дисбиоз рассматривается как ключевой патогенетический фактор ЯК, что подтверждается данными современных метагеномных исследований. Развитие высокопроизводительного секвенирования и биоинформатических алгоритмов позволило детально охарактеризовать структурно-функциональные нарушения микробиоты, а также идентифицировать специфические дисбиотические сигнатуры, ассоциированные с ЯК [2][3].
Поскольку бактериальный компонент в составе толстокишечного микробиома является доминирующим, подавляющее большинство работ посвящено именно анализу бактериальных сообществ, тогда как вклад микобиома (грибковая микробиота), вирома (вирусная составляющая) и археома (архебактерии) остается малоизученным [3—5]. Между тем, эти элементы представляют собой динамические экологические сети, способные модулировать иммунный ответ и влиять на патофизиологические механизмы ВЗК, что делает их перспективными объектами для дальнейших исследований.
Несмотря на относительно низкую численность (∼0,1% от общего пула микробных таксонов), грибковые сообщества представляют собой важный компонент кишечного микробиома человека. Традиционные ограничения, связанные с невозможностью культивирования многих видов in vitro, были частично преодолены благодаря внедрению высокопроизводительных методов секвенирования. Это позволило не только провести комплексный таксономический и функциональный анализ микобиома толстой кишки, но и выявить устойчивые корреляции между дисбиотическими изменениями грибковых сообществ и воспалительными процессами в СО кишечника [6][7].
Современные исследования демонстрируют, что представители микобиома и бактериального микробиома формируют сложную систему кросс-доменных взаимодействий, опосредованных как прямыми межмикробными контактами, так и секретируемыми метаболитами. Эти процессы оказывают модулирующее влияние на локальный иммунный ответ и могут потенцировать хроническое воспаление СО у пациентов с рецидивом ЯК [3][6].
Цель исследования — анализ таксономической структуры грибкового микробиома толстой кишки (микобиоты) у пациентов с ЯК в фазе клинической ремиссии и активного воспаления, а также построение предиктивной модели эффективности терапии на основе характеристик грибкового сообщества.
Материалы и методы
Формирование выборки пациентов с ЯК проходило путем клинико–лабораторного и инструментального обследования для определения клинической фазы, активности, степени тяжести заболевания. Клинико–лабораторные методы включали сбор жалоб и анамнестических данных, объективный осмотр и физикальное обследование, общеклинический и биохимический анализ крови, а также исследование фекального кальпротектина. Инструментальное обследование заключалось в проведении видеоилеоколоноскопии с забором биоптатов СО толстой кишки и последующей патоморфологической верификацией степени воспаления. Оценка активности ЯК проводилась с использованием шкалы Mayo, а также критериев Truelov–Witts. Эндоскопически активность заболевания была оценена с помощью индексов UCEIS и Schroeder.
В исследование включены 128 пациентов с ЯК, распределённых на две клинические группы: группа рецидива (n=86), средний возраст — 32,03±5,5 лет; мужчины — 42 (48,9%), женщины — 44 (51,1%) и группа ремиссии (n=42), средний возраст — 38,0±4,4 лет; мужчины — 19 (45,2%), женщины — 23 (54,8%). Анализ тяжести воспалительного процесса выявил два паттерна течения ЯК: часто-рецидивирующее течение с атакой средней тяжести зафиксировано у 72 пациентов (56,3% от общей выборки), редко-рецидивирующее течение с легкой атакой наблюдалось у 56 пациентов (43,8%).
Для определения таксономического состава грибковой микробиоты толстой кишки у пациентов с ЯК было проведено исследование копрофильтрата методом NGS-секвенирования 18S рибосомальной РНК.
Статистическая обработка
Статистическая обработка полученных данных была выполнена в пакете прикладных программ SPSS версии 26 (IBM, USA). Проверка на нормальность распределения количественных данных проводилась с помощью критериев Колмогорова–Смирнова (с коррекцией значимости Лильефорс) и Шапиро–Уилка. Гипотезы о соответствии распределения нормальному были отвергнуты, в связи с чем расчёт описательных статистик представлен медианой и квартилями. Сравнение групп выполнено с помощью непараметрического критерия Манна–Уитни. Для сравнения показателей, подчинявшихся нормальному закону распределения, применяли t–критерий Стьюдента. Различия признавались статистически значимыми при p<0,05.
Для прогнозирования ремиссии заболевания использован инструментарий логистической регрессии с расчётом отношения шансов, для компенсации количества наблюдений использована процедура бутстреп-оценивания. Для оценки качества прогноза использован ROC-анализ с расчётом чувствительности и специфичности.
Результаты
Анализ секвенирования 18S рРНК позволил выявить всего 15 родов и 28 видов эукариотических представителей в образцах пациентов с ЯК. Самыми часто регистрируемыми родами грибов у пациентов с рецидивом ЯК оказались основные представители толстокишечной микобиоты — дрожжи Candida и Malassezia, они были обнаружены у 81,8% пациентов, дрожжи Saccharomyces — у 45,5% пациентов, а также регистрировался род одноклеточных Blastocystis — у 36,4%. Вид Candida wounanorum — самый часто встречаемый вид грибов у пациентов с рецидивом ЯК (72,7% пациентов), далее следуют виды Candida_athensensis, Cryptococcus_terreus, Penicillium_camemberti, Malassezia_globosa, Blastocystis_hominis, Spizellomycetales–and–Rhizophlyctidales, Euglena_sanguinea – они обнаружены у 18,2% пациентов. Таксономический состав грибковой микробиоты пациентов с рецидивом ЯК представлен на рисунках 1 и 2.
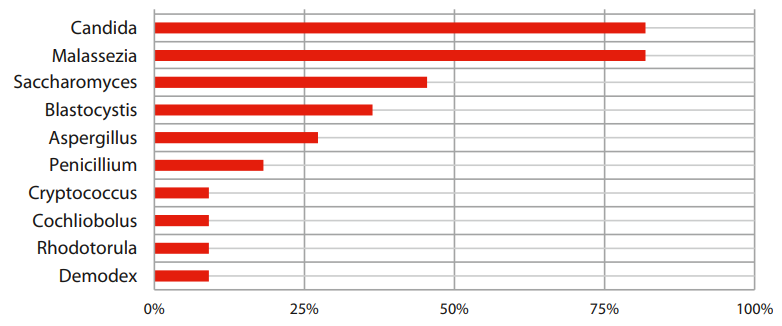
Рисунок 1. Представленность грибов у пациентов с рецидивом ЯК на уровне рода.
Figure 1. Representation of fungi in patients with relapsed UC at the genus level.
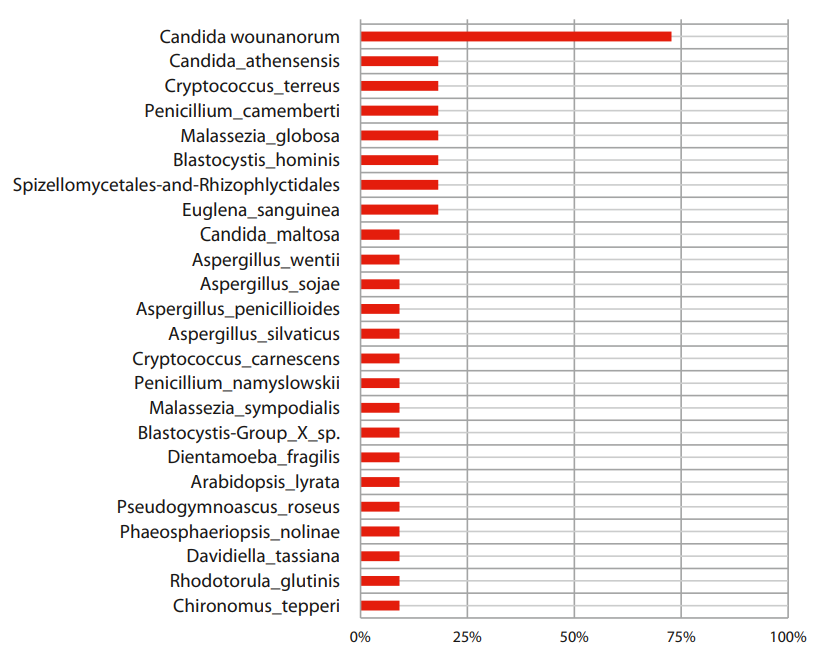
Рисунок 2. Представленность грибов у пациентов с рецидивом ЯК на уровне вида.
Figure 2. Representation of fungi in patients with relapsed UC at the species level.
Роды Candida и Malassezia регистрировались у всех пациентов с ремиссией ЯК, Blastocystis и Penicillium – у 40% пациентов. Самыми часто встречаемыми представителями грибковой микробиоты на уровне вида в данной группе оказались Candida wounanorum – обнаружены у 100% пациентов и Cryptococcus_vishniacii (у 40% пациентов), Penicillium_camemberti и Blastocystis_hominis обнаружились у 30% пациентов. Таксономический состав грибковой микробиоты пациентов с ремиссией ЯК представлен на рисунках 3 и 4.
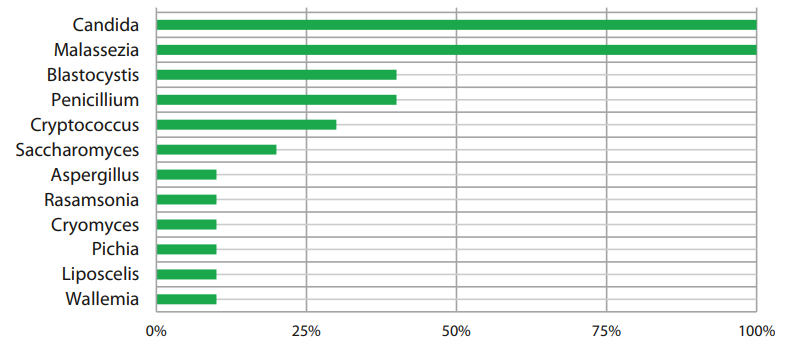
Рисунок 3. Представленность грибов у пациентов с ремиссией ЯК на уровне рода.
Figure 3. Representation of fungi in patients with UC remission at the genus level.
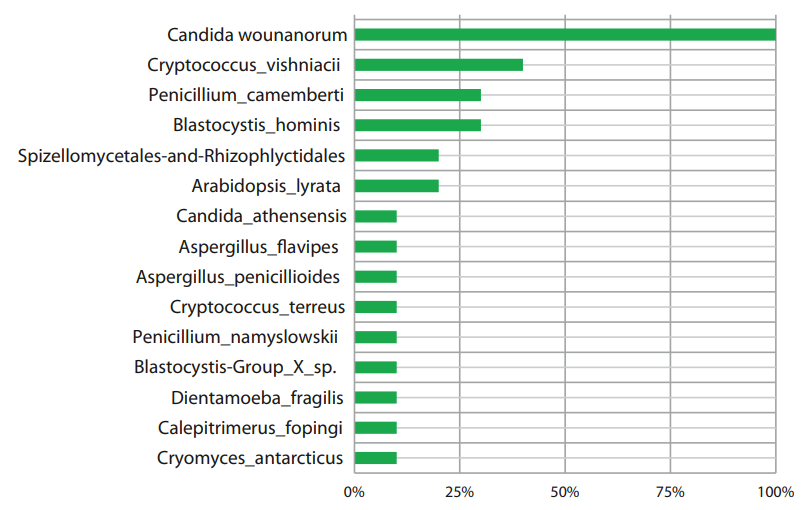
Рисунок 4. Представленность грибов у пациентов с ремиссией ЯК на уровне вида.
Figure 4. Representation of fungi in patients with remission of UC at the species level.
Индексы биоразнообразия (индексы Шеннона) на уровне рода и вида оказались довольно низкими: 0,161 [0,075; 0,613]% и 0,017 [0,0; 0,175]% в группе рецидива и 0,130 [0,053; 0,316]% и 0,079 [0,020; 0,493]% в группе ремиссии, что является характерным для микобиоты толстой кишки [8].
Для прогнозирования ремиссии на основе процентного соотношения обнаруженных родов грибов выполнена оценка модели логистической регрессии. Наиболее информативными для прогнозирования ремиссии оказались грибы родов Aspergillus, Malassezia и Blastocystis, обнаруженные в обеих группах исследования. Результаты оценки модели представлены в таблице 1. Модель статистически значима по критерию хи–квадрат (р=0,008), псевдо-коэффициент детерминации Кокса и Снелла равен 0,449, Нэйджелкерка — 0,599, что свидетельствует о наличии объясняющей способности модели. Все коэффициенты являются статистически значимыми.
Таблица / Table 1
Результаты многофакторного анализа влияния толстокишечной микобиоты на ремиссию язвенного колита (логистическая регрессия)
Results of multifactorial analysis of the influence of colon mycobiota on remission of ulcerative colitis (logistic regression)
Название | Коэффициент | ОШ | р* |
Aspergillus | –106,261 | 7,1∙10–47 | 0,007 |
Malassezia | 8,613 | 5500,1 | 0,008 |
Blastocystis | 0,037 | 1,038 | 0,008 |
Константа | –1,996 | 0,136 | 0,013 |
Примечание: * оценено с использованием процедуры бутстрепа на основе 970 выборок.
Формулу для данной модели можно представить следующим образом:
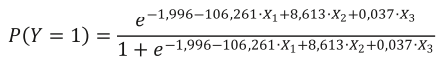
где Y — ремиссия язвенного колита;
X1 — процент грибов рода Aspergillus;
X2 — процент грибов рода Malassezia;
X3 — процент грибов рода Blastocystis;
e — основание натурального логарифма.
Оценка прогнозной способности построенной модели выполнена с использованием ROC-анализа. На рисунке 5 представлена ROC-кривая, площадь под которой составляет 0,8. Чувствительность и специфичность модели составляют 80%.
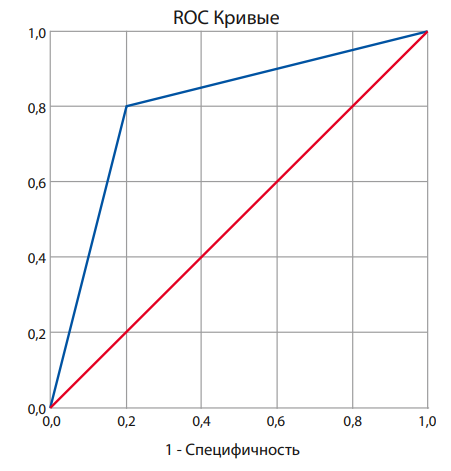
Рисунок 5. ROC-кривая для модели прогнозирования ремиссии ЯК на основании данных о представленности родов грибов.
Figure 5. ROC curve for the model for predicting remission of ulcerative colitis based on data on the representation of fungal microbiota.
С помощью индекса Юдена были определены оптимальные пороги отсечения для родов грибов. Пороговые значения составили 0,003% для рода Aspergillus, 0,0565% для рода Malassezia и 24,285% для рода Blastocystis. Пороговый уровень вероятности ремиссии, рассчитанный с помощью аналогичного индекса составил 28,30%, то есть если величина Р составляет 28,30% и более, то прогнозируется высокая эффективность консервативной терапии и достижение ремиссии ЯК.
Обсуждение
Таксономический ландшафт, выявленный с помощью 18S секвенирования образцов копрофильтрата пациентов с ЯК, характеризовался наличием как классических представителей грибковой флоры Candida, Malassezia, Saccharomyces, Penicillium, так и одноклеточных простейших Blastocystis, в частности видов Blastocystis_hominis и Dientamoeba_fragilis — колонизаторов кишечного микробиома, обладающих патогенными свойствами и ассоциированных с ВЗК. Доминирующими эукариотическими микроорганизмами у пациентов с ЯК в обеих группах зарегистрированы дрожжи Candida, Malassezia и Saccharomyces, являющиеся типовыми представителями комменсальной толстокишечной флоры, что соответствует данным, полученным при изучении микобиоты здоровой когорты Human Microbiome Project (HMP) [8].
Современный золотой стандарт диагностики ремиссии язвенного колита — эндоскопическое исследование с гистологической верификацией — обладает существенными ограничениями, связанными с его инвазивностью, высокой стоимостью и низкой приемлемостью для пациентов. Существующие лабораторные маркеры (фекальный кальпротектин, С–реактивный белок) демонстрируют недостаточную специфичность для точного мониторинга активности заболевания. В данном контексте разработка математической модели прогнозирования эффективности терапии приобретает особую клиническую значимость как потенциальная альтернатива инвазивной диагностике.
Представленная прогностическая модель, основанная на комплексном анализе клинико-лабораторных параметров, продемонстрировала высокую диагностическую эффективность (чувствительность — 80%, специфичность — 80%), что соответствует критериям удовлетворительной прогностической способности согласно рекомендациям FDA по валидации диагностических тестов. Полученные результаты позволяют рассматривать данный подход как перспективный инструмент для неинвазивного мониторинга пациентов с ЯК.
Заключение
Современные метагеномные исследования существенно расширили понимание роли микробного дисбиоза в патогенезе ЯК. Если ранние работы преимущественно фокусировались на бактериальном компоненте микробиоты, то применение высокопроизводительных технологий секвенирования нового поколения позволило выявить значительное таксономическое разнообразие микобиома толстой кишки и установить его потенциальное значение в развитии и поддержании воспалительного процесса. Однако патогенетические механизмы, посредством которых микобиом модулирует воспалительный ответ при ЯК, остаются недостаточно изученными и требуют дальнейших экспериментальных и клинических исследований.
Полученные в настоящем исследовании данные демонстрируют диагностическую ценность характеристик микобиома при ЯК. Выявленные дисбиотические изменения грибковой микробиоты могут служить дополнительными биомаркерами активности заболевания. Разработанная прогностическая модель представляет собой клинически значимый неинвазивный инструмент для оценки эффективности терапии и прогнозирования наступления ремиссии. Проведённое исследование вносит существенный вклад в понимание роли микобиома в патогенез ЯК и открывает новые возможности для персонализированного подхода к диагностике и лечению этого заболевания, включая разработку таргетной терапии, направленной на коррекцию микобиоценоза.
Список литературы
1. Lee M, Chang EB. Inflammatory Bowel Diseases (IBD) and the Microbiome-Searching the Crime Scene for Clues. Gastroenterology. 2021;160(2):524-537. https://doi.org/10.1053/j.gastro.2020.09.056
2. Zakerska-Banaszak O, Zuraszek-Szymanska J, Eder P, Ladziak K, Slomski R, Skrzypczak-Zielinska M. The Role of Host Genetics and Intestinal Microbiota and Metabolome as a New Insight into IBD Pathogenesis. Int J Mol Sci. 2024;25(17):9589. https://doi.org/10.3390/ijms25179589
3. Matijašić M, Meštrović T, Paljetak HČ, Perić M, Barešić A, Verbanac D. Gut Microbiota beyond Bacteria-Mycobiome, Virome, Archaeome, and Eukaryotic Parasites in IBD. Int J Mol Sci. 2020;21(8):2668. https://doi.org/10.3390/ijms21082668
4. Underhill DM, Braun J. Fungal microbiome in inflammatory bowel disease: a critical assessment. J Clin Invest. 2022;132(5):e155786. https://doi.org/10.1172/JCI155786
5. Iliev ID. Mycobiota-host immune interactions in IBD: coming out of the shadows. Nat Rev Gastroenterol Hepatol. 2022;19(2):91-92. https://doi.org/10.1038/s41575-021-00541-2
6. Balderramo DC, Romagnoli PA, Granlund AVB, Catalan-Serra I. Fecal Fungal Microbiota (Mycobiome) Study as a Potential Tool for Precision Medicine in Inflammatory Bowel Disease. Gut Liver. 2023;17(4):505-515. https://doi.org/10.5009/gnl220537
7. Chin VK, Yong VC, Chong PP, Amin Nordin S, Basir R, Abdullah M. Mycobiome in the Gut: A Multiperspective Review. Mediators Inflamm. 2020;2020:9560684. https://doi.org/10.1155/2020/9560684
8. Nash AK, Auchtung TA, Wong MC, Smith DP, Gesell JR, Ross MC, et al. The gut mycobiome of the Human Microbiome Project healthy cohort. Microbiome. 2017;5(1):153. https://doi.org/10.1186/s40168-017-0373-4
Об авторах
Г. Н. ТарасоваРоссия
Тарасова Галина Николаевна, д.м.н., профессор, профессор кафедры пропедевтики внутренних болезней
Ростов-на-Дону
А. Д. Зубова
Россия
Зубова Анна Дмитриевна, преподаватель Центра симуляционного обучения; врач-терапевт
Ростов-на-Дону
Дополнительные файлы
Рецензия
Для цитирования:
Тарасова Г.Н., Зубова А.Д. Грибковый микробиом толстой кишки — новые возможности оценки предикции ремиссии и эффективности терапии язвенного колита. Южно-Российский журнал терапевтической практики. 2025;6(2):58-64. https://doi.org/10.21886/2712-8156-2025-6-2-58-64
For citation:
Tarasova G.N., Zubova A.D. The fungal microbiome of the colon provides new opportunities for assessing the prediction of remission and the effectiveness of ulcerative colitis therapy. South Russian Journal of Therapeutic Practice. 2025;6(2):58-64. (In Russ.) https://doi.org/10.21886/2712-8156-2025-6-2-58-64


























