Перейти к:
Цитокиновый профиль пациентов с кальцинозом коронарных артерий без ишемической болезни сердца
https://doi.org/10.21886/2712-8156-2025-6-2-24-31
Аннотация
Цель: изучить цитокиновый профиль у пациентов с коронарным кальцинозом разной степени выраженности без клинических проявлений ИБС. Материалы и методы: в исследование были включены 68 пациентов мужского пола, сопоставимых по возрасту, из них 25 человек с коронарным атерокальцинозом — соответствующие группе умеренного риска (I группа), 23 человека с коронарным атерокальцинозом — соответствующие группе высокого риска (II группа) и 20 респондентов группы контроля без клинических проявлений ИБС, которым рассчитывали коронарный индекс по методике Агатстона. Критериями исключения были сахарный диабет, онкопатология, заболевания соединительной ткани, хронические вирусные инфекции. Оценка коронарного кальция (КК) и расчёт индекса Агатстона проведены с помощью программного обеспечения для расчёта коронарного кальция Smart Score. Исследование цитокинов сыворотки крови (IL-4, IL-6, IL-10, IL-17, FNO-α и IFN-γ) проводили с помощью твёрдофазного иммуноферментного анализа с использованием тест-систем производства ООО «Цитокин», Санкт-Петербург, Россия. Статистический анализ результатов исследования проводили с применением программы Statistica 12.0 (StatSoft, США). Результаты: выявлены повышенные значения провоспалительных цитокинов в обеих группах коронарного кальциноза. Оценка индексов соотношения провоспалительных цитокинов к противоспалительным отражает поляризацию цитокинового профиля у пациентов с коронарным кальцинозом по провоспалительному пути, превалирование противовоспалительного резерва у пациентов с менее выраженным кальцинозом коронарных артерий. Заключение: продемонстрирована комплексная оценка цитокинового профиля у пациентов с различной степенью выраженности коронарного кальциноза без клинических проявлений ИБС, показывающая преобладание провоспалительного ответа в обеих группах при сохранности супрессивных иммунорегуляторных эффектов у пациентов с менее выраженным коронарным кальцинозом. Полученные данные не являются однозначными ввиду особенностей плейотропного эффекта цитокинов, что требует сопоставления результатов с количественными и функциональными показателями иммунокомпетентных клеток, ответственных за их синтез.
Ключевые слова
Для цитирования:
Шлык И.Ф., Андреева И.И., Моргунов М.Н., Харитонова М.В., Беседина Д.Ю. Цитокиновый профиль пациентов с кальцинозом коронарных артерий без ишемической болезни сердца. Южно-Российский журнал терапевтической практики. 2025;6(2):24-31. https://doi.org/10.21886/2712-8156-2025-6-2-24-31
For citation:
Shlyk I.F., Andreeva I.I., Morgunov M.N., Kharitonova M.V., Besedina D.Yu. Cytokine profile of patients with coronary artery calcification without ischemic heart disease. South Russian Journal of Therapeutic Practice. 2025;6(2):24-31. (In Russ.) https://doi.org/10.21886/2712-8156-2025-6-2-24-31
Введение
Кальциноз коронарных артерий, является одним из этапов развития атеросклероза, протекающий, как правило, синхронно с депозицией кальция в субинтимальном слое артерий [1]. Кальцификация интимы является активным процессом, ассоциированным с наличием факторов риска сердечно-сосудистых заболеваний, таких как старение, сахарный диабет, гиперлипидемия, местных факторов, которые стимулируют её образование [2]. Возникает данный патологический процесс в результате преципитации кальция, вызванной активностью хондроцитоподобных клеток, и воспалительным каскадом, активируемым макрофагами, моноцитами и локальным высвобождением различных цитокинов [3]. Кальцификация коронарных артерий представляет междисциплинарную проблему, которая влияет на исход лечения не только консервативного, но и хирургического. В связи с этим определение коронарного кальция является прогностическим маркером, для определения дальнейшей тактики ведения пациентов как при наличии предтестовой вероятности ИБС, так и при доказанной ИБС. Так, например, шкала SYNTAX II, позволяющая принять решение о методе реваскуляризации миокарда у пациентов с ИБС, коронарном стентировании или шунтировании, учитывающая коронарный кальциноз и сопутствующую патологию [4]. Однако данная шкала применяется непосредственно уже на стадии лечения значимого коронарного атеросклероза и не влияет на его вторичную профилактику. Важным в стратификации риска сердечно-сосудистых событий является не только оценка исхода активного атеросклероза, а именно кальциноза артерий, но и процессов, лежащих в основе его развития. В настоящее время одной из ведущий теорий атеросклероза признается ответ иммунной системы на повреждение, изучается и дополняется эта теория данными о клеточном, гуморальном иммунном ответе, цитокинах [5]. Однако работ, которые раскрывали бы те или иные звенья иммунного ответа у пациентов с коронарным кальцинозом, немного, и они носят противоречивый характер. При этом высказывается мнение о роли воспалительных цитокинов, инициирующих остеогенную дифференцировку и минерализацию сосудистой стенки, но не отражается одномоментное исследование противоспалительных цитокинов [6].
Цель исследования — изучение цитокинового профиля у пациентов с коронарным кальцинозом разной степени выраженности без клинических проявлений ИБС.
Материалы и методы
Исследование проводилось в ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России в рамках государственного задания Минздрава России. В исследование были включены пациенты с коронарным атеросклерозом без клинических проявлений ИБС, которым проведена мультиспиральная компьютерная томография, синхронизированная с ЭКГ, и рассчитан коронарный индекс (КИ) по методике Агатстона, где низкий риск — 0–10 ЕД., умеренный риск — 11–100 ЕД., высокий риск — 101–400 ЕД., очень высокий риск — ≥401 ЕД [7]. Протокол исследования одобрен локальным этическим комитетом. В исследовании приняли участие 68 пациентов мужского пола, из них 25 человек с коронарным атерокальцинозом — соответствующие группе умеренного риска (I группа), 23 человека с коронарным атерокальцинозом — соответствующие группе высокого риска (II группа) и 20 респондентов группы контроля, у которых нет клинических и инструментальных признаков коронарного атеросклероза, по данным СКТ коронарных артерий, сопоставимых по возрасту (54,2±1,6; 55,9±1,2 и 53,7±1,2 соответственно, р мн.=0,36). Пациенты обеих групп имели факторы риска атеросклероза (артериальная гипертензия, дислипидемия), а вошедших во II группу отличал фактор курения. Из фармакологического анамнеза: пациенты обеих групп не принимали гиполипидемические препараты. Критериями исключения были сахарный диабет, онкопатология, заболевания соединительной ткани, хронические вирусные инфекции. Всеми участниками исследования было подписано добровольное информированное согласие на участие и проведение необходимых исследований. С целью рандомизации групп была проведена спиральная компьютерная томография (СКТ) коронарных артерий и аорты (спиральный компьтерный томограф Revolution EVO, GE Healthcare) пациентам которым определены показания для этого исследования. Оценка коронарного кальция (КК) и расчёт индекса Агатстона проведены с помощью программного обеспечения для расчёта коронарного кальция Smart Score. Исследование цитокинов сыворотки крови (IL-4, IL-6, IL-10, IL-17, FNO-α и IFN-γ) проводили с помощью твердофазного иммуноферментного анализа (анализатор «Униплан» АИФР-01, ЗАО «Пикон», РФ) с использованием тест-систем производства ООО «Цитокин», Санкт-Петербург, Россия. Липидный профиль оценивали с помощью анализатора Konelab Prime 60i, США и реагентов «Холестерин общий», «Холестерин ЛПНП», «Холестерин ЛПВП», «Набор реагентов для определения триглицеридов GPO-PAP», производство НПФ Абрис плюс, Россия. Расчет индекса атеросгенности осуществляли следующим способом ИА=(ОХС-ЛПВП)/ЛПВП. Статистический анализ результатов исследования проводили с применением программы Statistica 12.0 (StatSoft, США). Показатели в группах представлены средним выборочным значением (М) со стандартной ошибкой (m). Нормальность распределения значений в выборках проверяли по критерию Шапиро-Уилка. Для сравнения показателей в трёх группах использовали дисперсионный анализ и критерий Краскела-Уоллиса. При попарном сравнении вводили поправку на число сравниваемых групп по Тьюки.
Результаты
Известно, что кальциноз коронарных артерий взаимосвязан с дислипидемией и другими факторами риска атеросклероза. В таблице 1 представлен индекс коронарного кальция, измеренный в обеих группах наблюдения, где отмечено большее значение во II группе с умеренно повышенным риском развития ИБС. Не менее интересным представляется анализ липидного профиля, отражающего повышенные относительно целевых показателей значения проатерогенных липидов (ЛПНП, ТГ) и снижение ЛПВП. При этом значимых различий между I и IIгруппами не выявлено.
Таблица / Table 1
Уровень коронарного кальция и липидного профиля у пациентов с коронарным кальцинозом
Сoronary calcium level and lipid profile in patients with coronary calcification
Показатель (целевой уровень) Indicator (target level) | I группа Group 1 (n=25) | II группа Group 2 (n=23) | р |
Индекс коронарного кальция, ЕД (отсутствие) Сoronary calcium index, ED (absence) | 40,3±5,71 | 262,6±19,4 | 0,001 |
Общий холестерин, ммоль/л (менее 4,0) Total cholesterol, mmol/l (less than 4.0) | 4,5±0,1 | 5,5±0,6 | 0,29 |
ЛПВП, ммоль/л (более 1,2) HDL, mmol/l (more than 1.2) | 1,1±0,02 | 1,0±0,04 | 0,6 |
ЛПНП, ммоль/л (менее 1,8) LDL, mmol/L (less than 1.8) | 2,8±0,15 | 3,1±0,22 | 0,4 |
Триглицериды, ммоль/л (менее 1,7) Triglycerides, mmol/l (less than 1.7) | 1,6±0,1 | 1,59±0,1 | 0,94 |
Индекс атерогенности Atherogenicity index | 2,9±0,1 | 4,1±0,3 | 0,08 |
Примечание: значение р полученное при сравнении I и II групп. Уровень достоверности принимался при значении р≤0,05. Данные представлены в виде M±m.
Note: p-value obtained by comparing group 1 and group 2. The significance level was accepted at p≤0.05. Data are presented as M±m.
Анализируя противовоспалительный цитокиновый профиль групп с коронарным кальцинозом в сопоставлении с контрольной, мы отмечаем значимое повышение IL-4 в I группе, при этом во II группе намечена лишь тенденция к его повышению, различий в содержании данного цитокина между группами I и II не выявлено (табл. 2). Содержание IL-10 в группе умеренного риска в 4 раза выше, чем в группе контроля, и в 2 раза выше, чем в группе высокого риска.
При сопоставительном анализе провоспалительного профиля не отмечено значимого отличия в содержании TNFα в обеих группах коронарного кальциноза и контрольной. Содержание IL-6 в сыворотке крови значимо выше в I и II группах по сравнению с контролем. Обращает внимание значительное повышение уровня IL-17 в обеих группах с коронарным кальцинозом, превышающее в 10 раз его содержание относительно группы контроля. Повышение более чем в 2 раза провоспалительного потенциала в обеих группах коронарного кальциноза подтверждает сывороточное содержании IFNγ (в сравнении с контролем).
Таблица / Table 2
Содержание цитокинов в сыворотке крови у пациентов с коронарным кальцинозом в сравнении с контролем
Serum cytokine levels in patients with coronary calcification compared to controls
Показатели Indicators | Контроль, Control (n=20) | I группа Group 1 (n=25) | II группа Group 2Group 2 (n=23) | р, контроль и I группа / control and group 1 | р, контроль и II группа / control and group 2 | р, I группа и II группа / group 1 and group 2 |
IL-4, пг/мл IL-4, pg/ml | 2,89±0,3 | 6,29±0,2 | 4,72±0,5 | 0,002 | 0,12 | 0,2 |
IL-10, пг/мл IL-10, pg/ml | 5,01±0,3 | 19,9±0,9 | 10,5±0,2 | 0,0001 | 0,0001 | 0,04 |
TNFα, пг/мл TNFα, pg/ml | 1,62±0,1 | 1,71±0,4 | 2,24±0,8 | 0,69 | 0,77 | 0,99 |
IL-6, пг/мл IL-6, pg/ml | 2,06±0,2 | 4,57±0,1 | 5,21±0,1 | 0,04 | 0,001 | 0,28 |
IL-17, пг/мл IL-17, pg/ml | 1,86±0,3 | 19,7±0,2 | 21,27±1,1 | 0,001 | 0,001 | 0,98 |
IFNγ, пг/мл IFNγ, pg/ml | 7,02±0,4 | 18,72±1,1 | 20,45±1,2 | 0,0001 | 0,0001 | 0,67 |
Индекс соотношения цитокинов Cytokine Ratio Index | ||||||
IFNγ/IL-4 | 2,37±0,1 | 3,44±0,41 | 4,95±0,57 | 0,0001 | 0,0001 | 0,36 |
IFNγ/IL-10 | 1,4±0,05 | 0,94±0,3 | 1,94±0,07 | 0,06 | 0,04 | 0,03 |
IL-17/IL-4 | 0,65±0,1 | 3,11±0,7 | 4,5±0,81 | 0,005 | 0,007 | 0,78 |
IL-17/IL-10 | 0,37±0,02 | 0,98±0,03 | 2,05±0,05 | 0,03 | 0,005 | 0,89 |
Примечание: значение р полученное при сравнении групп. Уровень достоверности принимался при значении р≤0,05. Данные представлены в виде M±m.
Note: p-value obtained when comparing groups. The significance level was accepted at p≤0.05. Data are presented as M±m.
Помимо констатации количественного содержания цитокинов, нами проведена оценка соотношения про- и противоспалительных цитокинов. На рисунке наглядно представлены показатели соотношения количественных параметров провоспалительных цитокинов IFNγ и IL-17 к содержанию противовоспалительных медиаторов, для отражения цитокинового баланса. В таблице 2 отражены значения уровня достоверности при сравнении с данными индексов в группах. Рассматривая в исследуемых группах соотношение IFNγ к IL-4 следует отметить значение более 1 как в контрольной, так и в группах с коронарным кальцинозом разной степени выраженности. Неоднозначны изменения IFNγ к IL-10, где значения больше 1 отмечены в группе контроля и II группе, при этом в I группе этот параметр менее 1. При оценке соотношения IL-17 к IL-4 и IL-10 в группе контроля выявлено преобладание противовоспалительной активности двух цитокинов. В группах с коронарным кальцинозом отмечено повышение провоспалительного потенциала за счёт уровня IL-17, причём чем более выражен коронарный кальциноз, тем больше этот индекс.
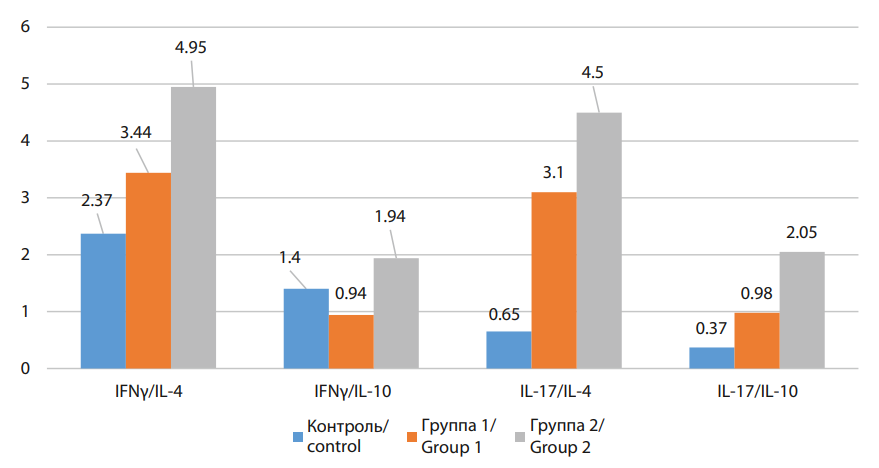
Рисунок. Иммунорегуляторные индексы в сравниваемых группах
Figure. Immunoregulatory indices in the compared groups
Таким образом, по результатам проведенного исследования можно отметить неоднозначное изменение цитокинового баланса у пациентов с коронарным кальцинозом.
Обсуждение
Роль различных цитокинов и их рецепторов в развитии атеросклероза на разных этапах, изучается длительное время, в том числе и в экспериментальных работах [8]. Известно, что для IL-4 характерна антиатерогенная роль, т.к., являясь медиатором Тh2, данный цитокин переключает иммунный ответ к синтезу антител с изотипа IgM на IgG к окисленным липопротеинам низкой плотности [9]. Данное положение отражено в работе Wang C. и соавт., где было показано, что уровень IL-4 значительно ниже в группе без ИБС [10]. В анализируемой литературе не найдены работы, изучающие циркулирующий в сыворотке крови IL-4 у пациентов с коронарным кальцинозом, отмечена лишь роль в эксперименте in vitro в подавлении синтеза остеопротегерина (фактор минерализации) гладкомышечными клетками коронарных артерий [11]. Таким образом, можно предположить, что, блокируя окисленные ЛПНП, принимающих прямое участие в воспалении при атеросклерозе и кальцинозе, повышенный уровень IL-4 в группе с меньшим уровнем индекса коронарного кальция свидетельствует о его защитной роли. Изучая роль противовоспалительного цитокина IL-10, мы отметили его значимое повышение в группах с коронарным кальцинозом, причем в I группе сывороточный уровень IL-10 был значимо выше, чем в группе с более выраженным кальцинозом. Полученные результаты сопоставимы с выводами крупномасштабного исследования MESA (Multi-Ethnic Study of Atherosclerosis), где было отмечено большее содержание IL-10 у пациентов с индексом коронарного кальция более 0 ЕД [12]. Возможно, это связано с активацией Т-регуляторных лимфоцитов, основным продуктом синтеза которых является противовоспалительный цитокин - IL-10, и подавлением синтеза макрофагами остеопонтина (кальцифицирующего агента) [13]. В другом исследовании была показана прямая корреляционная связь IL-10 с повышением уровня TNFα и коронарным кальцинозом, что подтверждает супрессивную роль IL-10 [14]. Однако встречаются и противоречивые данные о том, что более высокие уровни IL-10 связаны с более низкой атеросклеротической нагрузкой на коронарные артерии, но не с общим объёмом коронарной кальцификации [15]. Данный факт может служить предметом научных исследований и дискуссий. Значения IL-6, IL-17 и IFNγ достоверно выше в обеих группах наблюдения по сравнению с контролем, при этом в группе с индексом коронарного кальция более 100 ЕД, отмечалась лишь тенденция к повышению по сравнению с I группой. Отсутствие разницы между I и II группами может свидетельствовать об отсутствии значимости в степени коронарного кальциноза и содержания провоспалительных цитокинов. Обращает на себя внимание сопоставимый уровень TNFα во всех исследуемых группах, что противоречит результатам работ других авторов, так как TNFα, являясь плейотропным цитокином, играет ключевую роль в сосудистой кальцификации, секретируется в основном макрофагами в ответ на такие факторы, как окисленный ЛПНП и повреждённый внеклеточный матрикс. В различных экспериментальных работах была продемонстрирована роль TNFα, который способствует остеобластической дифференцировке гладкомышечных клеток сосудов и фибробластов за счёт активации факторов транскрипции посредством циклического АМФ. Более того, известно, что остеопротегерин, являясь растворимым рецептором суперсемейства TNF-α, способствует кальцификации артерий, усиливает экспрессию целого ряда провоспалительных цитокинов [16]. Напротив, TNF-α не обнаруживается в нормальной сосудистой интиме и липидных полосках и не превышает нормальных значений в сыворотке крови, в связи с чем мы можем предположить, что в наших группах с коронарным кальцинозом имеет место начальный этап развития атеросклероза, что и обусловливает отсутствие клинических проявлений ИБС и, соответственно, повышение TNF-α, так как значительное количество работ отражает увеличение содержания этого цитокина именно у пациентов с острым коронарным синдромом и клинически манифестированными вариантами стабильной ИБС. Клинические данные показывают, что уровень сывороточного IL-6 повышен у пациентов с коронарной кальцификацией. Цитокин способствует остеогенной сосудистой кальцификации, вызывая дифференцировку гладких миоцитов в остеобластоподобные клетки [17] путём активации лиганда NF-κB – RANKL, запускающего синтез и экспрессию интерлейкина 1β, одного из ведущих цитокинов воспалительного процесса. Наши данные согласуются с результатами крупного метаанализа, где рассматривались 29 исследований с изучением зависимости уровня IL-6 и различных исходов коронарного атеросклероза, в том числе развитие коронарного кальциноза. Такие исследования, как CIRT (Cardiovascular Inflammation Reduction Trial), MESA, CANTOS (Canakinumab Anti-Inflammatory Thrombosis Outcomes Study) показали прямую зависимость высокого уровня IL-6 и коронарного кальциноза, где в том числе рецепторы IL-6 рассматривались как терапевтическая мишень различной тяжести атеросклероза [18]. Следующим многоликим цитокином является интерлейкин 17. Популяция Th17 лимфоцитов немногочисленна в области атеросклеротической бляшки, однако IL-17 может синтезироваться макрофагами М1, тучными клетками в зоне коронарного кальциноза [19]. Немногочисленные работы показывают повышение содержания данного цитокина у пациентов не только с острым коронарным синдромом, но и выраженным кальцинозом, что сопоставимо с результатами проведённого нами исследования. Роль IL-17 в кальцификации коронарных артерий опосредована через воздействие на провоспалительные и противовоспалительные цитокины, хемокины, матриксные металлопротеиназы, молекулы адгезии, реализующееся в синтезе коллагена гладкомышечными клетками коронарных артерий, с последующим развитием фиброза как промежуточного этапа кальциноза коронарных артерий [20]. Повышенные значения IL-17 также могут быть связаны с его эффектом переключения макрофагов М1 (провоспалительный фенотип), на макрофаги М2 (противовоспалительный фенотип) увеличивая синтез цитокинов IL-4 и IL-10, уровень которых повышен в изучаемых нами группах [3]. Не менее интересным представляется анализ содержания IFNγ, значительно превышающее уровень в группах с коронарным кальцинозом по сравнению с контролем. В публикуемых работах различных авторов отмечены аналогичные результаты. Возможно, это связано с тем, что, являясь основным эффекторным цитокином Th1 лимфоцитов, IFN-γ может способствовать привлечению провоспалительных клеток (макрофагов) и ускорять развитие коронарного кальциноза, активацию и выработку антител IgG2a В-клетками к окисленным ЛПНП, которые также являются ключевыми регуляторами кальцификации атеросклеротических поражений [21]. Другими авторами отмечено свойство IFN-γ, реализуемое в увеличении транскрипции генов, повышающих синтез остеопонтина — мощного фактора сосудистой кальцификации [22].
Подводя итог анализа содержания и роли про- и противоспалительных цитокинов у пациентов с коронарным кальцинозом, мы не считаем возможным сделать однозначный вывод. Однако оценка индексов соотношения основных провоспалительных цитокинов к противоспалительным отражает поляризацию цитокинового профиля у пациентов с коронарным кальцинозом по провоспалительному пути и сохранение противовоспалительного резерва у пациентов с менее выраженным кальцинозом коронарных артерий.
Заключение
Таким образом, в нашей работе продемонстрирована комплексная оценка цитокинового профиля у пациентов с различной степенью выраженности коронарного кальциноза без клинических проявлений ИБС, показывающая преобладание провоспалительного ответа в обеих группах, с сохранностью иммунорегуляторных процессов в группе с менее выраженным коронарным кальцинозом. Полученные данные не являются однозначными ввиду плейотропности эффектов цитокинов, что требует сопоставления результатов с одномоментным анализом потенциала иммунокомпетентных клеток, ответственных за их синтез.
Список литературы
1. Небиеридзе Д.В., Никонова К.В., Сафарян А.С., Драпкина О.М. Коронарный кальций как инструмент оценки риска развития сердечно-сосудистых заболеваний. Профилактическая медицина. 2023;26(12):116‑120.
2. Nakahara T, Dweck MR, Narula N, Pisapia D, Narula J, Strauss HW. Coronary Artery Calcification: From Mechanism to Molecular Imaging. JACC Cardiovasc Imaging. 2017;10(5):582-593. https://doi.org/10.1016/j.jcmg.2017.03.005
3. Gambardella J, Wang X, Mone P, Khondkar W, Santulli G. Genetics of adrenergic signaling drives coronary artery calcification. Atherosclerosis. 2020;310:88-90. https://doi.org/10.1016/j.atherosclerosis.2020.07.025
4. Li C, Zhang W, Yang Y, Zhang Q, Li K, Chen M, et al. Prediction of SYNTAX score II improvement by adding temporal heart rate changes between discharge and first outpatient visit in patients with acute myocardial infarction. BMC Cardiovasc Disord. 2022;22(1):470. https://doi.org/10.1186/s12872-022-02929-7
5. Iside C, Affinito O, Punzo B, Salvatore M, Mirabelli P, Cavaliere C, et al. Stratification of Patients with Coronary Artery Disease by Circulating Cytokines Profile: A Pilot Study. J Clin Med. 2023;12(20):6649. https://doi.org/10.3390/jcm12206649
6. Cao J, Zu X, Liu J. The roles of immune cells in atherosclerotic calcification. Vascular. 2022;30(5):902-913. https://doi.org/10.1177/17085381211032756
7. Сафарян А.С., Выгодин В.А., Небиеридзе Д.В., Никонова К.В. Сопоставимость оценки сердечно-сосудистого риска согласно шкале SCORE и по кальциевому индексу коронарных артерий (индекс Агатстона). Кардиоваскулярная терапия и профилактика. 2023;22(9):3650.
8. Rafaqat S, Azam A, Hafeez R, Faseeh H, Tariq M, Asif M, et al. Role of interleukins in the pathogenesis of coronary heart disease: A literature review. World J Cardiol. 2025;17(3):103947. https://doi.org/10.4330/wjc.v17.i3.103947
9. Engelbertsen D, Andersson L, Ljungcrantz I, Wigren M, Hedblad B, Nilsson J, et al. T-helper 2 immunity is associated with reduced risk of myocardial infarction and stroke. Arterioscler Thromb Vasc Biol. 2013;33(3):637-644. https://doi.org/10.1161/ATVBAHA.112.300871
10. Wang C, Liu S, Yang Y, Kamronbek R, Ni S, Cheng Y, et al. Interleukin-4 and Interleukin-17 are associated with coronary artery disease. Clin Cardiol. 2024;47(2):e24188. https://doi.org/10.1002/clc.24188
11. Hofbauer LC, Schrader J, Niebergall U, Viereck V, Burchert A, Hörsch D, et al. Interleukin-4 differentially regulates osteoprotegerin expression and induces calcification in vascular smooth muscle cells. Thromb Haemost. 2006;95(4):708-714. PMID: 16601843.
12. Goldwater D, Karlamangla A, Merkin SS, Watson K, Seeman T. Interleukin-10 as a predictor of major adverse cardiovascular events in a racially and ethnically diverse population: Multi-Ethnic Study of Atherosclerosis. Ann Epidemiol. 2019;30:9-14.e1. https://doi.org/10.1016/j.annepidem.2018.08.013
13. Zhao Y, Huang Z, Gao L, Ma H, Chang R. Osteopontin/SPP1: a potential mediator between immune cells and vascular calcification. Front Immunol. 2024;15:1395596. https://doi.org/10.3389/fimmu.2024.1395596
14. An Y, Wang YT, Ma YT, Wulasihan M, Huang Y, Adi D, et al. IL-10 genetic polymorphisms were associated with valvular calcification in Han, Uygur and Kazak populations in Xinjiang, China. PLoS One. 2015;10(6):e0128965. https://doi.org/10.1371/journal.pone.0128965
15. Gauss S, Klinghammer L, Steinhoff A, Raaz-Schrauder D, Marwan M, Achenbach S, et al. Association of systemic inflammation with epicardial fat and coronary artery calcification. Inflamm Res. 2015;64(5):313-319. https://doi.org/10.1007/s00011-015-0809-x
16. Tintut Y, Patel J, Parhami F, Demer LL. Tumor necrosis factor-alpha promotes in vitro calcification of vascular cells via the cAMP pathway. Circulation. 2000;102(21):2636-2642. https://doi.org/10.1161/01.cir.102.21.2636
17. Kurozumi A, Nakano K, Yamagata K, Okada Y, Nakayamada S, Tanaka Y. IL-6 and sIL-6R induces STAT3-dependent differentiation of human VSMCs into osteoblast-like cells through JMJD2B-mediated histone demethylation of RUNX2. Bone. 2019;124:53-61. https://doi.org/10.1016/j.bone.2019.04.006
18. Mehta NN, deGoma E, Shapiro MD. IL-6 and Cardiovascular Risk: A Narrative Review. Curr Atheroscler Rep. 2024;27(1):12. https://doi.org/10.1007/s11883-024-01259-7
19. Gisterå A, Hansson GK. The immunology of atherosclerosis. Nat Rev Nephrol. 2017;13(6):368-380. https://doi.org/10.1038/nrneph.2017.51
20. Gisterå A, Robertson AK, Andersson J, Ketelhuth DF, Ovchinnikova O, Nilsson SK, et al. Transforming growth factor-β signaling in T cells promotes stabilization of atherosclerotic plaques through an interleukin-17-dependent pathway. Sci Transl Med. 2013;5(196):196ra100. https://doi.org/10.1126/scitranslmed.3006133
21. Stone SL, Peel JN, Scharer CD, Risley CA, Chisolm DA, Schultz MD, et al. T-bet Transcription Factor Promotes Antibody-Secreting Cell Differentiation by Limiting the Inflammatory Effects of IFN-γ on B Cells. Immunity. 2019;50(5):1172-1187.e7. https://doi.org/10.1016/j.immuni.2019.04.004
22. Icer MA, Gezmen-Karadag M. The multiple functions and mechanisms of osteopontin. Clin Biochem. 2018;59:17-24. https://doi.org/10.1016/j.clinbiochem.2018.07.003
Об авторах
И. Ф. ШлыкРоссия
Шлык Ирина Федоровна, д.м.н., доцент, заведующий кафедрой поликлинической и неотложной терапии
Ростов-на-Дону
И. И. Андреева
Россия
Андреева Ирина Ивановна, д.м.н., профессор кафедры клинической иммунологии и аллергологии
Ростов-на-Дону
М. Н. Моргунов
Россия
Моргунов Максим Николаевич, к.м.н., доцент кафедры ультразвуковой диагностики
Ростов-на-Дону
М. В. Харитонова
Россия
Харитонова Мария Владимировна, к.м.н., заведующая лабораторией клинической иммунологии и аллергологии
Ростов-на-Дону
Д. Ю. Беседина
Россия
Беседина Дарья Юрьевна, ассистент кафедры поликлинической терапии
Ростов-на-Дону
Дополнительные файлы
Рецензия
Для цитирования:
Шлык И.Ф., Андреева И.И., Моргунов М.Н., Харитонова М.В., Беседина Д.Ю. Цитокиновый профиль пациентов с кальцинозом коронарных артерий без ишемической болезни сердца. Южно-Российский журнал терапевтической практики. 2025;6(2):24-31. https://doi.org/10.21886/2712-8156-2025-6-2-24-31
For citation:
Shlyk I.F., Andreeva I.I., Morgunov M.N., Kharitonova M.V., Besedina D.Yu. Cytokine profile of patients with coronary artery calcification without ischemic heart disease. South Russian Journal of Therapeutic Practice. 2025;6(2):24-31. (In Russ.) https://doi.org/10.21886/2712-8156-2025-6-2-24-31
JATS XML


























