Перейти к:
Периоперационные результаты пациентов с резекцией лёгкого после имплантации коронарного стента
https://doi.org/10.21886/2712-8156-2025-6-2-6-14
Аннотация
Цель: оценить периоперационные результаты отмены антиагрегантных препаратов для пациентов, перенёсших операцию по поводу новообразования лёгкого с коронарными стентами. Материалы и методы: с января 2015 г. по июнь 2024 г. в ГБУЗ «Научно-исследовательском институте – Краевой клинической больнице №1 им. проф. С.В. Очаповского» (НИИ-ККБ№1) г. Краснодара 12 738 пациентам была выполнена реваскуляризация миокарда методом чрезкожной коронарной ангиопластики (ЧКВ). Средний возраст больных составил 64,1±12,4 года (минимально — 28 лет, максимально — 90 лет). Все пациенты были распределены на две группы: Группа С — ИБС и сопутствующий диагноз опухоли лёгкого (94 пациента); Группа D — ИБС без сопутствующего нообразования лёгкого, выбранная при помощи генератора случайных чисел в связи с многочисленностью исходной когорты (150 пациентов). Результаты: все пациенты прекратили приём антиагрегантых препаратов более чем за 5 дней до операции на лёгком, а в 67 случаях прекратили приём лекарств в течение 2 недель. В 20 случаях длительность лечения превышала 2 недели, поскольку план хирургического вмешательства был наложен на предоперационную амбулаторную бронхоскопию или пункционную биопсию, и пациенты повторно не принимали препарат. Общая частота сердечно-сосудистых осложнений внутригоспитально составила 17,02%. У 1 больного на вторые сутки после операции развилась тромбоэмболия лёгочной артерии низкого риска, у 2 пациентов развились симптомы застойной сердечной недостаточности, состояние улучшилось после лечения диуретиками и сосудорасширяющими средствами, зарегистрированы 10 случаев впервые возникшей фибрилляции предсердий, у 3 пациентов в первые 5 суток после операции отмечалась гипотония, потребовавшая присоединения инотропной поддержки. Выводы: в нашем исследовании для пациентов с новообразованиями лёгких с коронарными стентами, которым требовалось хирургическое вмешательство, было безопасно приостановить приём пероральных антитромбоцитарных препаратов перед операцией на лёгком, и в периоперационном периоде не произошло ни одного серьёзного нежелательного сердечно-сосудистого события или смерти.
Ключевые слова
Для цитирования:
Татаринцева З.Г., Барбухатти К.О., Халафян А.А., Акиньшина В.А., Космачева Е.Д., Синельникова М.Г. Периоперационные результаты пациентов с резекцией лёгкого после имплантации коронарного стента. Южно-Российский журнал терапевтической практики. 2025;6(2):6-14. https://doi.org/10.21886/2712-8156-2025-6-2-6-14
For citation:
Tatarintseva Z.G., Barbuhatti K.O., Khalafyan A.A., Akinshina V.A., Kosmacheva E.D., Sinelnikova M.G. Perioperative outcomes of lung resection patients after coronary stent implantation. South Russian Journal of Therapeutic Practice. 2025;6(2):6-14. (In Russ.) https://doi.org/10.21886/2712-8156-2025-6-2-6-14
Введение
У пациентов с раком лёгких очень часто встречается ишемическая болезнь сердца [1]. Некоторым пациентам, перенёсшим операцию, ранее были имплантированы коронарные стенты, и пациенты длительное время принимали антиагрегантные препараты. В периоперационном периоде необходимо взвесить неблагоприятные сердечно-сосудистые события после отмены препарата и риск кровотечений при продолжении приёма препарата. Исследования показали, что прекращение приёма антиагрегантных препаратов увеличивает риск тромбоза стента, но продолжение антиагрегантной терапии в периоперационном периоде увеличивает риск кровотечения [2][3]. Для пациентов, перенёсших несердечное хирургическое вмешательство после имплантации коронарного стента, стратегия периоперационной антиагрегантной терапии всё ещё остаётся неубедительной [4]. Недавние рекомендации предлагают разрабатывать индивидуальные стратегии посредством междисциплинарных консультаций, включая кардиологов, хирургов и анестезиологов, с учётом конкретных обстоятельств пациента, без каких-либо конкретных рекомендаций для торакальной хирургии или опухолей лёгких [5].
Анализ литературы показывает, что существует мало исследований по хирургии опухолей грудной клетки и лёгких в сочетании с коронарными стентами, большинство из которых представляют собой небольшие выборочные исследования [6][7]. Для этой особой группы пациентов клиническая практика нашего центра заключается в приостановке приёма пероральных антитромбоцитарных препаратов в периоперационный период. Настоящее исследование представляет собой одноцентровое ретроспективное исследование. Анализируя данные пациентов, перенёсших операцию по поводу новообразования лёгкого с коронарными стентами в нашем центре с января 2015 г. по июнь 2024 г., мы выяснили периоперационные результаты отмены антиагрегантных препаратов для этой группы лиц, что может быть полезно для будущей клинической работы и исследований.
Цель исследования — оценить периоперационные результаты отмены антиагрегантных препаратов для пациентов, перенёсших операцию по поводу новообразования лёгкого с коронарными стентами.
Материалы и методы
За анализируемый период времени 12 738 пациентам была выполнена реваскуляризация миокарда методом чрезкожной коронарной ангиопластики (ЧКВ). Средний возраст больных составил 64,1±12,4 года (минимально — 28, максимально — 90 лет).
Все пациенты были распределены на две группы: группа С — ИБС и сопутствующий диагноз опухоли лёгкого (94 пациента); группа D — ИБС без сопутствующего нообразования легкого, выбранная при помощи генератора случайных чисел в связи с многочисленностью исходной когорты (150 пациентов).
Ретроспективно проанализированы данные всех больных с новообразованием лёгких, которым были установлены коронарные стенты и которые были прооперированы в отделении торакальной хирургии ГБУЗ «Научно-исследовательском институте – Краевой клинической больнице №1 им. проф. С.В. Очаповского» (НИИ-ККБ№1) г. Краснодара (руководитель — академик РАН Порханов В.А.) с января 2015 г. по июнь 2024 г. Все пациенты нашего центра прекратили приём антиагрегантов как минимум за 5 дней до операции. Первичной конечной точкой исследования были внутригоспитальные сердечно-сосудистые осложнения и смерть. Определение основных неблагоприятных сердечно-сосудистых событий основано на предыдущих исследованиях и включает сердечную смерть, остановку сердца, инфаркт миокарда с подъёмом сегмента ST и без подъёма сегмента ST, а также тромбоз стента и проведение коронарной реваскуляризации, аортокоронарное шунтирование, стентирование и ангиопластика [8].
Статистический анализ данных был выполнен с помощью пакета прикладных программ STATISTICA 22. При описании количественных клинических показателей использовали среднее арифметическое и стандартное отклонения (М±SD); медиану (Ме) и межквартильный размах [ 25%; 75%], минимальное (мин.) и максимальное (макс.) значения. Для изучения корреляционных связей вычисляли непараметрический коэффициент корреляции Спирмена. Сравнение средних в двух независимых группах проводили при помощи критерия Манна–Уитни, при числе групп более двух применяли критерий Краскела–Уоллиса. Для оценки выживаемости использовался критерий Каплана-Мейера. За критическую величину уровня значимости (p) принимали значение менее 0,05.
Результаты
При сравнении пациентов, подвергнутых ЧКВ, с образованием в лёгком и без такового выяснилось, что в группе С чаще встречались мужчины, также пациенты из данной группы имели более отягощённый сердечно-сосудистый анамнез (ХСН, курение, ОНМК, МФА, ХБП), в лабораторных показателях обращали на себя внимание достоверно большие уровни гемоглобина, тромбоцитов, нейтрофилов и таких маркеров воспаления, как соотношение нейтрофилов к лимфоцитам и индекс системного иммунного воспаления (табл. 1).
Таблица / Table 1
Сравнительные характеристики пациентов из групп С и Д при поступлении в стационар
Comparative characteristics of patients from groups C and D upon admission to hospital
Переменная | Группа С, n=94 | Группа Д, n=150 | р |
Возраст, лет (M±SD) | 67,47±7,45 | 65,47±10,25 | 0,284 |
Мужчины, n (%) | 79 (84,04) | 120 (66,3) | 0,002* |
Женщины, n (%) | 15 (15,96) | 55 (33,7) | 0,002* |
Анамнестические данные | |||
ИМ в анамнезе, n (%) | 36 (38,30) | 49 (30,6) | 0,22 |
Хроническая сердечная недостаточность II–IV кл. по NYHA, n (%) | 87 (92,55) | 72 (48,0) | <0.001* |
АГ, n (%) | 84 (89,36) | 134 (83,7) | 0,22 |
ИКЧ ≥60 пачка/лет, n (%) | 41 (43,62) | 37 (28,4) | 0,016* |
ОНМК в анамнезе, n (%) | 19 (20,21) | 17 (10,6) | 0,04* |
Периферический атеросклероз, n (%) | 55 (58,51) | 13 (8,1) | <0,001* |
СД, n (%) | 24 (25,53) | 32 (20,0) | 0,31 |
Хроническая болезнь почек с СКФ <60 мл/мин, n (%) |
16 (17,02) | 32 (21,33) | 0,44 |
СКФ, мл/мин/1,72 м2 | 62,57±28,72 | 84,5±28,9 | <0,001* |
ИМТ, кг/м2 | 31,28±11,45 | 29,8±4,4 | 0,15 |
Данные Эхо-КГ при поступлении в стационар | |||
Левое предсердие, мм (M±SD) | 40,79±5,06 | 41,81±6,54 | 0,588 |
Конечный диастолический размер левого желудочка, мм (M±SD) | 50,61±6,01 | 52,45±7,98 | 0,062 |
Фракция выброса левого желудочка, % (M±SD) | 51,37±7,75 | 49,84±9,62 | 0,231 |
Правое предсердие, мм (M±SD) | 44,56±4,19 | 44,74±5,89 | 0,820 |
Правый желудочек, мм (M±SD) | 27,51±4,58 | 27,50±4,02 | 0,682 |
Максимальная толщина межжелудочковой перегородки, мм (M±SD) | 11,53±2,57 | 11,81±2,86 | 0,816 |
Систолическое давление в легочной артерии, мм рт. ст. (M±SD) | 21,64±15,22 | 18,23±15,32 | 0,087 |
Лабораторные данные при поступлении | |||
Мочевина, ммоль/л (M±SD) | 6,83±2,62 | 7,05±4,13 | 0,448 |
Креатинин, мкмоль/л (M±SD) | 87,91±29,18 | 97,58±53,04 | 0,184 |
Аспартатаминотрансфераза, Ед/л (M±SD) | 24,68±11,95 | 32,50±27,08 | 0,056 |
Аланинаминотрансфераза, ЕД/л (M±SD) | 25,91±18,52 | 28,73±21,03 | 0,349 |
Холестерин общий, ммоль/л (M±SD) | 4,88±1,45 | 4,74±1,27 | 0,647 |
ЛПНП, ммоль/л (M±SD) | 3,03±1,27 | 2,91±1,15 | 0,629 |
ЛПВП, ммоль/л (M±SD) | 1,09±0,33 | 1,05±0,31 | 0,330 |
Триглицериды, ммоль/л (M±SD) | 1,97±3,45 | 1,67±1,47 | 0,061 |
Билирубин, ммоль/л (M±SD) | 14,89±13,24 | 17,55±17,68 | 0,944 |
Лейкоциты, 10Е9/л | 8,87±2,62 | 10,44±4,92 | 0,110 |
Гемоглобин, г/л (M±SD) | 137,84±19,24 | 129,95±21,61 | 0,004* |
Эритроциты, 10Е12/л (M±SD) | 5,31±4,51 | 5,64±6,19 | 0,015* |
Тромбоциты, 10Е9/л (M±SD) | 257,30±84,05 | 236,63±92,94 | 0,022* |
Фибриноген, г/л (M±SD) | 5,50±1,44 | 5,61±1,83 | 0,923 |
АЧТВ, сек. (M±SD) | 34,66±8,16 | 34,14±8,44 | 0,634 |
ПТВ, сек. (M±SD) | 11,28±2,54 | 11,89±5,28 | 0,399 |
Нейтрофилы, 10Е9/л | 5,50±1,97 | 4,65±2,13 | 0,001* |
Лимфоциты, 10Е9/л | 2,26±0,80 | 2,10±59,58 | 0,72 |
Нейтрофилы/лимфоциты, Ед (M±SD) | 2,76±1,84 | 2,46±1,57 | 0,014* |
Тромбоциты/лимфоциты, Ед (M±SD) | 127,64±75,99 | 119,67±90,00 | 0,115 |
Индекс системного иммунного воспаления, Ед (M±SD) | 733,51±778,07 | 670,66±971,98 | 0,004* |
Примечание: ИМ — инфаркт миокарда; АГ — артериальная гипертензия; ИКЧ — индекс курящего человека; ОНМК — острое нарушение мозгового кровообращения; СД — сахарный диабет; СКФ — скорость клубочковой фильтрации; ИМТ — индекс массы тела; АЧТВ — активированное частичное тромбопластиновое время; ПТВ — протромбиновое время.
Пациентам из группы С выполнялась первым этапом реваскуляризация миокарда, а вторым этапом оперативное лечение с целью удаления образования в лёгком (атипичная резекция легкого или лобэктомия). В среднем после реваскуляризации миокарда до операции на легком проходило 44,35±63,42 дня. На рисунке 1 представлены временные параметры между реваскуляризацией и операцией на лёгком.
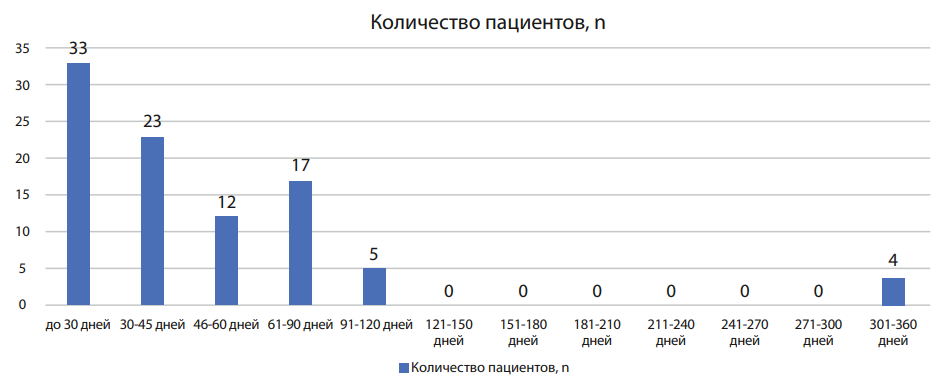
Рисунок 1. Время от момента реваскуляризации миокарда до операции на лёгком
Figure 1. Time from the moment of myocardial revascularization to lung surgery
Все пациенты прекратили приём антиагрегантых препаратов более чем за 5 дней до операции на лёгком, а 67 случаев прекратили приём лекарств в течение 2 недель. В 20 случаях длительность лечения превышала 2 недели, поскольку план хирургического вмешательства был наложен на предоперационную амбулаторную бронхоскопию или пункционную биопсию и пациенты повторно не принимали препарат. Ещё в 4 случаях наблюдалось длительное прекращение приема препарата на срок более полугода, из них в 2 случаях приём препарата прекратился из-за периодического кровохарканья, а в 2 случаях приём препарата прекратился по собственной инициативе. Низкомолекулярный гепарин (НМГ) использовался в качестве антикоагулянтного мостика для замены антитромбоцитарных препаратов перед операцией у 72 пациентов. Антиагрегантную терапию возобновляли через 72 часа после операции в зависимости от ситуации с послеоперационными дренажами. Периоперационная антитромбоцитарная терапия пациентов из группы С представлена в таблице 2.
Таблица / Table 2
Периоперационная антитромбоцитарная терапия пациентов из группы С
Perioperative antiplatelet therapy in patients from group C
Переменная | Дни | Количество пациентов, n (%) |
Время от отмены антиагрегантов до операции | 5–7 дней 8–14 дней > 14 дней | 52 (55,32) 22 (24,47) 20 (21,28) |
Пероральные антиагреганты | Аспирин Клопидогрел Тикагрелор Нет | 82 (87,23) 70 (74,47) 22 (23,40) 2 (2,13) |
Использование низкомолекулярного гепарина в качестве «моста» перед оперативным вмешательством | Да Нет | 72 (76,59) 22 (23,40) |
Общая частота сердечно-сосудистых осложнений внутригоспитально при нахождении в стационаре по поводу операции на лёгком составила 17,02%. У одного больного на вторые сутки после операции развилась тромбоэмболия лёгочной артерии низкого риска, потребовавшая назначения лечебных доз антикоагулянтных препаратов (эноксапарин из расчёта 1 мг/кг 2 раза в сутки). У двух пациентов развились симптомы застойной сердечной недостаточности и состояние улучшилось после лечения диуретиками и сосудорасширяющими средствами. После операции зарегистрированы 10 случаев впервые возникшей фибрилляции предсердий, у 3 пациентов в первые 5 суток после операции отмечалась гипотония, потребовавшая присоединения инотропной поддержки. Во всех случаях не было внутрибольничных смертей и серьёзных нежелательных сердечно-сосудистых событий (СНССС), то есть сердечной смерти, остановки сердца, инфаркта миокарда с подъёмом сегмента ST и без подъёма сегмента ST, тромбоза стента и т.д. (табл. 3).
Таблица / Table 3
Периоперационные сердечно-сосудистые осложнения у пациентов из группы С
Perioperative cardiovascular complications in patients from group C
Переменная | Данные |
Внутригоспитальная летальность | 0 |
Впервые выявленная фибрилляция предсердий, n (%) | 10 (10,64) |
Застойная сердечная недостаточность, n (%) | 2 (2,13) |
Тромбоэмболия лёгочной артерии, n (%) | 1 (1,06) |
Гипотония, n (%) | 3 (3,19) |
Обсуждение
Настоящее исследование представляет собой одноцентровое ретроспективное обсервационное исследование. Анализируя данные всех 94 пациентов, перенёсших операцию по поводу новообразования лёгкого после установки стента с января 2015 г. по июнь 2024 г., мы определили частоту сердечно-сосудистых осложнений в периоперационном периоде после отмены антиагрегантных препаратов. Результаты этого исследования показывают, что, с точки зрения гендерного распределения, в этой популяции мужчин гораздо больше, чем женщин (84,04% мужчин против 66,3% в группе ЧКВ без новообразования в лёгком, р=0,002), что соответствует данным Фернандес с соавт., которые собрали данные из базы Национального института рака [8]. В нашей группе случаев не было ни летальных исходов, ни СНССС. В случаях, включая сердечную недостаточность, впервые возникшую фибрилляцию предсердий, гипотонию, было подтверждено, что данные события не связаны с коронарной ишемией.
Исследования, связанные с ишемической болезнью сердца, показали, что злокачественные опухоли являются независимыми факторами риска тромбоза стента [9]. Прекращение приёма антитромбоцитарных препаратов также увеличивает риск тромбоза стента [2]. Чем короче время между имплантацией стента и операцией, тем выше риск СНССС, особенно тромбоза стента [10]. Zeng J и соавт. ретроспективно проанализировали 14 пациентов с нестабильной стенокардией и резектабельным раком лёгкого, которым было выполнена имплантаия стента в коронарную артерию и лобэктомия. Успешность процедуры составила 100%. Все пациенты были живы через 12 месяцев наблюдения; в периоперационном периоде у 1 пациента (7,14%) развился пневмоторакс [11]. В нашем исследовании внутригоспитальная летальность также составила 0%, однако количество осложнений в раннем послеоперационном периоде было значимо больше (17,02% в общей сложности), что может быть связано с большим набором пациентов (94 человека). Huang W с соавт. проанализировала 111 пациентов, перенёсших резекцию лёгкого по поводу рака лёгкого после коронарного стентирования. Общая частота сердечно-сосудистых осложнений составила 11,6%, включая нестабильную стенокардию (n=1, 0,9%), гипотензию (n=1, 0,9%), застойную сердечную недостаточность (n=2, 1,8%) и впервые возникшую фибрилляцию предсердий (n=10, 9,0%). Периоперационной летальности отмечено не было [8]. Данные результаты полностью совпадают с нашими данными, однако требуется ещё анализ отдалённых результатов, что является тематикой наших дальнейших изысканий.
У большинства пациентов в этом исследовании стенты были имплантированы в срок более 30 дней до операции на лёгком (64,89%), и только у 35,11% они были имплантированы в течение 1 месяца до операции. Это также может быть важной причиной того, что серьёзные события не возникло в этом исследовании.
Выводы исследований противоречивы относительно того, следует ли продолжать приём пероральных антиагрегантных препаратов в периоперационный период. Большинство исследований подтвердили, что продолжение приёма пероральных антитромбоцитарных препаратов перед операцией значительно увеличивает риск кровотечения и вероятность периоперационного переливания крови во время хирургических операций, включая резекцию лёгкого [3, 4, 11-13]. Некоторые исследования полагают, что это не увеличивает риск кровотечения [14]. Результаты исследований сильно различаются в зависимости от того, приведёт ли отмена антитромбоцитарных препаратов к увеличению частоты периоперационных СНССС, особенно в Европе, США и Азии. В исследованиях Cerfolio [12] и Atay [15] из США анализ подгрупп пациентов, перенёсших лобэктомию со стентами, показал, что частота СНССС после отмены препарата составила 36% и 8,5% соответственно. Исследования в Азии, в том числе Ю из Южной Кореи [13], Сонобе из Японии [16] и Ли Синь из Китая [17], не выявили СНССС после прекращения приёма антитромбоцитарных препаратов. Ограничением вышеуказанных исследований является небольшое количество образцов, а максимальное общее количество каждого исследования не превышает 35 случаев. Sonobe и др. [16] отметили, что, судя по базе данных по ишемической болезни сердца, частота тромбоза коронарных стентов в японской популяции намного ниже, чем в популяциях Европы и Америки. Частота использования голометалических стентов и стентов с лекарственным покрытием в пределах 30 дней составили 0,9% и 0,34% соответственно, европейское и американское население — 3,6% и 2,4% соответственно. Считается, что именно в этом причина разницы в результатах исследований между Европой, Америкой и Японией. Японским пациентам также рекомендуется приостановить приём антиагрегантных препаратов перед операцией.
Число больных раком лёгких с коронарными стентами, которым требуется хирургическое вмешательство, увеличивается с каждым годом, но данных исследований большой выборки не хватает. Мы обнаружили, что независимо от того, поддерживает ли заключение исследования отмену антитромбоцитарных препаратов, из описания методов исследования всё же можно увидеть, что в реальной клинической работе в Европе, США и Азии большинство пациентов, перенёсших торакальную хирургию, приостанавливают приём пероральных антиагрегантных препаратов перед операцией, что отражает обеспокоенность торакальных хирургов и неприятие риска периоперационного кровотечения [6, 7, 13, 15, 16]. В нашем исследовании пациентам с новообразованиями лёгких с коронарными стентами, которым требовалось хирургическое вмешательство, было безопасно приостановить приём пероральных антитромбоцитарных препаратов перед операцией, и в периоперационном периоде не произошло ни одного СНССС или смерти. В этом исследовании у 90 пациентов (95,74%) хирургические операции представляли собой долевые и более сложные резекции и только 4 (4,25%) пациентам выполнили лобэктомию. Онкоассоциированный пациент всегда имеет склонность к гиперкоагуляции и объяснить отсутствие тромбозов стентов в нашем исследовании возможно следующим: во-первых, 95,74% пациентов было прооперировано в объёме резекции лёгкого методом видео торакоскопии, что является относительно миниинвазивным методом хирургического лечения, во-вторых, у всех пациентов онкологическое заболевание было верифицировано на ранних этапах (средний размер образования в лёгком составил 29,79±23,26 мм, отсутствовали отдалённые метастазы). Ранее были опубликованы исследования, касающиеся введения НМГ в виде «моста» у пациентов с имплантированными коронарными стентами, которым перед операцией был отменён антиагрегантный препарат (клопидогрел или тикагрелор) для снижения рисков кровотечения в раннем послеоперационном периоде, но результаты противоречат нашим выводам. Например, Wang B. С соавт. продемонстрировал снижение частоты периоперационного повреждения миокарда после операции на фоне терапии «моста» НМГ. По сравнению с группой мостовой терапии в группе без мостовой терапии в данном исследовании была значительно более высокая доля пациентов, лечившихся от двухсосудистого заболевания, и более низкая доля пациентов, лечившихся от однососудистого заболевания. Этот результат может быть одной из причин более высокой частоты периоперационного повреждения миокарда в группе без мостовой терапии. Более того, мостовая терапия НМГ не увеличила риск периоперационного большого кровотечения и снизила частоту периоперационного тромбоза глубоких вен [7]. Наша группа пациентов была более однородной (все пациенты, подвергнутые ангиопластике коронарных артерий, имели однососудистое стентирование), вероятно, с этим связано отсутствие тромбозов стентов в наших наблюдениях. Хотя в некоторых наших клинических наблюдениях НМГ использовался в качестве связующего звена с антикоагулянтами, его эффективность всё ещё была недостаточной для сравнения эффектов НМГ. Невозможно было сравнить влияние различных сроков прекращения приёма антитромбоцитарных препаратов на исходы в виду малого количества наблюдаемых пациентов. В настоящее время отсутствуют регламентирующие документы, прописывающие терапию «моста» у онкологических пациентов после реваскуляризации миокарда, а также отсутствуют маркеры гемостаза, указывающие на необходимость преведения терапии «моста», что было подтверждено в нашем исследовании на уровне стандартных коагуляционных тестов, не выявивших отклонений в сравнении с группой сравнения. Есть данные об антикоагулянтной терапии у онкологических пациентов в раннем послеоперационном периоде на протяжении 10 дней для профилактики венозных тромбоэмболических осложнений, что было выполнено у пациентов из нашего наблюдения1.
В предшествующих исследованиях удалось выявить факторы риска ишемических миокардиальных событий (мостик НМГ, клиренс креатинина < 30 мл/мин., предоперационный гемоглобин < 10 г/дл, сахарный диабет и периоперационное среднее артериальное давление) и факторы риска кровотечений в раннем послеоперационном периоде (мостик НМГ, клиренс креатинина < 30 мл/мин. и предоперационное количество тромбоцитов < 70 × 109 /л) [7], чего не удалось в нашем исследовании в связи с отсутствием ишемических событий и кровотечений. Врачам следует учитывать факторы риска при принятии решения о прекращении периоперационной антиагрегантной терапии или применении переходной терапии НМГ в периоперационный период. Согласно существующим рекомендациям, периоперационное управление антитромботической терапией должно обсуждаться хирургом и кардиологом [5]. Несколько исследований показали, что риск периоперационных СНССС зависит от времени от стентирования коронарной артерии до несердечной операции. Однако оптимальное время для внесердечной операции всё ещё остается спорным, в связи с чем требуются дополнительные исследования в данном направлении.
Выводы
Это ретроспективное исследование предоставляет обновленную информацию о практических рекомендациях по периоперационному антитромботическому лечению у пациентов, которым коронарные стенты были имплантированы перед хирургическим лечением новообразования лёгкого. Наше исследование продемонстрировало безопасность приостановления приёма пероральных антитромбоцитарных препаратов перед операцией на лёгком, что не привело в периоперационном периоде к СНССС или смерти.
1. Общероссийская общественная организация «Российское общество клинической онкологии», общероссийский национальный союз «Ассоциация онкологов России». Российские клинические рекомендации по профилактике и лечению венозных тромбоэмболических осложнений у онкологических больных. 2021. 51с.
Список литературы
1. Powell B, Bolton WD. Management of Lung Cancer with Concomitant Cardiac Disease. Thorac Surg Clin. 2018;28(1):69-79. https://doi.org/10.1016/j.thorsurg.2017.08.008
2. Тарасов Р.С., Бохан Н.С., Ганюков В.И. Краткосрочная двойная антитромбоцитарная терапия после коронарного стентирования. Кардиология и сердечно-сосудистая хирургия. 2021;14(6):455‑463.
3. Premji AM, Blegen MB, Corley AM, Ulloa J, Booth MS, Begashaw M, et al. Dual antiplatelet management in the perioperative period: updated and expanded systematic review. Syst Rev. 2023;12(1):197. https://doi.org/10.1186/s13643-023-02360-9
4. Howell SJ, Hoeks SE, West RM, Wheatcroft SB, Hoeft A; OBTAIN Investigators of European Society of Anaesthesiology (ESA) Clinical Trial Network. Prospective observational cohort study of the association between antiplatelet therapy, bleeding and thrombosis in patients with coronary stents undergoing noncardiac surgery. Br J Anaesth. 2019;122(2):170-179. https://doi.org/10.1016/j.bja.2018.09.029
5. Valgimigli M, Bueno H, Byrne RA, Collet JP, Costa F, Jeppsson A, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS: The Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2018;39(3):213-260. https://doi.org/10.1093/eurheartj/ehx419
6. Халирахманов АФ, Газиев ЭА, Зинченко СВ, Абашев АР. Чрескожные коронарные вмешательства у пациентов с онкологическими заболеваниями. Поволжский онкологический вестник. 2018;9(5):56-61.
7. Wang B, Su Y, Ma C, Xu L, Mao Q, Cheng W, et al. Impact of perioperative low-molecular-weight heparin therapy on clinical events of elderly patients with prior coronary stents implanted > 12 months undergoing non-cardiac surgery: a randomized, placebo-controlled trial. BMC Med. 2024;22(1):171. https://doi.org/10.1186/s12916-024-03391-2
8. Huang W, Qi K, Chen Z, Li J. [Perioperative Outcomes of Patients Undergoing Pulmonary Resection for Lung Cancer after Coronary Stenting]. Zhongguo Fei Ai Za Zhi. 2020;23(1):36-40. (In Chinese). https://doi.org/10.3779/j.issn.1009-3419.2020.01.06
9. Hamana T, Otake H, Kuramitsu S, Shinozaki T, Ohya M, Horie K, et al. Association between cancer history and second-generation drug-eluting stent thrombosis: insights from the REAL-ST registry. Thromb J. 2023;21(1):60. https://doi.org/10.1186/s12959-023-00503-5
10. Rodriguez A, Guilera N, Mases A, Sierra P, Oliva JC, Colilles C; et al. Management of antiplatelet therapy in patients with coronary stents undergoing noncardiac surgery: association with adverse events. Br J Anaesth. 2018;120(1):67-76. Erratum in: Br J Anaesth. 2018;120(5):1143-1144. https://doi.org/10.1016/j.bja.2017.11.012
11. Zeng J, Yu J, Mei Q, Yuan Y, Zhang T, Mei L, et al. Percutaneous coronary intervention-lobectomy for Lung Cancer hybrid surgery: an initial case series. Cardiooncology. 2025;11(1):20. https://doi.org/10.1186/s40959-025-00317-6
12. Cerfolio RJ, Minnich DJ, Bryant AS. General thoracic surgery is safe in patients taking clopidogrel (Plavix). J Thorac Cardiovasc Surg. 2010;140(5):970-976. https://doi.org/10.1016/j.jtcvs.2010.07.051
13. Yu WS, Jung HS, Lee JG, Kim DJ, Chung KY, Lee CY. Safety of thoracoscopic surgery for lung cancer without interruption of anti-platelet agents. J Thorac Dis. 2015;7(11):2024-2032. https://doi.org/10.3978/j.issn.2072-1439.2015.11.40
14. Stamenovic D, Schneider T, Messerschmidt A. Aspirin for patients undergoing major lung resections: hazardous or harmless?†. Interact Cardiovasc Thorac Surg.;28(4):535-541. https://doi.org/10.1093/icvts/ivy255
15. Atay SM, Correa AM, Hofstetter WL, Mehran RJ, Rice DC, Roth JA, et al. Perioperative Outcomes of Patients Undergoing Lobectomy on Clopidogrel. Ann Thorac Surg. 2017;104(6):1821-1828. https://doi.org/10.1016/j.athoracsur.2017.05.021
16. Sonobe M, Sato T, Chen F, Fujinaga T, Shoji T, Sakai H, et al. Management of patients with coronary stents in elective thoracic surgery. Gen Thorac Cardiovasc Surg. 2011;59(7):477-482. https://doi.org/10.1007/s11748-011-0775-3
17. Xin L, Song-lei A, Xuchen M, Shaoyan Z, Xinxin M, Dong L, et al. Clinical analysis of lung resection in patients treated with antiplatelet therapy. Journal of Clinical Pulmonology. 2014;19(12):2165–2167. https://doi.org/10.3969/j.issn.1009-6663.2014.012.011
Об авторах
З. Г. ТатаринцеваРоссия
Татаринцева Зоя Геннадьевна, к.м.н., заведующая кардиологическим отделением; врач-кардиолог высшей категории, ассистент кафедры кардиохирургии и кардиологии ФПК и ППС
Краснодар
К. О. Барбухатти
Россия
Барбухатти Кирилл Олегович, д.м.н., профессор, кардиохирург, заведующий отделением кардиохирургии; заведующий кафедрой кардиохирургии и кардиологии ФПК и ППС
Краснодар
А. А. Халафян
Россия
Халафян Александр Альбертович, д.т.н., профессор кафедры прикладной математики
Краснодар
В. А. Акиньшина
Россия
Акиньшина Вера Александровна, к.п.н., доцент кафедры прикладной математики
Краснодар
Е. Д. Космачева
Россия
Космачева Елена Дмитриевна, д.м.н., профессор, заместитель главного врача по лечебной части; заведующая кафедрой терапии № 1 ФПК и ППС
Краснодар
М. Г. Синельникова
Россия
Синельникова Мария Геннадьевна, ординатор кафедры кардиохирургии и кардиологии ФПК и ППС
Краснодар
Рецензия
Для цитирования:
Татаринцева З.Г., Барбухатти К.О., Халафян А.А., Акиньшина В.А., Космачева Е.Д., Синельникова М.Г. Периоперационные результаты пациентов с резекцией лёгкого после имплантации коронарного стента. Южно-Российский журнал терапевтической практики. 2025;6(2):6-14. https://doi.org/10.21886/2712-8156-2025-6-2-6-14
For citation:
Tatarintseva Z.G., Barbuhatti K.O., Khalafyan A.A., Akinshina V.A., Kosmacheva E.D., Sinelnikova M.G. Perioperative outcomes of lung resection patients after coronary stent implantation. South Russian Journal of Therapeutic Practice. 2025;6(2):6-14. (In Russ.) https://doi.org/10.21886/2712-8156-2025-6-2-6-14
JATS XML


























