Перейти к:
Факторы, ассоциированные со снижением фракции выброса левого желудочка у пациентов с первичным инфарктом миокарда
https://doi.org/10.21886/2712-8156-2025-6-3-42-51
Аннотация
Цель: на основе данных тотального регистра острого коронарного синдрома (ОКС) по Краснодарскому краю определить факторы, ассоциированные со снижением фракции выброса левого желудочка (ФВ ЛЖ) у пациентов с первичным инфарктом миокарда (ИМ).
Материалы и методы: проведено рестроспективное исследование 5655 пациентов с первичным ИМ, включённых в тотальный регистр ОКС по Краснодарскому краю за период с 2022 г. по 2024 г. Изучена связь между показателями ФВ ЛЖ и клинико-анамнестическими и диагностическими данными пациентов. Значения ФВ ЛЖ оценивались методом Симпсона перед выпиской из стационара или ранее (в случае наступления госпитального летального исхода). В зависимости от показателя ФВ ЛЖ все пациенты были разделены на группы с низкой (≤ 40 %) ФВ ЛЖ (n = 1125), умеренно низкой (41-49 %) ФВ ЛЖ (n = 1258) и сохранённой (≥ 50 %) ФВ ЛЖ (n = 3272).
Результаты: проанализированы данные 5655 пациентов, включённых в тотальный регистр ОКС по Краснодарскому краю за период с 2022 г. по 2024 г. В качестве предикторов снижения ФВ ЛЖ у пациентов с первичным ИМ выявлены такие факторы, как наличие в анамнезе курения, хронической болезни почек, артериальной гипертензии и периферического атеросклероза, повышение тропонина, креатинина >130 мкмоль/л и глюкозы > 15 ммоль/л при поступлении, по данным лабораторных исследований крови, элевация сегмента ST и формирование патологического зубца Q на электрокардиограмме (ЭКГ), а также острая сердечная недостаточность (ОСН) II–IV класса по Killip и наличие ранних осложнений ИМ.
Заключение: наличие курения, хронической болезни почек, артериальной гипертензии и периферического атеросклероза в анамнезе, повышение тропонина, креатинина > 130 мкмоль/л и глюкозы > 15 ммоль/л, элевация сегмента ST, формирование патологического зубца Q, явления ОСН II–IV класса по Killip и возникновение ранних осложнений ассоциированы со снижением ФВ ЛЖ у пациентов с ИМ.
Ключевые слова
Для цитирования:
Карибова М.В., Кручинова С.В., Космачева Е.Д. Факторы, ассоциированные со снижением фракции выброса левого желудочка у пациентов с первичным инфарктом миокарда. Южно-Российский журнал терапевтической практики. 2025;6(3):42-51. https://doi.org/10.21886/2712-8156-2025-6-3-42-51
For citation:
Karibova M.V., Kruchinova S.V., Kosmacheva E.D. Factors associated with reduced left ventricular ejection fraction in patients with primary myocardial infarction. South Russian Journal of Therapeutic Practice. 2025;6(3):42-51. (In Russ.) https://doi.org/10.21886/2712-8156-2025-6-3-42-51
Введение
Сердечная недостаточность (СН) является важной медицинской и социально-экономической проблемой. В мире зарегистрировано более 64 миллионов случаев СН [1][2], и её распространенность продолжает расти. Такая тенденция обусловлена прежде всего достижениями практической кардиологии в области диагностики и лечения острого ИМ (ОИМ) [3][4], что способствует улучшению выживаемости, увеличению продолжительности жизни и росту числа пациентов с ХСН [2][5–8]. Так, СН развивается у 13% больных через 30 дней после выписки из стационара по поводу ИМ, достигая 20–30% в течение 1 года [9][10]. Несмотря на то, что применение ранней реперфузионной стратегии при ОИМ способствует ограничению зоны инфаркта [5][6], у ряда пациентов развивается систолическая дисфункция ЛЖ. Как известно, низкая ФВ ЛЖ связана с повышенным риском возникновения СН, ассоциированной с высокой летальностью и повторными госпитализациями [11–13]. Развитие СН у пациентов с перенесённым ИМ коррелирует с двухкратным увеличением риска смерти [12]. Кроме того, около 16–24% пациентов с ИМ в анамнезе повторно госпитализируются в течение 3–4 лет наблюдения после индексной госпитализации [9][14].
Данные регистрового исследования СН по Краснодарскому краю [15] показывают, что ишемическая болезнь сердца (ИБС), в том числе перенесённый ИМ (ПИМ), является ведущей причиной тяжёлой СН, требующей госпитализации по поводу декомпенсации. По данным регистра, выявлены значительная часть пациентов с ФВ ≤40% (51,7%), высокая доля госпитальных летальных исходов (82,4%) и годовая смертность (53,8%) пациентов со сниженной ФВ ЛЖ среди умерших по причине СН, что диктует необходимость изучения ранних предикторов снижения ФВ ЛЖ и, как следствие, развития СН после ПИМ. Выявление факторов, способствующих снижению ФВ ЛЖ, позволит определить больных с ИМ и высоким риском развития систолической дисфункции ЛЖ как основной причины тяжёлой СН в Краснодарском крае.
Материалы и методы
Проводимое исследование основано на ретроспективном анализе первичных данных тотального регистра ОКС по Краснодарскому краю, полученных в ходе реальной клинической практики за период с 2022 г. по 2024 г. Качество получаемых в ходе исследования данных обеспечивается посредством проверки отсутствующих или потенциально ошибочных данных, а также выходящих за пределы референсных значений. После исключения пациентов с нестабильной стенокардией и повторным ИМ в итоговый анализ вошли 5655 пациентов с первичным ИМ. ФВ ЛЖ оценивали методом Симпсона перед выпиской из стационара или ранее в случае наступления госпитального летального исхода. В зависимости от показателя ФВ ЛЖ все пациенты были разделены на группы с низкой (≤40%) ФВ ЛЖ (n=1125), умеренно низкой (41–49%) ФВ ЛЖ (n=1258) и сохранённой (≥50%) ФВ ЛЖ (n=3272). На основании данных регистра изучены половозрастные характеристики, клинико-диагностические и анамнестические данные, применяемые схемы лечения на догоспитальном и госпитальном этапах, особенности коронарного поражения и реваскуляризации миокарда, текущие осложнения ИМ и их связь с показателями ФВ ЛЖ.
Проведение исследования выполнено в соответствии с правилами клинической практики в Российской Федерации и этическими нормами, изложенными в Хельсинской декларации.
Статистическая обработка данных проводилась с использованием пакета программного обеспечения STATISTICA (Tibco, USA), версия 13. Проверка гипотезы о соответствии нормальному распределению осуществлялась с помощью критерия Хи-квадрат Пирсона. Ввиду того, что было установлено несоответствие распределения количественных показателей нормальному закону, помимо среднего арифметического и стандартного отклонений, показатели описывались медианой, нижней и верхней квартилью, минимальным и максимальным значением. Качественные показатели представляли как число и частоту. Различия считались статистически значимыми при p <0,05.
Результаты
По данным тотального регистра ОКС по Краснодарскому краю установлено, что чаще всего в региональные сосудистые центры с первичным ИМ были госпитализированы мужчины (68,9%) в возрасте <75 лет (81,9%). Статистический анализ показал отсутствие значимой связи между гендерными особенностями и значением ФВ ЛЖ (p>0,05) (рис. 1). В сравниваемых возрастных группах нФВ чаще выявлялась среди пациентов ≥75 лет, однако эта связь не достигла статистической значимости (рис. 2).
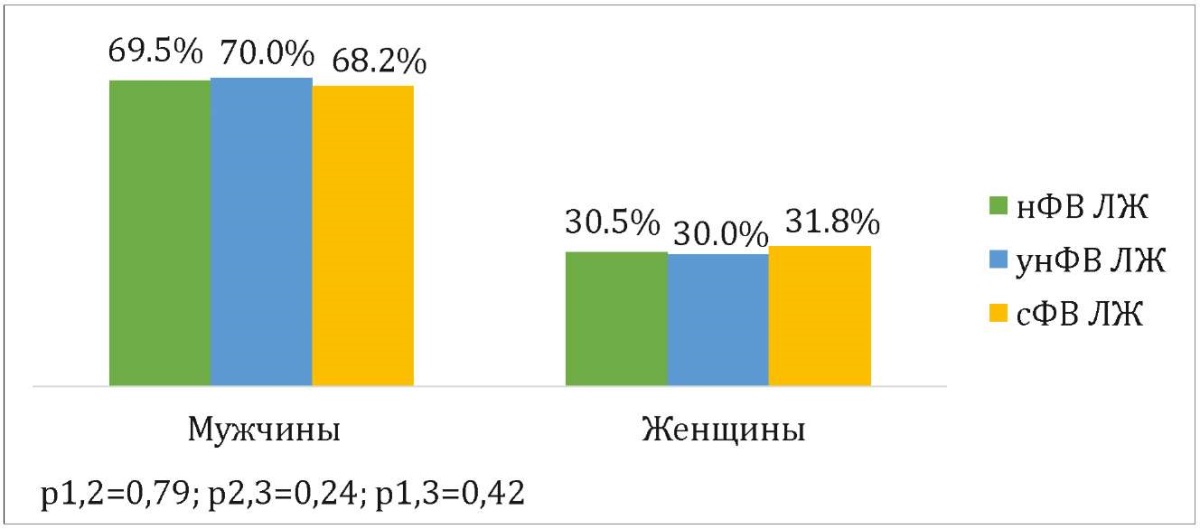
Рисунок 1. Сравнение гендерных характеристик пациентов между исследуемыми группами
Figure 1. Comparison of gender characteristics of patients between the study groups
Примечание: 1 — нФВ ЛЖ, 2 — унФВ ЛЖ, 3 — сФВ ЛЖ; нФВ ЛЖ — сниженная фракция выброса левого желудочка, унФВ ЛЖ — умеренно сниженная фракция выброса левого желудочка, сФВ ЛЖ — сохраненная фракция выброса левого желудочка.
Note: 1 — rEF, 2 — mrEF, 3 — pEF; rEF — reduced ejection fraction, mrEF — mildly reduced ejection fraction, pEF — preserved reduced ejection fraction.
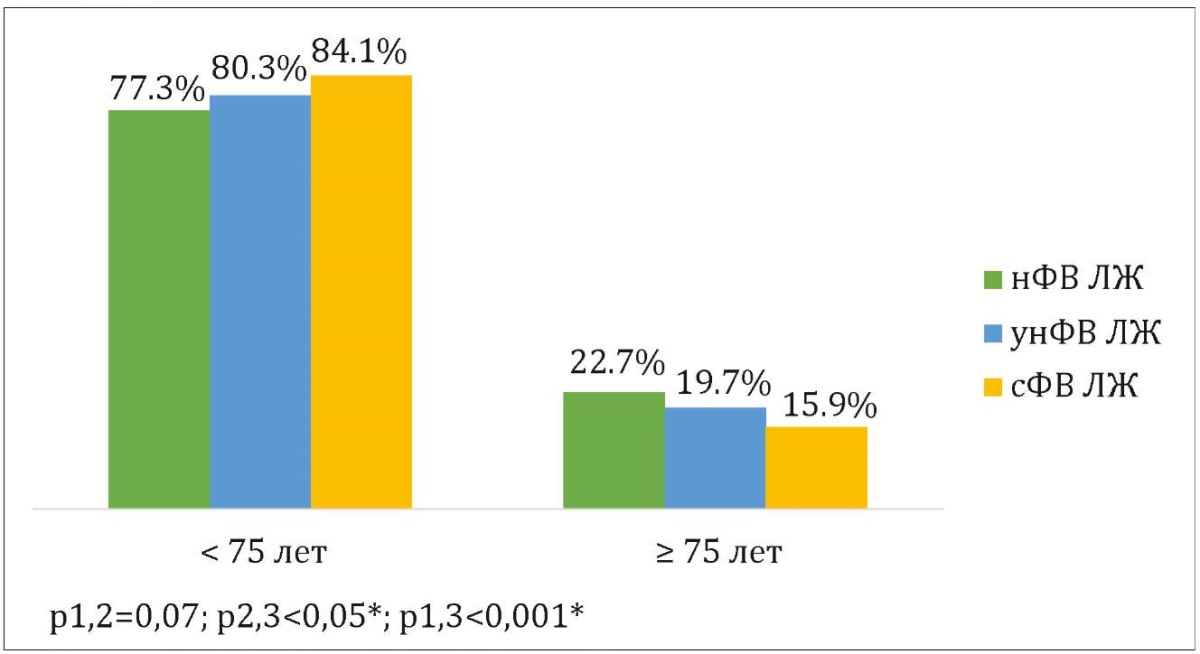
Рисунок 2. Сравнение возрастных характеристик пациентов между исследуемыми группами
Figure 2. Comparison age characteristics of patients between the study groups
Примечание: 1 — нФВ ЛЖ, 2 — унФВ ЛЖ, 3 — сФВ ЛЖ; * — статистически значимая связь; нФВ ЛЖ — сниженная фракция выброса левого желудочка, унФВ ЛЖ — умеренно сниженная фракция выброса левого желудочка, сФВ ЛЖ — сохраненная фракция выброса левого желудочка.
Note: 1 — rEF, 2 — mrEF, 3 — pEF; * — a statistically significant relationship; rEF — reduced ejection fraction, mrEF — mildly reduced ejection fraction, pEF — preserved reduced ejection fraction.
Между пациентами в исследуемых группах выявлены различия по таким факторам, как наличие в анамнезе периферического атеросклероза (ПА), хронической болезни почек (ХБП), артериальной гипертензии (АГ), ИБС и курения (табл. 1). При этом статистически значимая связь с нФВ выявлена при наличии ПА, ХБП, АГ и курения (р<0,05). Напротив, ИБС в прошлом преобладает среди пациентов с сФВ (58,3%, р<0,001) и не коррелирует со снижением ФВ ЛЖ. Пациенты в группе нФВ чаще имели СН в анамнезе, однако этот фактор достоверно не ассоциирован с ФВ ≤40% (р=0,11). Тем не менее, выявлена существенная корреляция между наличием в анамнезе СН и развитием систолической дисфункции (р=0,01). Также связано с ФВ ЛЖ <50% наличие сахарного диабета (СД) (р<0,001).
Таблица / Table 1
Анамнестические данные пациентов в исследуемых группах
Anamnestic data of patients in the study groups
нФВ (n=1125) | унФВ (n=1258) | сФВ (n=3272) | р1,2 | р2,3 | р1,3 | |
Аортокоронарное шунтирование | 43 (3,8%) | 40 (3,2%) | 111 (3,4%) | 0,43 | 0,74 | 0,53 |
Чрескожное коронарное вмешательство | 147 (13,1%) | 192 (15,3%) | 558 (17,1%) | <0,001 | 0,14 | <0,05 |
Нарушение мозгового кровообращения | 60 (5,3%) | 60 (4,8%) | 134 (4,1%) | 0,57 | 0,29 | 0,09 |
Периферический атеросклероз* | 314 (27,9%) | 273 (21,7%) | 531 (16,2%) | <0,001 | <0,001 | <0,001 |
Ишемическая болезнь сердца* | 427 (38,0%) | 626 (49,8%) | 1906 (58,3%) | <0,001 | <0,001 | <0,001 |
Хроническая болезнь почек* | 233 (20,7%) | 193 (15,3%) | 313 (9,6%) | <0,001 | <0,001 | <0,001 |
Хроническая сердечная недостаточность | 314 (27,9%) | 315 (25,0%) | 704 (21,5%) | 0,11 | 0,01 | <0,001 |
Хронические заболевания легких | 23 (2,0%) | 10 (0,8%) | 23 (0,7%) | 0,01 | 0,72 | <0,001 |
Артериальная гипертензия* | 1052 (93,5%) | 1145 (91,0%) | 2908 (88,9%) | 0,02 | 0,04 | <0,001 |
Дислипидемия | 612 (54,4%) | 739 (58,7%) | 1819 (55,6%) | 0,03 | 0,06 | 0,48 |
Сахарный диабет | 223 (19,8%) | 229 (18,2%) | 397 (12,1%) | 0,32 | <0,001 | <0,001 |
Курение* | 383 (34,0%) | 374 (29,7%) | 873 (26,7%) | 0,02 | 0,04 | <0,001 |
Примечание: * — статистически значимая разница между всеми группами сравнения.
Note: * — statistically significant difference between all comparison groups.
У пациентов с нФВ на ЭКГ при поступлении чаще регистрировались нарушения ритма сердца в виде фибрилляции или трепетания предсердий (ФП/ТП) (5,2%, р<0,05), в то время как в группах с унФВ и сФВ пациенты чаще имели синусовый ритм. При сравнительном анализе локализации ишемических изменений на ЭКГ была установлена корреляционная связь между снижением ФВ ЛЖ <50% и ИМ передней и нижней локализации (р<0,05). Следует отметить, что пациенты с ИМ нижней стенки ЛЖ значимо чаще встречались в группе унФВ по сравнению с нФВ (р=0,03), что указывает на менее выраженную систолическую дисфункцию при данной локализации ИМ. При отсутствии ишемических изменений на ЭКГ пациенты чаще имели сФВ (р<0,001). Большинство пациентов с нФВ имело Q-позитивный ИМ (72,7%, р<0,001), при поступлении у них чаще регистрировалась элевация сегмента ST на ЭКГ (49,3%, р<0,001) и отмечались явления ОСН II–IV класса по классификации Killip (40,1%, р<0,001).
Различий в характере поражения коронарного русла, ассоциированных со снижением ФВ ≤ 40%, между исследуемыми группами получено не было (p>0,05). Однако исследование показало, что систолическая дисфункция ЛЖ связана с многососудистым поражением коронарных артерий, в то время как ИМ без обструктивного поражения коронарных артерий чаще встречался у пациентов с сФВ (р<0,001). Реваскуляризация миокарда была выполнена 4717 пациентам (83,4%). При наличии обструктивного поражения коронарных артерий различий по частоте реваскуляризации между сравниваемыми группами не было зарегистрировано (p>0,05). В то же время тромболитическая терапия чаще проводилась пациентам с нФВ (16,4%, р<0,001), что обусловлено более частым выявлением элевации сегмента ST на ЭКГ среди них. Такие осложнения, как острая митральная регургитация, рецидивирующий ИМ и устраненная остановка кровообращения, чаще отмечались в группе нФВ (табл. 2).
Таблица / Table 2
Данные инструментальных методов обследования и особенности течения инфаркта миокарда
Data from instrumental examination methods and features of myocardial infarction
нФВ (n=1125) | унФВ (n=1258) | сФВ (n=3272) | р1,2 | р2,3 | р1,3 | |
Признаки сердечной недостаточности | ||||||
ОСН II–IV по Killip* | 451 (40,1%) | 104 (8,3%) | 110 (3,4%) | <0,001 | <0,001 | <0,001 |
Локализация изменений на ЭКГ | ||||||
Передняя | 506 (45,0%) | 576 (45,8%) | 1091 (33,3%) | 0,69 | <0,001 | <0,001 |
Боковая | 99 (8,8%) | 84 (6,7%) | 288 (8,8%) | 0,05 | 0,02 | 1 |
Нижняя* | 346 (30,8%) | 441 (35,1%) | 885 (27,1%) | 0,03 | <0,001 | 0,02 |
Другая (неуточненная)* | 174 (15,5%) | 157 (12,5%) | 1008 (30,8%) | 0,03 | <0,001 | <0,001 |
Изменения на ЭКГ | ||||||
Элевация сегмента ST* | 555 (49,3%) | 500 (39,8%) | 585 (17,9%) | <0,001 | <0,001 | <0,001 |
Q–позитивный ИМ* | 818 (72,7%) | 830 (66,0%) | 1651 (50,5%) | <0,001 | <0,001 | <0,001 |
Синусовый ритм | 1044 (92,8%) | 1205 (95,8%) | 3138 (95,9%) | <0,05 | 0,88 | <0,001 |
Фибрилляция предсердий | 59 (5,2%) | 35 (2,8%) | 86 (2,6%) | <0,05 | 0,71 | <0,001 |
Число поражённых сосудов | ||||||
Ни одного | 93 (8,3%) | 104 (8,3%) | 641 (19,6%) | 1 | <0,001 | <0,001 |
Один | 560 (49,8%) | 637 (50,6%) | 1651 (50,5%) | 0,69 | 0,95 | 0,69 |
Многососудистое поражение | 472 (42,0%) | 517 (41,1%) | 980 (30,0%) | 0,66 | <0,001 | <0,001 |
Реперфузионная стратегия | ||||||
Реваскуляризация | 1015 (90,2%) | 1126 (89,5%) | 2576 (78,7%) | 0,57 | <0,001 | <0,001 |
ТЛТ* | 185 (16,4%) | 99 (7,9%) | 122 (3,7%) | <0,001 | <0,001 | <0,001 |
Осложнения | ||||||
Реинфаркт* | 280 (24,9%) | 94 (7,5%) | 2 (0,1%) | <0,001 | <0,001 | <0,001 |
Устраненная остановка кровообращения | 3 (0,3%) | 0 (0,0%) | 1 (0,0%) | 0,05 | 1 | 0,05 |
Митральная регургитация* | 45 (4,0%) | 24 (1,9%) | 30 (0,9%) | <0,05 | <0,05 | <0,001 |
Примечание: * — статистически значимая разница между всеми группами сравнения; ИМ — инфаркт миокарда, ОСН — острая сердечная недостаточность, ТЛТ — тромболитическая терапия.
Note: * — statistically significant difference between all comparison groups; MI — myocardial infarction, AHF — acute heart failure, TLT — thrombolytic therapy.
В ходе анализа лабораторных показателей при поступлении установлена корреляция между снижением ФВ ЛЖ и повышением креатинина >130 мкмоль/л, а также глюкозы >15 ммоль/л (р<0,05). Кроме того, выявлено превалирующее повышение уровня тропонина в группе нФВ, в то время как нормальные показатели тропонина и МВ фракции креатинфосфокиназы наблюдались чаще в группе сФВ (р<0,05) (табл. 3).
Таблица / Table 3
Лабораторные показатели при поступлении
Laboratory parameters at admission
нФВ (n=1125) | унФВ (n=1258) | сФВ (n=3272) | р1,2 | р2,3 | р1,3 | |
Креатинин >130 мкмоль/л* | 151 (13,4%) | 117 (9,3%) | 228 (7,0%) | <0,001 | <0,001 | <0,001 |
Глюкоза >15 ммоль/л* | 73 (6,5%) | 58 (4,6%) | 79 (2,4%) | 0,04 | <0,001 | <0,001 |
Тромбоциты <200 10Е9/л | 324 (28,8%) | 433 (34,4%) | 1120 (34,2%) | <0,05 | 0,9 | <0,001 |
Гемоглобин <100 г/л | 27 (2,4%) | 41 (3,3%) | 64 (2,0%) | 0,19 | <0,05 | 0,42 |
Кардиоспецифические ферменты | ||||||
КФК-МВ и тропонин не повышены* | 320 (28,4%) | 424 (33,7%) | 1856 (56,7%) | <0,05 | <0,001 | <0,001 |
КФК-МВ и тропонин повышены | 621 (55,2%) | 657 (52,2%) | 965 (29,5%) | 0,14 | <0,001 | <0,001 |
КФК-МВ повышен/тропонин не повышен | 67 (6,0%) | 85 (6,8%) | 269 (8,2%) | 0,43 | 0,12 | 0,02 |
КФК-МВ не повышен/тропонин повышен* | 117 (10,4%) | 92 (7,3%) | 182 (5,6%) | <0,05 | 0,03 | <0,001 |
Примечание: * — статистически значимая разница между всеми группами сравнения; КФК-МВ — МВ фракция креатинфосфокиназы.
Note: * — statistically significant difference between all comparison groups; MB fraction of creatinephosphokinase.
При анализе проводимой терапии на догоспитальном этапе не выявлено различий в частоте применения ингибиторов ангиотензинпревращающего фермента (иАПФ) / блокаторов рецепторов ангиотензина, ацетилсалициловой кислоты, б-адреноблокаторов (ББ), блокаторов кальциевых каналов и антикоагулянтов (р>0,05). В течение госпитализации пациенты с нФВ чаще получали антагонисты минералокортикоидных рецепторов (АМКР), диуретическую и инотропную терапию (р<0,001), что обусловлено преобладанием явлений ОСН в этой группе (табл. 3).
Таблица / Table 5
Медикаментозная терапия
Drug therapy
нФВ (n=1125) | унФВ (n=1258) | сФВ (n=3272) | р1,2 | р2,3 | р1,3 | |
Предшествующая терапия | ||||||
АСК | 445 (39,6%) | 501 (39,8%) | 1381 (42,2%) | 0,92 | 0,14 | 0,11 |
иРААС | 565 (50,2%) | 558 (44,4%) | 1711 (52,3%) | <0,05 | <0,001 | 0,22 |
ББ | 402 (35,7%) | 438 (34,8%) | 1250 (38,2%) | 0,65 | 0,03 | 0,14 |
БКК | 89 (7,9%) | 73 (5,8%) | 259 (7,9%) | 0,04 | 0,02 | 1 |
Антикоагулянты | 23 (2,0%) | 30 (2,4%) | 81 (2,5%) | 0,51 | 0,85 | 0,32 |
Терапия в период госпитализации | ||||||
Диуретики* | 705 (62,7%) | 567 (45,1%) | 1238 (37,8%) | <0,001 | 0,02 | <0,001 |
Инотропные агенты* | 62 (5,5%) | 21 (1,7%) | 29 (0,9%) | <0,001 | 0,02 | <0,001 |
Нитраты | 371 (33,0%) | 380 (30,2%) | 839 (25,6%) | 0,1 | <0,05 | <0,001 |
АМКР* | 542 (48,2%) | 478 (38,0%) | 528 (16,1%) | <0,001 | <0,001 | <0,001 |
Ингибитор P2Y12 | 1100 (97,8%) | 1228 (97,6%) | 3097 (94,7%) | 0,75 | <0,001 | <0,001 |
Антикоагулянты | 725 (64,4%) | 858 (68,2%) | 2253 (68,9%) | 0,05 | 0,65 | <0,05 |
Блокаторы IIb/IIIa рецепторов | 20 (1,8%) | 41 (3,3%) | 52 (1,6%) | 0,02 | <0,05 | 0,65 |
ББ | 1035 (92,0%) | 1162 (92,4%) | 2990 (91,4%) | 0,72 | 0,28 | 0,53 |
иРААС | 994 (88,4%) | 1135 (90,2%) | 3013 (92,1%) | 0,16 | 0,04 | <0,05 |
БКК | 94 (8,4%) | 125 (9,9%) | 336 (10,3%) | 0,21 | 0,69 | 0,06 |
Примечание: * — статистически значимая разница между всеми группами сравнения; АМКР — антагонисты минералокортикоидных рецепторов, АСК — ацетилсалициловая кислота, ББ — бета-адреноблокаторы, БКК — блокаторы кальциевых каналов, иРААС — ингибиторы ренин-ангиотензин-альдостероновой системы.
Note: * — statistically significant difference between all comparison groups; AMCR — mineralocorticoid receptor antagonists, ASA — acetylsalicylic acid, BB — beta-blockers, CCB — calcium channel blockers, RAAS — inhibitors of the renin-angiotensin-aldosterone system.
Таким образом, на снижение ФВ ЛЖ у пациентов с ИМ оказывают влияние различные факторы. К ним относятся наличие в анамнезе ПА, ХБП, АГ и курения. Повышенный уровень тропонина, элевация сегмента ST, ФП/ТП на ЭКГ при поступлении и формирование патологического зубца Q способствуют снижению ФВ ЛЖ. Также ассоциировано со снижением ФВ ЛЖ повышение креатинина >130 мкмоль/л и глюкозы >15 ммоль/л. Важную роль играет и тяжесть инфаркта, соответствующая ОСН II—IV класса по классификации Killip, а также возникновение осложнений в виде рецидивирующего ИМ, острой митральной регургитации и устраненной остановки кровообращения.
Обсуждение
ИБС является ведущей причиной СН, которая часто возникает в результате осложнений, связанных с ОИМ, что ассоциировано с неблагоприятным прогнозом [16][17]. У 30–40% пациентов, перенёсших ИМ, наблюдается снижение ФВ ЛЖ, что сопряжено с повышенным риском летального исхода, достигающего 20–30% [18].
По данным тотального регистра ОКС по Краснодарскому краю, большинство пациентов с первичным ИМ на момент выписки из стационара имели ФВ ЛЖ ≥50% (57,9%). Тем не менее, несмотря на достигнутый за последние десятилетия существенный прогресс в лечении пациентов с ИМ, распространённость систолической дисфункции ЛЖ после ИМ остается высокой. В данном исследовании 42,1% пациентов при выписке имело ФВ ЛЖ <50%: 19,9% — нФВ ЛЖ, 22,2% — унФВ ЛЖ. Полученные данные сопоставимы с таковыми в исследовании Wohlfahrt P et al., где частота систолической дисфункции среди пациентов с ИМ при выписке составила 52,9% [19].
В ходе исследования установлено, что наличие ИБС в прошлом не коррелирует со снижением ФВ ЛЖ и превалирует в группе сФВ (58,3%). Это наблюдение согласуется с результатами исследования Hung et al., где пациенты с анамнезом ИБС имели меньший риск развития СН [9]. Такая тенденция может быть обусловлена тем, что они с большей вероятностью принимали ББ до наступления ОИМ. Напротив, наличие в анамнезе ПА, ХБП, АГ и курения ассоциируется со снижением ФВ ЛЖ. Кроме того, повышение тропонина, креатинина >130 мкмоль/л и глюкозы >15 ммоль/л, элевация сегмента ST и формирование патологического зубца Q, а также явления ОСН II–IV класса по Killip и наличие ранних осложнений ИМ достоверно снижают ФВ ЛЖ. Хотя наше исследование не обнаружило различий в локализации ИМ между всеми исследуемыми группами, установлена корреляционная связь между развитием систолической дисфункции ЛЖ и передней и нижней локализацией ИМ (р<0,05), при этом нижняя локализация ИМ ассоциируется с менее выраженной систолической дисфункцией. По данным нашего анализа, ФП при поступлении регистрируется чаще в группе нФВ (5,2%, р<0,05), но не различается между группами унФВ и сФВ (р=0,71). Также установлено, что наличие СД связано с ФВ ЛЖ <50% (р<0,001), при этом не выявлено существенных различий между группами нФВ и унФВ (р=0,32). Полученные данные демонстрируют сходство с результатами анализа, проведённого Wohlfahrt P et al. Авторы выявили тенденцию к снижению ФВ ЛЖ среди пациентов, которые имели ИМ с подъёмом сегмента ST (ИМпST) передней локализации, ФП, ХБП, гипергликемию и более высоки уровни тропонина, а также класс ОСН по Killip > I и устранённую остановку кровообращения [19]. В исследовании Hung et al. было установлено, что АГ, СД, ФП, ХБП, а также заболевания периферических сосудов являются значимыми предикторами развития СН после ИМ [9]. В другом исследовании Gho et al. показано, что СД в анамнезе, ФП, заболевание ПА, ИМпST при поступлении и курение являются независимыми прогностическими факторами развития СН после ИМ [14].
Наличие ассоциированных со снижением ФВ ЛЖ клинических состояний подчёркивает важность модификации образа жизни и коррегируемых факторов риска с целью достижения своевременного и полного контроля над данными заболеваниями, минимизации риска развития ИМ, систолической дисфункции ЛЖ и СН. Современная медицина располагает широким спектром методов для модификации факторов риска развития СН у пациентов с ИМ. Раннее восстановление адекватного кровотока в инфаркт-связанной коронарной артерии позволяет ограничить размер зоны инфаркта, сохранить систолическую функцию ЛЖ, минимизировать патологическое ремоделирования ЛЖ и снизить риск развития осложнений. Успех в лечении ИМ можно обеспечить, строго следуя клиническим рекомендациям по реперфузионной и антитромботической терапии, а также применением оптимальных доз препаратов, таких как иАПФ, ББ, АМКР и статины. В последнее время активно изучается использование ингибиторов глюкозо-натриевого котранспортера 2 типа (иГНКТ-2) и валсартана/сакубитрила у пациентов с ИМ с точки зрения их эффективности и безопасности [20–22], где применение иГНКТ-2 демонстрирует положительные эффекты [20][21]. В связи с этим поиск факторов, предрасполагающих к снижению ФВ ЛЖ у пациентов после ИМ, остаётся актуальным направлением исследований. Выявление таких факторов позволит определить пациентов, которым раннее добавление к терапии иГНКТ-2 принесёт наибольшую пользу.
Ограничения исследования
Данное исследование имеет несколько ограничений. Ретроспективный характер исследования и отсутствие сведений об исходных значениях ФВ ЛЖ в первые сутки госпитализации не позволяют оценить динамику ФВ ЛЖ и выделить группу пациентов с улучшенной ФВ ЛЖ. В связи с различной продолжительностью стационарного лечения больных с ОИМ, данные о значении ФВ ЛЖ не всегда однородны. Это связано с тем, что регистр фиксирует показатели ФВ ЛЖ, полученные при выписке, а в случае смерти пациента — в более ранний срок, независимо от дня госпитализации. Кроме того, у пациентов с ХСН в анамнезе ФВ ЛЖ была неизвестна и условно учитывалась >50%.
Перспективы дальнейших исследований
Перспективами нашего исследования являются оценка ФВ ЛЖ в динамике через 1 год после ИМ и выявление предикторов снижения ФВ ЛЖ в отдаленной перспективе, оценка частоты развития СН и их связь с выявленными факторами, а также выделение группы пациентов с улучшенной ФВ ЛЖ.
Заключение
Предикторами снижения ФВ ЛЖ у пациентов с первичным ИМ являются наличие в анамнезе курения, хронической болезни почек, артериальной гипертензии и периферического атеросклероза, повышение тропонина, креатинина >130 мкмоль/л и глюкозы >15 ммоль/л, элевация сегмента ST и формирование патологического зубца Q, а также явления ОСН II–IV класса по Killip и наличие ранних осложнений ИМ.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Smeets M, Vaes B, Mamouris P, Van Den Akker M, Van Pottelbergh G, Goderis G, et al. Burden of heart failure in Flemish general practices: a registry-based study in the Intego database. BMJ Open. 2019;9(1):e022972. DOI: 10.1136/bmjopen-2018-022972
2. GBD 2017 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2018;392(10159):1789-1858. Erratum in: Lancet. 2019;393(10190):e44. DOI: 10.1016/S0140-6736(18)32279-7.
3. Roth GA, Forouzanfar MH, Moran AE, Barber R, Nguyen G, Feigin VL, et al. Demographic and epidemiologic drivers of global cardiovascular mortality. N Engl J Med. 2015;372(14):1333-1341. DOI: 10.1056/NEJMoa1406656
4. Dunlay S.M., Roger V.L. Understanding the epidemic of heart failure: past, present, and future. Curr. Heart Fail. Rep. 2014;11(4):404-415. DOI: 10.1007/s11897-014-0220-x.
5. Fox KA, Steg PG, Eagle KA, Goodman SG, Anderson FA Jr, Granger CB, et al. Decline in rates of death and heart failure in acute coronary syndromes, 1999-2006. JAMA. 2007;297(17):1892-1900. DOI: 10.1001/jama.297.17.1892
6. Dégano IR, Salomaa V, Veronesi G, Ferriéres J, Kirchberger I, Laks T, et al. Twenty-five-year trends in myocardial infarction attack and mortality rates, and case-fatality, in six European populations. Heart. 2015;101(17):1413-1421. Erratum in: Heart. 2018;104(16):e2. DOI: 10.1136/heartjnl-2014-307310
7. Bragazzi NL, Zhong W, Shu J, Abu Much A, Lotan D, Grupper A, Younis A, Dai H. Burden of heart failure and underlying causes in 195 countries and territories from 1990 to 2017. Eur J Prev Cardiol. 2021;28(15):1682-1690. DOI: 10.1093/eurjpc/zwaa147
8. Поляков Д.С., Фомин И.В., Беленков Ю.Н., Мареев В.Ю., Агеев Ф.Т., Артемьева Е.Г., и др. Хроническая сердечная недостаточность в Российской Федерации: что изменилось за 20 лет наблюдения? Результаты исследования ЭПОХА-ХСН. Кардиология. 2021;61(4):4-14. DOI: 10.18087/cardio.2021.4.n1628
9. Hung J, Teng TH, Finn J, Knuiman M, Briffa T, Stewart S, et al. Trends from 1996 to 2007 in incidence and mortality outcomes of heart failure after acute myocardial infarction: a population-based study of 20,812 patients with first acute myocardial infarction in Western Australia. J Am Heart Assoc. 2013;2(5):e000172. DOI: 10.1161/JAHA.113.000172
10. Sulo G, Igland J, Vollset SE, Nygård O, Ebbing M, Sulo E, et al. Heart Failure Complicating Acute Myocardial Infarction; Burden and Timing of Occurrence: A Nation-wide Analysis Including 86 771 Patients From the Cardiovascular Disease in Norway (CVDNOR) Project. J Am Heart Assoc. 2016;5(1):e002667. DOI: 10.1161/JAHA.115.002667
11. Ambrosy AP, Fonarow GC, Butler J, Chioncel O, Greene SJ, Vaduganathan M, et al. The global health and economic burden of hospitalizations for heart failure: lessons learned from hospitalized heart failure registries. J Am Coll Cardiol. 2014;63(12):1123-1133. DOI: 10.1016/j.jacc.2013.11.053
12. Desta L, Jernberg T, Löfman I, Hofman-Bang C, Hagerman I, Spaak J, et al. Incidence, temporal trends, and prognostic impact of heart failure complicating acute myocardial infarction. The SWEDEHEART Registry (Swedish Web-System for Enhancement and Development of Evidence-Based Care in Heart Disease Evaluated According to Recommended Therapies): a study of 199,851 patients admitted with index acute myocardial infarctions, 1996 to 2008. JACC Heart Fail. 2015;3(3):234-242. DOI: 10.1016/j.jchf.2014.10.007
13. Choi Y, Lee KY, Kim SH, Kim KA, Hwang BH, Choo EH, et al. Predictors for early cardiac death after discharge from successfully treated acute myocardial infarction. Front Med (Lausanne). 2023;10:1165400. DOI: 10.3389/fmed.2023.1165400
14. Gho JMIH, Schmidt AF, Pasea L, Koudstaal S, Pujades-Rodriguez M, Denaxas S, et al. An electronic health records cohort study on heart failure following myocardial infarction in England: incidence and predictors. BMJ Open. 2018;8(3):e018331. Erratum in: BMJ Open. 2018;8(3):e018331corr1. DOI: 10.1136/bmjopen-2017-018331
15. Карибова М.В., Кручинова С.В., Гендугова М.Н., Космачева Е.Д. Сердечная недостаточность в Краснодарском крае: анализ текущей ситуации и пути ее улучшения. Терапия. 2025;11(2):17—31. DOI: 10.18565/therapy.2025.2.17-31
16. Hellermann JP, Jacobsen SJ, Gersh BJ, Rodeheffer RJ, Reeder GS, Roger VL. Heart failure after myocardial infarction : a review. Am J Med. 2002;113(4):324-330. DOI: 10.1016/s0002-9343(02)01185-3
17. Weir RA, McMurray JJ, Velazquez EJ. Epidemiology of heart failure and left ventricular systolic dysfunction after acute myocardial infarction: prevalence, clinical characteristics, and prognostic importance. Am J Cardiol. 2006;97(10A):13F-25F. DOI: 10.1016/j.amjcard.2006.03.005
18. Campo G, Saia F, Guastaroba P, Marchesini J, Varani E, Manari A, et al. Prognostic impact of hospital readmissions after primary percutaneous coronary intervention. Arch Intern Med. 2011;171(21):1948-1949. DOI: 10.1001/archinternmed.2011.536
19. Wohlfahrt P, Jenča D, Melenovský V, Šramko M, Kotrč M, Želízko M, et al. Trajectories and determinants of left ventricular ejection fraction after the first myocardial infarction in the current era of primary coronary interventions. Front Cardiovasc Med. 2022;9:1051995. DOI: 10.3389/fcvm.2022.1051995
20. Carberry J, Petrie MC, Lee MMY, Stanley B, Brooksbank KJM, Campbell RT, et al. Empagliflozin to prevent worsening of left ventricular volumes and systolic function after myocardial infarction (EMPRESS-MI). Eur J Heart Fail. 2025;27(3):566-576. DOI: 10.1002/ejhf.3560
21. von Lewinski D, Kolesnik E, Tripolt NJ, Pferschy PN, Benedikt M, Wallner M, et al. Empagliflozin in acute myocardial infarction: the EMMY trial. Eur Heart J. 2022;43(41):4421-4432. DOI: 10.1093/eurheartj/ehac494
22. Bellis A, Mauro C, Barbato E, Trimarco B, Morisco C. The PARADISE-MI trial: a new opportunity to improve the left ventricular remodelling in reperfused STEMI. ESC Heart Fail. 2022;9(6):3698-3701. DOI: 10.1002/ehf2.14159
Об авторах
М. В. КарибоваРоссия
Мария Васильевна Карибова, аспирант, врач-кардиолог
кафедра терапии № 1
Краснодар
С. В. Кручинова
Россия
София Владимировна Кручинова, к. м. н., доцент, врач-кардиолог
кафедра терапии № 1
Краснодар
Е. Д. Космачева
Россия
Елена Дмитриевна Космачева, д. м. н., проф., зав. кафедрой, зам. главного
врача по лечебной работе
кафедра терапии № 1
Краснодар
Дополнительные файлы
Рецензия
Для цитирования:
Карибова М.В., Кручинова С.В., Космачева Е.Д. Факторы, ассоциированные со снижением фракции выброса левого желудочка у пациентов с первичным инфарктом миокарда. Южно-Российский журнал терапевтической практики. 2025;6(3):42-51. https://doi.org/10.21886/2712-8156-2025-6-3-42-51
For citation:
Karibova M.V., Kruchinova S.V., Kosmacheva E.D. Factors associated with reduced left ventricular ejection fraction in patients with primary myocardial infarction. South Russian Journal of Therapeutic Practice. 2025;6(3):42-51. (In Russ.) https://doi.org/10.21886/2712-8156-2025-6-3-42-51


























