Перейти к:
Перспективы терапии центрального апноэ сна и дыхания Чейн-Стокса при сердечной недостаточности
https://doi.org/10.21886/2712-8156-2021-2-1-8-16
Аннотация
В этом обзоре обсуждаются факторы риска, клинические проявления, патофизиология, диагностика и варианты лечения центрального апноэ сна и дыхания Чейна-Стокса у пациентов с сердечной недостаточностью. Обсуждаются эффективность и перспективы терапевтических методов, таких как «сипап»-терапия, адаптивная сервовентиляция, трансвенозная стимуляция диафрагмального нерва.
Ключевые слова
Для цитирования:
Алехина Ю.В., Середенина Е.М., Калинкин А.Л. Перспективы терапии центрального апноэ сна и дыхания Чейн-Стокса при сердечной недостаточности. Южно-Российский журнал терапевтической практики. 2021;2(1):8-16. https://doi.org/10.21886/2712-8156-2021-2-1-8-16
For citation:
Alyokhina Y.V., Seredenina E.M., Kalinkin A.L. Prospects for the treatment of central sleep apnea and Cheyne-Stokes respiration in heart failure. South Russian Journal of Therapeutic Practice. 2021;2(1):8-16. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-1-8-16
СПИСОК СОКРАЩЕНИЙ
ИАГ – индекс апноэ-гипопноэ
ИЦА – индекс центрального апноэ
ЛЖВУ – левожелудочковое вспомогательное устройство
ПСГ – полисомнографическое исследование
СНнФВ – СН со сниженной фракцией левого желудочка
ТВНСДН – трансвенозная нейростимуляция диафрагмального нерва
ХСН – хроническая сердечная недостаточность
Введение
Несмотря на значительные успехи в лекарственной и интервенционной терапии сердечной недостаточности (СН) в последние десятилетия заболеваемость и смертность остаются высокими [1]. Стратегия лечения СН может заключаться в выявлении дополнительных проблем, которые способствуют прогрессированию заболевания и ухудшают прогноз, разработке методов диагностики и преодоления этих факторов. Одним из важнейших аспектов являются нарушения дыхания, которые вызывают эпизодическую гипоксемию, активацию симпатической нервной системы, увеличивают риск жизнеугрожающих нарушений ритма, усугубляют течение заболевания и ухудшают прогноз [2-5]. При этом риск летального исхода прямо коррелирует с выраженностью центрального апноэ сна (ЦАС) и прогрессивно возрастает при увеличении индекса апноэ / гипопноэ более 30/час [6].
Нарушения дыхания во время сна у пациентов с СН как с сохранённой, так и сниженной фракцией выброса левого желудочка включают обструктивное или центральное апноэ сна и встречаются, по разным данным, с частотой от 50% до 75% [7, 8]. Несмотря на широкую распространенность, нарушения дыхания у пациентов с СН остаются в значительной степени не диагностированными и не леченными. Известно, что обструктивное апноэ во время сна может усугублять течение артериальной гипертензии, сахарного диабета, ожирения, атеросклероза, которые являются предикторами развития СН [9]. С другой стороны, при СН наблюдаются нарушения дыхания центрального характера, в том числе дыхание Чейна-Стокса (ДЧС), связанные с нестабильностью системы дыхания. Увеличение тяжести СН в свою очередь может усугублять степень нарушения дыхания во время сна. Таким образом, между сердечной недостаточностью и обоими фенотипами нарушений дыхания существует двунаправленная связь, более того, значительная часть пациентов может демонстрировать комбинацию этих фенотипов [10]. Патофизиология обструктивного апноэ сна (ОАС) в настоящее время хорошо изучена, разработаны эффективные методы лечения (ночная оксигенотерапия, ночная вентиляция с постоянным положительным давлением в дыхательных путях, двухуровневым положительным давлением в дыхательных путях и адаптивная сервовентиляция (АСВ)) [11]. Напротив, понимание патофизиологии ЦАС является неполным, и ни одна из существующих терапевтических методик не имеет доказанного положительного влияния на прогноз этих пациентов. Таким образом, дальнейшее изучение механизмов, лежащих в основе ЦАС, и поиск новых терапевтических подходов для их коррекции представляется чрезвычайно актуальным.
Патофизиология нарушений дыхания при СН
Центральное апноэ сна характеризуется отсутствием воздушного потока, сопровождающимся прекращением вентиляционных усилий во время сна. ЦАС имеет циклический характер и проявляется периодами гипервентиляции, чередующимися с периодами апноэ. ЦАС обусловливает целый ряд патофизиологических нарушений, таких как изменения внутригрудного давления, перемежающуюся гипоксемию, воспаление, активацию симпатической нервной системы, нарушение и фрагментацию сна, метаболические нарушения, ремоделирование сердца и дисфункцию эндотелия [12,13].
В основе патофизиологии нарушений дыхания при СН лежат низкий сердечный выброс, высокая активация симпатической нервной системы и застой в легких. В настоящее время предполагается, что три основных фактора вызывают респираторную нестабильность при СН. Это гипервентиляция, увеличение времени циркуляции крови между легкими и центральными хеморецепторами и цереброваскулярная реактивность. Взаимодействие этих механизмов приводит к респираторной нестабильности и развитию периодического паттерна дыхания, характеризующуюся чередованием фаз гипервентиляции и центрального апноэ известного, как ДЧС [14].
Механизмы возникновения различных видов периодического дыхания при СН включают
- удлинение времени циркуляции крови от легких к хеморецепторам мозга с соответствующим замедлением процессов гуморальной активации дыхательного центра;
- увеличение чувствительности хеморецепторов к изменениям парциального давления кислорода и углекислого газа;
- подавление активности барорецепторов;
- гиперстимуляция юкстакаротидных рецепторов вследствие пре- и посткапиллярной легочной гипертензии (ЛГ) / отёка легких;
- нарушения импульсов от рецепторов растяжения в легочной ткани;
- нарушения тормозящего влияния от механорецепторов мышечной ткани дыхательных мышц [15].
Повышенная чувствительность периферических и центральных хеморецепторов при СН в последние годы была продемонстрирована в экспериментальных и клинических исследованиях. В исследовании Giannoni A. и соавт. у 60% пациентов с СН отмечалось усиление респираторной реакции на гипоксию и / или гиперкапнию по сравнению с контрольной группой [16].
Изменения хеморефлексов могут быть причиной целого ряда патофизиологических нарушений при СН, таких как усиленная вентиляция, возникновение аномального циклического дыхательного паттерна и гиперактивация симпатической нервной системы. Пациенты с аномально повышенной чувствительностью хеморецепторов демонстрируют усиленный респираторный ответ на физическую нагрузку, нарушения вегетативной регуляции и подавление функции барорецепторов, более высокую распространённость желудочковых аритмий, что может неблагоприятно повлиять на прогноз при СН [17]. В ряде клинических исследований получены доказательства того, что повышенная чувствительность периферических хеморецепторов является мощным и независимым предиктором смертности при СН [17, 18]. Дальнейшее изучение механизмов, регулирующих кардиореспираторные паттерны и их влияние на ухудшение сердечной функции и увеличение смертности при СН, позволит разработать терапевтические стратегии, направленные на улучшение качества жизни, снижение заболеваемости и смертности.
Клинические проявления и возможности диагностики
Важным аспектом выявления ЦСА при СН является анамнез состояния пациента во время сна, в том числе опрос партнёра. Пациенты с СН и ЦСА могут испытывать бессонницу, утомляемость и / или дневную сонливость, хотя последняя часто отсутствует. Пациенты также могут сообщать о частых пробуждениях, плохом качестве сна, пароксизмальной ночной одышке и никтурии. Иногда партнер может сообщать об апноэ или необычном дыхании. Зачастую эти симптомы связывают с самой СН и наличие ЦАС упускается из виду и пациентами, и клиницистами, а отсутствие лечения ухудшает прогноз пациента [11, 19, 20].
Возможно использование опросников (шкалы сонливости Эпворта, Берлинского опросника и др.) для скрининга, однако их информативность недостаточна. В настоящее время ни один из опросников не валидирован для пациентов с СН.
Выделен ряд факторов риска развития ЦАС при СН, включая мужской пол, более высокий функциональный класс, более низкую фракцию выброса, гипокапнию в состоянии бодрствования, более высокую распространенность фибрилляции предсердий, более высокие уровни натрийуретического пептида и частые ночные желудочковые аритмии [5]. Наличие даже одного фактора риска должно повышать настороженность клиницистов в отношении ЦАС и стимулировать проведение диагностического обследования (полисомнографии в специализированной лаборатории сна). Проведение полисомнографии также целесообразно при наличии ночной стенокардии, рецидивирующих аритмий, рефрактерной СН.
Связанное с СН ЦАС с ДЧС является наиболее распространенным из 8 типов центрального апноэ во сне в соответствии с последней версией международной классификации нарушений сна (ICSD-3) (AASM) [21].
Дыхание Чейна-Стокса с центральным апноэ сна (ДЧС-ЦАС) — это форма периодического дыхания, обычно наблюдаемая у пациентов с сердечной недостаточностью, при которой центральное апноэ чередуется с гиперпноэ, имеющим характер нарастания-убывания воздушного потока [22].
Американская академия медицины сна (AASM) рекомендует оценивать респираторное событие как дыхание Чейна-Стокса при наличии двух критериев. Во-первых, при регистрации эпизодов, по крайней мере, из трёх последовательных центральных апноэ и / или центральных гипопноэ, разделённых последовательно нарастающей и уменьшающейся амплитудой дыхания с продолжительностью цикла не менее 40 секунд (обычно от 45 до 90 секунд). Во-вторых, при пяти (и более) эпизодах центрального апноэ и / или центрального гипопноэ в час, связанных с вышеописанным паттерном дыхания, регистрируемым в течение минимум двух часов полисомнографического мониторинга [23].
Дыхательные нарушения обычно сопровождаются микропробуждениями и нарушением структуры сна [24] и возникают в период бодрствования [25]. Чаще такие циклические изменении паттерна дыхания сопровождаются изменением насыщения гемоглобина крови кислородом от 90% до 100% [23].
Тяжесть ЦАС обычно определяется индексом апноэ-гипопноэ (ИАГ) и продолжительностью ночной гипоксемии (период времени с насыщением гемоглобина крови кислородом ниже 90% (SpO2<90%). Недавнее исследование Oldenburg и соавт. определили ночную гипоксемию как наиболее надёжный предиктор выживаемости у пациентов с апноэ во сне и стабильной сердечной недостаточностью с пониженной фракцией выброса левого желудочка, тогда как только ИАГ был слабым предиктором смертности [22, 26].
В настоящее время предложен ряд методик для диагностики нарушений дыхания у пациентов с СН. Это различные портативные полисомнографические устройства, ночная пульсоксиметрия, респираторный телемониторинг, мониторинг импеданса дыхательных экскурсий для измерения вариабельности сердечного выброса в ответ на события апноэ. Для более широкого использования этих новых методов диагностики необходимы дальнейшие исследования и получение дополнительных данных об их эффективности.
Терапия центрального апноэ сна и дыхания Чейна-Стокса
Современные стратегии терапии центрального апноэ включают как оптимизацию медикаментозного лечения СН, так и использование методов, направленных непосредственно на дыхательные нарушения. Применение современной и адекватной медикаментозной терапии является важным первым шагом к лечению ЦАС. На сегодняшний день рассматриваются три группы препаратов, способствующих уменьшению тяжести ЦАС при СН (ингибиторы ангиотензинпревращающего фермента (АПФ), бета-адреноблокаторы и диуретики) [27 – 29]. Ингибитор карбоангидразы ацетазоламид уменьшает количество центральных респираторных событий и улучшает оксигенацию крови во время сна у больных СН и ДЧС. Клинически это проявляется в улучшении качества сна, уменьшении дневной утомляемости и сонливости [30, 31]. Вероятными механизмами являются непосредственно диуретический эффект, уменьшающий выраженность застойных явлений и развитие метаболического ацидоза, изменение чувствительности хеморецепторов и увеличение разницы между текущим уровнем PаCO2 и порогом возникновения апноэ. Основной вопрос недавнего мета-анализа 2020 г. был посвящён тому, насколько эффективен ацетазоламид при апноэ сна и зависит ли его эффект от типа апноэ или дозы ацетазоламида. Авторы включили 28 исследований, в которых дозы ацетазоламида варьировались от 36 до 1000 мг/сут, а продолжительность лечения составила от 1 до 90 дней (в среднем 6 дней). Ацетазоламид снизил ИАГ на 37,7% (95% ДИ, -44,7 до - 31,3) или 13,8/ч (95% ДИ, от -16,3 до -11,4; ИАГ= 36,5/ч). Снижение ИАГ было аналогичным при ОАС и ЦАС, более убедительное при дозах не менее 500 мг в сутки. Учитывая небольшую продолжительность лечения в большинстве исследований, возможность развития побочных эффектов, включая метаболический ацидоз и электролитный дисбаланс, для определения ценности длительного применения ацетазоламида у пациентов с СН и ЦАС необходимы тщательные исследования с долгосрочным наблюдением.
В настоящее время продолжается исследование ENTRESTO-SAS, трёхмесячное многоцентровое проспективное открытое когортное исследование в реальной практике, цель которого изучить влияние сакубитрила-валсартана на ИАГ у пациентов с СН, ФВ ЛЖ ≤35%, у которых сохраняются симптомы, несмотря на оптимальное лечение ингибитором АПФ, бета-блокатором и антагонистом минералокортикоидных рецепторов [32].
Несмотря на прогресс в медикаментозной терапии в последние десятилетия, ЦАС и ДЧС остаются широко распространенным явлением у пациентов с СН. Так, в исследовании T. Bitter и соавт., не было обнаружено различий в медикаментозной терапии у 1500 пациентов с СН и ЦАС или без дыхательных нарушений. Аналогичные результаты получены в исследовании O. Oldenburg и соавт., включавшем 700 пациентов с СН [33, 34]. Продолжается поиск других терапевтических подходов, которые могут оказывать положительное влияние на ЦАС при СН. Сердечная ресинхронизирующая терапия была предложена в качестве ещё одного потенциального подхода к лечению нарушений дыхания при СН. Систематический обзор J. Lamba и соавт. (2011 г.) включил 14 исследований, оценивавших динамику ИАГ у пациентов с СН и нарушениями дыхания на фоне кардиальной ресинхронизирующей терапии в зависимости от типа апноэ [35].
Результаты исследования продемонстрировали эффективность ресинхронизирующей терапии в отношении ИАГ (снижение показателей в среднем на -9,63/час (p <0,00001), ЦАС на -13,05 (p <0,00001)). При ОАС существенного снижения ИАГ не произошло (-3,32, p = 0,25). Возможные механизмы, вероятно, связаны с увеличением сердечного выброса на фоне ресинхронизирующей терапии, снижении венозного легочного давления, склонности к гипервентиляции и гипокапнии [36]. John S. Floras и T. Douglas Bradley представили иную концепцию: бивентрикулярная кардиостимуляция улучшает сердечный выброс, что приводит к сокращению времени циркуляции крови от легких к хеморецепторам и давления наполнения левого желудочка, что может уменьшить колебания в паттернах дыхания, предотвращая гипервентиляцию, которая предшествует событию апноэ [37].
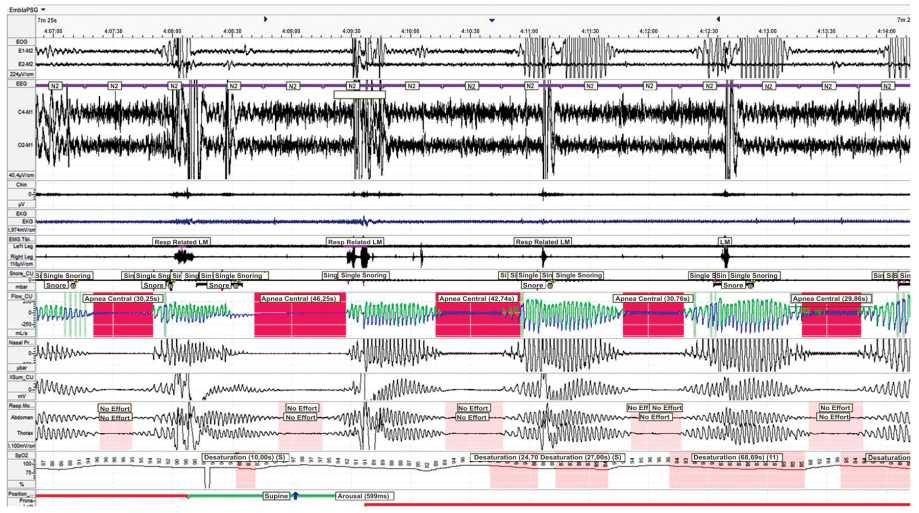
Рисунок 1. Центральные апноэ сна и дыхание Чейн-Стокса у больного с СН со сниженной фракцией левого желудочка (СНнФВ) (ФВ ЛЖ 15%). Чередование центрального апноэ сна (выделено прямоугольником) и эпизодов гипервентиляции. Сомнологическое отделение МНОЦ МГУ им. М.В. Ломоносова. Полисомнографическое исследование (Embla N7000).
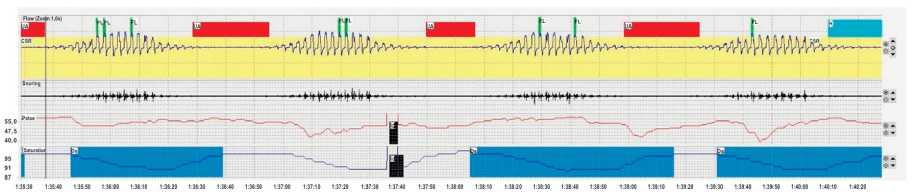
Рисунок 2. Пример дыхания Чейн-Стокса во время сна у пациента с СНнФВ терапевтического отделения МНОЦ МГУ им. М.В. Ломоносова при проведении кардиореспираторного исследования (ApneaLink).
Примечание: первый канал (Flow) — назофарингеальный воздушный поток. Проявления дыхания Чейна-Стокса: эпизоды центрального апноэ, перемежающиеся с гипервентиляцией по типу нарастание – убывание воздушного потока; второй канал (Snoring) — регистрация храпа (практически полное отсутствие эпизодов храпа); третий канал (Pulse) — частота пульса; четвёртый канал (Saturation) — насыщение гемоглобина крови кислородом.
«Сипап»-терапия и адаптивная сервовентиляция
«Сипап»-терапия стала первым методом респираторной поддержки, которая была применена для устранения центрального апноэ сна у больных ХСН с дыханием Чейн-Стокса. Было организовано крупное, рандомизированное исследование с целью проверки гипотезы, что лечение ДЧС с помощью постоянного положительного давления в дыхательных путях (CPAP) снизит первичную комбинированную конечную точку (смертность от всех причин, трансплантация сердца у пациентов с ХСН). [38]. Однако результаты оказались не столь обнадеживающими. Хотя «сипап»-терапия уменьшала количество центральных апноэ сна, улучшала ночную оксигенацию, увеличивала фракцию выброса ЛЖ, снижала уровень норадреналина и увеличивала пройденное расстояние при проведении 6-минутного теста с ходьбой, это не влияло на выживаемость пациентов с ХСН [39]. В дальнейшем при проведении post-hoc анализа было выявлено, что у лиц, у которых на фоне «сипап»- терапии происходило уменьшение ДЧС, наряду с увеличением фракции выброса левого желудочка улучшалась выживаемость по сравнению с теми лицами, у которых на фоне «сипап»- терапии проявления ДЧС не уменьшались [40].
В дальнейшем для лечения ДЧС использовались различные режимы двухуровневой вентиляции. Одним из таких методов является адаптивная сервовентиляция. Адаптивная сервовентиляция (АСВ) представляет собой разновидность двухуровневой неинвазивной вентиляции для устранения, прежде всего, центрального апноэ сна. Целевое давление воздушного потока АСВ регулируется в зависимости от параметров дыхания пациента, то есть постоянно адаптируется к конкретной ситуации. Поскольку аппарат АСВ постоянно настраивается в соответствии с потребностями пациента, дискомфорт, о котором часто сообщают пациенты при использовании «сипап»-терапии, практически полностью отсутствует.
Некоторые исследования показали, что АСВ является эффективной и превосходит «сипап»- терапию в устранении центрального апноэ сна и улучшении клинической симптоматики [41–43]. Считается, что раннее назначение адаптивной сервовентиляции может не только подавлять аномальные паттерны дыхания, но и улучшать сердечную функцию у пациентов с ХСН, а также увеличивает приверженность к терапии [41]. Однако результаты большого рандомизированного исследования по лечению ДЧС с помощью АСВ у пациентов с сердечной недостаточностью не выявили достоверного влияния на динамику течения СНнФВ несмотря на снижение ИАГ до 6.6 событий/час [44]. При этом как общая, так и сердечно-сосудистая смертности статистически значимо увеличились в группе, в которой проводилась терапия АСВ [44–46].
Несмотря на это, есть примеры успешного ведения пациентов с ДЧС. У пациента с ИБС, постоянной формой фибрилляции предсердий, стенокардией напряжения III ФК, ХСН с ФВ 36% и довольно обширным набором сопутствующих заболеваний вовремя начатая терапия позволила стабилизировать и улучшить клинически состояние пациента, более того в течение 5 месяцев отмечалась высокая приверженность к терапии, а ИАГ снизился до 1.5/час (до терапии - 31/час) [47].
Несмотря на то, что АСВ не рекомендуется пациентам с СН с ФВ <45% [19, 48], в настоящее время продолжается крупное рандомизированное исследование Advanced-HF, которое использует модификацию АСВ с использованием дополнительного «мёртвого» пространства с целью увеличения содержания CO2 для стабилизации дыхания. Результаты данного исследования должны быть опубликованы не ранее, чем через 1,5–2 года.
Трансвенозная стимуляция диафрагмального нерва
Трансвенозная нейростимуляция диафрагмального нерва (ТВНСДН), одобренная FDA как новый терапевтический метод лечения ЦАС, в настоящее время активно изучается в клинических исследованиях [49-55].
Трансвенозная нейростимуляция диафрагмального нерва — это новый подход к лечению центрального апноэ сна и ДЧС. Диагностика дыхательных нарушений осуществляется посредством оценки импеданса грудной клетки. Стимуляция диафрагмального нерва обеспечивает плавное сокращение диафрагмы, подобное нормальному дыхательному движению на протяжении запланированного периода сна. Данные рандомизированного исследования 151 пациента продемонстрировали, что это лечение улучшает дыхательные нарушения примерно на 50% (75). Серьёзные побочные эффекты, связанные с устройством или процедурой, наблюдались примерно у 10% пациентов, преимущественно связанные со смещением электрода.
Данная система помещается в грудную область, как правило, с правой стороны. Стимулирующий электрод помещается либо в левую перикардиофреническую вену (ПКФВ), либо в правую брахиоцефальную вену (ПБЦВ). Чувствительный электрод помещается в непарную вену для обнаружения актов дыхания. У преобладающего большинства пациентов не отмечается серьезных нежелательных явлений, связанных с имплантацией, и процедура является эффективной и безопасной аналогично процедуре имплантации ЭКС.
На фоне трансвенозной нейростимуляции диафрагмального нерва у 60% пациентов показатели дыхательных нарушений во время сна (ИАГ, индекс центрального анпоэ (ИЦА), индекс микропробуждений, индекс десатураций) достигли 50% снижения через 24 и 36 месяцев непрерывного его применения [52]. Серьёзные нежелательные явления, связанные с процедурой имплантации, в течение 24 месяцев были зарегистрированы только у 10% пациентов, никаких непредвиденных побочных эффектов устройства или смертей не было. В период между 24 и 36 месяцами также не было зарегистрировано никаких дополнительных нежелательных реакций. Подводя итоги вышеописанному, можем сказать, что такие результаты свидетельствуют о благоприятном воздействии длительной ТВНСДН у пациентов с ДЧС, которая, по-видимому, сохраняется в течение 36 месяцев без каких-либо осложнений. Авторы считают, что несмотря на трудности, возникающие в ходе выполнения методики, интервенционные внутрисосудистые методы заметно повышают приверженность к терапии и тем самым позволяют применять эту терапию для эффективного лечения ДЧС у большинства пациентов без дополнительных осложнений [56].
Как ещё один пример доказательства эффективности этого метода группой исследователей был представлен случай пациента 62 лет с тяжёлой формой СНнФВ ЛЖ (III ФК по NYHA, ФВ 15%), пароксизмальной желудочковой тахикардией и бивентрикулярной электрокардиостимуляцией в сочетании с выявленным при ПСГ ДЧС. Пациенту был установлен стимулятор диафрагмального нерва. Впоследствии пациент сообщил об уменьшении дневной сонливости и увеличении продолжительности ежедневных физических упражнений. Через 18 месяцев после инициации терапии ТВНСДН ИАГ снизился практически в 7 раз (с 46,3 событий/час до 6,9 событий/час), а индекс центрального апноэ сна (ИЦА) снизился в 213 раз (с 42,6 событий ЦАС/час до 0,2 событий ЦАС/час). Через два года после имплантации устройства он перенёс установку левожелудочкового вспомогательного устройства (ЛЖВУ) в связи с ухудшением симптомов СН и наличием рефрактерных желудочковых аритмий. С помощью настройки бивентрикулярного ЭКС, системы стимуляции диафрагмального нерва и ЛЖВУ они могли совместно работать без артефактов или помех. Последующее проведение ПСГ подтвердило успешное лечение ДЧС наряду с улучшением симптомов. Несмотря на нормализацию сердечного выброса после имплантации ЛЖВУ тяжёлая ХСН сохранялась. Данное исследование демонстрирует, что ТВНСДН является вариантом лечения пациентов с СН и среднетяжелым или тяжелым проявлениями ДЧС, включая и пациентов с установленным ЛЖВУ [33].
Согласно первым полученным результатам применения трансвенозной нейростимуляции диафрагмального нерва для лечения ЦАС, имеется положительное влияние на параметры сна и качество жизни. При этом не получено доказательств отрицательного влияния на смертность [57]. Для подтверждения этих результатов необходимы более крупные исследования, которые позволят рекомендовать эту методику для применения в рутинной практике.
Заключение
Разнообразие патогенеза и различия в терапевтических подходах к ДЧС при неоднозначной их эффективности требуют существенной доработки лечебно-диагностического алгоритма у больных с ДЧС. Несмотря на многообещающие эффекты «сипап»-терапии и адаптивной сервовентиляции, достоверной эффективности они не демонстрируют, к тому же имеется ряд осложнений, связанных с ухудшением сердечной функции и увеличением смертности. Будущие исследования должны сфокусироваться на особенностях развития ДЧС при различных патологиях с целью стратификации риска при сопутствующих заболеваниях, в частности ССЗ, а также совершенствовании подходов к лечению ДЧС. Такой подход позволит улучшить качество жизни, снизить заболеваемость и смертность больных с ДЧС и минимизировать возможные отсроченные побочные эффекты терапии.
Список литературы
1. Maggioni AP, Dahlstrom U, Filippatos G, Chioncel O, Crespo Leiro M, Drozdz J, et al. EURObservational Research Programme: regional differences and 1-year follow-up results of the Heart Failure Pilot Survey (ESC-HF Pilot). Eur J Heart Fail. 2013;15(7):808-17. DOI: 10.1093/eurjhf/hft050
2. Brack T. Cheyne-Stokes respiration in patients with congestive heart failure. Swiss Med Wkly. 2003;133(45-46):605-10. PMID: 14745666.
3. Coniglio AC, Mentz RJ. Sleep Breathing Disorders in Heart Failure. Heart Fail Clin. 2020;16(1):45-51. DOI: 10.1016/j.hfc.2019.08.009
4. Andreas S, Hagenah G, Moller C, Werner GS, Kreuzer H. Cheyne-Stokes respiration and prognosis in congestive heart failure. Am J Cardiol. 1996;78(11):1260-4. DOI: 10.1016/s0002-9149(96)00608-x
5. Hanly PJ, Zuberi-Khokhar NS. Increased mortality associated with Cheyne-Stokes respiration in patients with congestive heart failure. Am J Respir Crit Care Med. 1996;153(1):272-6. DOI: 10.1164/ajrccm.153.1.8542128
6. Lanfranchi PA, Braghiroli A, Bosimini E, Mazzuero G, Colombo R, Donner CF, et al. Prognostic value of nocturnal Cheyne-Stokes respiration in chronic heart failure. Circulation. 1999;99(11):1435-40. DOI: 10.1161/01.cir.99.11.1435
7. Arzt M, Oldenburg O, Graml A, Erdmann E, Teschler H, We-gscheider K, et al. Phenotyping of Sleep-Disordered Breathing in Patients With Chronic Heart Failure With Reduced Ejection Fraction-the SchlaHF Registry. J Am Heart Assoc. 2017;6(12):e005899. DOI: 10.1161/JAHA.116.005899
8. Arzt M, Woehrle H, Oldenburg O, Graml A, Suling A, Erdmann E, et al. Prevalence and Predictors of Sleep-Disordered Breathing in Patients With Stable Chronic Heart Failure: The SchlaHF Registry. JACC Heart Fail. 2016;4(2):116-125. DOI: 10.1016/j.jchf.2015.09.014
9. Selim BJ, Ramar K. Management of Sleep Apnea Syndromes in Heart Failure. Sleep Med Clin. 2017;12(1):107-121. DOI: 10.1016/j.jsmc.2016.10.004
10. Dharia SM, Brown LK. Epidemiology of Sleep-Disordered Breathing and Heart Failure: What Drives What. Curr Heart Fail Rep. 2017;14(5):351-364. DOI: 10.1007/s11897-017-0348-6
11. Bradley TD, Floras JS. Sleep apnea and heart failure: Part II: central sleep apnea. Circulation. 2003;107(13):1822-6. DOI: 10.1161/01.CIR.0000061758.05044.64
12. Cowie MR, Gallagher AM. Sleep Disordered Breathing and Heart Failure: What Does the Future Hold? JACC Heart Fail. 2017;5(10):715-723. DOI: 10.1016/j.jchf.2017.06.016.
13. Costanzo MR, Khayat R, Ponikowski P, Augostini R, Stellbrink C, Mianulli M, et al. Mechanisms and clinical consequences of untreated central sleep apnea in heart failure. J Am Coll Cardiol. 2015;65(1):72-84. DOI: 10.1016/j.jacc.2014.10.025
14. Eckert DJ, Jordan AS, Merchia P, Malhotra A. Central sleep apnea: Pathophysiology and treatment. Chest. 2007;131(2):595-607. DOI: 10.1378/chest.06.2287
15. Беграмбекова Ю.Л., Каранадзе Н.А., Орлова Я.А. Нарушения системы дыхания при хронической сердечной недостаточности. Кардиология. 2019;59(2S):15-24. DOI: 10.18087/cardio.2626
16. Giannoni A, Emdin M, Poletti R, Bramanti F, Prontera C, Piep-oli M, et al. Clinical significance of chemosensitivity in chronic heart failure: influence on neurohormonal derangement, Cheyne-Stokes respiration and arrhythmias. Clin Sci (Lond). 2008;114(7):489-97. DOI: 10.1042/CS20070292
17. Ponikowski P, Banasiak W. Chemosensitivity in chronic heart failure. Heart Fail Monit. 2001;1(4):126-31. PMID: 12634897.
18. Ponikowski P, Chua TP, Anker SD, Francis DP, Doehner W, Ba-nasiak W, et al. Peripheral chemoreceptor hypersensitivity: an ominous sign in patients with chronic heart failure. Circulation. 2001;104(5):544-9. DOI: 10.1161/hc3101.093699
19. Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JGF, Coats AJS, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2016;37(27):2129-2200. DOI: 10.1093/eurheartj/ehw128. Erratum in: Eur Heart J. 2016. PMID: 27206819.
20. Pinna GD, Maestri R, Mortara A, La Rovere MT. Cardiorespiratory interactions during periodic breathing in awake chronic heart failure patients. Am J Physiol Heart Circ Physiol. 2000;278(3):H932-41. DOI: 10.1152/ajpheart.2000.278.3.H932
21. Sateia MJ. International classification of sleep disor-ders-third edition: highlights and modifications. Chest. 2014;146(5):1387-1394. DOI: 10.1378/chest.14-0970
22. Terziyski K, Draganova A. Central Sleep Apnea with Cheyne-Stokes Breathing in Heart Failure - From Research to Clinical Practice and Beyond. Adv Exp Med Biol. 2018;1067:327-351. DOI: 10.1007/5584_2018_146
23. Perger E, Inami T, Lyons OD, Alshaer H, Smith S, Floras JS, et al. Distinct Patterns of Hyperpnea During Cheyne-Stokes Respiration: Implication for Cardiac Function in Patients With Heart Failure. J Clin Sleep Med. 2017;13(11):1235-1241. DOI: 10.5664/jcsm.6788. Erratum in: J Clin Sleep Med. 2018;14(4):703.
24. Javaheri S, Blackwell T, Ancoli-Israel S, Ensrud KE, Stone KL, Redline S; et al. Sleep-disordered Breathing and Incident Heart Failure in Older Men. Am J Respir Crit Care Med. 2016;193(5):561-8. DOI: 10.1164/rccm.201503-0536OC
25. Martinot JB, Borel JC, Le-Dong NN, Guenard HJ, Cuthbert V, Silkoff PE, et al. Monitoring mandibular movements to detect Cheyne-Stokes Breathing. Respir Res. 2017;18(1):66. DOI: 10.1186/s12931-017-0551-8
26. Oldenburg O, Wellmann B, Buchholz A, Bitter T, Fox H, Thiem U, et al. Nocturnal hypoxaemia is associated with increased mortality in stable heart failure patients. Eur Heart J. 2016;37(21):1695-703. DOI: 10.1093/eurheartj/ehv624
27. Walsh JT, Andrews R, Starling R, Cowley AJ, Johnston ID, Kinnear WJ. Effects of captopril and oxygen on sleep apnoea in patients with mild to moderate congestive cardiac failure. Br Heart J. 1995;73(3):237-41. DOI: 10.1136/hrt.73.3.237
28. Tamura A, Kawano Y, Naono S, Kotoku M, Kadota J. Relationship between beta-blocker treatment and the severity of central sleep apnea in chronic heart failure. Chest. 2007;131(1):130-5. DOI: 10.1378/chest.06-0919
29. MacDonald M, Fang J, Pittman SD, White DP, Malhotra A. The current prevalence of sleep disordered breathing in congestive heart failure patients treated with beta-blockers. J Clin Sleep Med. 2008;4(1):38-42. PMID: 18350960; PMCID: PMC2276820.
30. Javaheri S. Acetazolamide improves central sleep apnea in heart failure: a double-blind, prospective study. Am J Respir Crit Care Med. 2006;173(2):234-7. DOI: 10.1164/rccm.200507-1035OC
31. Schmickl CN, Landry SA, Orr JE, Chin K, Murase K, Ver-braecken J, et al. Acetazolamide for OSA and Central Sleep Apnea: A Comprehensive Systematic Review and MetaAnalysis. Chest. 2020;158(6):2632-2645. DOI: 10.1016/j.chest.2020.06.078
32. Jaffuel D, Molinari N, Berdague P, Pathak A, Galinier M, Dupuis M, et al. Impact of sacubitril-valsartan combination in patients with chronic heart failure and sleep apnoea syndrome: the ENTRESTO-SAS study design. ESC Heart Fail. 2018;5(3):222-230. DOI: 10.1002/ehf2.12270.
33. Bitter T, Westerheide N, Hossain SM, Prinz C, Horstkotte D, Oldenburg O. Symptoms of sleep apnoea in chronic heart failure-results from a prospective cohort study in 1,500 patients. Sleep Breath. 2012;16(3):781-91. DOI: 10.1007/s11325-011-0575-0
34. Oldenburg O, Lamp B, Faber L, Teschler H, Horstkotte D, Topfer V. Sleep-disordered breathing in patients with symptomatic heart failure: a contemporary study of prevalence in and characteristics of 700 patients. Eur J Heart Fail. 2007;9(3):251-7. DOI: 10.1016/j.ejheart.2006.08.003
35. Lamba J, Simpson CS, Redfearn DP, Michael KA, Fitzpatrick M, Baranchuk A. Cardiac resynchronization therapy for the treatment of sleep apnoea: a meta-analysis. Europace. 2011;13(8):1174-9. DOI: 10.1093/europace/eur128
36. White DP. Pathogenesis of obstructive and central sleep apnea. Am J Respir Crit Care Med. 2005;172(11):1363-70. DOI: 10.1164/rccm.200412-1631SO
37. Floras JS, Bradley TD. Atrial overdrive pacing for sleep apnea: a door now closed? Am J Respir Crit Care Med. 2005;172(1):1-3. DOI: 10.1164/rccm.2503007
38. Bradley TD, Logan AG, Floras JS; CANPAP Investigators. Rationale and design of the Canadian Continuous Positive Airway Pressure Trial for Congestive Heart Failure patients with Central Sleep Apnea--CANPAP. Can J Cardiol. 2001;17(6):677-84. PMID: 11420579.
39. Bradley TD, Logan AG, Kimoff RJ, Series F, Morrison D, Ferguson K, et al. Continuous positive airway pressure for central sleep apnea and heart failure. N Engl J Med. 2005;353(19):2025-33. DOI: 10.1056/NEJMoa051001
40. Arzt M, Floras JS, Logan AG, Kimoff RJ, Series F, Morrison D, et al. Suppression of central sleep apnea by continuous positive airway pressure and transplant-free survival in heart failure: a post hoc analysis of the Canadian Continuous Positive Airway Pressure for Patients with Central Sleep Apnea and Heart Failure Trial (CANPAP). Circulation. 2007;115(25):3173-80. DOI: 10.1161/CIRCULATIONAHA.106.683482
41. Huseini T, McArdle N, Jasper E, Kurmagadda S, Douglas J, King S, et al. The use and effectiveness of adaptive servo ventilation in central sleep apnea: a study of consecutive sleep clinic patients. J Sleep Res. 2020;29(4):e13016. DOI: 10.1111/jsr.13016
42. Javaheri S, Germany R, Greer JJ. Novel Therapies for the Treatment of Central Sleep Apnea. Sleep Med Clin. 2016;11(2):227-39. DOI: 10.1016/j.jsmc.2016.01.004
43. Somers V, Arzt M, Bradley TD, Randerath W, Tamisier R, Won C. Servo-Ventilation Therapy for Sleep-Disordered Breathing. Chest. 2018;153(6):1501-1502. DOI: 10.1016/j.chest.2018.03.052
44. Cowie MR, Woehrle H, Wegscheider K, Angermann C, d'Ortho MP, Erdmann E, et al. Adaptive Servo-Ventilation for Central Sleep Apnea in Systolic Heart Failure. N Engl J Med. 2015;373(12):1095-105. DOI: 10.1056/NEJMoa1506459
45. McEvoy RD, Antic NA, Heeley E, Luo Y, Ou Q, Zhang X, et al. CPAP for Prevention of Cardiovascular Events in Obstructive Sleep Apnea. N Engl J Med. 2016;375(10):919-31. DOI: 10.1056/NEJMoa1606599
46. Woehrle H, Cowie MR, Eulenburg C, Suling A, Angermann C, d'Ortho MP, et al. Adaptive servo ventilation for central sleep apnoea in heart failure: SERVE-HF on-treatment analysis. Eur Respir J. 2017;50(2):1601692. DOI: 10.1183/13993003.01692-2016
47. Калинкин А. Л., Шестопалова И.М., Ардашев А.В., Бертова О.Н., Кузовлев О.П. Дыхание Чейн-Стокса во время сна как маска обострения ИБС. Диагностика и лечение методом адаптивной сервовентиляции. Клиническая практика. 2014;(1):26-30.DOI: 10.17816/clinpract5126-30
48. Holt A, Bjerre J, Zareini B, Koch H, T0nnesen P, Gislason GH, et al. Sleep Apnea, the Risk of Developing Heart Failure, and Potential Benefits of Continuous Positive Airway Pressure (CPAP) Therapy. J Am Heart Assoc. 2018;7(13):e008684. DOI: 10.1161/JAHA.118.008684
49. Augostini RS, Afzal MR, Costanzo MR, Westlund R, Stellbrink C, Gutleben K, et al. How to implant a phrenic nerve stimulator for treatment of central sleep apnea? J Cardiovasc Electrophysiol. 2019;30(5):792-799. DOI: 10.1111/jce.13898
50. Costanzo MR, Augostini R, Goldberg LR, Ponikowski P, Stellbrink C, Javaheri S. Design of the remede System Pivotal Trial: A Prospective, Randomized Study in the Use of Respiratory Rhythm Management to Treat Central Sleep Apnea. J Card Fail. 2015;21(11):892-902. DOI: 10.1016/j.card-fail.2015.08.344
51. Costanzo MR, Ponikowski P, Coats A, Javaheri S, Augostini R, Goldberg LR, et al. Phrenic nerve stimulation to treat patients with central sleep apnoea and heart failure. Eur J Heart Fail. 2018;20(12):1746-1754. DOI: 10.1002/ejhf.1312
52. Costanzo MR, Ponikowski P, Javaheri S, Augostini R, Goldberg LR, Holcomb R, et al. Sustained 12 Month Benefit of Phrenic Nerve Stimulation for Central Sleep Apnea. Am J Cardiol. 2018;121(11):1400-1408. DOI: 10.1016/j.amj-card.2018.02.022
53. Fox H, Oldenburg O, Javaheri S, Ponikowski P, Augostini R, Goldberg LR, et al. Long-term efficacy and safety of phrenic nerve stimulation for the treatment of central sleep apnea. Sleep. 2019;42(11):zsz158. DOI: 10.1093/sleep/zsz158
54. Fudim M, Spector AR, Costanzo MR, Pokorney SD, Mentz RJ, Jagielski D, et al. Phrenic Nerve Stimulation for the Treatment of Central Sleep Apnea: A Pooled Cohort Analysis. J Clin Sleep Med. 2019;15(12):1747-1755. DOI: 10.5664/jcsm.8076
55. Jagielski D, Ponikowski P, Augostini R, Kolodziej A, Khayat R, Abraham WT. Transvenous stimulation of the phrenic nerve for the treatment of central sleep apnoea: 12 months' experience with the remede® System. Eur J Heart Fail. 2016;18(11):1386-1393. DOI: 10.1002/ejhf.593
56. Gutleben KJ, Fox H, Sommer P, Rudolph V, Nolker G. Interventional techniques to increase implantation success of transvenous phrenic nerve stimulation for central sleep apnea treatment. Sleep Breath. 2020;24(3):905-912. DOI: 10.1007/s11325-019-01917-0
57. Abraham WT, Jagielski D, Oldenburg O, Augostini R, Krueger S, Kolodziej A, et al. Phrenic nerve stimulation for the treatment of central sleep apnea. JACC Heart Fail. 2015;3(5):360-369. DOI: 10.1016/j.jchf.2014.12.013
Об авторах
Ю. В. АлехинаРоссия
Алехина Юлия Вадимовна - студентка факультета фундаментальной медицины.
Москва
Е. М. Середенина
Россия
Середенина Елена Михайловна - кандидат медицинских наук, старший научный сотрудник отдела возраст-ассоциированных заболеваний.
Москва
А. Л. Калинкин
Россия
Калинкин Александр Леонидович - руководитель центра медицины сна, ведущий научный сотрудник отдела воз-раст-ассоциированных заболеваний.
Москва
Рецензия
Для цитирования:
Алехина Ю.В., Середенина Е.М., Калинкин А.Л. Перспективы терапии центрального апноэ сна и дыхания Чейн-Стокса при сердечной недостаточности. Южно-Российский журнал терапевтической практики. 2021;2(1):8-16. https://doi.org/10.21886/2712-8156-2021-2-1-8-16
For citation:
Alyokhina Y.V., Seredenina E.M., Kalinkin A.L. Prospects for the treatment of central sleep apnea and Cheyne-Stokes respiration in heart failure. South Russian Journal of Therapeutic Practice. 2021;2(1):8-16. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-1-8-16


























