Перейти к:
Ассоциация показателя бета-адренореактивности мембран эритроцитов при инфаркте миокарда с генетическими особенностями бета-адренорецепторного аппарата
https://doi.org/10.21886/2712-8156-2021-2-1-32-39
Аннотация
Цель: изучить ассоциацию показателя бета-адренореактивности мембран эритроцитов с полиморфизмами гена бета-1-адренорецепторов ADRB1 (Ser49Gly и Arg389Gly).
Материалы и методы: в исследование включены 62 пациента с инфарктом миокарда (ИМ) — 49 мужчин в возрасте 58,0 (47,5; 64,5) лет и 13 женщин в возрасте 76,0 (61,5; 81,0) лет. Всем пациентам в первые 6 часов от начала развития ИМ выполнен анализ бета-адренореактивности мембран эритроцитов с использованием набора реагентов БЕТА-АРМ АГАТ. В зависимости от величины показателя бета-адренореактивности (β-АРМ) пациенты были разделены на две группы. В первую группу (n = 11) вошли пациенты с нормальным уровнем β-АРМ (от 2 до 20 усл.ед.). Вторую группу (n = 51) составили пациенты с повышенными значениями показателя β-АРМ (более 20 усл.ед.). Генетический анализ на определение полиморфизмов гена ADRB1 (Ser49Gly и Arg389Gly) проводился путем выделения ДНК из лейкоцитов периферической крови (Wizard Genomic DNA Purification Kit) с амплификацией методом ПЦР и дальнейшей электрофоретической детекцией. Статистическая обработка полученных данных выполнялась с помощью программ Statistica 10 и демо-версии IBM SPSS Statistics 20.0.
Результаты: для пациентов с повышенными значениями P-АРМ были характерны более высокие уровни маркеров некроза миокарда в крови (КФК, КФК-МВ и тропонина I) при остром ИМ, чем для пациентов первой группы (р = 0,009, p = 0,032 и p = 0,001 соответственно). Кроме того, вторая группа пациентов отличалась более частым развитием острой левожелудочковой недостаточности (33,3%; р = 0,026), а также наличием артериальной гипертонии в анамнезе до развития индексного ИМ (90,2%; р = 0,044). В отношении полиморфизма Arg389Gly были обнаружены существенные различия среди пациентов с нормальными и повышенными значениями P-АРМ в остром периоде ИМ. Так, вторую группу пациентов преимущественно составили носители генотипа 1165CC гена ADRB1 (n = 29; 56,9%; р = 0,043), а носительство аллеля 1165G значительно чаще наблюдалось среди пациентов первой группы (81,8%; ОШ = 5,93; ДИ 1,16 - 30,25; р = 0,043).
Заключение: установлена ассоциация генотипа 1165CC полиморфизма Arg389Gly гена ADRB1 с повышенными значениями показателя β-АРМ при остром ИМ. Обнаруженные ассоциации могут свидетельствовать о возможной генетической предрасположенности к гиперактивации САС, а также указывать на необходимость дальнейшего изучения полиморфизмов и уровня экспрессии гена ADRB1 у пациентов с высокими индивидуальными величинами β-АРМ, установленными в остром периоде ИМ.
Ключевые слова
Для цитирования:
Гарганеева А.А., Александренко В.А., Кужелева Е.А., Афанасьев С.А., Реброва Т.Ю., Муслимова Э.Ф., Максимов И.В. Ассоциация показателя бета-адренореактивности мембран эритроцитов при инфаркте миокарда с генетическими особенностями бета-адренорецепторного аппарата. Южно-Российский журнал терапевтической практики. 2021;2(1):32-39. https://doi.org/10.21886/2712-8156-2021-2-1-32-39
For citation:
Garganeeva A.A., Aleksandrenko V.А., Kuzheleva E.A., Afanasiev S.A., Rebrova T.Y., Muslimova E.F., Maksimov I.V. Association of beta-adrenergic reactivity index of erythrocyte membranes in myocardial infarction with genetic features of the beta-adrenoreceptor apparatus. South Russian Journal of Therapeutic Practice. 2021;2(1):32-39. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-1-32-39
Введение
В настоящее время известно, что одной из основных систем, регулирующих деятельность сердца, является симпато-адреналовая система (САС) [1–3], которая посредством своих медиаторов, адреналина и норадреналина, способствует развитию и дальнейшему прогрессированию многих кардиоваскулярных событий, в частности инфаркта миокарда (ИМ) [4]. Вегетативный дисбаланс, наблюдающийся на начальном этапе ишемических изменений в миокарде, сопровождается повышенным содержанием катехоламинов в крови и сердечной мышце [5]. Считается, что подобного рода изменения могут быть расценены, с одной стороны, как компенсаторная реакция, а с другой — представлять собой дополнительный фактор риска развития некроза миокарда [6]. Но, несмотря на достаточное активное внимание исследователей к проблеме гиперсимпатикотонии, до сих пор остаётся открытым вопрос о влиянии состояния САС на течение заболевания как на ранних сроках развития ИМ, так и на поздних этапах постинфарктного ремоделирования сердца [7].
Для определения активности САС разработано множество методик, прямых и косвенных, но единого подхода на сегодняшний день не существует, что диктует необходимость изучения и внедрения в практику наиболее экономически доступных и относительно простых в применении методов [8]. Учитывая тот факт, что прямые методы исследования бета-адренорецепторного аппарата клеток являются достаточно трудоёмкими и дорогими, отдельное внимание заслужили косвенные методики оценки активности САС [9]. Одним из таких методов является экспрессметод определения адренореактивности, основанный на факте изменения степени гипоосмотического гемолиза при связи адреномиметиков и адреноблокаторов с бета-адренорецепторами эритроцитов человека, в ходе которого ингибирование осмолиза эритроцитов зависит от количества функционально активных бета-адренорецепторов на поверхности клеток и указывает на их адренореактивность [9].
Вместе с тем, учитывая, что в настоящее время имеются лишь единичные работы, результатом которых является доказательство наличия связи между состоянием бета-адрренореактивности мембран эритроцитов и генетическими особенностями бета-адренорецепторного аппарата клеток, в частности геном бета-1- адренорецепторов (ADRB1), исследования в этом направлении являются не только актуальными, но и в целом отражают необходимость установления подобного рода ассоциаций для увеличения диагностического потенциала и расширения возможностей клинического применения методик определения активности САС.
Материалы и методы
В исследование включены 62 пациента с ИМ: 49 мужчин в возрасте 58,0 (47,5;64,5) лет и 13 женщин в возрасте 76,0 (61,5;81,0) лет, госпитализированных не позднее 6 часов от начала развития симптомов.
Диагноз ИМ выставляли в соответствии с текущими рекомендациями по диагностике и лечению ИМ [10, 11].
Работа выполнена в соответствии с Хельсинской декларацией Всемирной медицинской ассоциации. Протокол исследования одобрен локальным этическим комитетом НИИ кардиологии Томского НИМЦ (протокол № 163 от 8 ноября 2017 г.). Все пациенты подписали добровольное информированное согласие на включение в исследование с последующим забором крови и использованием полученных результатов в рамках исследования.
Критерии исключения пациентов из исследования были следующие: клиническая картина острого ИМ длительностью более 6 часов к моменту поступления в стационар; онкологические и аутоиммунные заболевания; терминальная почечная, печеночная недостаточность; тиреотоксикоз; острые хронические инфекционные заболевания или обострение хронических инфекционных заболеваний; психические расстройства; декомпенсация сахарного диабета; клапанные пороки сердца.
Всем включённым в исследование пациентам выполнялся генетический анализ на определение полиморфизмов гена бета-1- адренорецепторов ADRB1 (Ser49Gly и Arg389Gly). Генетическое исследование проводилось путём выделения ДНК из лейкоцитов периферической крови (Wizard Genomic DNA Purification Kit) с амплификацией методом ПЦР и дальнейшей электрофоретической детекцией.
Также на момент госпитализации всем пациентам проводился забор крови для анализа бета-адренореактивности по изменению осморезистентности эритроцитов под влиянием бета-адреноблокатора (1-(1-изопропиламино)-3- (1 нафталенил-окси)-2-пропанол гидрохлорид). Анализ выполнялся с помощью набора реагентов БЕТА-АРМ АГАТ. Данная методика основана на факте торможения гемолиза эритроцитов в присутствии бета-адреноблокатора. Степень гемолиза определяется по величине оптической плотности надосадочной жидкости, выраженной в процентах от величины оптической плотности контрольной пробы. Единицы процентов принимаются за условные единицы (усл.ед.) показателя бета-адренореактивности мембран эритроцитов (β-АРМ). При этом за норму были приняты установленные авторами данного экспресс-метода Р.И. Стрюк и И.Г. Длусской границы величины показателя β-АРМ в пределах 2-20 усл.ед. Повышенные значения показателя β-АРМ (более 20 усл.ед.) отражали сниженную адренореактивность, или уменьшение количества адренорецепторов на мембране эритроцитов.
Все обследованные пациенты были разделены на две группы в зависимости от величины показателя β-АРМ на момент острого ИМ. Первая группа (I группа, n = 11) была представлена пациентами с нормальным уровнем показателя бета-адренореактивности мембран эритроцитов (β-АРМ от 2 до 20 усл.ед.). Вторая группа (II группа, n = 51) включала пациентов с повышенными значениями данного показателя (β-АРМ более 20 усл.ед.).
Статистическая обработка полученных данных выполнялась с помощью программ STATISTICA 10 и демо-версии SPSS Statistics 20.0. Качественные данные представлены в виде абсолютных и относительных величин n (%). Сравнительный анализ номинальных данных выполнялся с использованием критерия x2 Пирсона и двустороннего точного теста Фишера в случае, если ожидаемое значение признака хотя бы в одной ячейке таблицы сопряжённости было меньше 5. Анализ количественных данных на соответствие нормальному закону распределения проводился с использованием критерия Шапиро-Уилка. Не соответствующие нормальному закону распределения количественные данные представлены в виде медианы и интерквартильного размаха (Me(Q25;75)). Для сравнения количественных данных в двух независимых выборках в случае распределения, отличного от нормального, применялся U-критерий Манна-Уитни. Критический уровень значимости при проверке статистических гипотез считался равным 0,05 (р — достигнутый уровень значимости).
Результаты
Группы не имели статистически значимых различий по возрастно-половому составу и основным клиническим характеристикам инфаркта миокарда, были также сопоставимы по наличию ишемической болезни сердца (ИБС) и хронической сердечной недостаточности (ХСН) в анамнезе. Кроме того, исследуемые группы не различались по наличию фибрилляции предсердий и частоте проведения интервенционной или хирургической коррекции коронарного кровотока в анамнезе, а также по частоте приема бета-адреноблокаторов до развития индексного ИМ (табл. 1). Вместе с тем, для пациентов второй группы было характерно более частое наличие в анамнезе артериальной гипертонии (АГ), чем для пациентов первой группы (90,2% и 63,6% случаев соответственно) (p = 0,044).
Кроме этого, у каждого третьего пациента в группе с повышенными значениями β-АРМ регистрировалось такое осложнение острого периода ИМ, как острая левожелудочковая недостаточность (ОЛЖН) (33,3%, n = 17), тогда как среди больных с нормальным уровнем β-АРМ случаи ОЛЖН не диагностировались (р = 0,026) (табл. 1).
Таблица 1
Клинико-анамнестическая характеристика пациентов с инфарктом миокарда в зависимости от уровня показателя β-АРМ

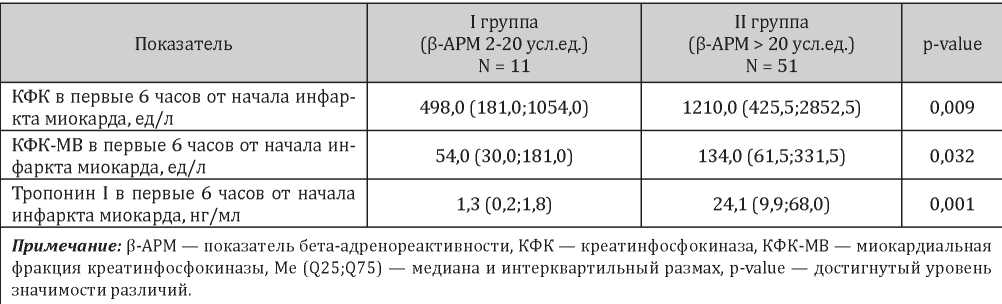
При анализе концентраций биомаркеров некроза в крови было установлено, что для пациентов с повышенными значениями показателя β-АРМ были характерны значительно более высокие уровни миокардиальных маркеров, чем для пациентов, у которых показатели β-АРМ были в пределах нормы. Так, уровень креатинфосфокиназы (КФК) у пациентов второй группы существенно превышал значения данного биомаркера в первой группе (1210,0 (425,5;2852,5) ед/л и 498,0 (181,0;1054,0) ед/л соответственно, p = 0,009). Аналогичной была картина в отношении креатинфосфокиназы-МВ (КФК-МВ) и высокочувствительного тропонина I. Уровень КФК-МВ во второй группе пациентов был более чем в два раза выше, чем в первой группе (134,0 (61,5;331,5) ед/л и 54,0 (30,0;181,0) ед/л соответственно, p = 0,032). В отношении уровня тропонина I наблюдалось более чем 20-кратное превышение нормальных значений данного показателя во второй группе больных (1,3 (0,2;1,8) нг/мл и 24,1 (9,9;68,0) нг/мл соответственно, p = 0,001) (табл. 2).
Таблица 2
Уровни биомаркеров некроза у пациентов исследуемых групп, Me (Q25; Q75)
С целью поиска ассоциации гена ADRB1 с показателями бета-адренореактивности мембран эритроцитов при ИМ у всех включённых в исследование пациентов были исследованы два полиморфизма данного гена (Ser49Gly и Arg389Gly).
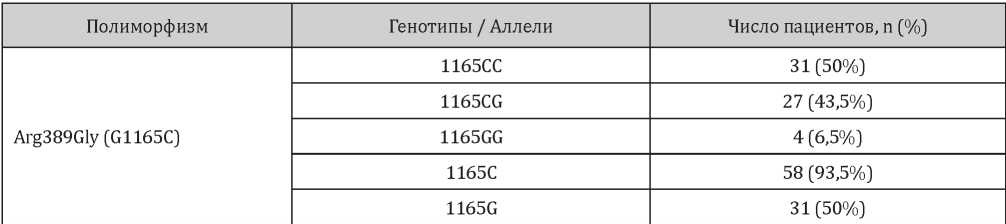
Распределение полиморфных вариантов полиморфизмов Ser49Gly и Arg389Gly гена ADRB1 представлено в табл. 3 и 4.
Таблица 3
Распределение генотипов и аллелей полиморфизма Ser49Gly гена ADRB1 у включённых в исследование пациентов
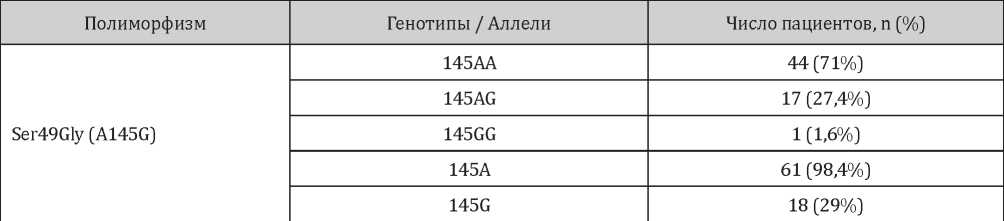
Таблица 4
Распределение генотипов и аллелей полиморфизма Arg389Gly гена ADRB1 у включенных в исследование пациентов
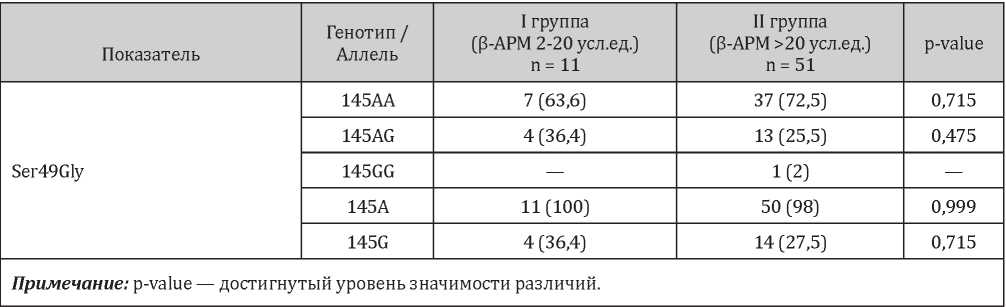
Для выявления ассоциации полиморфизмов гена ADRB1 с бета-адренореактивностью мембран эритроцитов был проведён анализ носительства генотипов и аллей исследуемых полиморфных вариантов в группах пациентов с нормальными и повышенными значениями показателя β-АРМ. Проведённый генетический анализ в отношении полиморфизма Ser49Gly гена ADRB1 не выявил статистически значимых различий в носительстве генотипов и аллелей данного полиморфизма в первой и второй группах (табл. 5).
Таблица 5
Распределение генотипов и аллелей полиморфизма Ser49Gly гена ADRB1 по группам в зависимости от уровня показателя β-АРМ, n (%)
Вместе с тем, были установлены существенные различия в носительстве генотипов и аллелей полиморфизма Arg389Gly гена ADRB1 среди пациентов с нормальными и повышенными значениями показателя β-АРМ на момент острого ИМ.
Выявлено, что во второй группе пациентов преобладало носительство генотипа CC гена ADRB1 (n = 29; 56,9%; p = 0,043), в то время как в первой группе чаще встречались носители генотипа CG (n = 8; 72,7%) (ОШ = 4,29; 95% ДИ 1,06–19,01; p = 0,045). Вместе с тем, носительство аллеля G значительно чаще наблюдалось среди пациентов с нормальными значениями показателя β-АРМ (81,8% и 43,1% соответственно) (ОШ = 5,93; ДИ 1,16–30,25; p = 0,043) (табл. 6). Вместе с тем, были установлены существенные различия в носительстве генотипов и аллелей полиморфизма Arg389Gly гена ADRB1 среди пациентов с нормальными и повышенными значениями показателя β-АРМ на момент острого ИМ.
Таблица 6
Распределение генотипов и аллелей полиморфизма Arg389Gly гена ADRB1 по группам в зависимости от уровня показателя β-АРМ, n (%)
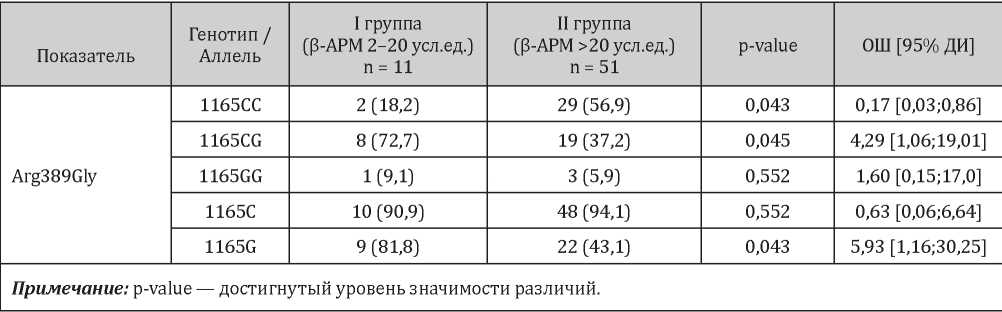
Выявлено, что во второй группе пациентов преобладало носительство генотипа CC гена ADRB1 (n = 29; 56,9%; p = 0,043), в то время как в первой группе чаще встречались носители генотипа CG (n = 8; 72,7%) (ОШ = 4,29; 95% ДИ 1,06– 19,01; p = 0,045). Вместе с тем, носительство аллеля G значительно чаще наблюдалось среди пациентов с нормальными значениями показателя β-АРМ (81,8% и 43,1% соответственно) (ОШ = 5,93; ДИ 1,16–30,25; p = 0,043) (табл. 6).
Обсуждение
Установлено, что пациенты с повышенным уровнем показателя бета-адренореактивности мембран эритроцитов, косвенно отражающем состояние гиперактивации САС, отличаются более неблагоприятными клинико-анамнестическими показателями на момент развития ИМ. Так, для данной группы больных характерны более высокие уровни миокардиальных маркеров некроза, чаще наблюдаются осложнения в острую стадию ИМ в виде ОЛЖН, а также преобладает неблагоприятный анамнестический фон в виде наличия АГ в анамнезе на момент развития ИМ. Данный факт находит свое подтверждение и в других работах, показавших, что высокие индивидуальные величины β-АРМ предопределяют гиперадренергический вариант гипертонической болезни, а также характеризуют более тяжелое течение сердечной недостаточности у пациентов с инфарктом миокарда, отражая тем самым повышенную активность САС [9, 12].
На сегодняшний день в доступной литературе отсутствуют убедительные доказательства наличия ассоциации гена бета-1-адренорецепторов с показателями бета-адренореактивности мембран эритроцитов, в частности у пациентов с ИМ. В то же время, имеются некоторые данные, указывающие на вероятное наличие такой взаимосвязи. Так, у пациентов с фибрилляцией предсердий и ХСН установлена ассоциация носительства гомозиготного генотипа Ser49Ser гена ADRB1 c высокими значениями показателя бетаадренореактивности мембран эритроцитов [13]. Вместе с тем, в данном исследовании не было обнаружено ассоциации β-АРМ с носительством гомо- или гетерозиготного генотипа полиморфизма Arg389Gly. В нашей работе, напротив, ассоциация с показателями бета-адренореактивности была выявлена для полиморфизма Arg389Gly, что может быть связано с особенностями выборки и включением в исследование пациентов с ИМ.
Исходя из того, что аллельные вариации гена бета-адренорецепторов детерминируют характер рецепторного ответа, в том числе в условиях гиперактивации САС [9,14], полученные ассоциации могут указывать на наличие взаимосвязи между уровнем β-АРМ и состоянием рецепторного аппарата САС сердца, что наводит на мысль о генетической предрасположенности к гиперактивации САС.
Все вышеперечисленное усиливает актуализацию вопроса о необходимости проведения подобного рода исследований, направленных на доказательство наличие взаимосвязей между состоянием адренореактивности и генетическими особенностями бета-адренорецепторного аппарата клеток.
Выводы
Установлена ассоциация генотипа 1165CC полиморфизма Arg389Gly гена бета-1-адренорецепторов с повышенными значениями показателя β-АРМ в остром периоде ИМ, что может свидетельствовать о возможной генетической предрасположенности к гиперактивации САС при ИМ. Обнаруженные в настоящем исследовании ассоциации указывают на необходимость дальнейшего изучения полиморфизмов, а также уровня экспрессии гена ADRB1 у пациентов с высокими индивидуальными величинами показателя бета-адренореактивности мембран эритроцитов, выявленными в остром периоде ИМ.
Список литературы
1. Bankenahally R., Krovvidi H. Autonomic nervous system: anatomy, physiology, and relevance in anaesthesia and critical care medicine. BJA Education. 2016;16(11):381-387. DOI: 10.1093/bjaed/mkw011.
2. Goldberger J.J., Arora R., Buckley U., Shivkumar K. Autonomic Nervous System Dysfunction: JACC Focus Seminar. Journal of the American College of Cardiology. 2019;73(10):1189-1206. doi: 10.1016/j.jacc.2018.12.064.
3. Johnson J.O. Chapter 12: Autonomic Nervous System: Physiology. Pharmacology and Physiology for Anesthesia (Second Edition). 2019:208-217.
4. De Lucia C, Piedepalumbo M., Paolisso G., Koch W.J. Sympathetic nervous system in age-related cardiovascular dysfunction: Pathophysiology and therapeutic perspective. International Journal of Biochemistry and Cell Biology. 2019;108:29-33. doi: 10.1016/j.biocel.2019.01.004.
5. Довгалевский П.Я., Фурман Н.В., Рыбак О.К., Мухторов В.В., Шамьюнов М.Р. Особенности течения острого инфаркта миокарда в зависимости от вегетативной регуляции сердечного ритма. Скорая медицинская помощь. 2001;4:47-49. eLIBRARY ID: 36264179
6. Нарыжная Н.В., Маслов Л.Н., Ревинская Ю.Г. Взаимодействие симпатоадреналовой и опиоидной систем как регуляторный механизм, определяющий устойчивость сердца к повреждающему действию стресса. Успехи фи-зиологичесских наук. 2001;32(4):37-73.
7. Олейников В.Э., Душина Е.В., Лукьянова М.В., Барменкова Ю.А., Моисеева И.Я. Оценка и прогностическое значение симпатовагального статуса пациентов в остром периоде инфаркта миокарда с подъемом сегмента ST. Сибирский медицинский журнал. 2018;33(4):90-97. doi: 10.29001/2073-8552-2018-33-4-90-97.
8. Шляхто Е.В., Конради А.О. Причины и последствия активации симпатической нервной системы при артериальной гипертензии. Артериальная гипертензия. 2003;9(3):81-88. doi: 10.18705/1607-419X-2003-9-3-81-88.
9. Стрюк Р.И., Длусская И.Г. Адренореактивность и сердечно-сосудистая система. М: Медицина. 2003:160 с.
10. Общество специалистов по неотложной кардиологии. Клинические рекомендации: Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы. Министерство здравоохранения Российской Федерации. 2016:1-13.
11. Рабочая группа по ведению пациентов с острым инфарктом миокарда с подъемом сегмента ST Европейского общества кардиологов. Рекомендации Европейского общества кардиологов по ведению пациентов с острым инфарктом миокарда с подъемом сегмента ST 2017. Российский кардиологический журнал. 2018;23(5):103-158. Doi: 10.15829/1560-4071-2018-5-103-158.
12. Александренко В.А., Реброва Т.Ю., Афанасьев С.А., Гарганеева А.А. Взаимосвязь адренореактивности со стадией хронической сердечной недостаточности у пациентов, перенесших инфаркт миокарда. Сибирский медицинский журнал. 2019;34(2):79-83. doi: 10.29001/2073-8552-2019-34-2-79-83.
13. Афанасьев С.А., Реброва Т.Ю., Муслимова Э.Ф., Борисова Е.В. Ассоциация полиморфных вариантов гена ADRB1 c сократительной дисфункцией миокарда и адренореактивностью эритроцитов у пациентов с нарушениями ритма. Российский кардиологический журнал. 2019;24(7):47-52. doi: 10.15829/1560-4071-2019-7-47-52.
Об авторах
А. А. ГарганееваРоссия
Гарганеева Алла Анатольевна - доктор медицинских наук, профессор, руководитель отделения патологии миокарда.
Томск
В. А. Александренко
Россия
Александренко Виктория Анатольевна - младший научный сотрудник отделения патологии миокарда, Научно-исследовательский институт кардиологии.
Томск
Е. А. Кужелева
Россия
Кужелева Елена Андреевна, кандидат медицинских наук, научный сотрудник отделения патологии миокарда.
Томск
С. А. Афанасьев
Россия
Афанасьев Сергей Александрович - доктор медицинских наук, профессор, руководитель лаборатории молекулярно-клеточной патологии и генодиагностики.
Томск
Т. Ю. Реброва
Россия
Реброва Татьяна Юрьевна - кандидат медицинских наук, научный сотрудник лаборатории молекулярно-клеточной патологии и генодиагностики.
Томск
Э. Ф. Муслимова
Россия
Муслимова Эльвира Фаритовна - кандидат медицинских наук, научный сотрудник лаборатории молекулярно-клеточной патологии и генодиагностики.
Томск
И. В. Максимов
Россия
Максимов Иван Вадимович, доктор медицинских наук, профессор, ведущий научный сотрудник отделения неотложной кардиологии.
Томск
Рецензия
Для цитирования:
Гарганеева А.А., Александренко В.А., Кужелева Е.А., Афанасьев С.А., Реброва Т.Ю., Муслимова Э.Ф., Максимов И.В. Ассоциация показателя бета-адренореактивности мембран эритроцитов при инфаркте миокарда с генетическими особенностями бета-адренорецепторного аппарата. Южно-Российский журнал терапевтической практики. 2021;2(1):32-39. https://doi.org/10.21886/2712-8156-2021-2-1-32-39
For citation:
Garganeeva A.A., Aleksandrenko V.А., Kuzheleva E.A., Afanasiev S.A., Rebrova T.Y., Muslimova E.F., Maksimov I.V. Association of beta-adrenergic reactivity index of erythrocyte membranes in myocardial infarction with genetic features of the beta-adrenoreceptor apparatus. South Russian Journal of Therapeutic Practice. 2021;2(1):32-39. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-1-32-39


























