Перейти к:
Ведущие предикторы ранней и поздней госпитальной летальности среди больных с острой декомпенсацией сердечной недостаточности и пути улучшения прогноза
https://doi.org/10.21886/2712-8156-2021-2-1-40-49
Аннотация
Цель: ипровести анализ ведущих причин ранней (первые двое суток) и поздней (после вторых суток) госпитальной летальности среди пациентов с острой декомпенсацией сердечной недостаточности.
Материалы и методы: ретроспективная одноцентровая когорта (n=718) пациентов с острой декомпенсацией сердечной недостаточности.
Результаты: предикторами прогноза для ранней госпитальной летальности оказались клинические проявления отёка лёгких, гепатомегалия, необходимость в применении инотропных и вазопрессорных препаратов, уровень систолического артериального давления и креатинина. Предикторами прогноза для поздней госпитальной летальности оказались клинические проявления отека легких, необходимость применения инотропных препаратов, внебольничная пневмония и лабораторные маркеры острого почечного повреждения.
Заключение: предложены тактические подходы, реализация которых может привести к улучшению госпитального прогноза пациентов.
Для цитирования:
Поляков Д.С., Фомин И.В., Виноградова Н.Г., Бадин Ю.В., Щербинина Е.В., Вайсберг А.Р. Ведущие предикторы ранней и поздней госпитальной летальности среди больных с острой декомпенсацией сердечной недостаточности и пути улучшения прогноза. Южно-Российский журнал терапевтической практики. 2021;2(1):40-49. https://doi.org/10.21886/2712-8156-2021-2-1-40-49
For citation:
Polyakov D.S., Fomin I.V., Vinogradova N.G., Badin Yu.V., Shcherbinina E.V., Vaisberg А.R. Leading predictors of early and late hospital mortality among patients with acute decompensated heart failure and ways to improve prognosis. South Russian Journal of Therapeutic Practice. 2021;2(1):40-49. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-1-40-49
Введение
Пациенты, находящиеся на финальном этапе сердечно-сосудистого континуума и формирующие хроническую сердечную недостаточность (ХСН), являются самым уязвимым контингентом. От момента выявления ХСН «denovo» до гибели больного обычно проходит около 10 лет [1]. Формирование острой декомпенсации сердечной недостаточности (ОДСН) приводит к необратимому уменьшению функциональных резервов миокарда и увеличивает риски летальных исходов с каждой последующей госпитализацией [2]. В последние десятилетия в экономически развитых странах мира за счёт улучшения качества и объёма оказания медицинской помощи отмечается снижение числа смертей от инфаркта миокарда и одновременно с этим отмечается рост распространенности ХСН в популяции [3], поэтому в ближайшем будущем всё более актуальной становится проблема улучшения прогноза у больных ХСН и ОДСН.
Цель исследования — выявление наиболее важных предикторов госпитальной летальности среди пациентов, госпитализированных с явлениями ОДСН, и обсуждение тактических подходов, реализация которых может привести к снижению рисков смерти при формировании декомпенсации.
Материалы и методы
В качестве объекта исследования использовалась выборка пациентов, включённых в ретроспективное обсервационное когортное одноцентровое исследование «ЭПОХА-Д-ХСН». В более ранних работах нами уже были изложены основные описательные статистики когорты [4]. В исследование включались все пациенты с клиническими проявлениями ОДСН, госпитализированные в одно из лечебных учреждений стационарного типа г. Нижнего Новгорода за период с июля 2014 г. по июль 2015 г. вне зависимости от характера основного заболевания. Специально сформированный комитет экспертов, состоящий из сотрудников кафедры внутренних болезней ПИМУ, занимающих должность не ниже доцента кафедры, осуществлял анализ каждого клинического случая с целью выявления признаков ОДСН. В исследование включались пациенты, у которых отмечались клинические проявления декомпенсации сердечной недостаточности и был выявлен факт назначения петлевых диуретиков и/или сердечных гликозидов внутривенно в первые сутки госпитализации. Пациенты поступали в стационар экстренно по направлению скорой медицинской помощи или из десяти поликлиник Нижнего Новгорода. В исследование не включались пациенты с острым коронарным синдромом, так как стационар, на базе которого проводилось исследование, не имел возможности проводить эндоваскулярные вмешательства. Общее число госпитализаций, подвергнутых анализу, составило 5374. Из них в 832 случаях (15,5%) были выявлены признаки ОДСН. В течение года наблюдения часть пациентов была госпитализирована с явлениями ОДСН повторно, в связи с чем в анализе приняли участие 718 пациентов. Для решения задач исследования была разработана специальная форма первичной документации, в которой фиксировались анамнестические, антропометрические и клинические данные на момент поступления в стационар, диагноз при поступлении и выписке, проводимая в стационаре терапия, отмечались результаты лабораторных и инструментальных методов исследования, фиксировался исход госпитализации. Несмотря на то, что в исследовании ЭПОХА-Д-ХСН доступна информация об отдалённых исходах госпитализированных пациентов, в данной работе продолжительность наблюдения ограничена сроками госпитализации.
Для расчёта скорости клубочковой фильтрации (СКФ, мл/мин/1,73 м2) использовалась формула MDRD4. Уровень среднего артериального давления (СрАД, мм рт.ст.) вычислялся по формуле СрАД = ДАД + (САД-ДАД)/3, а уровень пульсового давления (ПульсАД, мм рт.ст.) — по формуле ПульсАД = САД – ДАД, где САД и ДАД — уровни систолического и диастолического артериального давления, представленные в мм рт.ст. Для выявления острого повреждения почек (ОПП) были использованы модифицированные критерии, полученные на основе критериев ОПП из рекомендаций KDIGO [5]: уровень креатинина в ходе госпитализации повышался/ понижался в 1,5 раза и более в течение 7 дней, либо в период пребывания больного в стационаре уровень креатинина повышался/понижался на 26,5 мкмоль/л и более в течение 48 ч. Поскольку в литературе нет общего мнения об уровнях трансаминаз, при которых могло быть подтверждено повреждение печени у больных с ОДСН, были выбраны два критерия печеночной дисфункции: 1) уровни аланинаминотрансферазы (АлАТ) и аспартатаминотрансферазы (АсАТ), превышающие 123 и 111 Е/л соответственно; 2) уровни АлАТ и АсАТ, превышающие 300 и 200 Е/л соответственно [6, 7].
Статистическая обработка материала осуществлялась в среде R1. Описательные статистики подгрупп представлены медианой, первым и третьим квартилями в случае, если признак измеряется в непрерывной шкале, и процентной долей в случае, если признак носит номинативный или порядковый характер. Для оценки значимости межгрупповых различий выполнялся тест Манна-Уитни для количественных признаков и тест хи-квадрат или точный тест Фишера для номинативных или порядковых признаков. В случае множественных межгрупповых сравнений использовалась поправка на множественные сравнения Беньямини-Хохберга. Исходная выборка случайным образом была разделена на тестовую и контрольную подгруппы в соотношении 7:3. Финальные математические модели представлены логит-моделями, где в качестве зависимой переменной принимал участие факт гибели пациента в ходе госпитализации. Отбор предикторов для логит-модели осуществлялся при помощи алгоритмов пошагового отбора переменных, целенаправленного отбора переменных, «дерева классификации» («дерева принятия решений») и «случайного леса». Используя предложенные алгоритмами предикторы, выполнялось построение логит-модели с использованием данных тестового подмножества, после чего проводилась оценка чувствительности, специфичности и точности классификации модели на контрольном подмножестве. Уровень 0,05 выбран в качестве порогового для оценки статистической значимости полученных различий. В финальную модель могли быть включены предикторы, уровень значимости которых не достигал 0,05, в ситуациях, когда добавление переменной в модель приводило к статистически значимому увеличению точности классификации на контрольном подмножестве (эффект взаимодействия признаков).
Результаты исследования
В полученной выборке пациентов с ОДСН госпитальная летальность составила 6,1% случаев, закономерно увеличиваясь с возрастом. В возрастной группе моложе 80 лет летальность среди мужчин оказалась в два раза выше по сравнению с аналогичным показателем среди женщин (6,5% против 2,8%, p=0,02). В возрастной группе 80 лет и старше летальность оказалась выше среди женщин (11,3%) по сравнению с мужчинами (8,9%), хотя полученные различия не достигли уровня статистической значимости (р=0,79) из-за относительно небольшого числа пациентов данной возрастной группы. В ходе работы был выполнен анализ госпитальной летальности среди когорты пациентов с ОДСН за период госпитализации. Распределение доли умерших пациентов в зависимости от дня госпитализации представлено на рис. 1.
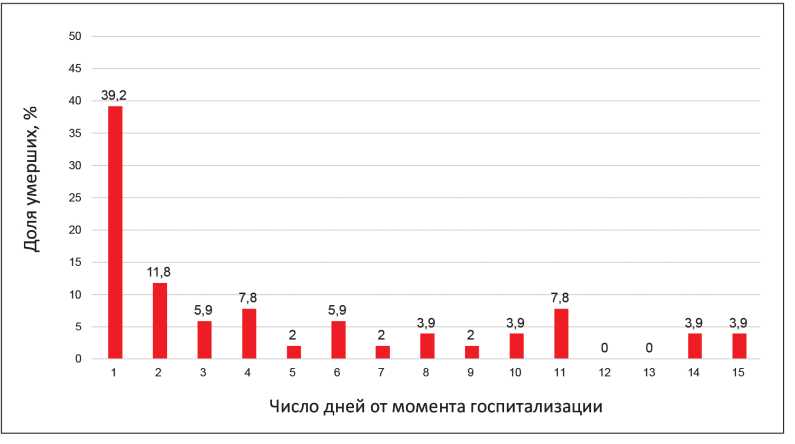
Рисунок 1. Доля умерших пациентов в зависимости от дня госпитализации.
Результаты проведенного анализа показали, что в первые сутки от момента госпитализации умерло 39,2% пациентов, тогда как на вторые сутки отмечалось снижение числа летальных исходов в три-четыре раза и доля умерших пациентов составила 11,8%. Суммарно 51% смертей в стационаре произошли в первый или второй день от момента госпитализации. После 15 дня госпитализации летальные исходы в выборке не регистрировались.
Исследователями сделано предположение о том, что основные причины летальности в первые двое суток от момента госпитализации и в более позднем периоде могут быть различными. Для проверки этой гипотезы были рассчитаны и оценены описательные статистики выживших и умерших пациентов в раннем и позднем госпитальном периодах. Результаты этого анализа представлены в таблице 1 (первые двое суток от момента госпитализации) и таблице 2 (после вторых суток от момента госпитализации).
Таблица 1
Описательные статистики пациентов с ОДСН, летальный исход у которых наступил в первые двое суток от момента госпитализации
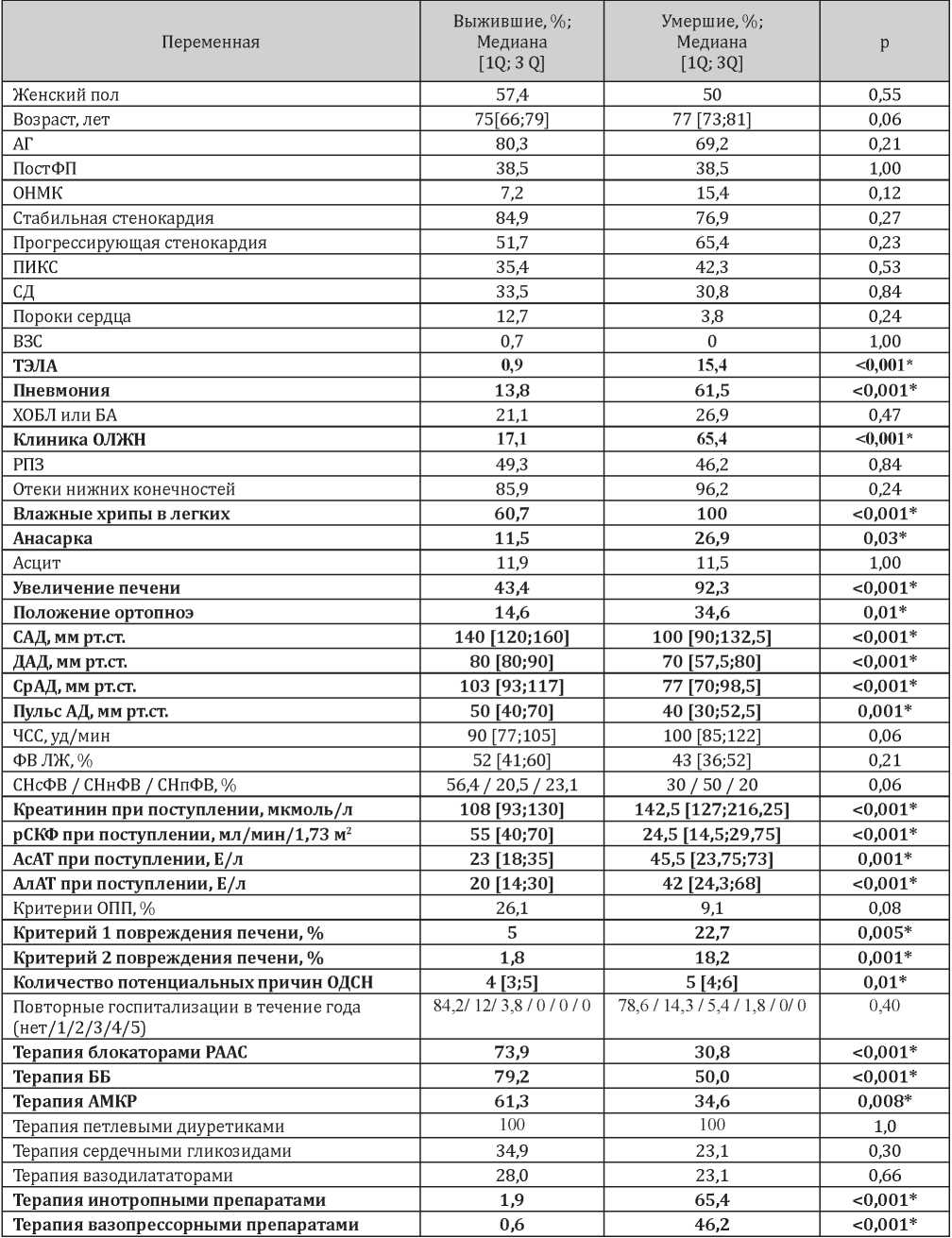
Примечание: * - различия признаны статистически значимыми
Таблица 2
Описательные статистики пациентов с ОДСН, летальный исход у которых наступил после вторых суток от момента госпитализации
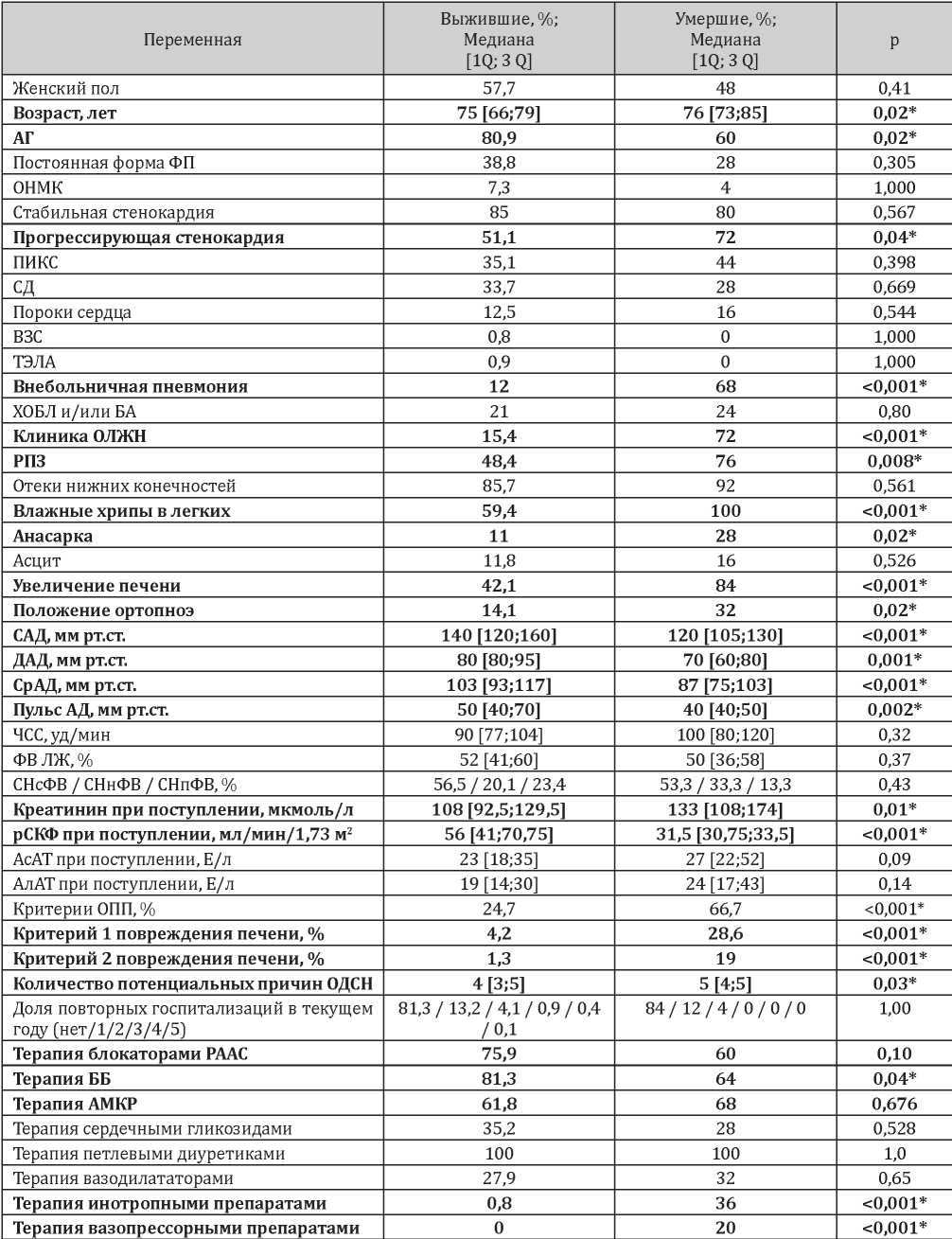
Примечание: * - различия признаны статистически значимыми
Анализ результатов, представленных в табл. 1, позволяет выявить статистически значимые различия между подгруппами пациентов, выживших и умерших к концу вторых суток госпитализации. Среди умерших почти в 15 раз чаще в качестве потенциальных причин ОДСН выявлялась тромбоэмболия легочной артерии (ТЭЛА) (р<0,001) и почти в 4 раза чаще — внебольничная пневмония (р<0,001). В подгруппе умерших выявлялась более тяжелая клиническая картина декомпенсации: в 3,8 раза чаще встречалась клиническая картина острой левожелудочковой недостаточности (ОЛЖН) в форме отека легких (p<0,001), в 2,4 раза чаще отмечена необходимость пребывания в положении ортопноэ (p=0,01), а также в 100% случаев выявлялись влажные хрипы в легких, что клинически подтверждает выраженность застойных явлений в малом круге кровообращения. Кроме того, среди умерших пациентов отмечались выраженные клинические проявления застоя в большом круге кровообращения в виде отеков нижних конечностей (в 96,2% случаев; р=0,24), гепатомегалии (в 92,3% случаев; р<0,001), анасарки (в 26,9% случаев, р=0,03). Умершие имели менее благоприятный гемодинамический профиль по сравнению с выжившими: среди них были выявлены более низкие значения САД (p<0,001) и ДАД (p<0,001), медианы которых составили всего 100 и 70 мм рт.ст. соответственно, прослеживалась тенденция к большим значениям ЧСС (р=0,06) и регистрировалась большая частота встречаемости СН с низкой фракцией выброса (СНнФВ).
Вероятнее всего, среди пациентов, умерших в первые двое суток с момента госпитализации, формирование выраженных застойных явлений и худший гемодинамический профиль являлись причиной более высокого риска формирования печеночной и почечной дисфункции. Так, среди умерших были выявлены более высокие значения креатинина (p<0,001), AсАТ (p=0,001) и АлАТ (p<0,001), большая частота встречаемости обоих критериев повреждения печени (в 4,5 раза чаще (p=0,005) выявлялся первый критерий и в 10,1 раза чаще (p=0,001) второй критерий), меньшие значения расчетной скорости клубочковой фильтрации (рСКФ, p<0,001). При этом частота
встречаемости критерия ОПП статистически значимо не различалась в подгруппах выживших и умерших. Это может быть объяснено тем, что согласно принятому определению, для выявления ОПП может потребоваться до 48 часов с момента госпитализации, тогда как большая часть летальных исходов в полученной выборке была зарегистрирована еще в первые сутки. Наконец, пациенты, умершие в первые двое суток, оказались более полиморбидны и имели большее число потенциальных причин ОДСН (p<0,01) по сравнению с выжившими.
Анализ лекарственной терапии позволил выявить, что умершие пациенты в первые двое суток значимо реже получали блокаторы ренин-ангиотензин-альдостероновой системы (РААС) (в 2,3 раза; р<0,001), бета-адреноблокаторы (ББ) (в 1,6 раза; р<0,001) и антагонисты минералокортикоидных рецепторов (АМКР) (в 1,8 раза; p=0,008), при этом среди них частота использования инотропных и вазопрессорных препаратов оказалась соответственно в 34,4 раза (p<0,001) и в 77 раз (p<0,001) выше. Вероятнее всего, представленные особенности терапии свидетельствуют о клинически выраженной гипотонии на момент госпитализации, что ограничивало возможности применения основных лекарственных средств для лечения сердечной недостаточности.
Анализ результатов, представленных в табл. 2, позволяет выявить статистически значимые различия в подгруппах выживших и умерших пациентов после вторых суток с момента госпитализации. Умершие пациенты оказались значимо старше (p=0,02). Среди потенциальных причин формирования ОДСН среди умерших реже выявлялась АГ (р=0,02), чаще — прогрессирующая стенокардия (в 1,4 раза; р=0,04) и внебольничная пневмония (в 5,6 раза; р<0,001). Клиническое течение основного заболевания в подгруппе с летальным исходом оказалось более тяжёлым: в 100% случаев на момент госпитализации были
выявлены влажные хрипы в легких, в 72% случаев отмечались клинические проявления ОЛЖН и отёка лёгких, около трети пациентов были вынуждены находиться в положении ортопноэ, у 76% пациентов были выявлены признаки застоя в лёгких. Гепатомегалия (84% случаев) и анасарка (28% случаев) статистически значимо чаще отмечались в подгруппе умерших пациентов. Отеки нижних конечностей с высокой вероятностью выявлялись как среди выживших, так и среди умерших пациентов. Уровень артериального давления и рСКФ среди умерших пациентов оказались статистически значимо ниже, а уровень креатинина сыворотки — выше.
Среди умерших в первые двое суток чаще отмечались критерии ОПП (66,7% против 24,7% случаев, p<0,001), первый и второй критерий повреждения печени (28,6% против 4,2% случаев (р<0,001) и 19% против 1,3% (р<0,001) соответственно).
Анализ медикаментозной терапии показал, что умершие пациенты реже получали ББ (р=0,04), но при этом инотропные препараты требовались каждому третьему больному, а вазопрессоры назначалась каждому пятому.
Среди переменных, указанных в табл. 1 и 2, при помощи статистических алгоритмов, описанных в разделе «Материалы и методы», был выполнен отбор предикторов, имеющих наибольшую значимость в отношении прогноза пациента. Оптимальной математической моделью для предсказания летального исхода в первые двое суток от момента госпитализации оказалась логит-модель, предикторы в которую были отобраны при использовании алгоритма «случайного леса». Результат работы данного алгоритма представлен на рисунке 2А, а экспоненты коэффициентов регрессионного уравнения — в таблице 3. При тестировании на контрольном подмножестве модель продемонстрировала чувствительность 1,0, специфичность 0,98, точность классификации 0,98. Для прогнозирования летального исхода после второго дня госпитализации оптимальной моделью оказалась логит-модель, предикторы в которую были отобраны алгоритмом «дерева решений» («дерева классификации»), результат работы которого представлен на рисунке 2Б, а экспоненты коэффициентов уравнения регрессии — в таблице 4. При тестировании на контрольном подмножестве данная модель продемонстрировала чувствительность 0,71, специфичность 0,97, точность классификации 0,96.
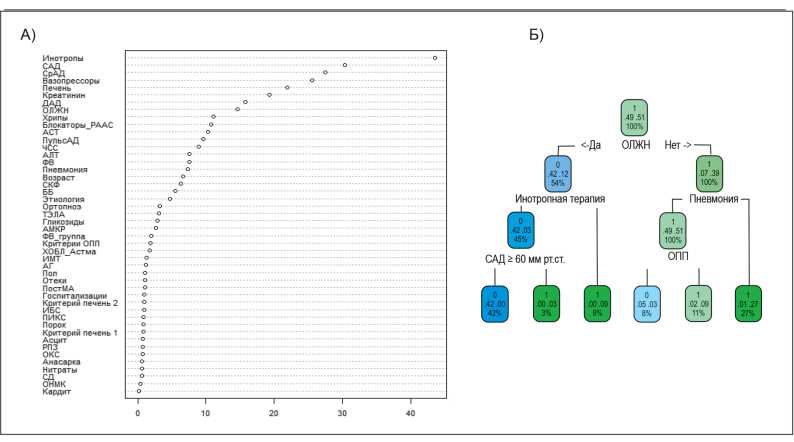
Рисунок 2. Результат работы алгоритмов по отбору оптимальных предикторов в модели предсказания летального исхода в первые двое суток от момента госпитализации (А) и после вторых суток (Б).
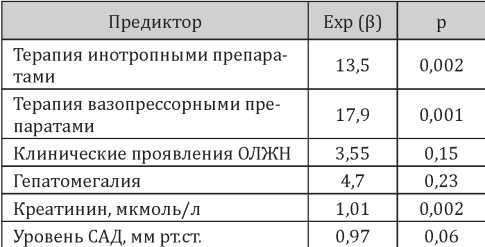
Анализ модели, представленной в таблице 3, демонстрирует, что наиболее значимыми предикторами летального исхода в первые двое суток от момента госпитализации среди пациентов с ОДСН являлись: необходимость терапии инотропными (увеличение риска в 13,5 раз; р=0,002) и вазопрессорными (увеличение риска в 17,9 раз; р=0,001) препаратами, наличие клинических проявлений ОЛЖН (увеличение риска в 3,55 раза (р=0,15) (в материалах и методах мы указали на возможность включения в финальную модель предикторов с уровнем p-value<0,05 в случае, если они улучшают классификацию в контрольной выборке), гепатомегалии (увеличение риска в 4,7 раза; р=0,23) и более высокие уровни сывороточного креатинина (увеличение риска на 1% на каждый 1 мкмоль/л; р=0,002). Более высокий уровень САД на момент поступления, наоборот, оказался протективным фактором и снижал риск смерти на 3% за каждый дополнительный мм рт.ст. (р=0,06).
Таблица 3
Коэффициенты логит-модели для предсказания летального исхода в первые двое суток после госпитализации
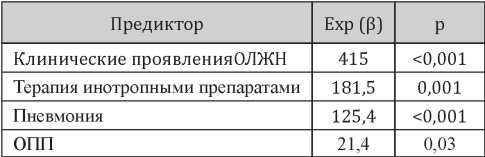
Анализ модели, представленной в табл. 4, свидетельствует о том, что риски смерти после вторых суток от момента госпитализации ассоциированы с наличием клинических проявлений ОЛЖН (увеличение риска в 415 раз; р<0,001), необходимостью в инотропной терапии (увеличение риска в 181,5 раза; р=0,001), присоединением внебольничной пневмонии (увеличение риска в 125,4 раза; р<0,001) и присутствием лабораторных признаков ОПП (увеличение риска смерти в 21,4 раза; р=0,03). Высокие значения экспоненты угловых коэффициентов членов регрессионного уравнения в таблице 4 свидетельствует о том, что эти предикторы являются определяющими для прогноза. Действительно, последующий анализ летальности после вторых суток от момента госпитализации показал, что в представленной выборке у умерших пациентов в 92,9% случаев присутствовал хотя бы один из указанных предикторов. Полученная модель продемонстрировала, что риск смерти оказался относительно невелик (менее 1%) при наличии одного из предикторов, однако при наличии двух предикторов происходило увеличение риска на 1–2 порядка, а сочетание трех и более предикторов предопределяло летальный исход в 87–100% случаев.
Таблица 4
Коэффициенты логит-модели для предсказания летального исхода после вторых суток
Обсуждение
По результатам работы, представленной выше, можно сделать вывод о том, что основными предикторами неблагоприятного исхода в полученной выборке как в раннем, так и в позднем периодах госпитализации оказались тяжёлые проявления ОЛЖН, застоя по малому и большому кругу кровообращения, формирование почечной дисфункции и низкий уровень артериального давления, который требует для своей коррекции назначения инотропных и вазопрессорных препаратов. На этапе после вторых суток к указанным выше предикторам добавляется еще один — наличие внебольничной пневмонии. Приоритетная коррекция указанных предикторов может обеспечить улучшение прогноза пациента.
В настоящее время клиническая медицина не располагает универсальными инотропными и вазоактивными препаратами, которые оказались бы более эффективными в отношении улучшения прогноза пациента по сравнению с добутамином или норадреналином [8, 9]. Имеются отдельные клинические исследования, свидетельствующие о том, что левосимендан в сравнении с добутамином может оказаться более эффективным в отношении влияния на маркеры почечной и печеночной дисфункции без значимого положительного влияния на конечные точки [7, 10]. Аналогичным образом, имеющиеся на настоящий момент альтернативные вазодилататоры в клинических исследованиях не показали преимуществ по сравнению с нитратами и стандартной диуретической терапией [11, 12]. Результаты мета-анализа показывают, что если назначение вазоактивной терапии неизбежно, то независимо от её типа, чем раньше она назначена, тем лучше оказывается прогноз пациента (оптимально — в течение первых 6 часов от момента поступления в стационар) [13]. Поиск новых инотропных и вазодилатирующих препаратов, способных улучшить прогноз пациента по сравнению со стандартной терапией, — одно из актуальных и важных направлений современной кардиологии.
Обсуждая пути улучшения прогноза при ОДСН, необходимо помнить, что для пациента с ХСН каждая повторная госпитализация увеличивает риски летальных исходов [14], поэтому предотвращение госпитализации может быть приравнено к улучшению прогноза в отношении выживаемости. В клинических испытаниях сакубитрил/валсартан демонстрирует убедительные преимущества по сравнению с эналаприлом в отношении влияния на конечные точки у пациентов с ХСН, в том числе на летальный исход. Назначение данного препарата в стационаре сразу после стабилизации гемодинамики приводит к снижению риска госпитализации по причине ухудшения сердечной недостаточности в течение 30 дней [15]. В нашей работе было показано, что объемная перегрузка с формированием выраженных застойных явлений является одним из важных предикторов прогноза. Опыт работы зарубежных клиник, где терапия петлевыми диуретиками назначалась амбулаторному пациенту внутривенно при ухудшении клинического течения ХСН («diuretic infusion clinic», «diuretic lounge» и др.), свидетельствует о том, что своевременная инициация или увеличение дозы петлевых диуретиков у пациента с утяжелением клинической симптоматики ХСН способны предотвратить формирование ОДСН и снизить риски госпитализации, что приведет к улучшению прогноза пациента [16, 17]. Аналогичным образом, самоконтроль пациента и активное врачебно-фельдшерское наблюдение за пациентом с ХСН в специализированном мультидисциплинарном центре Нижнего Новгорода позволяет своевременно корректировать терапию основного заболевания, что приводит к снижению рисков смерти и повторной госпитализации в 2,8-3 раза [18, 19].
Риски формирования кардиоренального синдрома с развитием ОПП у пациента с ОДСН тем больше, чем тяжелее стадия хронической болезни почек (ХБП) [20, 21]. Титрация вверх дозы основных лекарственных препаратов для лечения ХСН (блокаторов РААС, ББ) и достижение не менее 50% от целевой дозы лекарственного препарата позволяют не только улучшить прогноз и течение основного заболевания у пациента с СНнФВ, но и замедлить прогрессирование ХБП до более тяжелых стадий, что в свою очередь обеспечит снижение рисков формирования ОПП в случае ОДСН [22]. В 2019 г. были опубликованы результаты мета-анализа 41 клинического испытания с использованием ингибиторов натрий–глюкозного ко–транспортера 2 (SGLT2), в котором было показано, что предшествующее лечение препаратами данной группы может снижать риск формирования ОПП на 25% [23]. Однако для окончательного вывода об эффективности подобного подхода при формировании ОДСН необходимы целенаправленные клинические испытания в подгруппах пациентов, имеющих соответствующие риски.
В полученной выборке внебольничная пневмония оказалась значимым предиктором прогноза среди пациентов с ОДСН. Сходный прогноз был получен для больных пневмонией в сочетании с ОДСН в регистре «ОРАКУЛ-РФ» [24]. Большинство внебольничных пневмоний (30-50%) в настоящее время вызывается одним возбудителем — S. Pneumoniae2. В многоцентровом исследовании CAPITA [25] среди 84 тысяч пациентов в возрасте старше 65 лет 13-валентная противопневмококковая конъюгированная вакцина продемонстрировала 45% эффективность в отношении предотвращения внебольничной пневмонии, вызываемой вакцинассоциированными штаммами пневмококков. Согласно действующим клиническим рекомендациям, вакцинация против пневмококка рекомендована всем пациентам с ХСН [26].
Заключение
Снижение смертности среди пациентов с ОДСН является важной задачей современной кардиологии. Основными причинами ухудшения прогноза пациентов могут оказаться наличие выраженных застойных явлений по малому и большому кругу кровообращения, формирование ОПП и печеночной дисфункции, гипотония и ассоциированная с ней необходимость применения инотропной и/или вазопрессорной терапии, а также внебольничная пневмония. Наибольший эффект в отношении улучшения прогноза у пациента с ОДСН можно получить от мероприятий терапевтического и организационного характера, реализация которых должна осуществляться на амбулаторном этапе еще до госпитализации пациента.
1. R Core Team. R: A Language and Environment for Statistical Computing. R Foundation for Statistical Computing; 2019. http://www.R-project.org/
2. Российское респираторное общество, Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии. Внебольничная пневмония у взрослых. Клинические рекомендации.; 2019.
Список литературы
1. Chun S, Tu JV, Wijeysundera HC, Austin PC, Wang X, Levy D, et al. Lifetime analysis of hospitalizations and survival of patients newlyadmittedwithheartfailure.orrHeartFa/7.2012;5(4):414-21. doi: 10.1161/CIRCHEARTFAILURE.111.964791
2. Cowie MR, Anker SD, Cleland JGF, Felker GM, Filippatos G, Jaarsma T, et al. Improving care for patients with acute heart failure: before, during and after hospitalization. ESC Heart Fai7. 2014;1(2):110-145. doi: 10.1002/ehf2.12021.
3. Ezekowitz JA, Kaul P, Bakal JA, Armstrong PW, Welsh RC, McAlister FA. Declining in-hospital mortality and increasing heart failure incidence in elderly patients with first myocardial infarction. J Am Co77 Cardio7. 2009;53(1):13-20. doi: 10.1016/j.jacc.2008.08.067
4. Поляков Д.С., Фомин И.В., Валикулова Ф.Ю., Вайсберг А.Р., Краием Н., Бадин Ю.В. и др. Эпидемиологическая программа ЭПОХА-ХСН: декомпенсация сердечной недостаточности в реальной клинической практике (ЭПОХА-Д-ХСН). Журнал Сердечная Недостаточность. 2016;17(6):299-305. eLIBRARY ID: 27714432
5. Российское Диализное Общество. Клинические практические рекомендации KDIGO по острому почечному повреждению. Нефрология И Диализ. 2014;16(4):1-155. eLIBRARY ID: 23330010
6. Ambrosy AP, Vaduganathan M, Huffman MD, Khan S, Kwasny MJ, Fought AJ, et al. Clinical course and predictive value of liver function tests in patients hospitalized for worsening heart failure with reduced ejection fraction: an analysis of the EVEREST trial. Eur J Heart Fai7. 2012;14(3):302-11. doi: 10.1093/eurjhf/hfs007
7. Nikolaou M, Parissis J, Yilmaz MB, Seronde MF, Kivikko M, Laribi S, et al. Liver function abnormalities, clinical profile, and outcome in acute decompensated heart failure. Eur Heart J. 2013;34(10):742-9. doi: 10.1093/eurheartj/ehs332
8. Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JGF, Coats AJS, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Devel-oped with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2016;37(27):2129-2200. doi: 10.1093/eurheartj/ehw128
9. Bistola V, Arfaras-Melainis A, Polyzogopoulou E, Ikonomidis I, Parissis J. Inotropes in Acute Heart Failure: From Guidelines to Practical Use: Therapeutic Options and Clinical Practice. Card Fai7 Rev. 2019;5(3):133-139. doi: 10.15420/cfr.2019.11.2
10. Rafouli-Stergiou P, Parissis JT, Anastasiou-Nana M. Inotropes for the management of acute heart failure patients with renal dysfunction. Still an option? Expert Opin Pharmacother. 2012;13(18):2637-47. doi: 10.1517/14656566.2012.749859
11. Curfman G. Vasodilator Therapy in Acute Heart Failure. JAMA. 2019;322(23):2288-2289. doi: 10.1001/jama.2019.20285
12. Holt DB Jr, Pang PS. Vasodilator Therapies in the Treatment of Acute Heart Failure. Curr Heart Fai7 Rep. 2019;16(1):32-37. doi: 10.1007/s11897-019-0421-4.
13. Peacock WF, Emerman C, Costanzo MR, Diercks DB, Lopatin M, Fonarow GC. Early vasoactive drugs improve heart failure outcomes. Congest Heart Fai7. 2009;15(6):256-64. doi: 10.1111/j.1751-7133.2009.00112.x.
14. Setoguchi S, Stevenson LW, Schneeweiss S. Repeated hospitalizations predict mortality in the community population with heart failure. Am Heart J. 2007;154(2):260-6. doi: 10.1016/j.ahj.2007.01.041
15. Desai AS, Claggett BL, Packer M, Zile MR, Rouleau JL, Swed-berg K, et al. Influence of Sacubitril/Valsartan (LCZ696) on 30-Day Readmission After Heart Failure Hospitalization. J Am Co77 Cardio7. 2016;68(3):241-248. doi: 10.1016/j.jacc.2016.04.047.
16. Alghalayini KW. Effect of diuretic infusion clinic in preventing hospitalization for patients with decompensating heart 1 Российское респираторное общество, Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии. Внебольничная пневмония у взрослых. Клинические рекомендации.; 2019. failure. SAGE Open Med. 2020;8:2050312120940094. doi: 10.1177/2050312120940094.
17. Buckley LF, Carter DM, Matta L, Cheng JW, Stevens C, Belen-kiy RM, et al. Intravenous Diuretic Therapy for the Management of Heart Failure and Volume Overload in a Multidisciplinary Outpatient Unit. JACC Heart Fail. 2016;4(1):1-8. doi: 10.1016/j.jchf.2015.06.017
18. Виноградова Н.Г., Поляков Д.С., Фомин И.В. Риски повторной госпитализации пациентов с ХСН при длительном наблюдении в специализированном центре лечения ХСН и в реальной клинической практике. Кардиология. 2020;60(3):59-69. Doi: 10.18087/cardio.2020.3.n1002
19. Фомин И.В., Виноградова Н.Г. Организация специализированной медицинской помощи больным с хронической сердечной недостаточностью. Кардиосоматика. 2017;8(3):10-15. doi: 10.26442/2221-7185_8.3.10-15
20. Holgado JL, Lopez C, Fernandez A, Sauri I, Uso R, Trillo JL, et al. Acute kidney injury in heart failure: a population study. ESC Heart Fail. 2020;7(2):415-422. doi: 10.1002/ehf2.12595
21. Shirakabe A, Hata N, Kobayashi N, Shinada T, Tomita K, Tsu-rumi M, et al. Prognostic impact of acute kidney injury in patients with acute decompensated heart failure. Circ J. 2013;77(3):687-96. doi: 10.1253/circj.cj-12-0994
22. Romero-Gonzalez G, Ravassa S, Gonzalez O, Lorenzo I, Rojas MA, Garcia-Trigo I, et al. Burden and challenges of heart failure in patients with chronic kidney disease. A call to action. Nefrologia. 2020;40(3):223-236. doi: 10.1016/j.ne-fro.2019.10.005.
23. Menne J, Dumann E, Haller H, Schmidt BMW. Acute kidney injury and adverse renal events in patients receiving SGLT2-inhibitors: A systematic review and meta-analysis. PLoS Med. 2019;16(12):e1002983. doi: 10.1371/journal.pmed.1002983
24. Арутюнов А.Г., Драгунов Д.О., Арутюнов Г.П., Рылова А.К., Пашкевич Д.Д., Витер К.В., и др. Первое открытое исследование синдрома острой декомпенсации сердечной недостаточности и сопутствующих заболеваний в Российской Федерации. Независимый регистр ОРАКУЛ-РФ. Кардиология. 2015;55(5):12-21. eLIBRARY ID: 23756615
25. Bonten MJ, Huijts SM, Bolkenbaas M, Webber C, Patterson S, Gault S, et al. Polysaccharide conjugate vaccine against pneumococcal pneumonia in adults. N Engl J Med. 2015;372(12):1114-25. doi: 10.1056/NEJMoa1408544
26. Мареев В.Ю., Фомин И.В., Агеев Ф.Т., Беграмбекова Ю.Л., Васюк Ю.А., Гарганеева А.А., и др. Клинические рекомендации ОССН - РКО - РНМОТ. Сердечная недостаточность: хроническая (ХСН) и острая декомпенсированная (ОДСН). Диагностика, профилактика и лечение. Кардиология. 2018;58(6S):8-158. Doi: 10.18087/cardio.2475
Об авторах
Д. С. ПоляковРоссия
Поляков Дмитрий Сергеевич - кандидат медицинских наук, доцент кафедры терапии и кардиологии.
Нижний Новгород
И. В. Фомин
Россия
Фомин Игорь Владимирович - доктор медицинских наук, доц., заведующий кафедрой госпитальной терапии и общей врачебной практики имени В.Г. Вогралика.
Нижний Новгород
Н. Г. Виноградова
Россия
Виноградова Надежда Георгиевна - кандидат медицинских наук, доцент кафедры терапии и кардиологии.
Нижний Новгород
Ю. В. Бадин
Россия
Бадин Юрий Викторович - кандидат медицинских наук, доцент кафедры терапии и кардиологии.
Нижний Новгород
Е. В. Щербинина
Россия
Щербинина Елена Васильевна - кандидат медицинских наук, доцент кафедры терапии и кардиологии.
Нижний Новгород
А. Р. Вайсберг
Россия
Вайсберг Александра Рудольфовна - кандидат медицинских наук, доцент кафедры терапии и кардиологии.
Нижний Новгород
Рецензия
Для цитирования:
Поляков Д.С., Фомин И.В., Виноградова Н.Г., Бадин Ю.В., Щербинина Е.В., Вайсберг А.Р. Ведущие предикторы ранней и поздней госпитальной летальности среди больных с острой декомпенсацией сердечной недостаточности и пути улучшения прогноза. Южно-Российский журнал терапевтической практики. 2021;2(1):40-49. https://doi.org/10.21886/2712-8156-2021-2-1-40-49
For citation:
Polyakov D.S., Fomin I.V., Vinogradova N.G., Badin Yu.V., Shcherbinina E.V., Vaisberg А.R. Leading predictors of early and late hospital mortality among patients with acute decompensated heart failure and ways to improve prognosis. South Russian Journal of Therapeutic Practice. 2021;2(1):40-49. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-1-40-49


























