Перейти к:
ХОБЛ и доклинические признаки поражения сердечно-сосудистой системы
https://doi.org/10.21886/2712-8156-2021-2-2-70-79
Аннотация
Цель: выявление особенностей мозгового кровотока и поиск ранних признаков ремоделирования миокарда у больных хронической обструктивной болезнью лёгких (ХОБЛ) c различной степенью ограничения воздушного потока.
Материалы и методы: в исследование вошло 105 пациентов с хронической обструктивной болезнью лёгких (ХОБЛ) от 1 до 4 степени тяжести в зависимости от степени ограничения объёма форсированного выдоха за первую секунду (ОФВ1) без сердечно-сосудистых заболеваний (ССЗ), сахарного диабета, хронической болезни почек, ожирения, иных системных и онкологических заболеваний. Средний возраст — 57,12 ± 0,68 лет, мужчины — 45%. Выделены пять групп: ХОБЛ 1 степени тяжести (n = 24), ХОБЛ 2 степени (n = 39), ХОБЛ 3 степени (n = 30), ХОБЛ 4 степени (n = 12), контрольная группа (n = 37) без анамнеза курения и ССЗ. Всем измерено артериальное давление (АД), выполнена ультразвуковая транскраниальная допплерография. В группах ХОБЛ 1 и 2 степени выполнена трансторакальная эхокардиография с оценкой глобальной и локальной продольной деформации левого желудочка (ЛЖ) методом strain, определением диастолической дисфункция левого желудочка (ДДЛЖ). Оценены параметры средних значений деформации в базальных, медиальных и апикальных сегментах. Результаты обрабатывались с помощью Microsoft Excel 2016 и STATISTICA 10 (StatSoft, Inc., США).
Результаты: при ХОБЛ со снижением ОФВ1 до 2 степени у 56,4% пациентов выявлена артериальная гипертензия, при 3 степени - у 56,7% и 4 степени - у 100% пациентов. Изменений показателей кровотока в средней мозговой артерии (СМА) при ХОБЛ 1 – 3 степени не обнаружено. При ХОБЛ 4 степени выявлено достоверное повышение линейной скорости кровотока средних мозговых артерий и индекса периферического сосудистого сопротивления относительно контроля и пациентов с ХОБЛ 1 – 3 степени (р < 0,05). Частота выявления диастолической дисфункции левого желудочка (ДДЛЖ 1) типа при ХОБЛ 1 – 2 степени составила 27,7% и оказалась достоверно выше у лиц с ХОБЛ и артериальной гипертензией (АГ) — 62,5% (χ² = 11,5, р = 0,009). У пациентов с ХОБЛ выявлены патологические паттерны на уровне базальных и медиальных отделов левого желудочка.
Заключение: у пациентов с ХОБЛ без ССЗ выявлены доклинические признаки поражения органов-мишеней. Изменения мозгового кровотока в виде повышения линейной скорости кровотока и индекса периферического сосудистого сопротивления установлены при ХОБЛ 4 степени При ХОБЛ 1 и 2 степени определены признаки поражения миокарда левого желудочка ()в виде наличия ДДЛЖ I типа, частота встречаемости которой выше при сочетании ХОБЛ с артериальной гипертензией(АГ), а также патологические паттерны на уровне базальных и медиальных отделов левого желудочка. Изменения органов-мишеней свидетельствуют о необходимости их углубленного поиска с целью реклассификации сердечно-сосудистого риска и определения индивидуального плана профилактики.
Ключевые слова
Для цитирования:
Невзорова В.А., Захарчук Н.В., Шапкина Е.Ю., Кондрашова Е.А., Кондрашов Д.В. ХОБЛ и доклинические признаки поражения сердечно-сосудистой системы. Южно-Российский журнал терапевтической практики. 2021;2(2):70-79. https://doi.org/10.21886/2712-8156-2021-2-2-70-79
For citation:
Nevzorova V.A., Zakharchuk N.V., Shapkina E.U., Kondrashova E.A., Kondrashov D.V. COPD and preclinical cardiovascular disease. South Russian Journal of Therapeutic Practice. 2021;2(2):70-79. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-2-70-79
Введение
Общие факторы риска хронических неинфекционных заболеваний, стойко удерживающих лидирующие позиции среди причин смертности взрослого населения, в частности курение, малоподвижный образ жизни, избыточная масса тела и ожирение, изменение спектра и увеличения объёма воздействия неблагоприятных факторов окружающей среды позволили сформировать новую парадигму взаимоотношений между заболеваниями сердечно-сосудистой и дыхательной систем, обозначенную как кардиопульмональный континиум [1]. Объединяющим патогенетическим механизмом большинства сердечнососудистых заболеваний (ССЗ), хронической обструктивной болезни легких (ХОБЛ), хронической сердечной недостаточности (ХСН) является вялотекущее системное воспаление, инициирующее развитие сосудистой эндотелиальной дисфункции с последующими изменениями в органах мишенях. В ряде многоцентровых исследований доказана связь между наличием ХОБЛ и риском развития сердечно-сосудистых событий [2][3][4], в том числе мозговых катастроф [5], даже при отсутствии курения [6]. В программном документе GOLD от 2020 г. наличие умеренного когнитивного дефицита признаётся одним из системных проявлений ХОБЛ, механизмы развития которого не могут быть в полной мере объяснены ускоренным развитием атеросклероза мозговых сосудов и/или поражением белого вещества головного мозга, но имеющих тесную связь с ограничением воздушного потока [7]. Существует зависимость между падением лёгочной функции у пациентов ХОБЛ и риском возникновения сердечной недостаточности [8]. ХОБЛ как фактор риска возникновения ХСН, по данным исследований, регистрируется от 11 до 30% случаев [9]. В российской популяции, согласно исследованию RUSHFR, среди пациентов с ХСН со сниженной фракцией выброса частота ХОБЛ составляет от 11,5 до 26,6% [10]. Однако данные большинства регистров доказывают вклад ХОБЛ в развитие ХСН с сохранной фракцией выброса, диагностика которой у коморбидных пациентов вызывает значительные трудности [11]. В настоящее время особое значение в выявлении поражения миокарда при сохранении его сократительной функции придаётся изучению показателей глобальной продольной деформации левого желудочка (ЛЖ) с помощью спекл-трекинг эхокардиографии (СТЭ), основанной на отслеживании спекл-фрагментов серо-шкального изображения и оценке степени укорочения миокардиальных волокон в трех плоскостях [12].
Исходя из концепции ранней диагностики этапов кардиопульмононального континуума, направленной на оптимизацию возможных терапевтических мер воздействия, наибольший практический интерес представляет выявление доклинических признаков поражения органов-мишеней сердечно-сосудистой системы у пациентов с ХОБЛ.
Цель исследования — выявление особенностей мозгового кровотока и поиск ранних признаков ремоделирования миокарда у больных ХОБЛ c различной степенью ограничения воздушного потока.
Материал и методы
В группу исследования было включено 105 пациентов с ХОБЛ от 1 до 4 степени тяжести ограничения объёма форсированного выдоха за первую секунду (ОФВ1) без документированных сердечно-сосудистых заболеваний, сахарного диабета, хронической болезни почек, ожирения, иных системных и онкологических заболеваний. Средний возраст пациентов 57,12 ± 0,68 лет, мужчины составили 45%. Среди пациентов, включённых в исследование, исходя из степени ограничения ОФВ1 были выделены следующие группы: группа ХОБЛ 1 степени (n = 24), ХОБЛ 2 степени (n = 39), пациенты с ХОБЛ 3 степени (n = 30), ХОБЛ 4 степени (n = 12). Диагноз ХОБЛ и степень ограничения ОФВ1 подтверждены результатами спирометрии на аппарате Spirolab III до и после пробы с бронхолитиками (400 мкг сальбутамола) (ОФВ1 / ФЖЕЛ 0 < 70% и прирост ОФВ1 < 12% от исходных значений). Контрольная группа пациентов (n = 37) была отобрана среди сопоставимых по полу и возрасту лиц без длительного анамнеза табакокурения и документированных хронических неинфекционных заболеваний (ХНИЗ). Всем обследованным было измерено артериальное давление (АД) согласно ГОСТ 52623.1–2008 Федерального агентства РФ по техническому регулированию и метрологии «Технология выполнения простой медицинской услуги. Измерение артериального давления на периферических артериях А 02.12.002». С помощью прибора «Nicolet Companion Biomedikal» (США) и датчика с частотой 2 МГц методом ультразвуковой транскраниальной допплерографии изучали показатели кровотоков в левой и правой средней мозговой артерии (СМА), так как это наиболее крупные ветви внутренних сонных артерий, кровоснабжающие соответствующие полушария головного мозга. Оценивались параметры линейной скорости кровотока (ЛСК) и индексы периферического сосудистого сопротивления: Vсист. (систолическая скорость кровотока), Vдиаст. (диастолическая скорость кровотока), Vсред. (средняя скорость кровотока), PI (пульсационный индекс), IR (индекс резистентности). Для выявления признаков раннего ремоделирования миокарда у больных ХОБЛ с лёгкой и умеренной степенями ограничения ОФВ1 была выполнена трансторокальная эхокардиография на приборе «Vivid E9» GE (США) линейным датчиком с частотой 9 мГц, секторным датчиком М5S с частотой 1,5 – 4,6 мГц с оценкой глобальной и локальной продольной деформации левого желудочка (ЛЖ) с 17 сегментарным делением методом strain. Диастолическая дисфункция левого желудочка (ДДЛЖ ЛЖ) 1 типа определялась при оценке трансмитрального потока и экскурсии межжелудочковой перегородки (МЖП) (Е/а < 0,8, Е/е’ > 15). С целью установления региональных паттернов деформации миокарда ЛЖ проводилась оценка параметров средних значений деформации в базальных (СБ), медиальных (средних) (СМ) и апикальных сегментах (СА). Для уточнения полученных данных в сравнительном аспекте использовали методику Phelan D. и соавт. [13] для расчёта относительной деформации в базальных (БОД), средних (СОД) и апикальных сегментах (АОД) и рассчитывали показатель относительной региональной деформации (ОРД) в соответствии с методикой Senapati A. и соавт. [14]. Дополнительно оценивали простые соотношения средних значений деформации базальных к средним сегментам (базально-медиальный паттерн (БМП), базальных к апикальным (базальноапикальный паттерн (БАП), средних к апикальным (медиально-апикальный паттерн (МАП)).
Протокол исследования был одобрен независимым этическим комитетом ФГБОУ ВО «Тихоокеанский государственный медицинский университет» Минздрава России. Получено информированное добровольное согласие всех пациентов на участие в исследовании.
Результаты обрабатывались при помощи пакета программ Microsoft Excel 2016 и STATISTICA 10 (StatSoft, Inc., США) в операционной среде Windows 7. Качественные критерии представлены в виде абсолютных и относительных величин, выраженных в процентах. Количественные признаки оценивались, исходя из типа распределения в выборке. При нормальном распределении данные представлены в виде среднего и стандартного отклонения (М±δ), при ненормальном — в виде медианы и интерквартильного размаха (Med (Нкв, Вкв)). Последующий анализ при нормальном распределении проводился методами параметрической статистики с использованием критерия Стьюдента, при ненормальном применялись непараметрические методы с критерием Манна–Уитни. Статистически значимыми признавались различия величин при уровне р < 0,013 при сравнении четырёх групп, р < 0,017 — при сравнении трёх групп. Значимость расхождения признаков при непараметрическом распределении оценивалась с помощью критерия Пирсона χ2.
Результаты
У лиц с ХОБЛ, включённых в исследование, более чем в половине случаев выявлена артериальная гипертензия (АГ), частота встречаемости которой зависела от спирометрической тяжести ХОБЛ. Так, в группе ХОБЛ 1 ст. с ОФВ1 > 80% пациентов с АГ не выявлено. При умеренной степени ограничения ОФВ1 от 50 до 80 % от должных величин АГ установлена у 56,4% пациентов со средними значениями АД 153,7 (148,0; 158,4) / 85,9(78,9; 92,8) мм рт.ст. В группе ХОБЛ 3 ст., где ограничение ОФВ1 составило 30 – 49% от должного, АГ была обнаружена у 56,7% пациентов со средним АД 150,3 (146,8; 153,9) / 88,8(84,6; 92,2) мм рт.ст. По мере прогрессирования снижения ОФВ1 < 30% от должного в группе ХОБЛ 4 ст. у 100% пациентов выявлена АГ, средние значения АД составили 152,9 (144,6; 159,1) / 92,9 (85,2; 98,2) мм рт.ст.
Учитывая вариабельность количественных показателей мозгового кровотока и их зависимость от уровня АД, для оценки мозгового кровотока были отобраны пациенты с 1-й степенью АГ, которые достигли целевых значений на фоне антигипертензивной терапии. Согласно данным литературы, для таких пациентов не характерны явления артериолосклероза, а фоновые показатели кровотока в интракраниальных артериях соответствуют нормативным возрастным значениям [15, 16, 17]. В связи с этим ожидаемые нами результаты исследования показателей мозгового кровотока в большей степени зависели от наличия ХОБЛ, а не от присутствия АГ.
Результаты проведения допплерографии в средней мозговой артерии у пациентов с ХОБЛ представлены в табл. 1.
Таблица 1
Показатели допплерографии в средней мозговой артерии при ХОБЛ (данные представлены в виде Med (Нкв, Вкв)
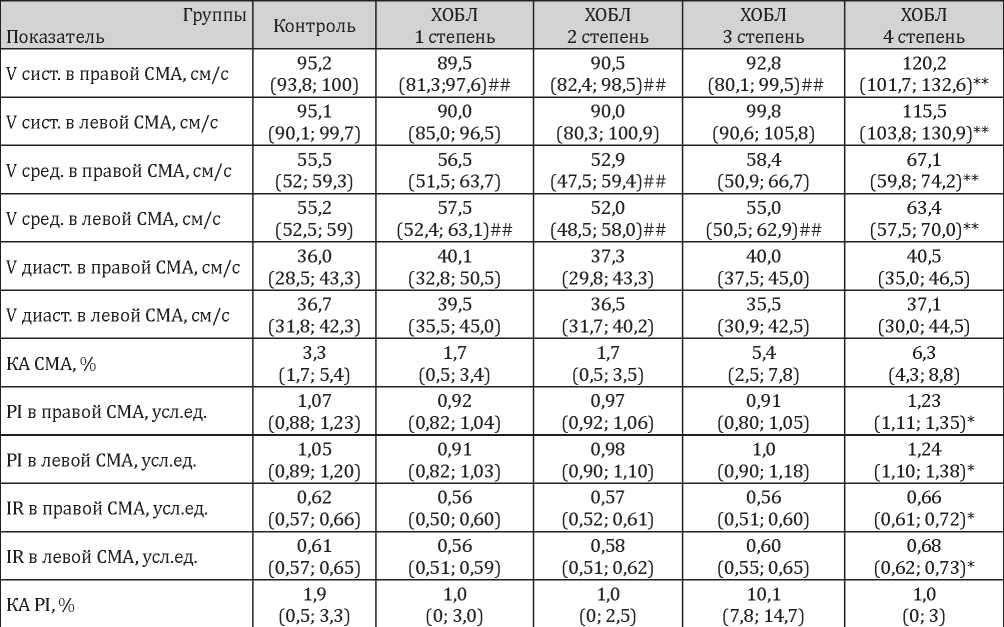
Примечание: Vсист. — систолическая скорость кровотока, Vдиаст. — диастолическая скорость кровотока, Vсред. — средняя скорость кровотока, IR — индекс резистентности, PI — пульсационный индекс, КА — коэффициента симметрии, * — различия статистически значимы между группой контроля и ХОБЛ при р < 0,05, ** — различия статистически значимы между группой контроля и ХОБЛ при р < 0,01; ## — различия статистически значимы между 1, 2, 3 степенью ХОБЛ и 4 степенью ХОБЛ при р < 0,013.
Согласно полученным данным, у пациентов с ограничением ОФВ1 от 1 до 3 степени отсутствовали достоверные изменения скорости кровотока в СМА. У пациентов с 1, 2 и 3 спирометрической степенью ХОБЛ показатели систолической скорости кровотока в правой СМА составили соответственно 89,5 (81,3;97,6), 90,5 (82,4; 98,5) и 92,8 (80,1; 99,5) см/с, не отличаясь от группы контроля (р >0,05). При исследовании левой СМА показатели систолической скорости кровотока также находились в пределах допустимого диапазона значений, без достоверности различий с группой контроля (р >0,05). Важно подчеркнуть, что анализ значений систолической, средней и диастолической скоростей кровотока в группах ХОБЛ 1, 2, 3 степени тяжести в зависимости от показателей ОФВ1 не подтвердил статистически значимой разницы между группами. При 4 степени снижения ОФВ1 установлено повышение ЛСК правой и левой СМА в диапазоне значений 120,2 (101,7; 132,6) см/с и 115,5 (103,8; 130,9) см/с соответственно, при сравнении как с группой контроля (р <0,05), так и группами ХОБЛ 1 – 3 ст. Кроме того в группе ХОБЛ 4 ст. обнаружено повышение средней скорости кровотока в правой СМА до 67,1 (59,8; 74,2) см/с, в левой СМА — до 63,4 (57,5; 70,0) см/с, статистически значимо отличаясь от группы контроля (55,5 (52; 59,3) и 55,2 (52,5; 59) см/с (р <0,05)).
При 1, 2 и 3 степени ХОБЛ также не обнаружено достоверного повышения индексов периферического сосудистого сопротивления по сравнению с группой контроля (табл. 1), что в сочетании с неизмененными показателями ЛСК в данных группах отражает высокие уровни автономности и компенсации мозгового кровотока при лёгком, умеренном и средне-тяжелом ограничениях ОФВ1.
При 4 степени ХОБЛ или выраженном ограничении показателей воздушного потока отмечалось статистически значимое повышение не только скоростных показателей кровотока, но и индексов периферического сосудистого сопротивления. Пульсационный индекс в правой СМА составил 1,23 (1,11; 1,35) усл. ед., в левой СМА — 1,24 (1,10; 1,38) усл.ед., что значимо отличается от группы контроля (р <0,05). Индекс резистентности в правой и левой СМА составил 0,66 (0,61; 0,72) и 0,68 (0,62; 0,73) усл. ед. соответственно, при сравнении с контрольной группой р <0,05 (табл. 1). При оценке уровня ассиметрии в показателях кровотока в СМА при ХОБЛ во всех группах превышения допустимых значений обнаружено не было.
Таким образом, изучение показателей мозгового кровотока при проведении допплерографии СМА у пациентов с ХОБЛ продемонстрировало сохранение механизмов его саморегуляции при снижении ОФВ1 от 1 до 3 степени. При этом значительное падение показателей ОФВ1 ≤30% сопровождалось статистически значимым увеличением скоростных показателей мозгового кровотока и индексов сосудистого сопротивления, что может иметь значение для риска развития сосудистых катастроф и когнитивных нарушений у пациентов с ХОБЛ.
Результаты ряда исследований доказывают, что доклинические признаки поражения миокарда, а именно гипертрофия миокарда ЛЖ, изменение спектра трансмитрального и транстрикуспидального потоков выявляются не на ранних стадиях ХНИЗ [18]. Для того, чтобы установить и оценить характер доклинического поражения миокарда при ХОБЛ и провести сравнительный анализ особенностей ремоделирования миокарда при сочетании ХОБЛ и АГ, дополнительно были выделены две группы. В первую группу включили пациентов с ХОБЛ 1 и 2 степени, во вторую — с ХОБЛ 2 степени и АГ. Выбор групп обусловлен возможным вкладом поражения миокарда правого желудочка в развитие доклинических признаков изменения миокарда левого желудочка при более значимых изменениях ОФВ1 [19]. Согласно данным эхокардиографии, ни у одного из пациентов в данных группах не установлены признаки гипертрофии миокарда левого желудочка (ГМЛЖ), увеличения размеров камер сердца, либо снижения фракции выброса. Тем не менее, во всех группах обследованных выявлены признаки диастолической дисфункции левого желудочка (ДДЛЖ) I типа, которую определяли согласно оценке трансмитрального потока и экскурсии МЖП (Е/а <0,8, Е/е’ >15). Частота встречаемости ДДЛЖ I типа разнится в выделенных группах обследованных (табл. 2) согласно Н- критерию Kruskal-Wallis. Так, в первой группе она установлена в 27,7% случаев и во второй — в 62,5%. При сочетании ХОБЛ и АГ частота встречаемости ДДЛЖ I типа статистически значимо выше (χ² = 11,5, р = 0,009 без указания в таблице) относительно всех прочих групп.
Таблица 2
Частота встречаемости ДДЛЖ I типа у пациентов, включенных в исследование

Согласно данным ЭХОКГ, выполненной методом strain, показатели глобальной продольной деформации ЛЖ соответствуют нормативным значениям во всех группах (более 19%), статистически значимые различия в зависимости от наличия АГ и ХОБЛ по сравнению с группой контроля отсутствуют (табл. 3). Также не выявлены изменения в показателях локальной продольной деформации ЛЖ. В связи с этим нам представилось интересным оценить средние показатели локальной продольной деформации на различных уровнях левого желудочка (базальном, медиальном и апикальном). В результате установлено, что средние значения деформации ЛЖ в апикальных сегментах (СА) не имеют статистически значимых различий во всех обследованных группах. В медиальных (СМ) и базальных сегментах (СБ) средние значения деформации ЛЖ ниже в группе пациентов с сочетанием
ХОБЛ и АГ по сравнению с группой контроля (z = 2,0, р = 0,04; z = 2,0, р = 0,04).
Таблица 3
Среднее значение продольной деформации по уровням ЛЖ
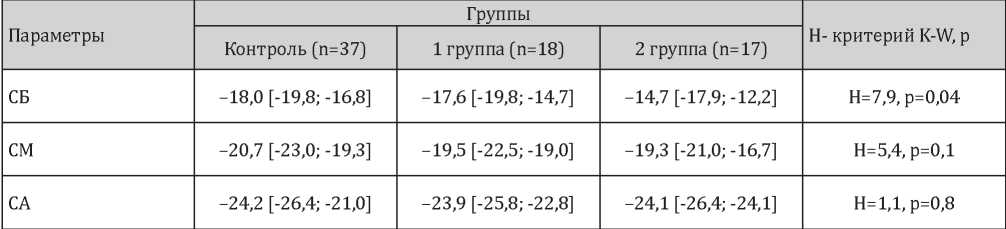
Примечание: СБ — среднее значение показателей локальной продольной деформации ЛЖ в базальных сегментах; СМ — среднее значение показателей локальной продольной деформации ЛЖ в медиальных сегментах; СА — среднее значение показателей локальной продольной деформации ЛЖ в апикальных сегментах.
Принимая во внимание отсутствие четких нормативных значений для показателей локальной продольной деформации ЛЖ, связанных с особенностями его кинетики, мы сочли необходимым сравнить примененные в исследовании расчеты с методиками иных авторов, в частности, с оценкой относительных показателей локальной продольной деформации ЛЖ в базальных, медиальных, апикальных сегментах, описанной Phelan D. и соавт. в 2012 г. [14] и Senapati A. и соавт. в 2016 г. [15]. Результаты представлены в табл. 4. Как следует из представленных данных, показатели относительной деформации миокарда в базальных сегментах (БОД) ниже по сравнению с группой контроля у пациентов с ХОБЛ и у пациентов с сочетанием ХОБЛ и АГ (z = -2,0, р = 0,04; z = -2,5, р = 0,01). Показатели относительной деформации миокарда в средних сегментах (СОД) и в апикальных сегментах (АОД) значимо ниже по сравнению с интактной группой только в группе ХОБЛ и АГ (z = -2,3, р = 0,02). Результаты исследования, рассчитанные согласно методике Senapati A. и соавт., в частности относительная региональная деформация (ОРД), в том числе отражающая поражение миокарда ЛЖ на различных уровнях, статистически значимо выше при сочетании ХОБЛ и АГ (z = 2,6, р = 0,01) (табл. 4). Таким образом, использование различных методов оценки доклинического поражения миокарда свидетельствует о наличии патологического паттерна сократительной активности кардиомиоцитов прежде всего на базальном уровне ЛЖ у пациентов с АГ и ранней степенью ограничения воздушного потока.
Таблица 4
Показатели относительной продольной деформации по уровням ЛЖ (БОД, СОД, АОД) (Phelan D. и соавт. (2012)), ОРД (Senapati A. и соавт. (2016))
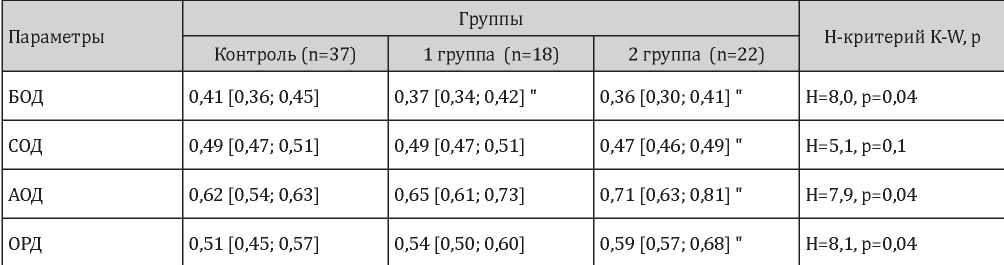
Примечание: ʺ — различия статистически значимы по сравнению с группой контроля (p<0,05). БОД — относительная деформация миокарда в базальных сегментах, СОД — относительная деформация миокарда в средних сегментах, АОД — относительная деформация миокарда ЛЖ в апикальных сегментах, ОРД — относительная региональная деформация.
Для оценки соотношения показателей локальной продольной деформации ЛЖ между различными уровнями в ходе работы рассчитаны значения паттернов (базально-медиального, базально-апикального, медиально-апикального) по методу Senapati A. и соавт. [14]. Результаты представлены в табл. 5. Во всех группах обследованных отсутствуют изменения в показателях базально-медиального паттерна. Наиболее существенные различия установлены у пациентов с сочетанием ХОБЛ и АГ: изменения показателей базально-апикального паттерна (БАП) при сравнении с данными группы контроля, а также медиально-апикального паттерна (МАП) при сравнении с группой ХОБЛ.
Таблица 5
Показатели регионарных паттернов деформации ЛЖ
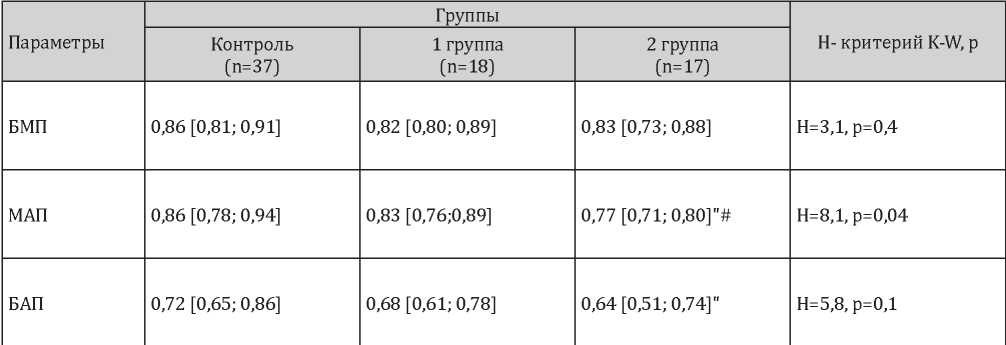
Примечание: ʺ — различия статистически значимы по сравнению с группой контроля (р <0,05); # — различия статистически значимы по сравнению с первой группой (р <0,05); БМП — базально-медиальный паттерн, МАП — медиально-апикальный паттерн, БАП — базально-апикальный паттерн.
Таким образом, оценку показателей глобальной продольной и локальной деформации миокарда для выявления доклинического нарушения сократимости кардиомиоцитов на ранних стадиях ХОБЛ, АГ и при их сочетании следует признать недостаточной. Необходимо более детальное изучение патологических паттернов сократительной активности на различных уровнях левого желудочка и прежде всего его базального отдела.
Обсуждение
Выполненное исследование показало, что у пациентов с ХОБЛ без установленных ранее сердечно-сосудистых заболеваний почти в половине случаев регистрируется АГ, частота встречаемости которой увеличивается по мере ухудшения показателей скорости воздушного потока. Согласно литературным данным, частота встречаемости АГ при ХОБЛ колеблется в различных диапазонах и зависит от критериев включения в исследования, объема выборки, расовых особенностей и т.д., составляя в среднем 34 – 50%, по данным различных авторов [20]. Преобладание АГ в качестве ведущего фактора коморбидности при ХОБЛ свидетельствует о значимости известных и предполагаемых патогенетических механизмов развития кардиопульмонального континуума в виде системной сосудистой эндотелиальной дисфункции, поддерживаемой неконтролируемым вялотекущим воспалением, дисбалансом оксидативных и антиоксидантных систем, потерей клеточного энергетического потенциала и др. Значимый вклад в истощение наиболее уязвимого вазодилататорного резерва сосудистого эндотелия вносит повреждающее действие табачного дыма как ведущего фактора ХОБЛ, прежде всего определяющего дисбаланс синтеза оксида азота (NO) и накопление молекул пероксинитрита, образуемых за счёт реакций высокоактивных радикалов кислорода с молекулами NO. При усиленной генерации радикалов кислорода, что характерно для табакокурения, равновесие смещается от вазодилататорного эффекта NO в сторону повреждающего действия пероксинитрита, являющегося мощным вазоконстриктором [21][22][23]. В нарушение функции сосудистого эндотелия по мере прогрессирования ограничения воздушного потока при ХОБЛ могут вносить вклад ситуационные нарушения газообмена в виде персистирующих гипоксии и гиперкапнии, прогрессирование воспаления с развитием дисбаланса в системе матриксных протеиназ с развитием деструкции соединительнотканного сосудистого матрикса, изменения восприятия внеклеточного и внутриклеточного сигналинга и стойкое сосудистое ремоделирование [24][25][26]. Реализация данных механизмов имеет ряд особенностей в зависимости от локализации сосудистого бассейна, преобладания в сосудистой стенке гладкомышечных, эластических или коллагеновых волокон [27].
В данной работе продемонстрированы особенности церебральной гемодинамики при ХОБЛ в зависимости от степени ограничения воздушного потока. Результаты транскраниальной допплерографии показали, что у больных ХОБЛ с 1, 2 и 3 степенью снижения ОФВ1 не наблюдаются изменения показателей ЛСК в системе СМА, свидетельствуя в пользу адекватного функционирования системы саморегуляции мозгового кровотока у данной категории пациентов.
Наиболее характерной реакцией СМА при регулировании церебральной гемодинамики в ответ на гетерогенные стимулы является констрикция, что выражается в виде статистически значимого повышения индексов периферического сосудистого сопротивления при 4 степени ХОБЛ. Констрикция представляет собой базовый механизм перераспределения кровотока, защищающий головной мозг от избыточного притока крови. Такие изменения сосудистого тонуса являются компенсаторными, но при этом могут значительно ограничивать адаптационные возможности артериальной системы головного мозга и способствовать развитию церебральных осложнений при ХОБЛ, а при чрезмерной констрикции — приводить к срыву механизмов компенсации и саморегуляции.
Развитие коморбидности на ранних стадиях ХОБЛ, несомненно, увеличивает индивидуальный сердечно-сосудистый риск у пациента. Установленный рост частоты выявления ДДЛЖ у пациентов с ХОБЛ 1 – 2 степени в сочетании с АГ 1 степени может указывать на снижение эластичности миокарда, сочетаемой с избыточным фиброобразованием на фоне роста давления наполнения в полости левого желудочка [28]. Установлено, что показатели деформации в медиальных и базальных сегментах миокарда значимо ниже в группе пациентов с сочетанием ХОБЛ и АГ по сравнению с группой контроля, что, очевидно, отражает уязвимость контрактильной способности кардиомиоцитов у пациентов с ХОБЛ 1-2 степени и наличием АГ, которая проявляется прежде всего в базальных и медиальных отделах левого желудочка.
Указанные изменения не отражаются на показателях как глобальной, так и локальной сократимости левого желудочка и требуют детализации оценки в различных отделах с акцентом на базальные отделы. Иными словами, использование различных методов оценки доклинического поражения миокарда свидетельствует о наличии патологического паттерна сократительной активности кардиомиоцитов, прежде всего, на базальном уровне ЛЖ у пациентов с АГ и ранней степенью ограничения воздушного потока. Изменение тканевой архитектуры миокарда на ранних доклинических уровнях в виде изменения контрактильной активности волокон затрагивает в первую очередь базальный отдел с переходом в медиальный, от места наибольшей представленности фиброза к наибольшей выраженности мышечной массы миокарда левого желудочка (область верхушки). Таким образом, у пациентов с ХОБЛ без обозначенных сердечно-сосудистых заболеваний наблюдаются доклинические признаки поражения органов сердечно-сосудистой системы.
Заключение
Установленные изменения показателей мозгового кровотока на интракраниальном уровне в виде повышения всех скоростных значений, связаны с прогрессирующим снижением ОФВ1. Значимое повышение систолической скорости кровотока СМА определено при 4 степени ограничения ОФВ1 по сравнению с 1 – 3 степенью ХОБЛ и с группой контроля. У пациентов с ХОБЛ 4 ст. происходит компенсаторное повышение индексов периферического сосудистого сопротивления, очевидно, вносящее вклад в сохранение уязвимых механизмов ауторегуляции мозгового кровотока.
У больных ХОБЛ с 1-й и 2-й спирометрической степенями снижения ОФВ1 установлены доклинические признаки поражения миокарда ЛЖ в виде наличия ДДЛЖ I типа, частота встречаемости которой достоверно возрастает при сочетании ХОБЛ с АГ 1 степени. К маркерам доклинического поражения миокарда у пациентов с ХОБЛ следует отнести наличие патологических паттернов на уровне базальных и медиальных отделов левого желудочка, выявленных с помощью Спекл-трекинг эхокардиографии с использованием расчетов оценки сократительной активности миокарда на различных уровнях.
Выявленные изменения поражения органов-мишеней сердечно-сосудистой системы у пациентов с ХОБЛ свидетельствуют о необходимости их углубленного поиска с целью уточнения сердечно-сосудистого риска и определения индивидуализированного плана проведения возможных корригирующих мероприятий.
Список литературы
1. Hawkins NM, Virani S, Ceconi C. Heart failure and chronic obstructive pulmonary disease: the challenges facing physicians and health services. Eur Heart J. 2013;34(36):2795-803. DOI: 10.1093/eurheartj/eht192
2. Agusti A, Calverley PM, Celli B, Coxson HO, Edwards LD, Lomas DA, et al. Characterisation of COPD heterogeneity in the ECLIPSE cohort. Respir Res. 2010;11(1):122. DOI: 10.1186/1465-9921-11-122
3. Berger JS, Sanborn TA, Sherman W, Brown DL. Effect of chronic obstructive pulmonary disease on survival of patients with coronary heart disease having percutaneous coronary intervention. Am J Cardiol. 2004;94(5):649-51. DOI: 10.1016/j.amjcard.2004.05.034
4. Anthonisen NR, Connett JE, Enright PL, Manfreda J; Lung Health Study Research Group. Hospitalizations and mortality in the Lung Health Study. Am J Respir Crit Care Med. 2002;166(3):333-9. DOI: 10.1164/rccm.2110093
5. Portegies ML, Lahousse L, Joos GF, Hofman A, Koudstaal PJ, Stricker BH, et al. Chronic Obstructive Pulmonary Disease and the Risk of Stroke. The Rotterdam Study. Am J Respir Crit Care Med. 2016;193(3):251-8. DOI: 10.1164/rccm.201505-0962OC
6. Truelsen T, Prescott E, Lange P, Schnohr P, Boysen G. Lung function and risk of fatal and non-fatal stroke. The Copenhagen City Heart Study. Int J Epidemiol. 2001;30(1):145-51. DOI: 10.1093/ije/30.1.145
7. Schroeder EB, Welch VL, Evans GW, Heiss G. Impaired lung function and subclinical atherosclerosis. The ARIC Study. Atherosclerosis. 2005;180(2):367-73. DOI: 10.1016/j.atherosclerosis.2004.12.012
8. Agarwal SK, Heiss G, Barr RG, Chang PP, Loehr LR, Chambless LE, et al. Airflow obstruction, lung function, and risk of incident heart failure: the Atherosclerosis Risk in Communities (ARIC) study. Eur J Heart Fail. 2012;14(4):414-22. DOI: 10.1093/eurjhf/hfs016
9. van Deursen VM, Urso R, Laroche C, Damman K, Dahlström U, Tavazzi L, et al. Co-morbidities in patients with heart failure: an analysis of the European Heart Failure Pilot Survey. Eur J Heart Fail. 2014;16(1):103-11. DOI: 10.1002/ejhf.30
10. Sitnikova MY, Lyasnikova EA, Yurchenko AV, Trukshina MA, Libis RA, Kondratenko VY, et al. [Results of Russian Hospital Chronic Heart Failure Registry in Three Subjects of Russian Federation]. Kardiologiia. 2015;55(10):5-13. (In Russian). DOI: 10.18565/cardio.2015.10.5-13
11. Uijl A, Lund LH, Vaartjes I, Brugts JJ, Linssen GC, Asselbergs FW, et al. A registry-based algorithm to predict ejection fraction in patients with heart failure. ESC Heart Fail. 2020;7(5):2388-2397. DOI: 10.1002/ehf2.12779
12. Ли В.В., Тимофеева Н.Ю., Задионченко В.С., Адашева Т.В., Высоцкая Н.В. Современные аспекты ремоделирования сердца у больных хронической обструктивной болезнью легких. Рациональная Фармакотерапия в Кардиологии. 2018;14(3):379-386. DOI: 10.20996/1819-6446-2018-14-3-379-386
13. Phelan D, Collier P, Thavendiranathan P, Popović ZB, Hanna M, Plana JC, et al. Relative apical sparing of longitudinal strain using two-dimensional speckle-tracking echocardiography is both sensitive and specific for the diagnosis of cardiac amyloidosis. Heart. 2012;98(19):1442-8. DOI: 10.1136/heartjnl2012-302353
14. Senapati A, Sperry BW, Grodin JL, Kusunose K, Thavendiranathan P, Jaber W, et al. Prognostic implication of relative regional strain ratio in cardiac amyloidosis. Heart. 2016;102(10):748-54. DOI: 10.1136/heartjnl-2015-308657
15. Верещагин Н.В., Моргунов В.А., Гулевская Т.С. Патология головного мозга при атеросклерозе и артериальной гипертонии. М.: Медицина, 1997.
16. Лелюк В.Г., Лелюк С.Э. Церебральное кровообращение и артериальное давление. М.: Реальное время, 2004.
17. Шулутко Б.И., Алмазов В.А. Артериальная гипертензия 2000. - Ренкор, 2001.
18. Чевплянская О.Н., Дударев М.В., Мельников А.В. Продольная деформация левого желудочка и состояние коронарного кровотока у пациентов с высоким нормальным артериальным давлением. Артериальная гипертензия. 2016;22(3):282-290. DOI: 10.18705/1607-419X-2016-22-3-282-290
19. Gorter TM, van Veldhuisen DJ, Bauersachs J, Borlaug BA, Celutkiene J, Coats AJS, et al. Right heart dysfunction and failure in heart failure with preserved ejection fraction: mechanisms and management. Position statement on behalf of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2018;20(1):16-37. DOI: 10.1002/ejhf.1029
20. Задионченко В.С., Адашева Т.В., Федорова И.В., Нестеренко О.И., Миронова М.А. Артериальная гипертония и хроническая обструктивная болезнь легких: клиникопатогенетические параллели и возможности терапии. Российский кардиологический журнал. 2009;(6):62-68. eLIBRARY ID: 13039047
21. Малахов В. А., Завгородняя А. Н., Лычко В. С. и др. Проблема оксида азота в неврологии. Сумы : СумДПУ им. А. С. Макаренка, 2009.
22. Joannides R, Haefeli WE, Linder L, Richard V, Bakkali EH, Thuillez C, et al. Nitric oxide is responsible for flow-dependent dilatation of human peripheral conduit arteries in vivo. Circulation. 1995;91(5):1314-9. DOI: 10.1161/01.cir.91.5.1314
23. Somers MJ, Harrison DG. Reactive oxygen species and the control of vasomotor tone. Curr Hypertens Rep. 1999;1(1):102-8. DOI: 10.1007/s11906-999-0080-z
24. Baker AH, Edwards DR, Murphy G. Metalloproteinase inhibitors: biological actions and therapeutic opportunities. J Cell Sci. 2002;115(Pt 19):3719-27. DOI: 10.1242/jcs.00063
25. Candelario-Jalil E, Yang Y, Rosenberg GA. Diverse roles of matrix metalloproteinases and tissue inhibitors of metalloproteinases in neuroinflammation and cerebral ischemia. Neuroscience. 2009;158(3):983-94. DOI: 10.1016/j.neuroscience.2008.06.025
26. Johnson C, Galis ZS. Matrix metalloproteinase-2 and -9 differentially regulate smooth muscle cell migration and cellmediated collagen organization. Arterioscler Thromb Vasc Biol. 2004;24(1):54-60. DOI: 10.1161/01.ATV.0000100402.69997. C3
27. Пыцкий В.И. Ремоделирование органов – типовой патологический процесс. Астма. 2010;11(2):65-74. eLIBRARY ID: 15798303
28. Бродская Т.А., Гельцер Б.И., Невзорова В.А., Моткина Е.В. Артериальная и миокардиальная ригидность у больных хронической обструктивной болезнью легких. Казанский медицинский журнал. 2008;89(5):642-647. eLIBRARY ID: 11911659
Об авторах
В. А. НевзороваРоссия
Вера Афанасьевна Невзорова, д.м.н., проф., директор и института терапии и инструментальной диагностики
Владивосток
Н. В. Захарчук
Россия
Наталья Владимировна Захарчук, д.м.н., доцент института терапии и инструментальной диагностики
Владивосток
Е. Ю. Шапкина
Россия
Шапкина Елена Юрьевна, к.м.н., доцент школы медицины
Владивосток
Е. А. Кондрашова
Россия
Кондрашова Елена Анатольевна, ассистент института терапии и инструментальной диагностики
Владивосток
Д. В. Кондрашов
Россия
Кондрашов Дмитрий Васильевич, студент 6 курса лечебного факультета
Владивосток
Дополнительные файлы
Рецензия
Для цитирования:
Невзорова В.А., Захарчук Н.В., Шапкина Е.Ю., Кондрашова Е.А., Кондрашов Д.В. ХОБЛ и доклинические признаки поражения сердечно-сосудистой системы. Южно-Российский журнал терапевтической практики. 2021;2(2):70-79. https://doi.org/10.21886/2712-8156-2021-2-2-70-79
For citation:
Nevzorova V.A., Zakharchuk N.V., Shapkina E.U., Kondrashova E.A., Kondrashov D.V. COPD and preclinical cardiovascular disease. South Russian Journal of Therapeutic Practice. 2021;2(2):70-79. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-2-70-79


























