Перейти к:
Острое повреждение почек у пациентов с хронической сердечной недостаточностью
https://doi.org/10.21886/2712-8156-2021-2-3-6-17
Аннотация
Проблема хронической сердечной недостаточности (ХСН), а особенно ХСН со сниженной фракцией выброса является одной из наиболее значимых для современных систем здравоохранения. Это обусловлено высокой смертностью, сниженным качеством жизни, частыми эпизодами госпитализаций и выраженной коморбидностью пациентов с данной патологией. Вовлечение в патологический процесс почек является одним из наиболее встречаемых коморбидных состояний при сердечно-сосудистых заболеваниях. Имеется большое количество патогенетических механизмов взаимнонегативного влияния сердечной недостаточности и нарушения функции почек, нашедших отражение в понятии «кардиоренальный синдром». Более того, медикаментозная терапия ХСН может быть одной из причин поражения почек. Особенно угрожаемыми состояниями являются эпизоды острой декомпенсации кровообращения, а также новая коронавирусная инфекция (COVID-19). Целью данного обзора является консолидация имеющихся в международной литературе данных о проблеме острого повреждения почек у пациентов с ХСН. Проблема хронической сердечной недостаточности (ХСН), а особенно ХСН со сниженной фракцией выброса является одной из наиболее значимых для современных систем здравоохранения. Это обусловлено высокой смертностью, сниженным качеством жизни, частыми эпизодами госпитализаций и выраженной коморбидностью пациентов с данной патологией. Вовлечение в патологический процесс почек является одним из наиболее встречаемых коморбидных состояний при сердечно-сосудистых заболеваниях. Имеется большое количество патогенетических механизмов взаимнонегативного влияния сердечной недостаточности и нарушения функции почек, нашедших отражение в понятии «кардиоренальный синдром». Более того, медикаментозная терапия ХСН может быть одной из причин поражения почек. Особенно угрожаемыми состояниями являются эпизоды острой декомпенсации кровообращения, а также новая коронавирусная инфекция (COVID-19). Целью данного обзора является консолидация имеющихся в международной литературе данных о проблеме острого повреждения почек у пациентов с ХСН.
Ключевые слова
Для цитирования:
Арутюнов А.Г., Башкинов Р.А., Батлук Т.И., Мельников Е.С., Ермилова А.Н. Острое повреждение почек у пациентов с хронической сердечной недостаточностью. Южно-Российский журнал терапевтической практики. 2021;2(3):6-17. https://doi.org/10.21886/2712-8156-2021-2-3-6-17
For citation:
Arutyunov A.G., Bashkinov R.A., Batluk T.I., Melnikov E.S., Ermilova A.N. Acute kidney injury in patients with chronic heart failure. South Russian Journal of Therapeutic Practice. 2021;2(3):6-17. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-3-6-17
Введение
Острое повреждение почек (ОПП) — патологическое состояние, развивающееся в результате непосредственного острого воздействия ренальных и / или экстраренальных повреждающих факторов, продолжающееся до семи суток и характеризующееся быстрым (часы – дни) развитием признаков повреждения или дисфункции почек различной степени выраженности.
В практической деятельности ОПП следует определять в соответствии с рекомендациями KDIGO как наличие как минимум одного из следующих критериев:
- нарастания креатинина ≥ 0,3 мг/дл (≥ 26,5 мкмоль/л) в течение 48 часов;
- нарастания креатинина ≥ 1,5 раза от исходного, которое, как известно (или предполагается), произошло в течение семи суток;
- темпа диуреза < 0,5 мл/кг/ч в течение 6 часов.
Критерий «48 часов» был принят для того, чтобы констатировать факт свершившегося ОПП («устоявшегося» ОПП). В том случае, если ОПП возникает и полностью разрешается в течение 48 часов, следует говорить о полном и быстром разрешении ОПП. Кроме того, он позволяет дифференцировать два различных эпизода ОПП (возможно, разной этиологии). Для определения тяжести ОПП могут использоваться различные критерии (RIFLE, AKIN, KDIGO), однако в клинической практике рекомендуется использовать критерии в соответствии с классификацией KDIGO (2012) (табл. 1) [1].
Таблица 1
Критерии тяжести острого повреждения почек по KDIGO (2012) [2]

ОПП ассоциировано с высокой смертностью, более продолжительным пребыванием в стационаре, а также повышением риска развития хронической болезни почек (ХБП) [3][4][5][6][7]. Частота встречаемости ОПП составляет 10 – 15% у госпитализированных пациентов и более 50% у лиц, находящихся в палатах интенсивной терапии [8]. ОПП наиболее часто сопровождает сердечно-сосудистые заболевания (ССЗ) (20%); инфекционные заболевания (18%); заболевания кожи и мягких тканей (15%); эндокринные заболевания, болезни пищеварительной системы и нарушения обмена веществ (13%); респираторные заболевания (12%); мочеполовые заболевания (12%); травмы и отравления (12%) [3]. По данным исследования Wang et al. среди 19 249 госпитализаций частота ОПП составила 22,7%, а вероятность его развития была выше у пожилых людей, афроамериканцев и пациентов с исходно сниженной функцией почек (все p — < 0,001). При этом наиболее частыми причинами госпитализации были ССЗ (25,4%) [9]. ОПП встречается у 5 – 30% пациентов кардиохирургических отделений и связано с более тяжёлым течением основного заболевания и послеоперационного периода, достигая 80% смертности [10][11]. Исследование GISSI-HF продемонстрировало среднее снижение скорости клубочковой фильтрации (СКФ) у пациентов с сердечной недостаточностью (СН) на 2,57 мл/мин. / 1,73 м2 в год [12]. По данным исследования Zeng X. et al. ОПП наблюдалось у 18,3% всех госпитализированных (из которых 70,9% приходились на первую стадию, 17,1% — на вторую стадию и 12,0% — на третью стадию), а частота ОПП среди лиц, госпитализированных по поводу декомпенсации хронической сердечной недостаточности (ХСН), составляла 47,4% [13].
Выделяют три основные группы ОПП — преренальные, ренальные, постренальные (табл. 2).
Таблица 2
Возможные причины острого повреждения почек [1]
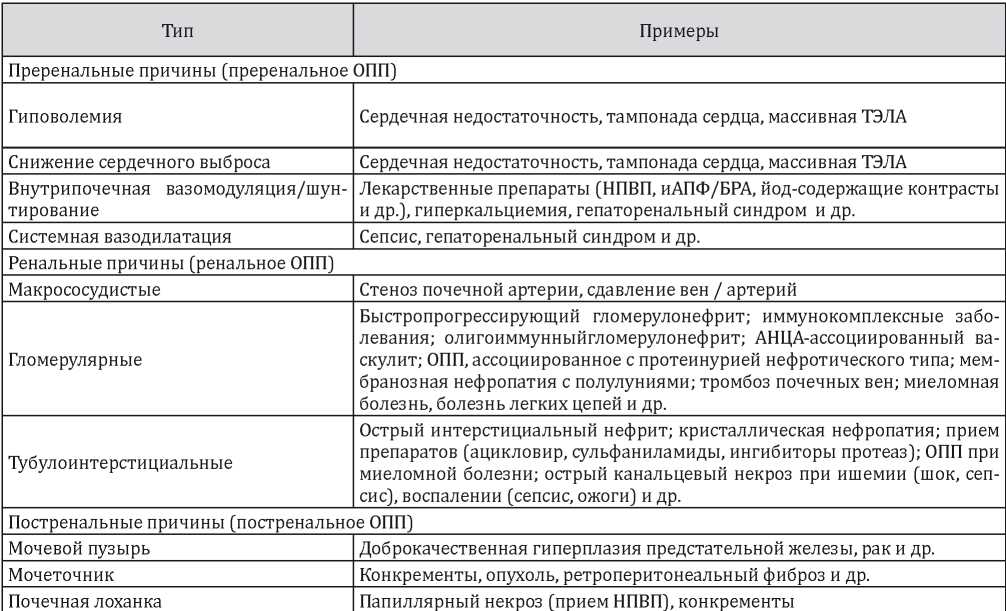
Примечание: ТЭЛА — тромбоэмболия легочной артерии; НПВП — нестероидные противовоспалительные препараты; иАПФ — ингибиторы ангиотензин-превращающего фермента; БРА — блокаторы рецепторов ангиотензина II; АНЦА — антинейтрофильные цитоплазматические антитела; ОПП — острое повреждение почек.
ХСН является ассоциированным с ОПП состоянием, наряду с артериальной гипертензией (АГ), сахарным диабетом (СД), ХБП, анемией, билатеральным стенозом почечных артерий. В то же время приём лекарственных средств, используемых для терапии ХСН (диуретики, ингибиторы ангиотензин-превращающего фермента (иАПФ), блокаторы рецепторов ангиотензина II и их комбинация), являются модифицируемыми факторами риска ОПП (табл. 3) [1].
Таблица 3
Факторы риска и ассоциированные состояния при остром повреждении почек [1]
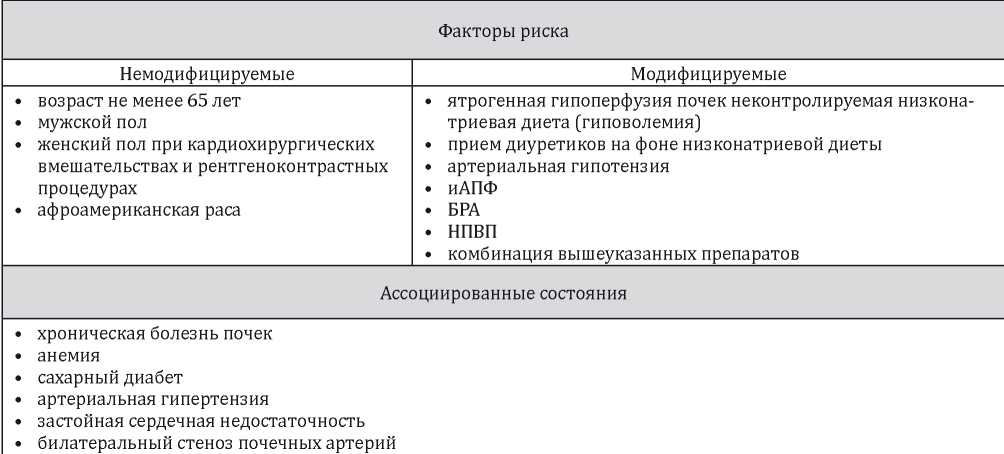
Примечание: иАПФ — ингибиторы ангиотензин-превращающего фермента; БРА — блокаторы рецепторов ангиотензина II; НПВП — нестероидные противовоспалительные препараты.
Понятие кардиоренального синдрома
Наличие одновременно существующих поражения сердца и почек получило название «Кардиоренальный синдром» (КРС), при котором первичные нарушения в функционировании одного органа могут приводить к вторичной дисфункции или нарушениям функции другого [14][15]. В основе формирования КРС лежит прогрессирование гемодинамических нарушений (снижение сердечного выброса, развитие венозного застоя и повышение внутрибрюшного давления), нейрогуморальная активация (симпатическая нервная система (СНС) и ренинангиотензин-альдостероновая система (РААС), избыточный синтез эндотелина, вазопрессина и др.), эндотелиальная дисфункция, воспаление и окислительный стресс, атеросклеротическое поражение сосудов, задержка натрия и воды, анемия, ХПБ в анамнезе и др. [16][17].
Выделяют пять типов кардиоренального синдрома [14][15]:
1 тип — острый кардиоренальный синдром (острое ухудшение функции сердца, приводящее к повреждению и/или дисфункции почек);
2 тип — хронический кардиоренальный синдром (хронические нарушения функции сердца, приводящие к повреждению или дисфункции почек). Является самым распространённым, был зарегистрирован у 63% пациентов, госпитализированных с застойной сердечной недостаточностью [18];
3 тип — острый ренокардиальный синдром (ОПП, приводящее к повреждению сердца и/или его дисфункции);
4 тип — хронический ренокардиальный синдром (ХБП, приводящая к повреждению сердца, заболеванию и / или его дисфункции). Существует дифференцированная и независимая связь между тяжестью ХБП и неблагоприятными сердечными исходами. В недавнем метаанализе Tonelli M. et al. [19] была описана связь между тяжестью дисфункции почек и риском смерти от всех причин, при этом избыточная смертность от CCЗ составляла более 50% от общей смертности;
5 тип — вторичный кардиоренальный синдром (системные состояния, приводящие к одновременному повреждению и / или дисфункции сердца и почек). Хотя этот подтип не имеет дисфункции первичных и / или вторичных органов, он относится к ситуациям, когда оба органа одновременно поражаются острыми или хроническими системными заболеваниями (сепсис, системная красная волчанка, СД, амилоидоз и другие).
По данным крупных ретроспективных исследований [20][21][22][23], посвящённых влиянию ХСН и лекарственной терапии [17][24] на развитие ОПП, было показано, что поражение почек наиболее часто формируется в первые дни стационарного лечения, а также связано с более высокой смертностью от ССЗ и всех причин. ОПП при ХСН являлось причиной увеличенной продолжительности госпитализации [21, 25 –27], повышения частоты повторных госпитализаций [28][29] и ускорения прогрессирования ХБП до 4-й и 5-й стадий [30]. Также было показано, что риск неблагоприятного исхода сохраняется независимо от того, было ли ОПП временным или устоявшимся [29][31], и что даже ранние стадии ОПП влияют на риск летального исхода [24].
Оценка артериального давления (АД) и функции почек (креатинин, мочевина сыворотки крови, СКФ, уровень электорлитов и другие) крайне важны для всех пациентов с декомпенсацией ХСН в отношении риска развития ОПП [32]. Так, высокие показатели мочевины и низкие значения систолического АД являлись независимыми и значимыми предикторами неблагоприятного прогноза [33][34][35].
В анализе программы CHARM с участием 2743 пациентов было выявлено, что снижение функции почек связано с худшим прогнозом у пациентов с ХСН. Более низкая расчётная СКФ (рСКФ), определяемая по формуле MDRD, а также СН с низкой фракцией выброса являются значимыми независимыми предикторами неблагоприятного исхода. При рСКФ 45-60 мл/ мин. / 1,73 м2 отношение рисков (ОР) для первичной конечной точки (риск смерти от ССЗ или госпитализация по поводу обострения ХСН) составило 1,54; при рСКФ менее 45 мл/мин. / 1,73 м2 — 1,86 (р < 0,001); а для показателя смертности от всех причин ОР составило 1,5 (р = 0,006) и 1,91 (р = 0,001) соответственно. Таким образом, нарушение функции почек является важным прогностическим показателем [36]. В исследовании по оценке прогностической значимости ОПП у пациентов с ХСН, включавшем 30529 человек, было зарегистрировано 5294 случая ОПП у 3970 пациентов за 3,2 года. Было выявлено, что ОПП развивается в 15% случаев и является нередким осложнением у пациентов с наличием ХСН и острой СН (ОСН). Поражение почек чаще встречалось у женщин с СД и АГ, а также у лиц с низкой СКФ [37].
Патогенетические пути поражения почек при сердечной недостаточности
Факторы риска, такие как АГ, СД, ожирение, альбуминурия, прием диуретиков и других лекарственных препаратов, связаны с риском более быстрого снижения СКФ и ухудшения функции почек у пациентов, госпитализированных с СН. Более того, любое выявляемое снижение функции почек связано с повышенной смертностью и длительным пребыванием в стационаре. Важно отметить, что снижение СКФ является более сильным предиктором неблагоприятного исхода, чем снижение фракции выброса левого желудочка при CН по данным Hillege H.L. et al. [38].
Имеется несколько факторов, способствующих снижению СКФ при ХСН. Во-первых, это уменьшение количества функционально активных нефронов. Во-вторых, нейрогуморальная активация способствует как снижению почечного кровотока, так и гиперфильтрации, за счёт увеличения синтеза ангиотензина II, который стимулирует вазоконстрикцию сосудов почек (преимущественно выносящей артериолы) [39][40]. В-третьих, повышение центрального венозного давления (ЦВД) приводит к снижению почечного кровотока [41][42][43][44]. В-четвертых, повышенное внутрибрюшное давление, нарушение функции висцеральной сосудистой сети и абдоминального лимфооттока, а также дисфункция перегруженных органов брюшной полости, нарушение функции кишечного барьера и эндокринные эффекты гормонов или токсинов [40][45][46]. Наконец, агрессивная диуретическая терапия может привести к снижению почечного кровотока [25][47].
Быстропрогрессирующие изменения СКФ при ОСН зачастую связаны со временным снижением СКФ отдельного нефрона из-за гемодинамических изменений или прямого воздействия лекарственных средств. Лишь в некоторых случаях эти изменения приводят к потере функционирующих нефронов и необратимым последствиям. При ХСН изменения СКФ с течением времени связаны с прогрессирующей потерей функционирующих нефронов, несмотря на компенсаторное увеличение СКФ отдельных нефронов [48]. Стоит отметить, что при снижении количества функционирующих нефронов возможности компенсации (увеличение СКФ отдельного нефрона) являются ограниченными, что в конечном итоге приводит к ускоренной гибели оставшихся клеток.
В нормальных условиях почечная перфузия или почечный кровоток составляет около 20% от сердечного выброса и определяется разницей между почечным артериальным, венозным и внутрибрюшным давлением и сопротивлением сосудистой сети почек. Важной особенностью почечной микроциркуляции является саморегуляция, поддерживающая СКФ в узких пределах, влияя на сопротивление афферентных артериол, в ответ на почечное АД и изменения потока крови через нефрон. Из-за гемодинамических и нейрогормональных изменений почечный кровоток при СН снижается, что вызывает реакцию афферентной (вазодилатация) и эфферентной (вазокнстрикция) артериол с целью поддержания СКФ (рис. 1) [49][50]. Негемодинамические факторы, включая активацию РААС, активацию СНС, воспаление, эндотелиальную дисфункцию и окислительный стресс, также способствуют развитию повреждения почек [51].
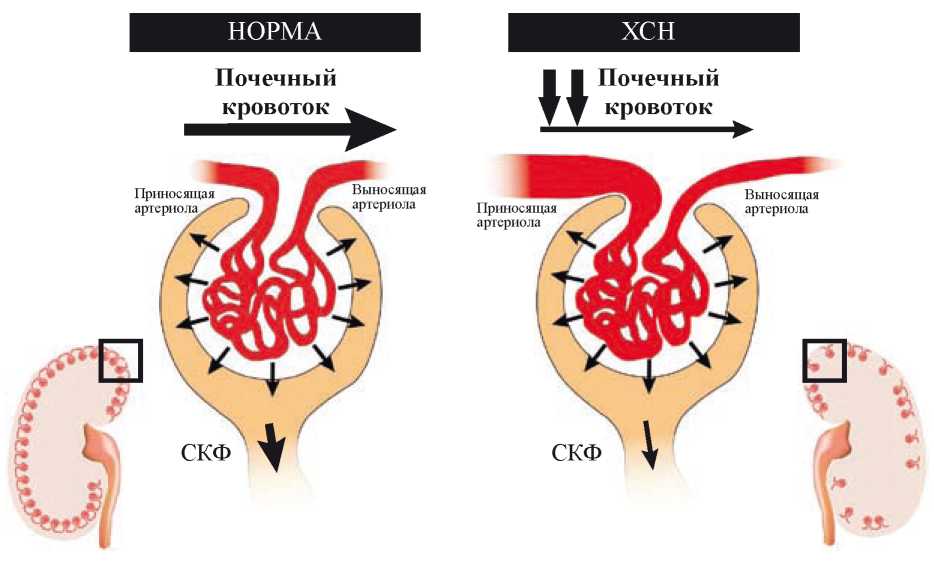
Рисунок 1. У пациентов с хронической сердечной недостаточностью наблюдается снижение скорости клубочковой фильтрации и почечного кровотока, что приводит к увеличению фракции фильтрации и повышенному сопротивлению почечных сосудов в выносящей артериоле [адаптировано из 52].
При СН нарушается экскреция натрия и жидкости за счёт увеличения реабсорбции воды и растворённых веществ в проксимальных канальцах с последующим снижением поступления жидкости в петлю Генле. Более того, нейрогуморальная активация приводит к увеличению реабсорбции натрия в восходящих частях петли Генле [53]. Снижение кровотока в результате вазоконсткрикции предотвращает выведение растворенных веществ из мозгового вещества почек, что снижает способность к разбавлению мочи и экскреции свободной жидкости [54][55]. В нормальных условиях большие количества экзогенного альдостерона не вызывают отёков, поскольку экскреция натрия с мочой превышает индуцированную альдостероном его дистальную реабсорбцию [56]. При ХСН возможен такой феномен, как «прорыв альдостерона», обусловленный потерей способности дистальных отделов нефрона к полной реабсорбции увеличенного количества натрия в результате повышения объема и активации натрийуретических пептидов.
Повышенное ЦВД напрямую влияет на почечный кровоток, что приводит к нарушению исходной СКФ и развитию повреждения почек как при острой, так и при хронической СН [57][58]. Таким образом, дисфункция правого желудочка также связана с повреждением почек, приводя к увеличению венозного застоя [58]. По данным исследования Mullens W. et al. [58] венозный застой являлся самым важным гемодинамическим фактором, влияющим на нарушение функции почек у пациентов с декомпенсацией СН. Другие исследования показали, что временное пережатие почечной вены приводит к уменьшению экскреции натрия, снижению СКФ и почечного кровотока [60][61]. Повышение ЦВД приводит к увеличению почечного интерстициального давления, провоцирующего гипоксию клеток почек [62], а также связано со снижением СКФ у пациентов с первичной легочной гипертензией и относительно сохранным сердечным выбросом [63]. Более того, имеются данные о влиянии на функцию почек повышенного внутрибрюшного давления, вызванного висцеральным отеком или асцитом [39].
Влияние лекарственной терапии ХСН на функцию почек
Нарушение функции почек является одним из предикторов исхода СН. Тем не менее, интерпретация изменений функции почек имеет важное значение для оптимальной терапии как хронической, так и острой СН. Подход к оценке функции канальцев (диуретический ответ) помимо оценки СКФ, особенно во время острой СН, обеспечивает надлежащую оценку функции почек и восстановление солевого и водного баланса. Точно так же при ХСН правильная интерпретация изменений сывороточного креатинина во время титрования ингибиторов РААС помогает реализовать наиболее оптимальные варианты лечения [64]. Пациентам с СН необходимы регулярное наблюдение и мониторинг биохимических параметров для обеспечения безопасности и оптимального дозирования лекарственных средств, а также для выявления осложнений или прогрессирования заболевания, которые могут потребовать изменения плана лечения.
Важно помнить, что диуретики, ингибиторы РААС и антагонисты минералокортикоидных рецепторов улучшают клинические симптомы ХСН, однако в некоторых случаях они также могут быть связаны с ухудшением функции почек, в том числе провоцировать ОПП [65].
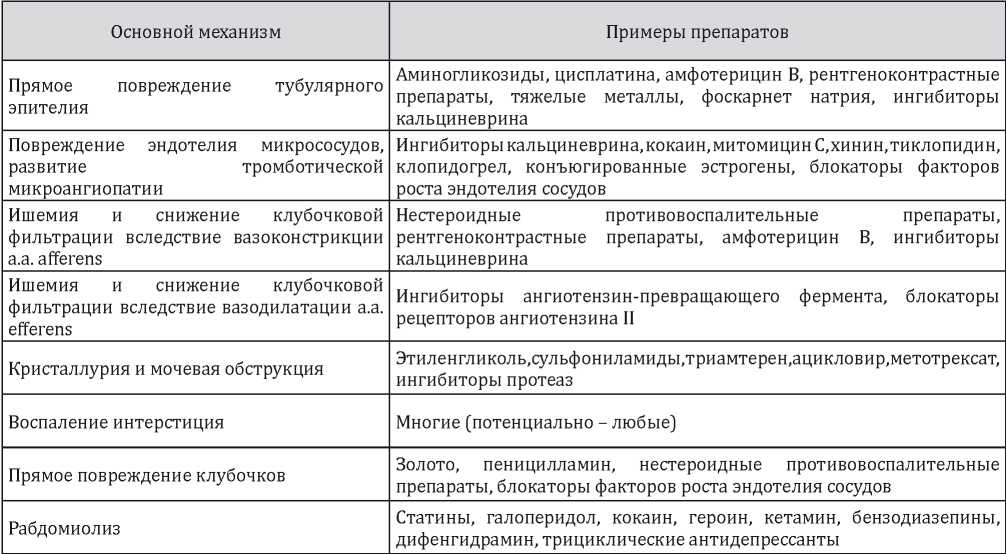
ОПП, ассоциированное с приёмом лекарственных препаратов, может быть связано с прямым повреждением нефронов, негативным воздействием на сосуды почек (вазоконстрикция, вазодилатация, повреждение эндотелия, тромботическая микроангиопатия), повышением риска кристаллообразования и рабдомиолизом (Таблица 4) [1].
Таблица 4
Основные механизмы развития острого повреждения почек лекарственной этиологии [1]
Так, во время госпитализации по поводу декомпенсации СН больные подвергаются многочисленным медикаментозным вмешательствам, таким как инициирование и титрование дозы блокаторов РААС и агрессивная диуретическая терапия [44][66][67].
В литературе имеются сообщения о том, что ингибирование РААС может приводить к транзиторному снижению СКФ [68]. В некоторых случаях после начала данной терапии можно ожидать временного падения рСКФ до 15 – 20%. Это явление является внутриклубочковой гемодинамической особенностью, которая не связана с потерей функционирующих нефронов и, следовательно, не вызывает внутреннего повреждения почек. В исследовании CONSENSUS (терапия эналаприлом в северной Скандинавии) у 11% пациентов наблюдалось увеличение уровня креатинина сыворотки в два раза [69]. В большинстве случаев это происходило на ранней стадии и у большинства пациентов повышенный (относительно первоначального) уровень креатинина сохранялся в течение всего периода наблюдения (24 недели) [70].
Согласно существующим кардиологическим рекомендациям [71], при увеличении уровня креатинина на 50% после инициации терапии иАПФ следует прекратить дальнейший прием препарата. В то же время, согласно нефрологическим рекомендациям, этот порог составляет 30% [1].
Высокие дозы петлевых диуретиков также могут иметь негативные эффекты, особенно в сочетании со значительным нарушением функции почек, тогда как спиронолактон и бетаадреноблокаторы могут оказывать защитное действие [72].
Использование внутривенных петлевых диуретиков часто необходимо на госпитальном этапе, так как позволяет преодолеть резистентный отек, однако высокие дозы неминуемо будут оказывать повреждающее действие на клубочки и могут приводить к снижению функции почек [73][74]. Зачастую это является обратимым явлением, поскольку снижение давления в сосудах почек немедленно улучшало диурез и повышало СКФ (по данным исследования Firth J.F. et al [75]). Пациенты, нуждающиеся в высоких дозах диуретиков, обычно имеют более выраженную степень СН, тем не менее, их нерациональное применение может быть самостоятельной проблемой [76] и приводить к ухудшению прогноза [77]. Петлевые диуретики увеличивают количество канальцевой жидкости, поступающей в дистальный отдел нефрона, за счёт их мощного ингибирующего действия на натрий-, калий-, хлортранспортеры в восходящей части петли Генле. Следовательно, они снижают осмотический градиент, который способствует реабсорбции воды в собирательных трубочках. Из-за влияния петлевых диуретиков на концентрационную функцию почек реабсорбируется меньше свободной воды, что приводит к выработке гипотонической мочи [78]. Нарушение функции почек связывают с гипоперфузией органа из-за прогрессирующего нарушения сердечного выброса или истощения внутрисосудистого объема [79]. Гемоконцентрация (уменьшение содержания воды в крови относительно количества форменных элементов), вероятно, связана с агрессивностью диуреза более высокими дозами петлевых диуретиков, большей потерей жидкости, более высокой скоростью потери жидкости, более быстрым снижением давления в правом предсердии и давления заклинивания легочных капилляров. У пациентов, имеющих гемоконцентрацию, шансы на снижение функции почек были значительно выше, тем самым подтверждая, что истощение внутрисосудистого объёма является очень важным механизмом, регулирующим кардио-нефральные взаимодействия. Гемоконцентрация тесно связана с нарушением функции почек (OR = 5,3, p < 0,001), тогда как изменение давления в правом предсердии (p = 0,36) и изменение давления заклинивания лёгочных капилляров (p = 0,53) не продемонстрировало прямой зависимости. В другом исследовании пациенты с гемоконцентрацией имели значительно более низкую, 180-дневную, смертность (HR = 0,31, p = 0.013) [66].
Из представленных данных можно сделать вывод, что пациенты с ХСН с учётом коморбидной патологии, медикаментозного воздействия и наличия ХБП имеют очень высокие риски развития ОПП преимущественно на госпитальном этапе. Однако также следует учитывать, что у пациентов, получающих терапию в соответствии с международными рекомендациями, находящихся на современных схемах квадротерапии ХСН, этот риск снижается. Так, терапия ингибиторами натрий-глюкозного контранспортера 2 типа (SGLT2) демонстрировала снижение прогрессирования поражения почек (рис. 2) [81][82][83]. По данным исследования PARADIGM-HF терапия комбинацией валсартана и сакубитрила у пациентов с ХСН замедляла прогрессирование ХБП по сравнению с эналаприлом (рис. 3) [84].
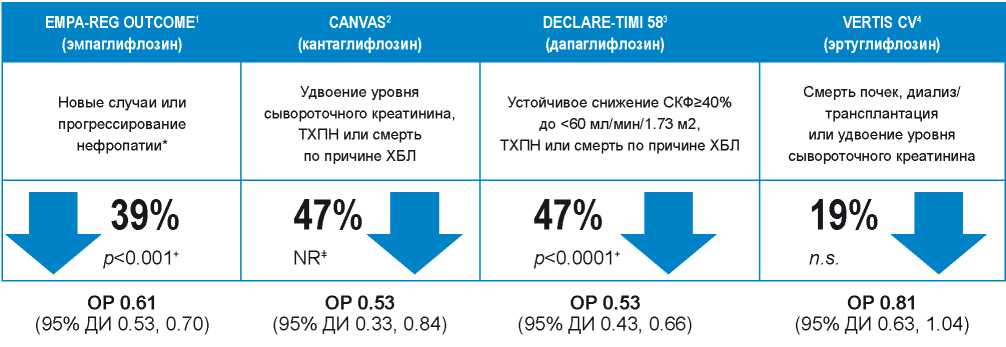
Рисунок 2. Исследования сердечно-сосудистой безопасности ингибиторов натрий-глюкозного контранспортера 2-го типа (SGLT2).
Примечание: * — определяется как прогрессирование макроальбуминурии, удвоение сывороточного креатинина, начало заместительной почечной терапии или смерть по причине хронической болезни почек, + — номинальное значение р, ± — значения р нет в публикации. [Источники: 1 – 81; 2 – 82; 3 – 83; 4 — Cannon C.P. et al. ADA 2020. Oral presentation]
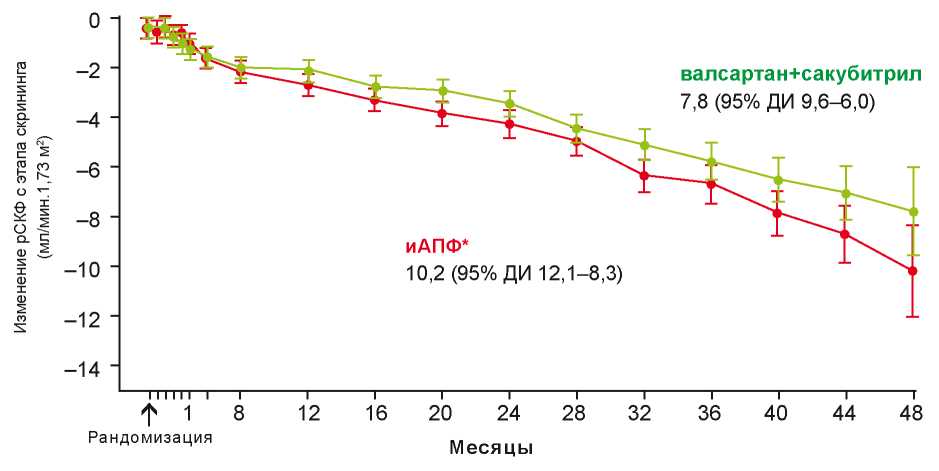
Рисунок 3. Динамика уровня расчётной скорости клубочковой фильтрации на фоне терапии валсартан + сакубитрил и эналаприл у пациентов с наличием хронической сердечной недостаточности и хронической болезни почек.
Примечание: иАПФ — ингибитор ангиотензин-превращающего фермента эналаприл [адаптировано из 84].
ОПП, ассоциированное с инфекциями на фоне ХСН
Ещё одним значимым патогенетическим механизмом, приводящим к развитию ОПП на фоне ХСН, является развитие инфекционного заболевания. Это может быть как бактериальная инфекция (например, пневмония, вызванная
пневмококком), так и любая вирусная инфекция [85][86]. Особенно актуальной является декомпенсации кровообращения, на фоне переносимой COVID-19 инфекции [87][88][89]. Очевидно, что имеется прямая связь поражения почек с течением инфекционного процесса. В связи с этим данный вопрос требует более активного изучения, по причине небольшого количества наблюдений.
Заключение
Острое повреждение почек является потенциальным жизнеугрожающим состоянием, требующим интенсивной терапии. Хроническая сердечная недостаточность — ассоциированное c острым повреждением почек состояние. Имеется большое количество патогенетических механизмов взаимонегативного влияния сердечной недостаточности и нарушения функции почек, нашедших отражение в понятии «кардиоренальный синдром». Пациенты, имеющие сочетанное поражение сердца и почек, имеют более серьезный прогноз и требуют более тщательного наблюдения. Особое внимание стоит уделять лечебной тактике основного и сопутствующих заболеваний, так как возможно развитие лекарственно индуцированного острого повреждения почек. Необходим тщательный мониторинг функции почек для профилактики их острого повреждения с целью улучшения прогноза, качества жизни, а также её продолжительности у пациентов с хронической сердечной недостаточностью.
Список литературы
1. Ассоциация нефрологов, Научное общество нефрологов России, Ассоциация анестезиологов-реаниматологов России, Национальное общество специалистов в области гемафереза и экстракорпоральной гемокорреции. Клинические рекомендации «Острое повреждение почек (ОПП)». 2020.
2. Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group. KDIGO Clinical Practice Guideline for Acute Kidney Injury. Kidney inter., Suppl. 2012;2:1–138. Doi: 10.1038/kisup.2012.6
3. Chertow G.M., Burdick E., Honour M., Bonventre J.V., Bates D.W. Acute kidney injury, mortality, length of stay, and costs in hospitalized patients. J Am Soc Nephrol. 2005;16(11):3365-3370. Doi: 10.1681/ASN.2004090740
4. Uchino S., Bellomo R., Goldsmith D., Bates S., Ronco C. An assessment of the RIFLE criteria for acute renal failure in hospitalized patients. Crit Care Med. 2006;34(7):1913-1917. Doi: 10.1097/01.CCM.0000224227.70642.4F
5. Mandelbaum T., Scott D.J., Lee J., Mark R.G., Malhotra A., Waikar S.S., et al. Outcome of critically ill patients with acute kidney injury using the Acute Kidney Injury Network criteria. Crit Care Med. 2011;39(12):2659-2664. Doi: 10.1097/CCM.0b013e3182281f1b
6. Bucaloiu I.D., Kirchner H.L., Norfolk E.R., Hartle J.E. 2nd, Perkins R.M. Increased risk of death and de novo chronic kidney disease following reversible acute kidney injury. Kidney Int. 2012;81(5):477-485. Doi: 10.1038/ki.2011.405
7. Lafrance J.P., Djurdjev O., Levin A. Incidence and outcomes of acute kidney injury in a referred chronic kidney disease cohort. Nephrol Dial Transplant. 2010;25(7):2203-2209. Doi: 10.1093/ndt/gfq011
8. Ronco C., Bellomo R., Kellum J.A. Acute kidney injury. Lancet. 2019;394(10212):1949-1964. Doi: 10.1016/S0140-6736-(19)32563-2
9. Wang H.E., Muntner P., Chertow G.M., Warnock D.G. Acute kidney injury and mortality in hospitalized patients. Am J Nephrol. 2012;35(4):349-355. Doi: 10.1159/000337487
10. Rosner M.H., Okusa M.D. Acute kidney injury associated with cardiac surgery. Clin J Am Soc Nephrol. 2006;1(1):19-32. Doi: 10.2215/CJN.00240605
11. Chertow G.M., Levy E.M., Hammermeister K.E., Grover F., Daley J. Independent association between acute renal failure and mortality following cardiac surgery. Am J Med. 1998;104(4):343-348. Doi: 10.1016/s0002-9343(98)00058-8
12. Damman K., Masson S., Lucci D., Gorini M., Urso R., Maggioni A.P., et al. Progression of Renal Impairment and Chronic Kidney Disease in Chronic Heart Failure: An Analysis From GISSI-HF. J Card Fail. 2017;23(1):2-9. Doi: 10.1016/j.cardfail.2016.09.006
13. Zeng X., McMahon G.M., Brunelli S.M., Bates D.W., Waikar S.S. Incidence, outcomes, and comparisons across definitions of AKI in hospitalized individuals. Clin J Am Soc Nephrol. 2014;9(1):12-20. Doi: 10.2215/CJN.02730313
14. Ronco C., Haapio M., House A.A., Anavekar N., Bellomo R. Cardiorenal andomiz. J Am Coll Cardiol. 2008;52(19):1527-1539. Doi: 10.1016/j.jacc.2008.07.051
15. Pokhrel N., Maharjan N., Dhakal B., Arora R.R. Cardiorenal syndrome: A literature review. Exp Clin Cardiol. 2008;13(4):165-170. PMID: 19343160; PMCID: PMC2663478
16. Резник Е.В., Никитин И.Г. Кардиоренальный синдром у больных с сердечной недостаточностью как этап кардиоренального континуума (часть 1): определение, классификация, патогенез, диагностика, эпидемиология (обзор литературы). Архивъ внутренней медицины. 2019;9(1):5-22. Doi: 10.20514/2226-6704-2019-9-1-5-22
17. Nohria A., Hasselblad V., Stebbins A., Pauly D.F., Fonarow G.C., Shah M., et al. Cardiorenal interactions: insights from the ESCAPE trial. J Am Coll Cardiol. 2008;51(13):1268-1274. Doi: 10.1016/j.jacc.2007.08.072
18. Heywood J.T., Fonarow G.C., Costanzo M.R., Mathur V.S., Wigneswaran J.R., Wynne J., et al. High prevalence of renal dysfunction and its impact on outcome in 118,465 patients hospitalized with acute decompensated heart failure: a report from the ADHERE database. Card Fail. 2007;13(6):422-430. Doi: 10.1016/j.cardfail.2007.03.011
19. Tonelli M., Wiebe N., Culleton B., House A., Rabbat C., Fok M., et al. Chronic kidney disease and mortality risk: a systematic review. J Am Soc Nephrol. 2006;17(7):2034-2047. Doi: 10.1681/ASN.2005101085
20. Forman D.E., Butler J., Wang Y., Abraham W.T., O’Connor C.M., Gottlieb S.S., et al. Incidence, predictors at admission, and impact of worsening renal function among patients hospitalized with heart failure. J Am Coll Cardiol. 2004;43(1):61-67. Doi: 10.1016/j.jacc.2003.07.031
21. Gottlieb S.S., Abraham W., Butler J., Forman D.E., Loh E., Massie B.M., et al. The prognostic importance of different definitions of worsening renal function in congestive heart failure. J Card Fail. 2002;8(3):136-141. Doi: 10.1054/jcaf.2002.125289
22. Goldberg A., Hammerman H., Petcherski S., Zdorovyak A., Yalonetsky S., Kapeliovich M., et al. Inhospital and 1-year mortality of patients who develop worsening renal function following acute ST-elevation myocardial infarction. Am Heart J. 2005;150(2):330-337. Doi: 10.1016/j.ahj.2004.09.055
23. Parikh C.R., Coca S.G., Wang Y., Masoudi F.A., Krumholz H.M. Long-term prognosis of acute kidney injury after acute myocardial infarction. Arch Intern Med. 2008;168(9):987-995. Doi: 10.1001/archinte.168.9.987
24. Jose P., Skali H., Anavekar N., Tomson C., Krumholz H.M., Rouleau J.L., et al. Increase in creatinine and cardiovascular risk in patients with systolic dysfunction after myocardial infarction. J Am Soc Nephrol. 2006;17(10):2886-2891. Doi: 10.1681/ASN.2006010063
25. Krumholz H.M., Chen Y.T., Vaccarino V., Wang Y., Radford M.J., Bradford W.D., et al. Correlates and impact on outcomes of worsening renal function in patients > or =65 years of age with heart failure. Am J Cardiol. 2000;85(9):1110-1113. Doi: 10.1016/s0002-9149(00)00705-0
26. Metra M., Nodari S., Parrinello G., Bordonali T., Bugatti S., Danesi R., et al. Worsening renal function in patients andomizedd for acute heart failure: clinical implications and prognostic significance. Eur J Heart Fail. 2008;10(2):188-195. Doi: 10.1016/j.ejheart.2008.01.011
27. Cowie M.R., Komajda M., Murray-Thomas T., Underwood J., Ticho B. Prevalence and impact of worsening renal function in patients hospitalized with decompensated heart failure: results of the prospective outcomes study in heart failure (POSH). Eur Heart J. 2006;27(10):1216-1222. Doi: 10.1093/eurheartj/ehi859
28. Smith G.L., Vaccarino V., Kosiborod M., Lichtman J.H., Cheng S., Watnick S.G., et al. Worsening renal function: what is a clinically meaningful change in creatinine during hospitalization with heart failure?. J Card Fail. 2003;9(1):13-25. Doi: 10.1054/jcaf.2003.3
29. Latchamsetty R., Fang J., Kline-Rogers E., Mukherjee D., Otten R.F., LaBounty T.M., et al. Prognostic value of transient and sustained increase in in-hospital creatinine on outcomes of patients admitted with acute coronary syndrome. Am J Cardiol. 2007;99(7):939-942. Doi: 10.1016/j.amjcard.2006.10.058
30. Newsome B.B., Warnock D.G., McClellan W.M., Herzog C.A., Kiefe C.I., Eggers P.W., et al. Long-term risk of mortality and end-stage renal disease among the elderly after small increases in serum creatinine level during hospitalization for acute myocardial infarction. Arch Intern Med. 2008;168(6):609-616. Doi: 10.1001/archinte.168.6.609
31. Logeart D., Tabet J.Y., Hittinger L., Thabut G., Jourdain P., Maison P., et al. Transient worsening of renal function during hospitalization for acute heart failure alters outcome. Int J Cardiol. 2008;127(2):228-232. Doi: 10.1016/j.ijcard.2007.06.007
32. Fonarow G.C., Adams K.F. Jr., Abraham W.T., Yancy C.W., Boscardin W.J.; ADHERE Scientific Advisory Committee, Study Group, and Investigators. Risk stratification for in-hospital mortality in acutely decompensated heart failure: classification and regression tree analysis. JAMA. 2005;293(5):572-580. Doi: 10.1001/jama.293.5.572
33. Lee D.S., Austin P.C., Rouleau J.L., Liu P.P., Naimark D., Tu J.V. Predicting mortality among patients hospitalized for heart failure: derivation and validation of a clinical model. JAMA. 2003;290(19):2581-2587. Doi: 10.1001/jama.290.19.2581
34. De Luca L., Fonarow G.C., Adams K.F. Jr., Mebazaa A., Tavazzi L., Swedberg K., et al. Acute heart failure syndromes: clinical scenarios and pathophysiologic targets for therapy. Heart Fail Rev. 2007;12(2):97-104. Doi: 10.1007/s10741-007-9011-8
35. Gheorghiade M., Abraham W.T., Albert N.M., Greenberg B.H., O’Connor C.M., She L., et al.; OPTIMIZE-HF Investigators and Coordinators. Systolic blood pressure at admission, clinical characteristics, and outcomes in patients hospitalized with acute heart failure. JAMA. 2006;296(18):2217-2226. Doi: 10.1001/jama.296.18.2217
36. Hillege H.L., Nitsch D., Pfeffer M.A., Swedberg K., McMurray J.J., Yusuf S., et al. Renal function as a predictor of outcome in a broad spectrum of patients with heart failure. Circulation. 2006;113(5):671-678. Doi: 10.1161/CIRCULATIONAHA.105.580506
37. Holgado J.L., Lopez C., Fernandez A., Sauri I., Uso R., Trillo J.L., et al. Acute kidney injury in heart failure: a population study. ESC Heart Fail. 2020;7(2):415-422. Doi: 10.1002/ehf2.12595
38. Hillege H.L., Girbes A.R., de Kam P.J., Boomsma F., de Zeeuw D., Charlesworth A., et al. Renal function, neurohormonal activation, and survival in patients with chronic heart failure. Circulation. 2000;102(2):203-210. Doi: 10.1161/01.cir.102.2.203
39. Mullens W., Abrahams Z., Skouri H.N., Francis G.S., Taylor D.O., Starling R.C., et al. Elevated intra-abdominal pressure in acute decompensated heart failure: a potential contributor to worsening renal function?. J Am Coll Cardiol. 2008;51(3):300-306. Doi: 10.1016/j.jacc.2007.09.043
40. Mullens W., Abrahams Z., Francis G.S., Taylor D.O., Starling R.C., Tang W.H. Prompt reduction in intra-abdominal pressure following large-volume mechanical fluid removal improves renal insufficiency in refractory decompensated heart failure. J Card Fail. 2008;14(6):508-514. Doi: 10.1016/j.cardfail.2008.02.010
41. Tang W.H., Mullens W. Cardiorenal syndrome in decompensated heart failure. Heart. 2010;96(4):255-260. Doi: 10.1136/hrt.2009.166256
42. Mullens W., Nijst P. Cardiac Output and Renal Dysfunction: Definitely More Than Impaired Flow. J Am Coll Cardiol. 2016;67(19):2209-2212. Doi: 10.1016/j.jacc.2016.03.537
43. Hanberg J.S., Sury K., Wilson F.P., Brisco M.A., Ahmad T., Ter Maaten J.M.,, et al. J Am Coll Cardiol. 2016;67(19):2199-2208. Doi: 10.1016/j.jacc.2016.02.058
44. Testani J.M., Chen J., McCauley B.D., Kimmel S.E., Shannon R.P. Potential effects of aggressive decongestion during the treatment of decompensated heart failure on renal function and survival. Circulation. 2010;122(3):265-272. Doi: 10.1161/CIRCULATIONAHA.109.933275
45. Verbrugge F.H., Grieten L., Mullens W. Management of the cardiorenal syndrome in decompensated heart failure. Cardiorenal Med. 2014;4(3-4):176-188. Doi: 10.1159/000366168
46. Verbrugge F.H., Dupont M., Steels P., Grieten L., Malbrain M., Tang W.H., et al. Abdominal contributions to cardiorenal dysfunction in congestive heart failure. Abdominal contributions to cardiorenal dysfunction in congestive heart failure. J Am Coll Cardiol. 2013;62(6):485-495. Doi: 10.1016/j.jacc.2013.04.070
47. Dupont M., Mullens W., Finucan M., Taylor D.O., Starling R.C., Tang W.H. Determinants of dynamic changes in serum creatinine in acute decompensated heart failure: the importance of blood pressure reduction during treatment. Eur J Heart Fail. 2013;15(4):433-440. Doi: 10.1093/eurjhf/hfs209
48. Damman K., Navis G., Voors A.A., Asselbergs F.W., Smilde T.D., Cleland J.G., et al. Worsening renal function and prognosis in heart failure: systematic review and meta-analysis. J Card Fail. 2007;13(8):599-608. Doi: 10.1016/j.cardfail.2007.04.008
49. Cody R.J., Ljungman S., Covit A.B., Kubo S.H., Sealey J.E., Pondolfino K., et al. Regulation of glomerular filtration rate in chronic congestive heart failure patients. Kidney Int. 1988;34(3):361-367. Doi: 10.1038/ki.1988.189
50. Cody R.J., Torre S., Clark M., Pondolfino K. Age-related hemodynamic, renal, and hormonal differences among patients with congestive heart failure. Arch Intern Med. 1989;149(5):1023-1028. PMID: 2655542.
51. Rangaswami J., Bhalla V., Blair J.E.A., Chang T.I., Costa S., Lentine K.L., et al. Cardiorenal Syndrome: Classification, Pathophysiology, Diagnosis, and Treatment Strategies: A Scientific Statement From the American Heart Association. Circulation. 2019;139(16):e840-e878. Doi: 10.1161/CIR.000000000000066452. Mullens W., Verbrugge F.H., Nijst P., Tang W.H.W. Renal sodium
52. avidity in heart failure: from pathophysiology to treatment strategies. Eur Heart J. 2017;38(24):1872-1882. Doi: 10.1093/eurheartj/ehx035
53. GOTTSCHALK C.W. Micropuncture studies of tubular function in the mammalian kidney. Folia Med Neerl. 1962;5:11-30. PMID: 13900773.
54. Park F., Mattson D.L., Skelton M.M., Cowley A.W.Jr. Localization of the vasopressin V1a and V2 receptors within the renal cortical and medullary circulation. Am J Physiol. 1997;273(1 Pt 2):R243-R251. Doi: 10.1152/ajpregu.1997.273.1.R243
55. Star R.A., Nonoguchi H., Balaban R., Knepper M.A. Calcium and cyclic adenosine monophosphate as second messengers for vasopressin in the rat inner medullary collecting duct. J Clin Invest. 1988;81(6):1879-1888. Doi: 10.1172/JCI113534
56. Schrier R.W. Aldosterone ‘escape’ vs ‘breakthrough’. Nat Rev Nephrol. 2010;6(2):61. Doi: 10.1038/nrneph.2009.228
57. Damman K., van Deursen V.M., Navis G., Voors A.A., van Veldhuisen D.J., Hillege H.L. Increased central venous pressure is associated with impaired renal function and mortality in a broad spectrum of patients with cardiovascular disease. J Am Coll Cardiol. 2009;53(7):582-588. Doi: 10.1016/j.jacc.2008.08.080
58. Mullens W., Abrahams Z., Francis G.S., Sokos G., Taylor D.O., Starling R.C., et al. Importance of venous congestion for worsening of renal function in advanced decompensated heart failure. J Am Coll Cardiol. 2009;53(7):589-596. Doi: 10.1016/j.jacc.2008.05.068
59. Verhaert D., Mullens W., Borowski A., Popović Z.B., Curtin R.J., Thomas J.D., et al. Right ventricular response to intensive medical therapy in advanced decompensated heart failure. Circ Heart Fail. 2010;3(3):340-346. Doi: 10.1161/CIRCHEARTFAILURE.109.900134
60. Burnett J.C. Jr., Haas J.A., Knox F.G. Segmental analysis of sodium reabsorption during renal vein constriction. Am J Physiol. 1982;243(1):F19-F22. Doi: 10.1152/ajprenal.1982.243.1.F19
61. Wathen R.L., Selkurt E.E. Intrarenal regulatory factors of salt excretion during renal venous pressure elevation. Am J Physiol. 1969;216(6):1517-1524. Doi: 10.1152/ajplegacy.1969.216.6.1517
62. Maxwell M.H., Breed E.S., Schwartz I.L. Renal venous pressure in chronic congestive heart failure. J Clin Invest. 1950;29(3):342-348. Doi: 10.1172/JCI102263
63. Damman K., Navis G., Smilde T.D., Voors A.A., van der Bij W., van Veldhuisen D.J., et al. Decreased cardiac output, venous congestion and the association with renal impairment in patients with cardiac dysfunction. Eur J Heart Fail. 2007;9(9):872-878. Doi: 10.1016/j.ejheart.2007.05.010
64. Mullens W., Damman K., Testani J.M., Martens P., Mueller C., Lassus J., et al. Evaluation of kidney function throughout the heart failure trajectory – a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2020;22(4):584-603. Doi: 10.1002/ejhf.1697
65. Damman K., Valente M.A., Voors A.A., O’Connor C.M., van Veldhuisen D.J., Hillege H.L. Renal impairment, worsening renal function, and outcome in patients with heart failure: an updated meta-analysis. Eur Heart J. 2014;35(7):455-469. Doi: 10.1093/eurheartj/eht386
66. Kula A.J., Hanberg J.S., Wilson F.P., Brisco M.A., Bellumkonda L., Jacoby D., et al. Influence of Titration of Neurohormonal Antagonists and Blood Pressure Reduction on Renal Function and Decongestion in Decompensated Heart Failure. Circ Heart Fail. 2016;9(1):e002333. Doi: 10.1161/CIRCHEARTFAILURE.115.002333
67. Verbrugge F.H., Duchenne J., Bertrand P.B., Dupont M., Tang W.H., Mullens W. Uptitration of renin-angiotensin system blocker and beta-blocker therapy in patients hospitalized for heart failure with reduced versus preserved left ventricular ejection fractions. Am J Cardiol. 2013;112(12):1913-1920. Doi: 10.1016/j.amjcard.2013.08.013
68. Packer M., Lee W.H., Kessler .PD. Preservation of glomerular filtration rate in human heart failure by activation of the renin-angiotensin system. Circulation. 1986;74(4):766-774. Doi: 10.1161/01.cir.74.4.766
69. CONSENSUS Trial Study Group. Effects of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). N Engl J Med. 1987;316(23):1429-1435. Doi: 10.1056/NEJM198706043162301
70. Ljungman S., Kjekshus J., Swedberg K. Renal function in severe congestive heart failure during treatment with enalapril (the Cooperative North Scandinavian Enalapril Survival Study [CONSENSUS] Trial). Am J Cardiol. 1992;70(4):479-487. Doi: 10.1016/0002-9149(92)91194-9
71. Williams B., Mancia G., Spiering W., Agabiti Rosei E., Azizi M., Burnier M., et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension [published correction appears in J Hypertens. 2019 Jan;37(1):226]. J Hypertens. 2018;36(10):1953-2041. Doi: 10.1097/HJH.0000000000001940
72. Brunner-La Rocca H.P., Knackstedt C., Eurlings L., Rolny V., Krause F., Pfisterer M.E., et al. Impact of worsening renal function related to medication in heart failure. Eur J Heart Fail. 2015;17(2):159-168. Doi: 10.1002/ejhf.210
73. Арутюнов А.Г., Драгунов Д.О., Арутюнов Г.П., Рылова А.К., Соколова А.В. Влияние на прогноз комбинированной мочегонной терапии у пациентов, страдающих циррозом печени, ХБП и пневмонией на фоне декомпенсации кровообращения. Журнал Сердечная Недостаточность. 2015;16(1):11–21. eLIBRARY ID: 25277006
74. Арутюнов А.Г., Драгунов Д.О., Арутюнов Г.П., Рылова А.К., Соколова А.В. Влияние лекарственных форм петлевого диуретика с различной скоростью высвобождения на ранний и отсроченный прогноз у пациентов с декомпенсацией кровообращения. Кардиология. 2015;54(9):24-32. Doi: 10.18565/cardio.2014.9.24-32.
75. Firth J.D., Raine A.E., Ledingham J.G. Raised venous pressure: a direct cause of renal sodium retention in oedema?. Lancet. 1988;1(8593):1033-1035. Doi: 10.1016/s0140-6736-(88)91851-x
76. Wehling M. Morbus diureticus in the elderly: epidemic overuse of a widely applied group of drugs. J Am Med Dir Assoc. 2013;14(6):437-442. Doi: 10.1016/j.jamda.2013.02.002
77. Ahmed A., Husain A., Love T.E., Gambassi G., Dell’Italia L.J., Francis G.S., et al. Heart failure, chronic diuretic use, and increase in mortality and hospitalization: an observational study using propensity score methods. Eur Heart J. 2006;27(12):1431-1439. Doi: 10.1093/eurheartj/ehi890
78. Ali S.S., Olinger C.C., Sobotka P.A., Dahle T.G., Bunte M.C., Blake D., et al. Loop diuretics can cause clinical natriuretic failure: a prescription for volume expansion. Congest Heart Fail. 2009;15(1):1-4. Doi: 10.1111/j.1751-7133.2008.00037.x
79. Ljungman S., Laragh J.H., Cody R.J. Role of the kidney in congestive heart failure. Relationship of cardiac index to kidney function. Drugs. 1990;39 Suppl 4:10-24. Doi: 10.2165/00003495-199000394-00004
80. Testani J.M., Chen J., McCauley B.D., Kimmel S.E., Shannon R.P. Potential effects of aggressive decongestion during the treatment of decompensated heart failure on renal function and survival. Circulation. 2010;122(3):265-272. Doi: 10.1161/CIRCULATIONAHA.109.933275
81. Wanner C., Inzucchi S.E., Lachin J.M., Fitchett D., von Eynatten M., Mattheus M. et al. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med. 2016;375(4):323-334. Doi:10.1056/NEJMoa1515920
82. Perkovic V., de Zeeuw D., Mahaffey K.W., Fulcher G., Erondu N., Shaw W. et al. Canagliflozin and renal outcomes in type 2 diabetes: results from the CANVAS Program andomized clinical trials. Lancet Diabetes Endocrinol. 2018;6(9):691-704. Doi: 10.1016/S2213-8587(18)30141-4
83. Mosenzon O., Wiviott S.D., Cahn A., Rozenberg A., Yanuv I., Goodrich E.L., et al. Effects of dapagliflozin on development and progression of kidney disease in patients with type 2 diabetes: an analysis from the DECLARE-TIMI 58 randomised trial [published correction appears in Lancet Diabetes Endocrinol. 2019 Aug;7(8):e20]. Lancet Diabetes Endocrinol. 2019;7(8):606-617. Doi: 10.1016/S2213-8587(19)30180-9
84. Damman K., Gori M., Claggett B., Jhund P.S., Senni M., Lefkowitz M.P., et al. Renal Effects and Associated Outcomes During Angiotensin-Neprilysin Inhibition in Heart Failure. JACC Heart Fail. 2018;6(6):489-498. Doi: 10.1016/j.jchf.2018.02.004
85. Арутюнов А.Г., Рылова А.К., Арутюнов Г.П. Пневмония у госпитализированных пациентов с декомпенсацией кровообращения (Регистр Павловской больницы). Журнал сердечная недостаточность. 2014;15(3):146-159. eLIBRARY ID: 25276966
86. Арутюнов А.Г., Драгунов Д.О., Арутюнов Г.П., Соколова А.В., Рылова А.К. Влияние основных факторов риска у пациентов на прогноз при декомпенсации сердечной недостаточности. Кардиология. 2014;54(12):37-43. Doi: 10.18565/cardio.2014.12.37-43.
87. Арутюнов А.Г., Драгунов Д.О., Арутюнов Г.П., Рылова А.К., Пашкевич Д.Д., Витер К.В., и др. Первое открытое исследование синдрома острой декомпенсации сердечной недостаточности и сопутствующих заболеваний в Российской Федерации. Независимый регистр ОРАКУЛРФ. Кардиология. 2015;55(5):12-21. doi: 10.18565/cardio.2015.5.12-21
88. Арутюнов Г.П., Тарловская Е.И., Арутюнов А.Г., Беленков Ю.Н., Конради А.О., Лопатин Ю.М., и др. Международный регистр “Анализ динамики Коморбидных заболеваний у пациенТов, перенесшИх инфицироВание SARS-CoV-2” (AКТИВ) и регистр “Анализ госпитализаций Коморбидных пациенТов ИнфицироВанных в период второй волны SARS-CoV-2” (AКТИВ 2). Российский кардиологический журнал. 2021;26(3):4358. doi: 10.15829/1560-4071-2021-4358.
89. Арутюнов Г.П., Тарловская Е.И., Арутюнов А.Г., Беленков Ю.Н., Конради А.О., Лопатин Ю.М., и др. Международный регистр “Анализ динамики Коморбидных заболеваний у пациенТов, перенесших инфицирование SARS-CoV-2” (АКТИВ SARS-CoV-2): анализ предикторов неблагоприятных исходов острой стадии новой коронавирусной инфекции. Российский кардиологический журнал. 2021;26(4):4470. doi: 10.15829/1560-4071-2021-4470
Об авторах
А. Г. АрутюновРоссия
Арутюнов Александр Григорьевич, д.м.н., профессор кафедры пропедевтики внутренних болезней педиатрического факультета;
генеральный секретарь
Москва
Р. А. Башкинов
Россия
Башкинов Роман Андреевич, медицинский советник
Москва
Т. И. Батлук
Россия
Батлук Татьяна Ивановна, к.м.н., ассистент кафедры пропедевтики внутренних болезней педиатрического факультета;
Медицинский советник
Москва
Е. С. Мельников
Россия
Мельников Евгений Сергеевич, медицинский советник
Москва
А. Н. Ермилова
Россия
Ермилова Анастасия Николаевна, медицинский советник
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Арутюнов А.Г., Башкинов Р.А., Батлук Т.И., Мельников Е.С., Ермилова А.Н. Острое повреждение почек у пациентов с хронической сердечной недостаточностью. Южно-Российский журнал терапевтической практики. 2021;2(3):6-17. https://doi.org/10.21886/2712-8156-2021-2-3-6-17
For citation:
Arutyunov A.G., Bashkinov R.A., Batluk T.I., Melnikov E.S., Ermilova A.N. Acute kidney injury in patients with chronic heart failure. South Russian Journal of Therapeutic Practice. 2021;2(3):6-17. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-3-6-17


























