Перейти к:
Хроническая обструктивная болезнь легких и фибрилляция предсердий
https://doi.org/10.21886/2712-8156-2021-2-4-22-29
Аннотация
Хроническая обструктивная болезнь лёгких (ХОБЛ) имеет тесную взаимосвязь с развитием сердечной недостаточности и фибрилляции предсердий (ФП). В патогенезе развития ФП у пациентов с ХОБЛ имеют значение снижение оксигенации, гиперкапния, лёгочная гипертензия, диастолическая дисфункция, окислительный стресс, воспаление, изменения размера предсердий, а также использование респираторных препаратов для лечения ХОБЛ. Понимание взаимосвязи между ХОБЛ и ФП имеет особое значение, поскольку наличие аритмии оказывает значительное влияние на смертность, особенно при обострениях ХОБЛ. При наличии ХОБЛ у пациентов с ФП наблюдается более быстрое прогрессированием ФП, рецидивы ФП после катетерной аблации, а также увеличением смертности от сердечно‑сосудистых заболеваний. Лечение основного заболевания, коррекция гипоксии и кислотно‑щелочного дисбаланса является терапией первой линии для пациентов с ХОБЛ, у которых развивается ФП. Кардиоселективные β‑адреноблокаторы безопасны и могут применяться при ХОБЛ. Аблация при ФП является эффективной и безопасной, а также улучшает качество жизни этих пациентов.
Ключевые слова
Для цитирования:
Глова С.Е., Разумовский И.В. Хроническая обструктивная болезнь легких и фибрилляция предсердий. Южно-Российский журнал терапевтической практики. 2021;2(4):22-29. https://doi.org/10.21886/2712-8156-2021-2-4-22-29
For citation:
Glova S.E., Razumovsky I.V. Chronic obstructive pulmonary disease and atrial fibrillation. South Russian Journal of Therapeutic Practice. 2021;2(4):22-29. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-4-22-29
Введение
Хроническая обструктивная болезнь легких (ХОБЛ) — одна из ведущих причин заболеваемости и смертности во всем мире [1]. Общая распространённость среди мужчин в возрасте 30 лет и старше составляет 14,3% (95% ДИ: 13,3–15,3%) по сравнению с 7,6% (95% ДИ: 7,0–8,2%) у женщин [2]. ХОБЛ в настоящее время является четвёртой по распространённости причиной смерти в мире и, по прогнозам, станет третьей к 2030 г. при отсутствии вмешательств, направленных на устранение факторов риска, особенно курения, воздействия продуктов сгорания топлива и загрязнения окружающей среды [2]. Одной из наиболее часто встречающейся аритмией при ХОБЛ является фибрилляция предсердий (ФП), и именно она связана с повышением сердечно-сосудистой заболеваемости и смертности у данной когорты пациентов [3]. Установлено, что ХОБЛ независимо связана с ФП [4][5], но точные патофизиологические механизмы сложны и до конца не изучены. Наличие ФП у пациентов с ХОБЛ ухудшает прогноз, в то время как наличие ХОБЛ у пациентов с ФП также оказывает определённое влияние на прогрессирование ФП, успех кардиоверсии, исходы аблации и смертность. Специальные лекарства и терапевтические эффекты могут улучшить прогноз в этой популяции.
Хроническая обструктивная болезнь лёгких и фибрилляция предсердий
Накопление доказательств указывает на то, что ХОБЛ связана с ФП [4][5]. Copenhagen City Heart Study показало, что уменьшение объема форсированного выдоха за одну секунду (ОФВ1) является независимым предиктором начала ФП [6]. В исследовании ARIC после многопараметрической корректировки традиционных факторов риска сердечно-сосудистых заболеваний отношение рисков (ОР) ФП при сравнении самого низкого и самого высокого квартилей ОФВ1 составило 1,37 (95% ДИ: 1,02–1,83) для белых женщин, 1,49 ( 95% ДИ: 1,16–1,91) — для белых мужчин, 1,63 (95% ДИ: 1,00–2,66) — для чернокожих женщин и 2,36 (95% ДИ: 1,30–4,29) — для чернокожих мужчин [7]. Крупное популяционное когортное исследование Malmo Preventive Project установило, что ОФВ1 был обратно пропорционален заболеваемости ФП [ОР: 1,39 (95% доверительный интервал (ДИ): 1,16–1,68; p = 0,001) для женщин и ОР: 1,20 (95% ДИ: 1,13–1,29; p <0,0001) для мужчин)] [8]. Форсированная жизненная ёмкость лёгких (ФЖЕЛ) также обратно пропорциональна частоте возникновения ФП [ОР: 1,20 (95% ДИ: 1,03–1,41; p = 0,020) для женщин и ОР: 1,08 (95% ДИ: 1,02–1,14; p = 0,01) для мужчин] [8]. В недавнем исследовании Konecny et al. выявлено, что ХОБЛ была связана с повышенной вероятностью ФП или трепетания предсердий (23,3% против 11,0%, соответственно, p <0,0001) по сравнению с пациентами без ХОБЛ [9]. ХОБЛ также ассоциируется с послеоперационной ФП [10]. Было доказано, что при острых обострениях ХОБЛ нарушение лёгочной функции, гиперкапния и высокие значения артериального давления в лёгочной артерии являются независимыми предикторами развития ФП [11].
Патофизиологические механизмы, влияющие на хроническую обструктивную болезнь лёгких и фибрилляцию предсердий
Исследования, изучающие влияние гипоксии на электрофизиологию предсердий, дали противоречивые результаты. В экспериментальных моделях Krause et al. не наблюдали электрофизиологических эффектов, приводящих к увеличению возникновения ФП в условиях глубокой гипоксемии [12]. Аналогичные результаты были получены Stevenson et al. которые не смогли показать влияние гипоксии на рефрактерность предсердий. Их результаты свидетельствуют против прямого электрофизиологического эффекта гипоксии, но нельзя исключить косвенное аритмогенное влияние через активацию симпатической нервной системы [13]. Вызванная гипоксией экспрессия фактора роста эндотелия сосудов (VEGF) регулируется индуцируемым гипоксией фактором-1 альфа (HIF-1a), транскрипционным фактором для VEGF, который является модулятором для восприятия и реагирования на изменения концентрации кислорода [14]. Экспрессия матриксной металлопротеиназы-9 (MMP-9), приводящей к десмоплазии, увеличивается в фибриллирующих предсердиях и может способствовать структурному ремоделированию предсердий [14]. Возможно, что активирующая регуляция HIF-1a / VEGF участвует в усилении экспрессии MMP-9 в условиях гипоксии [14]. Su et al. установили, что HIF-1α способствует экспрессии трансформирующего фактора роста бета (TGF-β1), который контролирует пролиферацию, клеточную дифференцировку и другие функции в большинстве клеток и MMP-9 и таким образом участвует в фиброзе предсердий [15]. У пациентов с ХОБЛ также было обнаружено удлинение QTc по сравнению с контрольной группой [16]. В исследовании ARIC изучался удлиненный интервал QT, скорректированный с использованием формулы Фрамингема (QTc) в качестве предиктора возникновения ФП, и было показано, что удлиненный интервал QTc прогнозирует примерно двукратное повышение риска ФП [17]. Интервал QTc отражает эффективный рефрактерный период предсердий (AERP), предполагая, что интервал QTc может использоваться как маркер рефрактерности предсердий, имеющий значение для оценки риска ФП и терапевтических стратегий [18].
Гиперкапния также связана с возникновением ФП при ХОБЛ. Гиперкапния вызывает увеличение рефрактерности и значительное замедление проводимости миокарда предсердий [19]. Возвращение CO2 к норме приводит к быстрому возвращению рефрактерности к исходным уровням, но замедление проводимости сохраняется, что позволяет предположить, что гиперкапния может способствовать развитию ФП после коррекции гиперкапнии [19]. Гиперкапния и гипоксемия вызывают сужение лёгочных артериол, что приводит к легочной гипертензии. Лёгочная гипертензия приводит к дилатации правого предсердия и увеличению трансмурального давления на эндокардиальные сосуды, изменяя распределение кровотока, что может вызывать аритмию [11]. При обострениях ХОБЛ ФП чаще встречается у пациентов с более высоким уровнем PaCO2 и более высокими значениями систолического давления в лёгочной артерии [11].
В последнее время появилось представление о том, что в предсердиях пациентов с ХОБЛ может присутствовать длительное и неоднородное распространение деполяризации. В недавнем исследовании Acar et al. показали, что удлинение времени внутрипредсердного проведения, измеренное с помощью двумерного или тканевого допплеровского исследования, независимо связано с соотношением ОФВ1 / ФЖЕЛ [20]. Дисперсия зубца P (PWD) (разница в максимальной и минимальной продолжительности зубца P) также оказалась независимым фактором риска развития ФП [21]. PWD была больше в острой фазе, чем в стабильной, и больше у пациентов с более частыми обострениями, что позволяет предположить, что PWD может быть целью для прогнозирования, профилактики и лечения острых обострений ХОБЛ [22]. Длительность P-волны и интервал PQ являются факторами риска развития ФП у пациентов с P pulmonale, а длительность P-волны сильно коррелирует с интервалом PQ >150 мс [23].
ХОБЛ способствует диастолической дисфункции желудочков [24]. Диастолическая дисфункция левого желудочка связана с тяжестью заболевания и может служить другим возможным патофизиологическим механизмом инициации и сохранения ФП [24]. Также дисфункция правого желудочка и повышенное давление в лёгочной артерии связаны с индексом объема правого предсердия у пациентов с лёгочной гипертензией вследствие ХОБЛ и способствуют развитию ФП [25].
Окислительный стресс и воспаление представляют собой основные патогенетические механизмы ХОБЛ, а также участвуют в инициации и сохранении ФП [26]. Поэтому можно предположить, что окислительные и воспалительные реакции, связанные с ХОБЛ, могут способствовать развитию ФП.
Респираторные препараты и фибрилляция предсердий
Было показано, что применение препаратов для лечения ХОБЛ ускоряет развитие ФП. Использование β-агонистов короткого и длительного действия может повысить риск ФП при ХОБЛ. β-агонисты могут вызывать аритмогенность из-за воздействия на хронотропию, деполяризацию, реполяризацию и распределение калия в клетках, опосредованных β-адренорецепторами. Укорочение рефрактерности предсердий может способствовать индукции ФП и объяснять повышенную частоту аритмии при ХОБЛ [28].
Антихолинергические препараты подавляют парасимпатический контроль частоты сердечных сокращений, что связано с увеличением частоты тахиаритмий [29]. Исследователи Lung Health Study сообщили об относительном риске госпитализаций из-за наджелудочковой тахикардии 4,5 (95% ДИ: 0,97–20,8), связанного с использованием ингаляционного ипратропия короткого действия по сравнению с плацебо [30]. Ogale и др. также сообщили о повышенном риске аритмии, связанной с использованием ипратропия [31], однако эти результаты не были подтверждены в рандомизированных контролируемых исследованиях тиотропия [32].
Метилксантиновые препараты, такие как теофиллин и аминофиллин, также вызывают ускорение развития ФП [33]. Ответственные механизмы включают эффекты деполяризации и истощение электролитов с повышенной экскрецией калия и магния с мочой. В исследовании «случай-контроль» кратковременное применение теофиллина было связано с повышенным риском ФП [33].
Использование глюкокортикоидов было связано с почти двукратным повышением риска ФП [34]. Несмотря на то, что среди пользователей ингаляционных стероидов не было обнаружено повышенного риска аритмий в целом, пероральные стероиды были связаны с ФП. По-видимому, несколько механизмов вовлечены в развитие ФП у пациентов, получавших кортикостероиды. Длительное применение глюкокортикоидов связано с повышенным риском атеросклероза, гипертонии, сахарного диабета, увеличения левого предсердия, сердечной недостаточности и ишемической болезни сердца, состояний, которые являются хорошо известными факторами риска ФП. Также было высказано предположение о том, что высокие дозы кортикостероидов опосредуют отток калия через прямое действие на клеточную мембрану, вызывая аритмии. Более того, повышенный риск ФП, у пациентов, использующих высокие дозы, предполагает, что кортикостероиды могут иметь прямой аритмогенный эффект.
Патофизиологические механизмы, влияющие на развитие ФП при ХОБЛ, представлены на рис. 1.
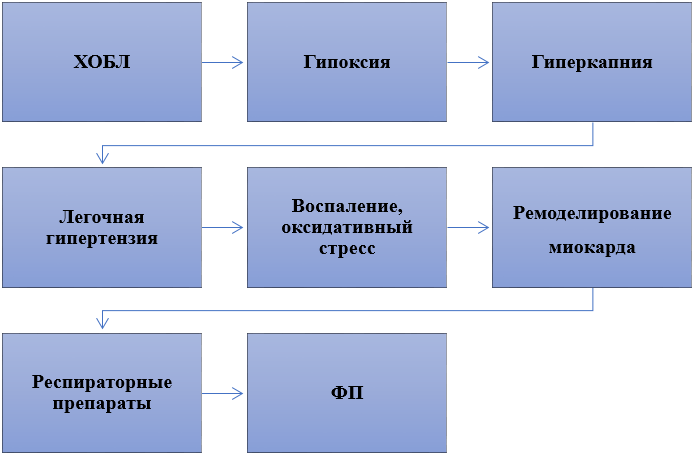
Рисунок 1. Графическое изображение основных патофизиологических механизмов, связывающих ХОБЛ и ФП
Прогностическое значение фибрилляции предсердий при хронической обструктивной болезни лёгких
Чрезвычайно важно учитывать прогноз и развитие сердечно-сосудистых осложнений у пациентов с ФП и ХОБЛ. BODE Index — это многомерная система оценки, которая оценивает индекс массы тела, выраженность обструкции дыхательных путей, одышку и переносимость физических нагрузок у пациентов с ХОБЛ, а также прогнозирует смертность и отдалённые результаты. У пациентов с более высокими показателями BODE Index значительно чаще встречаются аритмии, а именно наджелудочковая тахикардия, ФП и трепетание предсердий [35].
Шкала DECAF объединила пять предикторов смертности (шкала одышки MRC, эозинопения, консолидация, ацидемия и ФП) у пациентов с ХОБЛ [36]. Оценка по шкале DECAF проста и является более эффективным предиктором смертности госпитализированных пациентов с обострением ХОБЛ, она показала лучшие прогностические результаты, чем шкала CURB-65, и может помочь клиницистам более точно предсказать прогноз и уровень помощи для улучшения результатов лечения.
С другой стороны, наличие ХОБЛ у пациентов с ФП, по-видимому, оказывает специфическое влияние на прогрессирование ФП и смертность. Артериальная гипертония, возраст, перенесённый инсульт или транзиторная ишемическая атака, ХОБЛ и сердечная недостаточность являются независимыми предикторами прогрессирования ФП [37]. Основываясь на этих параметрах, de Vos et al. разработали шкалу HATCH (сокращение от артериальной гипертонии, возраста, перенесённой преходящей транзиторной ишемической атаки или инсульта, ХОБЛ и сердечной недостаточности), которая независимо предсказывает прогрессирование ФП. Поскольку показатель HATCH коррелирует с возникновением ФП, его можно использовать для отбора пациентов для усиленного мониторинга ЭКГ. Оценка HATCH также может использоваться в качестве предиктора новых эпизодов ФП после оперативных вмешательств и полезна для прогнозирования краткосрочного успеха электрической кардиоверсии ФП на ранних стадиях [38]. Однако в исследовании Kochhäuser et al. сообщили, что оценка HATCH является плохим предиктором прогрессирования ФП (площадь под кривой 0,54), тогда как диаметр левого предсердия 45 мм (отношение шансов — 3,46, P <0,001) и сердечная недостаточность (отношение шансов — 3,11, P = 0,036) были сильными и независимыми предикторами прогрессирования ФП [39].
Euro Heart Survey по ФП было направлено на то, чтобы дать представление о современной кардиоверсии ФП в реальной практике и определить предикторы как немедленного, так и долгосрочного успеха. Было установлено, что отсутствие ХОБЛ прогнозирует успешную электрическую кардиоверсию и поддержание синусового ритма в течение одного года [40]. В исследованиях также оценивалась эффективность и безопасность лечения ФП с помощью радиочастотной катетерной аблации у пациентов с ХОБЛ. Roh et al. исследовали электро-анатомические изменения в лёгочных венах у пациентов с хроническими заболеваниями лёгких с ФП и оценили их влияние на результаты катетерной аблации [41]. Они сообщили, что эффективность катетерной аблации сопоставима с таковой у пациентов с нормальной функцией лёгких. Цель другого исследования под руководством Gu — изучить влияние ХОБЛ на исходы катетерной аблации у пациентов с ФП с точки зрения рецидивов и качества жизни [42]. Несмотря на то, что наличие ХОБЛ предсказывало более частое рецидивирование после однокатетерной аблации у пациентов с ФП, значительное улучшение качества жизни наблюдалось в популяции пациентов с ХОБЛ после абляции [42]. Наличие ХОБЛ может также увеличить риск ишемического инсульта у пациентов с ФП [43]. Nadeem и др. установили, что ФП в сочетании с ХОБЛ является более сильным предиктором ишемического нарушения мозгового кровообращения, чем только ФП или только ХОБЛ [43]. В программе EURObservational Research Programme (EORP-AF) было доказано, что ХОБЛ широко распространена у европейских пациентов с ФП и связана с более высокими показателями сердечно-сосудистой смерти, смерти от всех причин и комбинированной точкой любого тромбоэмболического события/кровотечения/смерти от сердечно-сосудистых заболеваний [44]. Также годовое наблюдение в регистре EORP-AF дало картину современного использования оральных антикоагулянтов (ОАК) у европейских пациентов с ФП и показало низкую частоту тромбоэмболических и геморрагических событий у пациентов с ФП, хотя смертность была высокой. Общий уровень использования OAК в целом был высоким (84,9%), была очевидна значительная географическая неоднородность в назначении новых ОАК или антагонистов витамина К. Применение ОАК было связано с более низким риском всех основных неблагоприятных исходов. Все виды лечения были связаны с более низким риском смерти от сердечно-сосудистых заболеваний и смерти от всех причин [45][46].
По данным Huang и др., наличие ХОБЛ у пациентов с ФП является независимым фактором риска общей смертности в течение одного года и смертности от сердечно-сосудистых заболеваний [47]. Кроме того, данные исследований ROCKET AF [48] и ARISTOTLE [49] показали, что ХОБЛ тесно связана со смертностью от всех причин при ФП.
Антиаритмическая терапия и вмешательства при фибрилляции предсердий при хронической обструктивной болезни лёгких
Лечение ХОБЛ у пациентов с сопутствующей ФП должно быть таким же, как и у пациентов без ФП [50]. Имеющиеся данные свидетельствуют об общем приемлемом профиле безопасности для использования β-агонистов длительного действия, холинолитиков и ингаляционных кортикостероидов. Напротив, следует соблюдать осторожность при использовании β-агонистов короткого действия и теофиллина, которые могут ускорить ФП и ухудшить контроль сердечного ритма.
У пациентов с ХОБЛ, у которых развивается ФП, лечение основного заболевания лёгких и коррекция гипоксии и кислотно-щелочного дисбаланса имеют первостепенное значение и представляют собой терапию первой линии [50]. Пропафенон следует применять с осторожностью у пациентов со значительным бронхоспазмом, тогда как их можно безопасно применять у пациентов с ХОБЛ. Дилтиазем и верапамил хорошо переносятся и эффективны. Также можно использовать амиодарон или дигоксин в комбинации с блокаторами кальциевых каналов. Было показано, что раннее профилактическое введение амиодарона пациентам с ХОБЛ после аортокоронарного шунтирования снижает риск развития ФП. Использование β-адреноблокаторов у пациентов с ХОБЛ и сопутствующими сердечно-сосудистыми заболеваниями вызывает споры, и в результате их назначают недостаточно, несмотря на растущие данные, подтверждающие их безопасность и эффективность. Текущие данные подтверждают, что ХОБЛ не является противопоказанием для терапии кардиоселективными β-адреноблокаторами. Использование β-блокаторов у пациентов с ХОБЛ может не только снизить риск общей смертности, но и снизить риск обострений ХОБЛ [51]. Кардиоверсия должна быть предпринята у пациентов с ХОБЛ, которые становятся гемодинамически нестабильными в результате пароксизмальной ФП. У пациентов, невосприимчивых к медикаментозной терапии, можно рассмотреть возможность абляции атриовентрикулярных узлов. Доказано, что аблация при ФП является эффективной и безопасной и улучшает качество жизни при ХОБЛ. Однако необходимы дополнительные исследования с большим размером выборки и долгосрочным наблюдением для оценки эффективности и безопасности лечения ФП с помощью катетерной аблации, а также с различными типами операций при ХОБЛ [52].
Заключение
Всё больше данных указывает на то, что ХОБЛ связана с ФП. Наличие ФП при ХОБЛ оказывает значительное влияние на смертность, в то время как наличие ХОБЛ при ФП оказывает специфическое влияние на прогрессирование ФП, успех кардиоверсии, исходы аблации и смертность. Полное выяснение патофизиологических механизмов, влияющих на ХОБЛ и ФП, откроет возможность для улучшения терапевтических возможностей и снижения смертности у этих пациентов. Лечение основного заболевания легких и коррекция гипоксии и кислотно-щелочного дисбаланса представляет собой терапию первой линии для пациентов с ХОБЛ, у которых развивается ФП. β-адреноблокаторы традиционно противопоказаны при ХОБЛ, однако недавние данные свидетельствуют о том, что кардиоселективные β-блокаторы безопасны и снижают частоту обострений ХОБЛ и смертность. Аблация ФП может быть безопасно выполнена при ХОБЛ и улучшает качество жизни.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. Authors declares no conflict of interest.
Список литературы
1. Vestbo J, Hurd SS, Agustí AG, Jones PW, Vogelmeier C, Anzueto A, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary. Am J Respir Crit Care Med. 2013;187 (4):347–65. DOI: 10.1164/rccm.201204–0596PP.
2. Adeloye D, Chua S, Lee C, Basquill C, Papana A, Theodoratou E, et al. Global and regional estimates of COPD prevalence: Systematic review and meta-analysis. J Glob Health. 2015;5 (2):020415. DOI: 10.7189/jogh.05–020415.
3. Beyerbach DM, Zipes DP. Mortality as an endpoint in atrial fibrillation. Heart Rhythm. 2004;1 (2 Suppl): B8–18, discussion B18–9. DOI: 10.1016/j.hrthm.2004.04.018.
4. Chahal H, Heckbert SR, Barr RG, Bluemke DA, Jain A, Habibi M, et al. Ability of Reduced Lung Function to Predict Development of Atrial Fibrillation in Persons Aged 45 to 84 Years (from the Multi-Ethnic Study of Atherosclerosis-Lung Study). Am J Cardiol. 2015;115 (12):1700–4. DOI: 10.1016/j.Amjcard.2015.03.018.
5. Konecny T, Park JY, Somers KR, Konecny D, Orban M, Soucek F, et al. Relation of chronic obstructive pulmonary disease to atrial and ventricular arrhythmias. Am J Cardiol. 2014;114 (2):272–7. DOI: 10.1016/j.amjcard.2014.04.030.
6. Buch P, Friberg J, Scharling H, Lange P, Prescott E. Reduced lung function and risk of atrial fibrillation in the Copenhagen City Heart Study. Eur Respir J. 2003;21 (6):1012–6. DOI: 10.1183/09031936.03.00051502.
7. Li J, Agarwal SK, Alonso A, Blecker S, Chamberlain AM, London SJ, et al. Airflow obstruction, lung function, and incidence of atrial fibrillation: the Atherosclerosis Risk in Communities (ARIC) study. Circulation. 2014;129 (9):971–80. DOI: 10.1161/CIRCULATIONAHA.113.004050.
8. Johnson LS, Juhlin T, Engström G, Nilsson PM. Reduced forced expiratory volume is associated with increased incidence of atrial fibrillation: the Malmo Preventive Project. Europace. 2014;16 (2):182–8. DOI: 10.1093/europace/eut255.
9. Konecny T, Park JY, Somers KR, Konecny D, Orban M, Soucek F, et al. Relation of chronic obstructive pulmonary disease to atrial and ventricular arrhythmias. Am J Cardiol. 2014;114 (2):272–7. DOI: 10.1016/j.amjcard.2014.04.030.
10. Geçmen Ç, Babür Güler G, Erdoğan E, Hatipoğlu S, Güler E, Yılmaz F, et al. SYNTAX score predicts postoperative atrial fibrillation in patients undergoing on-pump isolated coronary Artery bypass grafting surgery. Anatol J Cardiol. 2016;16 (9):655–61. DOI: 10.5152/anatoljcardiol.2015.6483.
11. Terzano C, Romani S, Conti V, Paone G, Oriolo F, Vitarelli A. Atrial fibrillation in the acute, hypercapnic exacerbations of COPD. Eur Rev Med Pharmacol Sci. 2014;18 (19):2908–17. PMID: 25339486.
12. Krause PC, Inoue H, Zipes DP. Electrophysiologic alterations produced by hypoxia in the canine heart. Am Heart J. 1989;117 (3):550–61. DOI: 10.1016/0002–8703 (89)90728-x.
13. Stevenson IH, Roberts-Thomson KC, Kistler PM, Edwards GA, Spence S, Sanders P, et al. Atrial electrophysiology is altered by acute hypercapnia but not hypoxemia: implications for promotion of atrial fibrillation in pulmonary disease and sleep apnea. Heart Rhythm. 2010;7 (9):1263–70. DOI: 10.1016/j.Hrthm.2010.03.020.
14. Ogi H, Nakano Y, Niida S, Dote K, Hirai Y, Suenari K, et al. Is structural remodeling of fibrillated atria the consequence of tissue hypoxia? Circ J. 2010;74 (9):1815–21. DOI: 10.1253/circj.Cj-09–0969.
15. Su F, Zhang W, Chen Y, Ma L, Zhang H, Wang F. Significance of hypoxia-inducible factor-1α expression with atrial fibrosis in rats induced with isoproterenol. Exp Ther Med. 2014;8 (6):1677–1682. DOI: 10.3892/etm.2014.1989.
16. Sievi NA, Clarenbach CF, Camen G, Rossi VA, van Gestel AJ, Kohler M. High prevalence of altered cardiac repolarization in patients with COPD. BMC Pulm Med. 2014;14:55. DOI: 10.1186/1471–2466–14–55.
17. Mandyam MC, Soliman EZ, Alonso A, Dewland TA, Heckbert SR, Vittinghoff E, et al. The QT interval and risk of incident atrial fibrillation. Heart Rhythm. 2013;10 (10):1562–8. DOI: 10.1016/j.hrthm.2013.07.023.
18. Nguyen KT, Gladstone RA, Dukes JW, Nazer B, Vittinghoff E, Badhwar N, et al. The QT Interval as a Noninvasive Marker of Atrial Refractoriness. Pacing Clin Electrophysiol. 2016;39 (12):1366–1372. DOI: 10.1111/pace.12962.
19. Stevenson IH, Roberts-Thomson KC, Kistler PM, Edwards GA, Spence S, Sanders P, et al. Atrial electrophysiology is altered by acute hypercapnia but not hypoxemia: implications for promotion of atrial fibrillation in pulmonary disease and sleep apnea. Heart Rhythm. 2010;7 (9):1263–70. DOI: 10.1016/j. Hrthm.2010.03.020.
20. Acar G, Kahraman H, Akkoyun M, Kilinc M, Zencir C, Yusufoglu E, et al. Evaluation of atrial electromechanical delay and its relationship to inflammation and oxidative stress in patients with chronic obstructive pulmonary disease. Echocardiography. 2014;31 (5):579–85. DOI: 10.1111/echo.2442.
21. Bhatt SP, Nanda S, Kintzer JS. Arrhythmias as trigger for acute exacerbations of chronic obstructive pulmonary disease. Respir Med. 2012;106 (8):1134–8. DOI: 10.1016/j.Rmed.2012.04.007.
22. Bhatt SP, Nanda S, Kintzer JS. Arrhythmias as trigger for acute exacerbations of chronic obstructive pulmonary disease. Respir Med. 2012;106 (8):1134–8. DOI: 10.1016/j. Rmed.2012.04.007.
23. Hayashi H, Miyamoto A, Kawaguchi T, Naiki N, Xue JQ, Matsumoto T, et al. P-pulmonale and the development of atrial fibrillation. Circ J. 2014;78 (2):329–37. DOI: 10.1253/circj.Cj-13–0654.
24. Baum C, Ojeda FM, Wild PS, Rzayeva N, Zeller T, Sinning CR, et al. Subclinical impairment of lung function is related to mild cardiac dysfunction and manifest heart failure in the general population. Int J Cardiol. 2016;218:298–304. DOI: 10.1016/j.Ijcard.2016.05.034.
25. Agoston-Coldea L, Petrovai D, Mihalcea I, Revnic R, Mocan T, Lupu S. Right Atrium Volume Index in Patients with Secondary Pulmonary Hypertension Due to Chronic Obstructive Pulmonary Disease. Acta Cardiol Sin. 2015;31 (4):325–36. DOI: 10.6515/acs20150119a.
26. Harada M, Van Wagoner DR, Nattel S. Role of inflammation in atrial fibrillation pathophysiology and management. Circ J. 2015;79 (3):495–502. DOI: 10.1253/circj.CJ-15–0138.
27. Wilcheskym,ernstp,brophyjm,plattrw,Suissa S. Bronchodilator use and the risk of arrhythmia in COPD: part 2: reassessment in the larger Quebec cohort. Chest. 2012;142 (2):305–311. DOI: 10.1378/chest.11–1597.
28. Kallergis EM, Manios EG, Kanoupakis EM, Schiza SE, Mavrakis HE, Klapsinos NK, et al. Acute electrophysiologic effects of inhaled salbutamol in humans. Chest. 2005;127 (6):2057–63. DOI: 10.1378/chest.127.6.2057.
29. Singh S, Loke YK, Enright P, Furberg CD. Pro-arrhythmic and pro-ischaemic effects of inhaled anticholinergic medications. Thorax. 2013;68 (1):114–6. DOI: 10.1136/thoraxjnl-2011-201275.
30. Anthonisen NR, Connett JE, Enright PL, Manfreda J; Lung Health Study Research Group. Hospitalizations and mortality in the Lung Health Study. Am J Respir Crit Care Med. 2002;166 (3):333–9. DOI: 10.1164/rccm.2110093.
31. Ogale SS, Lee TA, Au DH, Boudreau DM, Sullivan SD. Cardiovascular events associated with ipratropium bromide in COPD. Chest. 2010;137 (1):13–9. DOI: 10.1378/chest.08–2367.
32. Hohlfeld JM, Furtwaengler A, Könen-Bergmann M, Wallenstein G, Walter B, Bateman ED. Cardiac safety of tiotropium in patients with COPD: a combined analysis of Holter-ECG data from four randomised clinical trials. Int J Clin Pract. 2015;69 (1):72–80. DOI: 10.1111/ijcp.12596.
33. Huerta C, Lanes SF, García Rodríguez LA. Respiratory medications and the risk of cardiac arrhythmias. Epidemiology. 2005;16 (3):360–6. DOI: 10.1097/01.ede.0000158743.90664.a7.
34. Christiansen CF, Christensen S, Mehnert F, Cummings SR, Chapurlat RD, Sørensen HT. Glucocorticoid use and risk of atrial fibrillation or flutter: a population-based, casecontrol study. Arch Intern Med. 2009;169 (18):1677–83. DOI: 10.1001/archinternmed.2009.297.
35. Grabicki M, Parysek H, Batura-Gabryel H, Brodnicka I. Comorbidities as an element of multidimensional prognostic assessment of patients with chronic obstructive pulmonary disease. J Physiol Pharmacol. 2008;59 Suppl 6:297–301. PMID: 19218653.
36. Steer J, Gibson J, Bourke SC. The DECAF Score: predicting hospital mortality in exacerbations of chronic obstructive Pulmonary disease. Thorax. 2012;67 (11):970–6. DOI: 10.1136/thoraxjnl-2012–202103.
37. De Vos CB, Pisters R, Nieuwlaat R, Prins MH, Tieleman RG, Coelen RJ, et al. Progression from paroxysmal to persistent atrial fibrillation clinical correlates and prognosis. J Am Coll Cardiol. 2010;55 (8):725–31. DOI: 10.1016/j.jacc.2009.11.040.
38. Emren SV, Kocabaş U, Duygu H, Levent F, Şimşek EÇ, Yapan Emren Z, et al. The role of HATCH score in predicting the success rate of sinus rhythm following electrical cardioversion of atrial fibrillation. Kardiol Pol. 2016;74 (9):978–84. DOI: 10.5603/KP.a2016.0044.
39. Kochhäuser S, Dechering DG, Trought K, Hache P, haigcarter T, Khaykin Y, et al. Predictors for Progression of Atrial Fibrillation in Patients Awaiting Atrial Fibrillation Ablation. Can J Cardiol. 2016;32 (11):1348–1354. DOI: 10.1016/j.Cjca.2016.02.031.
40. Pisters R, Nieuwlaat R, Prins MH, Le Heuzey JY, Maggioni AP, Camm AJ, et al. Clinical correlates of immediate success and outcome at 1-year follow-up of real-world cardioversion of atrial fibrillation: the Euro Heart Survey. Europace. 2012;14 (5):666–74. DOI: 10.1093/europace/eur406.
41. Roh SY, Choi JI, Lee JY, Kwak JJ, Park JS, Kim JB, et al. Catheter ablation of atrial fibrillation in patients with chronic lung disease. Circ Arrhythm Electrophysiol. 2011;4 (6):815–22. DOI: 10.1161/CIRCEP.110.960435.
42. Gu J, Liu X, Tan H, Zhou L, Jiang W, Wang Y, et al. Impact of chronic obstructive pulmonary disease on procedural outcomes and quality of life in patients with atrial fibrillation undergoing catheter ablation. J Cardiovasc Electrophysiol. 2013;24 (2):148– 54. DOI: 10.1111/j.1540–8167.2012.02448.x.
43. Nadeem R, Sharieff A, Tanna S, Sidhu H, Molnar J, Nadeem A. Potential Augmentation of the Risk of Ischemic Cerebrovascular Accident by Chronic Obstructive Pulmonary Disease in Patients with Atrial Fibrillation. J Stroke Cerebrovasc Dis. 2015;24 (8):1893–6. DOI: 10.1016/j.jstrokecerebrovasdis.2015.04.034.
44. Proietti M, Laroche C, Drozd M, Vijgen J, Cozma DC, Drozdz J, et al. Impact of chronic obstructive pulmonary disease on prognosis in atrial fibrillation: A report from the eurobservational Research Programme Pilot Survey on Atrial Fibrillation (EORP-AF) General Registry. Am Heart J. 2016;181:83–91. DOI: 10.1016/j.ahj.2016.08.011.
45. Boriani G, Proietti M, Laroche C, Fauchier L, Marin F, Nabauer M, et al. Contemporary stroke prevention strategies in 11 096 European patients with atrial fibrillation: a report from the eurobservational Research Programme on Atrial Fibrillation (EORP-AF) Long-Term General Registry. Europace. 2018;20 (5):747–757. DOI: 10.1093/europace/eux301.
46. Boriani G, Proietti M, Laroche C, Fauchier L, Marin F, Nabauer M, et al. Association between antithrombotic treatment and outcomes at 1-year follow-up in patients with atrial fibrillation: the EORP-AF General Long-Term Registry. Europace. 2019;21 (7):1013–1022. DOI: 10.1093/europace/euz032.
47. Huang B, Yang Y, Zhu J, Liang Y, Zhang H, Tian L, et al. Clinical characteristics and prognostic significance of chronic obstructive pulmonary disease in patients with atrial fibrillation: results from a multicenter atrial fibrillation registry study. J Am Med Dir Assoc. 2014;15 (8):576–81. DOI: 10.1016/j.Jamda.2014.04.009.
48. Ugowe FE, Hellkamp AS, Wang A, Becker RC, Berkowitz SD, Breithardt G, et al. Pharmacotherapy for diabetes and stroke risk: Results from ROCKET AF. Heart Rhythm O2. 2021;2 (3):215–222. DOI: 10.1016/j.hroo.2021.04.001.
49. Al-Khatib SM, Mulder H, Wojdyla D, Lopes RD, Wallentin L, Alexander JH, et al. Apixaban Versus Warfarin in Patients With Atrial Fibrillation and Left Ventricular Hypertrophy: Insights From the ARISTOTLE Trial. Circ Arrhythm Electrophysiol. 2021;14 (3): e009614. DOI: 10.1161/CIRCEP.120.009614.
50. Hindricks G, Potpara T, Dagres N, Arbelo E, Bax JJ, Blomström-Lundqvist C, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for cardiothoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021;42 (5):373–498. DOI: 10.1093/eurheartj/ehaa612. Erratum in: Eur Heart J. 2021;42 (5):507. Erratum in: Eur Heart J. 2021;42 (5):546–547. Erratum in: Eur Heart J. 2021. PMID: 32860505.
51. Gulea C, Zakeri R, Alderman V, Morgan A, Ross J, Quint JK. Beta-blocker therapy in patients with COPD: a systematic literature review and meta-analysis with multiple treatment comparison. Respir Res. 2021;22 (1):64. DOI: 10.1186/s12931-021-01661-8.
52. Huang B, Yang Y. Radiofrequency catheter ablation of atrial fibrillation in patients with chronic obstructive pulmonary disease: opportunity and challenge: response to Dr. Kumar’s comment. J Am Med Dir Assoc. 2015;16 (1):83–4. DOI: 10.1016/j.jamda.2014.09.014.
Об авторах
С. Е. ГловаРоссия
Глова Светлана Евгеньевна, кандидат медицинских наук, доцент кафедры терапии
Ростов-на-Дону
И. В. Разумовский
Разумовский Игорь Валерьевич, аспирант кафедры терапии кафедры терапии
Ростов-на-Дону
Рецензия
Для цитирования:
Глова С.Е., Разумовский И.В. Хроническая обструктивная болезнь легких и фибрилляция предсердий. Южно-Российский журнал терапевтической практики. 2021;2(4):22-29. https://doi.org/10.21886/2712-8156-2021-2-4-22-29
For citation:
Glova S.E., Razumovsky I.V. Chronic obstructive pulmonary disease and atrial fibrillation. South Russian Journal of Therapeutic Practice. 2021;2(4):22-29. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-4-22-29


























