Перейти к:
Случай инфаркта миокарда в следствии спонтанной диссекции коронарной артерии
https://doi.org/10.21886/2712-8156-2022-3-1-95-105
Аннотация
В настоящее время спонтанная диссекция коронарной артерии все чаще диагностируется как одна из причин развития острого коронарного синдрома. В статье представлены данные об эпидемиологии, группах риска, факторах, предрасполагающих и способствующих развитию заболевания. Описан клинический случай инфаркта миокарда с элевацией сегмента ST, возникшего в результате спонтанной диссекции правой коронарной артерии у пациентки в возрасте 53 лет.
Ключевые слова
Для цитирования:
Холодова В.Е., Намитоков А.М., Донец Е.К., Кручинова С.В., Космачева Е.Д. Случай инфаркта миокарда в следствии спонтанной диссекции коронарной артерии. Южно-Российский журнал терапевтической практики. 2022;3(1):95-105. https://doi.org/10.21886/2712-8156-2022-3-1-95-105
For citation:
Kholodova V.E., Namitokov A.M., Donets E.K., Kruchinova S.V., Kosmacheva E.D. A case of myocardial infarction due to spontaneous dissection of the coronary artery. South Russian Journal of Therapeutic Practice. 2022;3(1):95-105. (In Russ.) https://doi.org/10.21886/2712-8156-2022-3-1-95-105
Вступление
В последние годы уделяется большое внимание такому феномену, как инфаркт миокарда без обструкции коронарных артерий (ИМБОКА), представляющему собой гетерогенную патологию, к развитию которого могут привести трoмбофилии, спазм, аномалии строения и эмболии в коронарные артерии (КА), микроваскулярный спазм, а также спонтанная диссекция коронарных артерий (СДКА) [1]. Распространённость ИМБОКА, по данным современных литературных источников, составляет 1–13% всех пациентов с диагнозом ОИМ [2].
К развитию СДКА может привести повреждение интимы и, как следствие, образование интрамуральной гематомы и ложного канала в просвете коронарной артерии [3] или первично формирующейся интрамуральной гематомы из-за спонтанного кровотечения из vasa vasorum, что в дальнейшем может привести к разрыву интимы сосуда [4–6]. Образование интрамуральной гематомы, ложного канала приводит к сужению, обструкции просвета артерии и развитию ишемии и инфаркта миокарда [3–7].
Истинная частота и распространённость СДКА в настоящее время неизвестна. Это связано с несколькими причинами, такими как гиподиагностика ОКС у молодых пациентов, малая доступность внутрикоронарных визуализирующих методик в клинической практике. Золотым стандартом оценки состояния коронарного русла является коронароангиография, которая, однако, имеет ограничения в диагностике диссекций коронарных артерий ввиду невозможности полноценной оценки состояния стенки сосуда. Кроме того очевидно, что часть пациентов, умерших на догоспитальном этапе и не подвергшихся коронарографии, могли иметь именно СДКА в качестве основного механизма развития критической ишемии. Предполагают, что вероятная распространённость СДКА составляет 1,7–4% в общей популяции [8]. У женщин с ОКС в возрасте до 50 лет — 35% [7][9–20]. Распространённость СДКА, по данным оптической когерентной томографии, составляет 4% (Nishiguchi T, Tanaka A, Oz-aki Y, et al.) [22]. При инфаркте миокарда, ассоциированном с беременностью (в третьем триместре или послеродовом периоде) — 43% [23]. Множественная спонтанная диссекция коронарных артерий наблюдается в 23% случаев, и чаще поражается левая коронарная артерия (32–50%) [21][24].
К группам риска относятся следующие категории: женщины, которые составляют 90–92% всех пациентов с СКДА (возраст — 44–55 лет, европеоидная раса (81–83%)). У пациентов с данной патологией могут отсутствовать традиционные факторы риска, такие как курение, сахарный диабет, ожирение [25]. Предрасполагающими факторами возникновения СДКА являются фибромускулярная дисплазия, беременность, повторные роды, заболевания соединительной ткани, системные заболевания, гормональная терапия (комбинированные оральные контрацептивы), глюкокортикоиды и идиопатические факторы [7][8][19][26–35].
Спровоцировать развитие СДКА могут интенсивные физические нагрузки, психоэмоциональный стресс, увеличение тонуса блуждающего нерва (рвота, кашель, приём кокаина, амфетамина, метамфетамина) [36–42]. Известны различные литературные источники, где описаны случаи возникновения СДКА после физического напряжения, употребления наркотиков (кокаина), использования оральных контрацептивов, у пациентов с синдромом Марфана, Элерса-Данлоса IV типа, дефицитом α1-антитрипсина [41][43–47].
Описание случая
Пациентка Б., 53 года, 27.10.2020 г. доставлена бригадой скорой помощи в клинику с жалобами на боли давящего характера за грудиной, длительные, с иррадиацией в левое плечо, слабость.
Из анамнеза известно, что описанные жалобы появились утром в 6 ч. 30 мин. на фоне полного благополучия. Пациентка обратилась за медицинской помощью, выполнена ЭКГ, диагностирован ОКСпST. Госпитализирована в стационар по месту жительства, где было проведено следующее лечение: гепарин, клопидогрел 300 мг, тромболизис метализе 10 мг, аспирин 300 мг. На фоне проводимого лечения боли были купированы. Далее, согласно имеющейся маршрутизации, транспортирована и госпитализирована в региональный сосудистый центр (РСЦ) для инвазивного лечения.
При сборе анамнеза жизни установлено следующее: повышение артериального давления (АД) максимально до 150/100 мм рт. ст. около 7 лет, принимает гипотензивную терапию. Нарушение ритма сердца и боли ангинозного характера ранее не беспокоили. Наследственность по сердечно-сосудистым заболеваниям не отягощена, вредные привычки, сопутствующие заболевания отрицала.
Данные объективного осмотра при поступлении: кожные покровы и слизистые нормальной окраски и влажности, телосложение гиперстеническое, подкожная клетчатка развита избыточно (вес — 100 кг, рост — 172 см, индекс массы тела (ИМТ) — 33,8 кг/м2), периферические отёки отсутствуют. При проведении физикального обследования выявлено: границы сердца в пределах нормы, тоны приглушены, ритм — правильный, частота сердечных сокращений (ЧСС) — 60 в минуту, пульс — ритмичный, 60 ударов в минуту, удовлетворительного наполнения и напряжения, АД на руках — 160/67 мм рт. ст., грудная клетка правильной формы; при аускультации лёгких выслушивается ослабленное везикулярное дыхание, хрипов нет; частота дыхательных движений — 18 в минуту. Sp O2 — 96% на воздухе.
По данным инструментальных методов исследования выявлены следующие изменения. На электрокардиограмме (догоспитальный этап) ритм — синусовый, ЧСС — 51 в мин. Отклонение эл. оси сердца влево. Нарушение внутрижелудочковой проводимости. Элевация сегмента ST в отведениях II, III, aVF до 4 мм. Двухфазный зубец Т в отведении aVL (рис. 1).
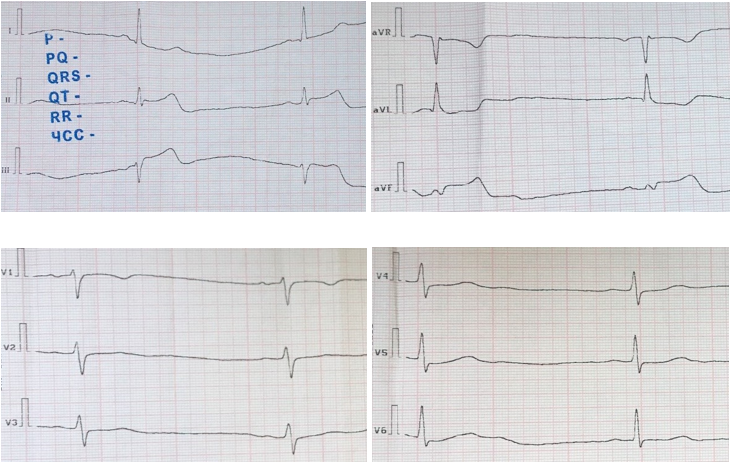
Рисунок 1. Электрокардиограмма на догоспитальном этапе.
На ЭКГ (госпитальный этап — стационар по месту жительства после проведения тромболизиса) синусовый ритм с ЧСС 62 в мин. Отклонение эл. оси сердца влево. Нарушение внутрижелудочковой проводимости. Элевация сегмента ST в отведениях II, III, aVF до 2 мм (рис. 2).
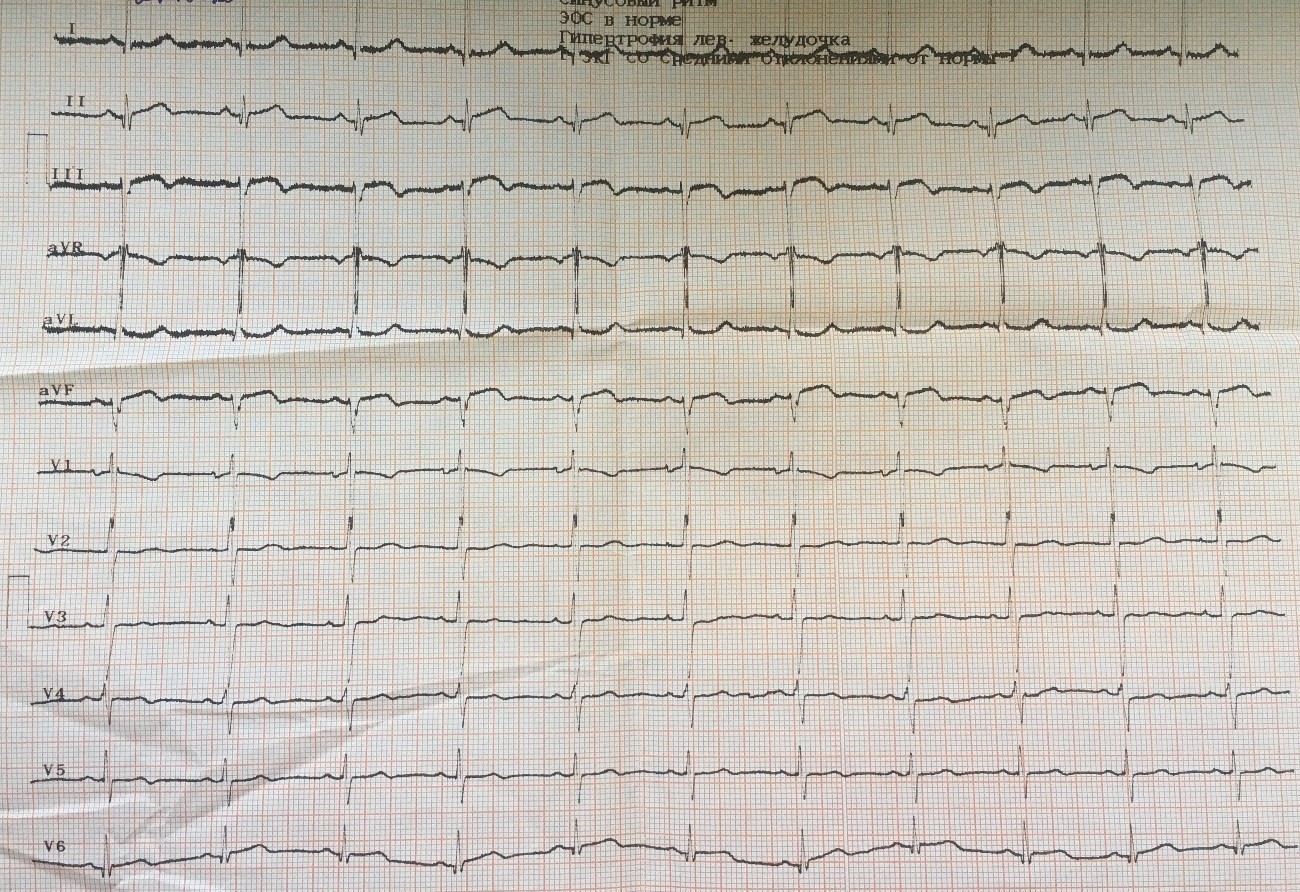
Рисунок 2. Электрокардиограмма на госпитальном этапе в стационаре по месту жительства после проведения тромболизиса.
На ЭКГ (госпитальный этап в РСЦ) синусовый ритм с ЧСС 62 в мин. ЭОС отклонена влево. Нарушение проводимости — блокада передней ветви левой ножки пучка Гиса. Отрицательный зубец Т в отведениях III, aVF, V4-V6. Двухфазный зубец Т в отведениях II, V3 (рис. 3).
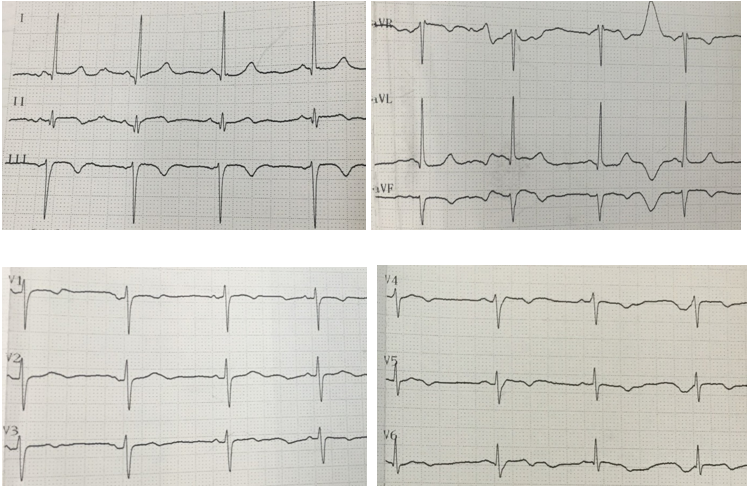
Рисунок 3. Электрокардиограмма при поступлении в региональный сосудистый центр (1-е сутки инфаркта миокарда).
По данным эхокардиографии, отмечалось нарушение локальной сократимости миокарда левого желудочка (ЛЖ) — выраженный гипокинез нижнебоковой области в базальных и средних сегментах, базальных сегментов нижней, нижне-перегородочной области. Общая сократимость миокарда ЛЖ (фракция выброса) — 55 %.
По результатам коронароангиографии (лучевой доступ) была выявлена линейная диссекция в дистальном отделе правой коронарной артерии (ПКА) с пристеночными дефектами контрастирования (тромб) (рис. 4). Ангиографическая картина соответствовала критериям СДКА: отсутствие атеросклеротического поражения правой коронарной артерии, наличие лоскута интимы в просвете сосуда; распространение контраста вне сосуда после инъекции; начало и окончание двойного хода сосуда (просвет истинного и ложного сосудов); сжатие просвета сосуда гематомой, снижение просвета сосуда.
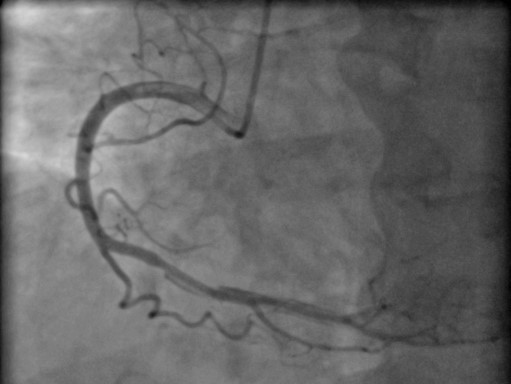
Рисунок 4. Коронароангиография при поступлении в региональный сосудистый центр (27.10.2020г.): линейная диссекция в дистальном отделе правой коронарной артерии с пристеночными дефектами контрастирования – тромб.
При поступлении выполнен биохимический анализ крови, липидный профиль, общий анализ крови, коагулограмма, общий анализ мочи, также определён уровень кардиоспецифических ферментов при поступлении и в динамике (табл. 1, 2, 3, 4, 5, 6, 7, 8).
Таблица 1
Общий анализ крови (при поступлении).

Таблица 2
Биохимический анализ (при поступлении).

Таблица 3
Определение уровня тропонина I (при поступлении).

Таблица 4
Липидный спектр (при поступлении).

Таблица 5
Коагулограмма (при поступлении).
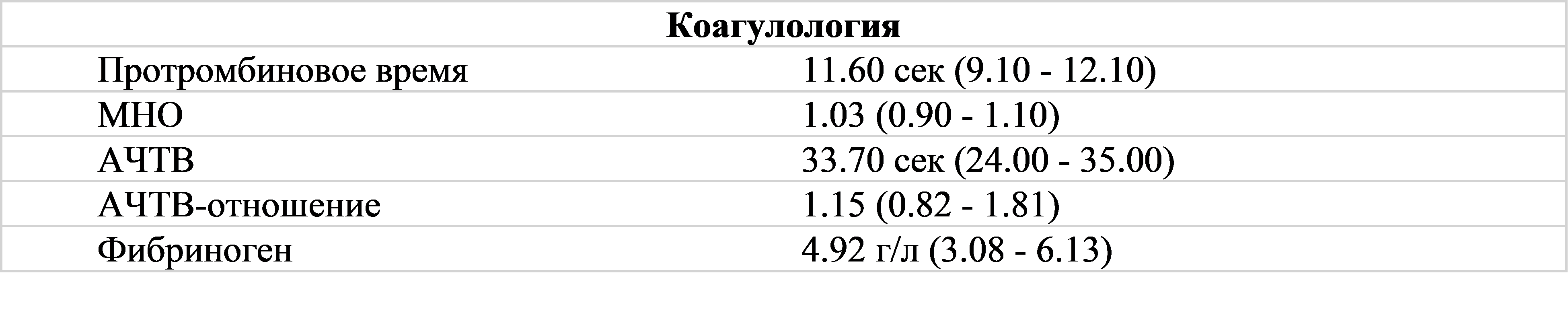
Таблица 6
Общий анализ мочи (при поступлении).

Таблица 7
Определение уровня кардиоспецифических ферментов (в динамике через 6 часов после поступления).

Таблица 8
Определение уровня кардиоспецифических ферментов (в динамике через 12 часов после поступления).

Поскольку у пациентки имелась линейная диссекция в дистальном отделе, тромбоз ПКА ввиду высокой вероятности фрагментирования тромбов при попытке аспирации и, как следствие, дистальной эмболии, принято решение продолжить консервативную терапию (оптимальная антикоагулянтная и антиагрегантная терапия), динамическое наблюдение с последующим ангиографическим контролем через 72 часа.
В последующие трое суток у пациентки сохранялись периодические боли ангинозного характера, без существенной динамики по данным ЭКГ (рис. 5).
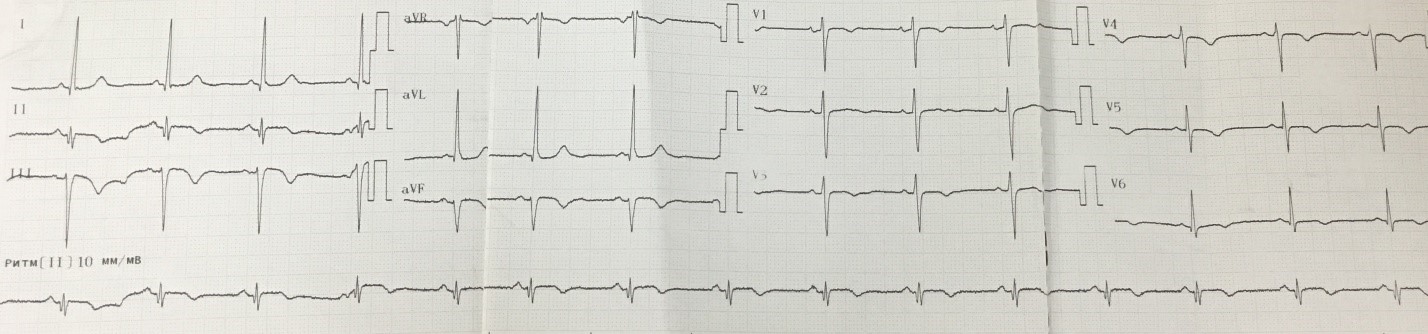
Рисунок 5. Электрокардиограмма (2-е сутки инфаркта миокарда).
На 4-е сутки от даты инфаркта миокарда (30.10.2020 г.) выполнена КАГ, по данным которой сохранялась линейная диссекция в дистальном отделе ПКА, произошел практически полный лизис тромбов (рис 6). В связи с сохранением диссекции в ПКА жалоб пациентки на боли ангинозного характера, принято решение об оперативном вмешательстве, реваскуляризации миокарда методом чрескожного коронарного вмешательства.

Рисунок 6. Контрольная коронароангиография на 4-е сутки инфаркта миокарда (30.10.2020г.): сохраняется линейная диссекция в дистальном отделе правой коронарной артерии, произошел практически полный лизис тромбов.
30.10.2020 г. выполнена экстренная операция — чрескожная транслюминальная коронарная ангиопластика правой коронарной артерии с имплантацией стента «Promus PREMIER» 3,0×32 мм. На контрольной ангиографии просвет артерии в месте имплантации стента был восстановлен, но сохранялась линейная диссекция в терминальном отделе правой коронарной артерии с переходом на проксимальный и средний отделы задней нисходящей артерии. Кровоток TIMI 2 (рис. 7).
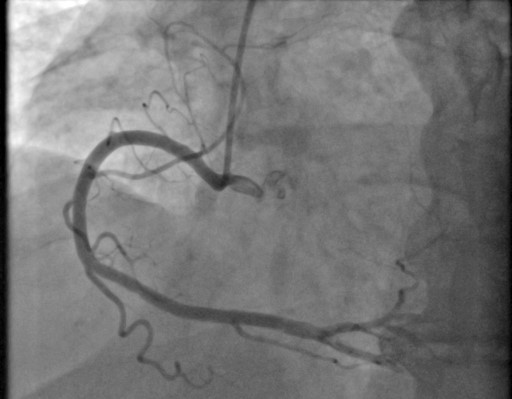
Рисунок 7. Коронароангиография, выполнена операция: чрескожная транслюминальная коронарная ангиопластика правой коронарной артерии с имплантацией стента «Promus PREMIER» 3,0 x 32 мм (30.10.2020г.): просвет артерии в месте имплантации стента восстановлен, но сохраняется линейная диссекция в терминальном отделе правой коронарной артерии с переходом на проксимальный и средний отделы задней нисходящей артерии. Кровоток TIMI 2
На фоне проводимого лечения аспирином 100 мг, тикагрелором 90 мг 2 раза в день, бисопрололом 5 мг, лозартаном 50 мг, розувастатином 20 мг пациентка чувствовала себя относительно удовлетворительно, состояние её стабилизировалось, одышка и ангинозные боли не рецидивировали, постепенное расширение двигательного режима переносила удовлетворительно, АД стабилизировалось на уровне 120/80 мм рт. ст., на серии ЭКГ сохранялась элевация сегмента ST в отведениях III, aVF до 1 мм (рис. 8). По данным эхокардиографии, выполненной в динамике на 8-е сутки инфаркта миокарда (03.11.2020 г.): общая сократимость миокарда ЛЖ снизилась: фракция выброса составила 47%, сохранялся гипокинез нижней, нижнебоковой и нижне-перегородочной стенок. Выписана под наблюдение кардиолога по месту жительства на 11-е сутки инфаркта миокарда (06.11.2020 г.).
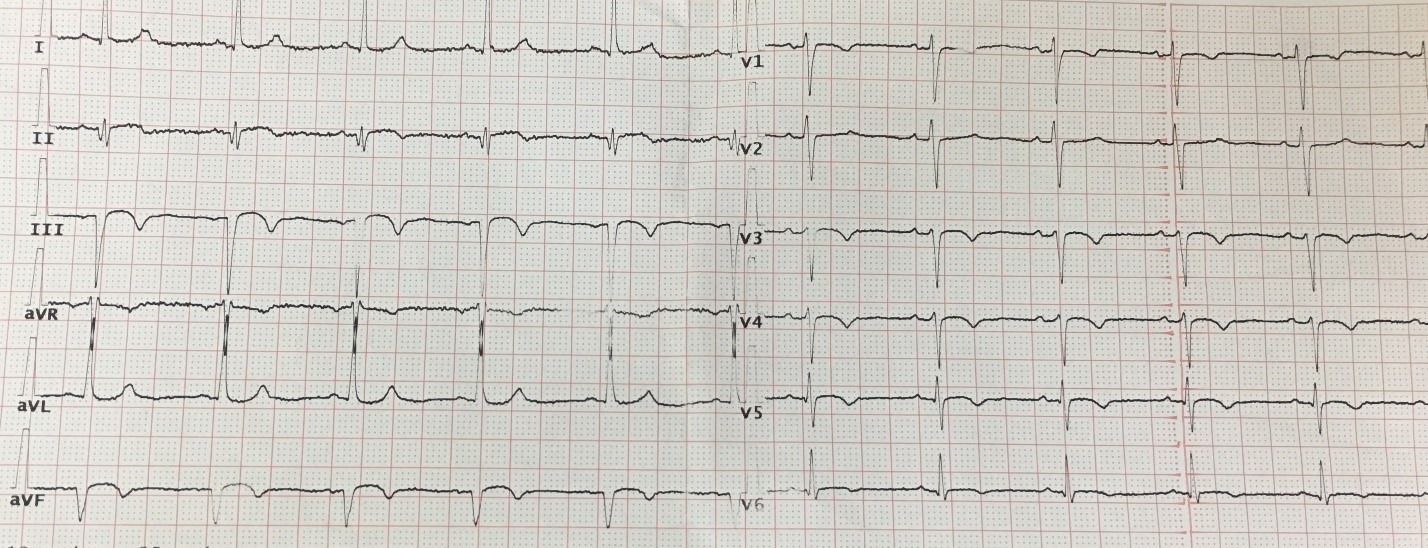
Рисунок 8. Электрокардиограмма (11-е сутки инфаркта миокарда).
Обсуждение
СДКА — одна из редких причин развития острого коронарного синдрома. С повышением осведомленности о СДКА и более широким использованием внутрисосудистой визуализации, диагностика СДКА стала более частой.
После постановки диагноза СДКА, консервативная тактика ведения на основе экспертных мнений предпочтительна [48]. Однако экстренное хирургическое вмешательство (АКШ, ЧКВ) может быть выполнено у пациентов, у которых наблюдается нестабильная гемодинамика, жизнеугрожающие аритмии, диссекция ствола левой коронарной артерии и/или двух магистральных артерий в проксимальных сегментах или у пациентов с продолжающейся ишемией миокарда. Тем не менее, это может быть сопряжено с высокими рисками из-за хрупкости сосудистой стенки [20]. Также необходимо обратить внимание на пациентов с СДКА, получающих только медикаментозную терапию, так как у них есть риск возникновения повторного инфаркта миокарда, развивающегося в результате распространения диссекции коронарной артерии, что может потребовать проведения экстренной реваскуляризации [17–19]. Таким образом, необходимо динамическое наблюдение пациентов с СДКА, которым проводится консервативное лечение.
В связи с тем, что отсутствуют рандомизированные контролируемые исследования, в настоящее время нет точных рекомендаций относительно оптимального лечения и тактики ведения пациентов с СДКА. Отсутствуют и точные данные как о распространённости, так и о патофизиологии данного заболевания. В большинстве случаев решение о выборе лечения пациента с данной патологией принимается индивидуально и эмпирически в каждом клиническом случае.
Заключение
В данном клиническом случае в результате возникновения спонтанной диссекции и тромбоза дистального отдела правой коронарной артерии мы наблюдали развитие острого инфаркта миокарда нижней стенки левого желудочка. Изначально ввиду высокой вероятности фрагментирования тромбов в ПКА при попытке аспирации и, как следствие, дистальной эмболии, принято решение о проведении консервативной тактики лечения и динамическом наблюдении. Но в связи с периодически возникающими болями за грудиной давящего характера, выполнена контрольная коронароангиография на 4-е сутки от даты развития инфаркта миокарда. Учитывая, что по результатам контрольной коронароангиографии произошёл практически полный лизис тромбов, но сохранялась линейная диссекция в дистальном отделе ПКА, а также жалобы пациентки на боли ангинозного характера, выполнено эндоваскулярное лечение.
Ввиду отсутствия общепринятых рекомендаций лечения СДКА необходим индивидуальный подход и более длительное динамическое наблюдение пациентов с данной патологией. Дальнейшие исследования, в том числе накопление опыта по принципу «случай-контроль», могут быть полезны для определения наилучшей тактики ведения, диагностики и лечения пациентов с СДКА, а также чтобы минимизировать частоту развития осложнений, которые возникают во время и после проведения инвазивных вмешательств.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Pasupathy S, Air T, Dreyer RP, Tavella R, Beltrame JF. Systematic review of patients presenting with suspected myocardial infarction and nonobstructive coronary arteries. Circulation. 2015;131(10):861-70. DOI: 10.1161/CIRCULATIONAHA.114.011201.
2. Кручинова С.В., Космачева Е.Д., Рафф С.А., Порханов В.А. Анализ данных пациентов с инфарктом миокарда без обструктивного поражения коронарных артерий при сравнении тотального регистра острого коронарного синдрома по Краснодарскому краю с зарубежными регистрами. Сибирский журнал клинической и экспериментальной медицины. 2018;33(4):38-43. DOI: 10.29001/2073-8552-2018-33-4-38-43.
3. Saw J, Mancini GBJ, Humphries K, Fung A, Boone R, Starovoytov A et al. Angiographic appearance of spontaneous coronary artery dissection with intramural hematoma proven on intracoronary imaging: Intracoronary Imaging in SCAD Cases. Catheterization and Cardiovascular Interventions. 2016;87(2):E54-61. DOI: 10.1002/ccd.26022.
4. Paulo M, Sandoval J, Lennie V, Dutary J, Medina M, Gonzalo N et al. Combined Use of OCT and IVUS in Spontaneous Coronary Artery Dissection. JACC: Cardiovascular Imaging. 2013;6(7):830-2. DOI: 10.1016/j.jcmg.2013.02.010.
5. Kwon T-G, Gulati R, Matsuzawa Y, Aoki T, Guddeti RR, Herrmann J et al. Proliferation of Coronary Adventitial Vasa Vasorum in Patients With Spontaneous Coronary Artery Dissection. JACC: Cardiovascular Imaging. 2016;9(7):891-2. DOI: 10.1016/j.jcmg.2015.11.030 .
6. Alfonso F, Paulo M, Gonzalo N, Dutary J, Jimenez-Quevedo P, Lennie V et al. Diagnosis of Spontaneous Coronary Artery Dissection by Optical Coherence Tomography. Journal of the American College of Cardiology. 2012;59(12):1073-9. DOI:10.1016/j.jacc.2011.08.082.
7. Vrints CJM. Spontaneous coronary artery dissection. Heart. 2010;96(10):801-8. DOI: 10.1136/hrt.2008.162073.
8. Rogowski S, Maeder MT, Weilenmann D, Haager PK, Ammann P, Rohner F, et al. Spontaneous Coronary Artery Dissection: Angiographic Follow-Up and Long-Term Clinical Outcome in a Predominantly Medically Treated Population. Catheter Cardiovasc Interv. 2017;89(1):59-68. DOI: 10.1002/ccd.26383.
9. Bulkley BH, Roberts WC. Dissecting aneurysm (hematoma) limited to coronary artery. A clinicopathologic study of six patients. The American Journal of Medicine. 1973;55(6):747-56. PMID: 4753640.
10. Robinowitz M, Virmani R, McAllister HA JrU null. Spontaneous coronary artery dissection and eosinophilic inflammation: a cause and effect relationship? The American Journal of Medicine. 1982;72(6):923-8. PMID: 7091163.
11. DeMaio SJ, Kinsella SH, Silverman ME. Clinical course and longterm prognosis of spontaneous coronary artery dissection. The American Journal of Cardiology. 1989;64(8):471-4. PMID: 277379058.
12. Pretty HC. Dissecting aneurysm of coronary artery in a woman aged 42: rupture. BMJ. 1931;1(3667):667. DOI: 10.1136/bmj.1.3667.667
13. Saw J. Spontaneous Coronary Artery Dissection. Canadian Journal of Cardiology. 2013;29(9):1027-33. DOI: 10.1016/j.cjca.2012.12.018.
14. Poon K, Bell B, Raffel OC, Walters DL, Jang I-K. Spontaneous Coronary Artery Dissection: Utility of Intravascular Ultrasound and Optical Coherence Tomography During Percutaneous Coronary Intervention. Circulation: Cardiovascular Interventions. 2011;4(2):e5-7. DOI: 10.1161/CIRCINTERVENTIONS.110.959593.
15. Saw J, Poulter R, Fung A, Wood D, Hamburger J, Buller CE. Spontaneous Coronary Artery Dissection in Patients With Fibromuscular Dysplasia: A Case Series. Circulation: Cardiovascular Interventions. 2012;5(1):134-7. DOI: 10.1161/CIRCINTERVENTIONS.111.966630.
16. Saw J, Ricci D, Starovoytov A, Fox R, Buller CE. Spontaneous Coronary Artery Dissection. JACC: Cardiovascular Interventions. 2013;6(1):44-52. DOI: 10.1016/j.jcin.2012.08.017.
17. Tweet MS, Hayes SN, Pitta SR, Simari RD, Lerman A, Lennon RJ et al. Clinical Features, Management, and Prognosis of Spontaneous Coronary Artery Dissection. Circulation. 2012;126(5):579-88. DOI: 10.1161/CIRCULATIONAHA.112.105718.
18. Alfonso F, Paulo M, Lennie V, Dutary J, Bernardo E, Jimenez-Quevedo P et al. Spontaneous Coronary Artery Dissection. JACC: Cardiovascular Interventions. 2012;5(10):1062-70. DOI:10.1016/j.jcin.2012.06.014.
19. Saw J, Aymong E, Sedlak T, Buller CE, Starovoytov A, Ricci D et al. Spontaneous Coronary Artery Dissection: Association With Predisposing Arteriopathies and Precipitating Stressors and Cardiovascular Outcomes. Circulation: Cardiovascular Interventions. 2014;7(5):645-55. DOI: 10.1161/CIRCINTERVENTIONS.114.001760.
20. Жукова Н.С., Шахнович Р.М., Меркулова И.Н., Сухинина Т.С., Певзнер Д.В., Староверов И.И. Спонтанная диссекция коронарных артерий. Кардиология. 2019;59(9):52-63. DOI: 10.18087/cardio.2019.9.10269
21. Thompson EA, Ferraris S, Gress T, Ferraris V. Gender differences and predictors of mortality in spontaneous coronary artery dissection: a review of reported cases. J Invasive Cardiol. 2005;17(1):59-61. PMID: 15640544.
22. Nishiguchi T, Tanaka A, Ozaki Y, Taruya A, Fukuda S, Taguchi H, et al. Prevalence of spontaneous coronary artery dissection in patients with acute coronary syndrome. Eur Heart J Acute Cardiovasc Care. 2016;5(3):263-70. DOI: 10.1177/2048872613504310.
23. Elkayam U, Jalnapurkar S, Barakkat MN, Khatri N, Kealey AJ, Mehra A, et al. Pregnancy-associated acute myocardial infarction: a review of contemporary experience in 150 cases between 2006 and 2011. Circulation. 2014;129(16):1695-702. DOI: 10.1161/CIRCULATIONAHA.113.002054.
24. Rashid HN, Wong DT, Wijesekera H, Gutman SJ, Shanmugam VB, Gulati R, et al. Incidence and characterisation of spontaneous coronary artery dissection as a cause of acute coronary syndrome--A single-centre Australian experience. Int J Cardiol. 2016;202:336-8. DOI: 10.1016/j.ijcard.2015.09.072.
25. Dhawan R, Singh G, Fesniak H. Spontaneous coronary artery dissection: the clinical spectrum. Angiology. 2002;53(1):89-93. DOI: 10.1177/000331970205300112.
26. Prasad M, Tweet MS, Hayes SN, Leng S, Liang JJ, Eleid MF, et al. Prevalence of extracoronary vascular abnormalities and fibromuscular dysplasia in patients with spontaneous coronary artery dissection. Am J Cardiol. 2015;115(12):1672-7. DOI: 10.1016/j.amjcard.2015.03.011.
27. Tweet MS, Eleid MF, Best PJ, Lennon RJ, Lerman A, Rihal CS, et al. Spontaneous coronary artery dissection: revascularization versus conservative therapy. Circ Cardiovasc Interv. 2014;7(6):777-86. DOI: 10.1161/CIRCINTERVENTIONS.114.001659.
28. Lettieri C, Zavalloni D, Rossini R, Morici N, Ettori F, Leonzi O et al. Management and Long-Term Prognosis of Spontaneous Coronary Artery Dissection. The American Journal of Cardiology. 2015;116(1):66-73. DOI: 10.1016/j.amjcard.2015.03.039
29. Kanaroglou S, Nair V, Fernandes JR. Sudden cardiac death due to coronary artery dissection as a complication of cardiac sarcoidosis. Cardiovascular Pathology. 2015;24(4):244-6. DOI:10.1016/j.carpath.2015.01.001
30. Srinivas M, Basumani P, Muthusamy R, Wheeldon N. Active inflammatory bowel disease and coronary artery dissection. Postgraduate Medical Journal. 2005;81(951):68-70. DOI: 10.1136/pgmj.2004.018952.
31. Chu KH, Menapace FJ, Blankenship JC, Hausch R, Harrington T. Polyarteritis nodosa presenting as acute myocardial infarction with coronary dissection. Catheterization and Cardiovascular Diagnosis. 1998;44(3):320-4. PMID: 9676806.
32. Reddy S, Vaid T, Ganiga Sanjeeva NC, Shetty RK. Spontaneous coronary artery dissection as the first presentation of systemic lupus erythematosus. BMJ Case Reports. 2016;2016(2016):bcr2016216344. DOI: 10.1136/bcr-2016-216344.
33. Bayar N, Çağırcı G, Üreyen ÇM, Kuş G, Küçükseymen S, Arslan Ş. The Relationship between Spontaneous Multi-Vessel Coronary Artery Dissection and Celiac Disease. Korean Circulation Journal. 2015;45(3):242–4. DOI: 10.4070/kcj.2015.45.3.242.
34. Nisar M, Mya T. Spontaneous coronary artery dissection in the context of positive anticardiolipin antibodies and clinically undiagnosed systemic lupus erythematosus. Lupus. 2011;20(13):1436-8. DOI: 10.1177/o961203311406765.
35. Протасова Е.А., Фурман Н.В., Титков И.В., Олейник А.О., Гусев К.В. Спонтанная диссекция коронарной артерии как причина развития острого инфаркта миокарда. Кардиоваскулярная терапия и профилактика. 2014;13(5):70-73. DOI: 10.15829/1728-8800-2014-5-70-73.
36. Smyth A, O'Donnell M, Lamelas P, Teo K, Rangarajan S, Yusuf S. Physical Activity and Anger or Emotional Upset as Triggers of Acute Myocardial Infarction: The INTERHEART Study. Circulation. 2016;134(15):1059-67. DOI: 10.1161/CIRCULATIONAHA.116.023142.
37. Jaffe BD, Broderick TM, Leier CV. Cocaine-Induced Coronary- Artery Dissection. New England Journal of Medicine. 1994;330(7):510-1. DOI: 10.1056/NEJM199402173300719.
38. Velusamy M, Fisherkeller M, Keenan ME, Kiernan FJ, Fram DB. Spontaneous coronary artery dissection in a young woman precipitated by retching. The Journal of Invasive Cardiology. 2002;14(4):198-201. PMID: 11923575.
39. Karabinos I, Papadopoulos A, Koulouris S, Kranidis A, Korovesis S, Katritsis D. Spontaneous coronary artery dissection during a dobutamine stress echocardiography. Echocardiography (Mount Kisco, N.Y.). 2006;23(3):232-4. DOI: 10.1111/j.1540-8175.2006.00141.x.
40. Sivam S, Yozghatlian V, Dentice R, McGrady M, Moriarty C, Di Michiel J et al. Spontaneous coronary artery dissection associated with coughing. Journal of Cystic Fibrosis. 2014;13(2):235-7. DOI: 10.1016/j.jcf.2013.10.003.
41. Ellis CJ, Haywood GA, Monro JL. Spontaneous coronary artery dissection in a young woman resulting from an intense gymnasium «work-out». International Journal of Cardiology. 1994;47(2):193-4. PMID: 7721492.
42. Aghasadeghi K, Aslani A. Spontaneous coronary artery dissection in a professional body builder. International Journal of Cardiology. 2008;130(3):e119-20. DOI: 10.1016/j.ijcard.2007.06.151.
43. Steinhauer JR, Caulfield JB. Spontaneous coronary artery dissection associated with cocaine use: a case report and brief review. Cardiovasc Pathol. 2001;10(3):141-5. DOI: 10.1016/s1054-8807(01)00074-6.
44. Masuda T, Akiyama H, Kurosawa T, Ohwada T. Long-term followup of coronary artery dissection due to blunt chest trauma with spontaneous healing in a young woman. Intensive Care Med. 1996;22(5):450-2. DOI: 10.1007/BF01712164.
45. Borczuk AC, van Hoeven KH, Factor SM. Review and hypothesis: the eosinophil and peripartum heart disease (myocarditis and coronary artery dissection)--coincidence or pathogenetic significance? Cardiovasc Res. 1997;33(3):527-32. DOI: 10.1016/s0008-6363(96)00257-x.
46. Bonacchi M, Prifti E, Giunti G, Frati G, Leacche M, Brancaccio G, Sani G. Emergency management of spontaneous coronary artery dissection. J Cardiovasc Surg (Torino). 2002;43(2):189-93. PMID: 11887053.
47. Martin Davila F., Delgado Portela M., Garcia Rojo M. et al. Coronary artery dissection in alpha-1-antitrypsin deficiency. Histopathology. 1999;34:376—8.
48. Tweet MS, Gulati R, Hayes SN. What Clinicians Should Know About Spontaneous Coronary Artery Dissection. Mayo Clin Proc. 2015;90(8):1125-30. DOI: 10.1016/j.mayocp.2015.05.010.
Об авторах
В. Е. ХолодоваРоссия
Холодова Валерия Евгеньевна - врач-ординатор.
Краснодар.
А. М. Намитоков
Россия
Намитоков Алим Муратович – кандидат медицинских наук, заведующий кардиологическим отделением №2 НИИ - ККБ № 1 им. проф. С.В. Очаповского Минздрава Краснодарского края; ассистент кафедры терапии #1 КубГМУ.
Краснодар.
Е. К. Донец
Россия
Донец Екатерина Константиновна - врач-кардиолог.
Краснодар.
С. В. Кручинова
Россия
Кручинова София Владимировна - врач-кардиолог НИИ - ККБ № 1 им. проф. С.В. Очаповского Минздрава Краснодарского края; ассистент кафедры терапии #1 ФПК и ППС КубГМУ.
Краснодар.
Е. Д. Космачева
Россия
Космачева Елена Дмитриевна – доктор медицинских наук, профессор, заместитель главного врача по медицинской части НИИ - ККБ № 1 им. проф. С.В. Очаповского Минздрава Краснодарского края; заведующий кафедрой терапии №1 ФПК и ППС КубГМУ.
Краснодар.
Рецензия
Для цитирования:
Холодова В.Е., Намитоков А.М., Донец Е.К., Кручинова С.В., Космачева Е.Д. Случай инфаркта миокарда в следствии спонтанной диссекции коронарной артерии. Южно-Российский журнал терапевтической практики. 2022;3(1):95-105. https://doi.org/10.21886/2712-8156-2022-3-1-95-105
For citation:
Kholodova V.E., Namitokov A.M., Donets E.K., Kruchinova S.V., Kosmacheva E.D. A case of myocardial infarction due to spontaneous dissection of the coronary artery. South Russian Journal of Therapeutic Practice. 2022;3(1):95-105. (In Russ.) https://doi.org/10.21886/2712-8156-2022-3-1-95-105


























