Перейти к:
Дополнительные эффекты диосмина в лечении артериальной гипертензии у пациентов с нарушением венозного кровотока почек
https://doi.org/10.21886/2712-8156-2022-3-2-63-70
Аннотация
Цель: изучение влияния диосмина в комплексной антигипертензивной терапии на функцию почек у пациентов с АГ и нарушением венозного кровотока почек.
Материалы и методы: наблюдали 147 пациентов с АГ в возрасте 40,86±8,27 лет с признаками двухстороннего нарушения венозного кровотока в почках, которые в зависимости от объема терапии разделены на 2 группы и 2 подгруппы. Группу сравнения составили 57 больных АГ с неизмененным венозным кровотоком в обеих почках.
Результаты: установлено, что при наличии нарушения венозного кровотока в почечных венах использование дополнительного назначения диосмина позволяет сохранить или улучшить фильтрационную способность почек. Требуется проведение дополнительных наблюдений за пациентами с нарушением венозного кровотока в почках для оценки эффективности антигипертензивной терапии отдельными препаратами с применением и без веноактивных средств.
Заключение: дополнительное включение диосмина в комплексную антигипертензивную терапию пациентов с артериальной гипертензией и нарушением венозного кровотока почек позволяет сохранить и улучшить функцию почек с нормализацией СКФ.
Для цитирования:
Ждамарова О.И., Елисеева Л.Н., Урбан П.И. Дополнительные эффекты диосмина в лечении артериальной гипертензии у пациентов с нарушением венозного кровотока почек. Южно-Российский журнал терапевтической практики. 2022;3(2):63-70. https://doi.org/10.21886/2712-8156-2022-3-2-63-70
For citation:
Zhdamarova O.I., Eliseeva L.N., Urban P.I. Additional effects of diosmin in the treatment of arterial hypertension in patients with impaired renal venous blood flow. South Russian Journal of Therapeutic Practice. 2022;3(2):63-70. (In Russ.) https://doi.org/10.21886/2712-8156-2022-3-2-63-70
Введение
В структуре сердечно-сосудистых заболеваний артериальной гипертензии [АГ] отводится особое место не только как самостоятельному заболеванию со своими тяжёлыми, а часто и фатальными осложнениями, но и как фактору риска развития и прогрессирования других кардиоваскулярных заболеваний [1][2].
Высокая распространённость АГ (до 40–45% населения планеты) определяет неизбежность вариабельности патогенетических форм АГ в соответствии с коморбидными состояниями и преобладанием тех или иных механизмов развития АГ [3]. Указанные факты определяют возможность преимущественной эффективности определённых групп антигипертензивных препаратов.
Накопленные к настоящему времени исследования АГ основаны на изучении преимущественно значений артериального звена кровообращения в реализации патогенетических механизмов формирования и прогрессирования этой патологии. При этом анализ эффектов медикаментозной терапии АГ также демонстрирует преобладание исследований и акцентуации влияния лекарственных препаратов именно на артериальное звено системы кровообращения [1]. Вместе с тем, венозная система не может не участвовать в реализации развития АГ и действии антигипертензивных препаратов. Ещё в 1964 г. Derrick J. R. et. al. в экспериментальном исследовании на собаках показали, что уменьшение просвета почечных вен на 60–80% приводит через 4 месяца к стойкому повышенное артериального давления (АД) на 36%. Морфологическим результатом сужения почечной вены стали развитие фиброза, тубулярная дегенерация, ишемия гломерул и утолщение стенок артериол, характерные для развития хронической АГ [4]. Дополнительные объяснения влияния нарушения венозного оттока из почек представлены в экспериментальной работе Doty J. M., Saggi B. H., Sugerman H. J. et al. (1999) [5], в которой установлено, что повышение давления в почечной вене на 30 мм рт. ст. в течение двух часов вызывает снижение кровотока в почечной артерии и падение клубочковой фильтрации (с 26 до 8 мл/мин.) по сравнению с контролем, что запускает выброс в кровоток альдостерона, активацию ренина и увеличение экскреции альбумина с мочой. Интересно, что восстановление венозного оттока частично или полностью нивелировало указанные сдвиги. Имеются также клинические исследования о влиянии иАПФ на венозное звено [6]. В предшествующих наших исследованиях [7][8] также установлено наличие значимой ассоциации нарушений венозного оттока из почек с выраженностью резистивных нарушений в артериальном звене почечного кровообращения.
Однако работ, характеризующих возможность коррекции нарушений венозного оттока с помощью веноактивных препаратов в условиях АГ недостаточно, что и явилось основой нашего исследования.
Цель исследования — изучить влияние диосмина (изолированно или в комплексной антигипертензивной терапии) на функцию почек у пациентов с артериальной гипертензией и нарушением венозного кровотока почек.
Материалы и методы
Дизайн исследования включал три этапа.
1 этап — стандартное обследование подписавших информированное согласие пациентов с АГ с дополнительным исследованием особенностей артериального и венозного кровотока почек с использованием авторской методики1.
Всем пациентам проведено исследование уровня креатинина крови с расчётом скорости клубочковой фильтрации по формуле CKD-EPI. Ультразвуковое исследование почек, допплерогафическое исследование ренального артериального и венозного кровотока осуществлялось многочастотным датчиком конвексного формата на ультразвуковом сканере ACCUVIX A30 в положении больного на боку. Для количественной характеристики артериального ренального кровотока оценивались максимальная Vmax (систолическая) и минимальная Vmin (конечная диастолическая) скорости в магистральной почечной артерии (ПА); расчёт индексов резистентности (RI) осуществляли с использованием программного обеспечения аппарата по общепринятой формуле. Кровоток в магистральных почечных венах (МПВ) регистрировали вблизи ворот почки при задержке дыхания на спокойном неглубоком выдохе. Разницу (dVven) между максимальной (Vven max) и минимальной (Vven min) скоростью венозного кровотока в МПВ, превышающую 20 см/сек., расценивали как нарушение почечного венозного кровотока.
Традиционные морфометрические показатели сердца определяли с помощью Эхо-КГ (ACCUVIX A30): оценивали конечный диастолический размер левого желудочка (КДР ЛЖ мм), относительную толщину стенок ЛЖ (ОТС), массу миокарда (ММЛЖ гр), индекс массы миокарда левого желудочка (иММЛЖ гр/м2). Метаболические параметры включали индекс массы тела (ИМТ) по Кетле, определение общего холестерина (ОХ ммоль/л) и триглицеридов (ТГ ммоль/л).
Традиционно исследовали ЭКГ в 12 отведениях, 75% больных выполнено СМАД.
2 этап — скрининг обследованных пациентов и отбор респондентов для клинического наблюдения:
Критерии включения: мужчины и женщины в возрасте 28–68 лет, страдающие АГ 1–2 стадии и 1–2 степенью повышения АД с двухсторонним нарушением почечного венозного кровотока по результатам допплерографического исследования магистральных сосудов почек, подписавших информированное согласие на динамическое наблюдение. В исследование не включались больные с симптоматической АГ, нарушениями ритма сердца, пороками сердца, урологической патологией, хроническими заболеваниями в стадии обострения, онкологическими заболеваниями
В исследование включено 147 больных АГ с двухсторонним нарушением почечного венозного кровотока из них 67 мужчин и 80vженщин в возрасте 40,86±8,27 (от 28 до 68 лет). Среди всех обследованных 69 человек получали постоянную антигипертензивную терапию, они составили первую группу наблюдения. 78 человек с АГ 1 стадии и непостоянным повышением АД до 1 ст., не получающие АГТ, вошли во вторую группу. В каждой группе выделили подгруппу «А» — пациенты без установленной патологии венозного русла; 1-А подгруппа объединила 34 человека (получающих АГТ) и 2-А подгруппа включила 41 человека. В подгруппы Б вошли пациенты, имеющие сопутствующую патологию вен (варикозная болезнь нижних конечностей, варикоцеле, геморрой). 1Б подгруппа (получающие АГТ) объединила 35 человек, 2Б подгруппа — 37 человек (без АГТ). Диагноз внепочечной патологии вен фиксировался по результатам предшествующего обследования флебологом, урологом, хирургом (учитывались только пациенты с патологией вен без обострения и трофических нарушений).
Больным 1Б и 2Б подгрупп был назначен 2-хмесячный курс диосмина (600 мг в сутки). При этом больные 1А и 2А группы продолжили традиционную АГТ, которая проводилась до включения в исследование не менее 3-х месяцев и не менялась в процессе наблюдения. Всем пациентам также были даны рекомендации по коррекции существующих или потенциальных факторов риска развития АГ.
В группу сравнения включено 57 пациентов (26 женщин, 31 мужчина) в возрасте 43,35±6,39лет с АГ 1–2 стадии 1–2 степенью повышения АД, у которых при допплерографии ренальных сосудов в магистральных венах обеих почек регистрировался нормальный кровоток.
3 этап — оценка особенностей клинических проявлений АГ и динамики фильтрационной функции почек через 16,0±2,5 недели наблюдения (включая и период курсового лечения диосмином у пациентов 1Б и 2Б групп) повторно исследовался уровень креатинина крови с расчетом СКФ. Оценивалась динамика скорости клубочковой фильтрации за период наблюдения с пересчетом на 1 месяц.
Статистическую обработку полученных данных выполняли с использованием пакета лицензионных статистических программ STATISTICA 6.0 (Statsoft Inc., USA). Данные обрабатывали методами вариационной статистики. Все данные представлены в виде M±SD, статистическая значимость различий устанавливалась при p<0,05.
Результаты
Характеристика основных клинико-лабораторных и инструментальных параметров у обследованных пациентов приведена в табл. 1.
Таблица 1
Клиническая характеристика и показатели Эхо-КГ у пациентов групп наблюдения и контроля
|
Группа сравнения АГТ |
1 группа АГТ |
2 группа без АГТ |
|
|
Возраст (лет) |
43,35±6,39 |
43,46±8,3 |
38,55 ±7,56§@ |
|
ИМТ (кг/м2) |
29,9±4,2 |
28,54±5,24 |
26,1±4,24§@ |
|
Креатинин (мкмоль/л) |
88,8±11,19 |
84,48 ±13,47* |
81,42 ±13,09@ |
|
СКФ (CKD-EPI) мл/мин/1,73м2 |
84,13±10,26 |
85,2±13,88 |
91,48 ±13,35§@ |
|
КДР ЛЖ мм |
47,5±3,24 |
47,8±3,55 |
47,02 ±2,8 |
|
ММЛЖ гр |
211,02±51,29 |
204,74±56,7 |
174,35±37,35§@ |
|
иММЛЖ гр/м2 |
103,72±20,5 |
104,43 ±22,33 |
91,85 ±14,07§@ |
|
ОТС |
0,43±0,05 |
0,418 ±0,05 |
0,38 ±0,03§@ |
Примечание: Данные представлены в виде среднего значения (М)±стандартное отклонение (SD). Статистическая значимость различий: (p<0,05): * — между первой группой и группой контроля,§ — между второй группой и группой контроля,@ — между первой и второй группами. АГТ — антигипертензивная терапия. ИМТ (кг/м2) — индекс массы тела по Кетле. СКФ (CKD-EPI) — скорость клубочковой фильтрации, рассчитанная по формуле CKD-EPI; КДР ЛЖ — конечный диастолический размер левого желудочка; ММЛЖ — масса миокарда левого желудочка; иММЛЖ — индекс массы миокарда левого желудочка; ОТС — относительная толщина стенок левого желудочка. МПВ — кровоток в магистральных почечных венах.
Пациенты первой группы были сопоставимы по возрасту и ИМТ с группой контроля, а пациенты второй группы, имеющие начальные проявления АГ, были ожидаемо моложе и имели более низкие показатели ИМТ как по отношению к группе сравнения, так и по отношению к первой группе наблюдения. У пациентов второй группы выявлены достоверно меньшие размеры КДР, ММЛЖ и иММЛЖ, а также выше скорость клубочковой фильтрации по отношению к группе сравнения и первой группе. В группе сравнения ожирением страдали 32 человека (56,1%), в первой группе — 26 чел. (37%), во второй группе — 13 чел. (16,6%).
Изменения показателей артериального ренального кровотока в целом у наблюдаемых больных были типичны для пациентов с АГ и соответствовали нашим предшествующим исследованиям [8].
Таблица 2
Показатели ренального кровотока у пациентов первой, второй групп и группы контроля
|
Показатели |
Группа сравнения АГТ |
1 группа АГТ |
2 группа без АГТ |
|||
|
Правая почка |
Левая почка |
Правая почка |
Левая почка |
Правая почка |
Левая почка |
|
|
Vmax (см/сек.) |
74,56±12,46 |
74,67±12,95 |
72,28±11,04 |
72,75±12,37 |
75,87±11,88@ |
73,87±10,13 |
|
Vmin (см/сек.) |
26,07±4,99 |
25,38±3,89 |
23,83±3,86* |
23,66±3,89* |
25,9±4,36@ |
24,85±3,76@ |
|
RI |
0,645±0,03 |
0,653±0,03 |
0,67±0,02* |
0,674±0,02* |
0,659±0,02§@ |
0,664±0,01§@ |
|
Vven max (см/сек.) |
28,46±7,26 |
28,36±5,94 |
31,04±7,23* |
30,55±6,77* |
30,04±6,01 |
30,22±7,12§ |
|
Vven min (см/сек.) |
15±8,39 |
12,54±6,398 |
4,5± 4,8* |
3,2±4,68* |
3,95±4§ |
3,05±4,73§ |
|
dVven (см/сек.) |
13,46±4,46 |
15,88±3,8 |
26,54±5,45* |
27,35±5,4* |
26,09±4,59§ |
27,17±6,26§ |
Примечание: данные представлены в виде среднего значения (М), стандартного отклонения (SD). Статистическая значимость различий — (p<0,05): * — между первой группой и группой контроля,§ — между второй группой и группой контроля,@ — между первой и второй группами. АГТ — антигипертензивная терапия, Vmax (см/сек.) — максимальная скорость кровотока в МПА; Vmin (см/сек.) — минимальная скорость кровотока в МПА; RI — индексы резистентности в артериях почек; Vven max (см/сек.) — максимальная скорость кровотока в МПВ; Vven min (см/сек.) — минимальная скорость кровотока в МПВ; dVven (см/сек.) — разница Vven max и Vven min.
Индексы резистентности в артериях почек в первой и второй группах были достоверно выше, чем в группе сравнения. Также в группах наблюдения имелись отличия в показателях венозного кровотока почек: более низкие показатели минимальной скорости и выше разность между максимальной и минимальной скоростью в магистральных венах почек, что характерно для нарушения почечного венозного кровотока.
Таблица 3
Исходные показатели Эхо-КГ, уровня креатинина крови и скорости клубочковой фильтрации в группах
|
Группа сравнения |
1А группа АГТ |
1Б группа АГТ + диосмин |
2А группа |
2Б группа |
|
|
Возраст (лет) |
43,35±6,39 |
43,31±7,97 |
43,62±8,76 |
37,5±6,39§ |
39,49±8,44@ |
|
ИМТ (кг/м2) |
29,9±4,2 |
28,0±4,84* |
29,1±5,63 |
25,41±4,2§ |
26,7±4,23@ |
|
Креатинин мкмоль/л |
88,8±11,19 |
83,27 ±12,92* |
85,68±14,08 |
81,27±11,6§ |
81,6±14,46@ |
|
СКФ (CKD-EPI) |
84,13±10,26 |
86,18±13,5 |
84,24±14,39 |
92,47±13,8§ |
90,56±13,02@ |
|
КДР ЛЖ |
47,5±3,24 |
47,66±3,7 |
47,6±3,44 |
47,06±3,06 |
46,99±2,56 |
|
ММЛЖ |
211,02 ±51,29 |
203,74±53,16 |
205,79±61 |
174,3±38,5§ |
174,37±36,7@ |
|
иММЛЖ |
103,72±20,5 |
104,34 ±19,73 |
104,52±25,1 |
92,4±15,27§ |
91,28±12,96@ |
|
ОТС |
0,43±0,05 |
0,42 ±0,04 |
0,415±0,05 |
0,39±0,04§ |
0,39±0,03@ |
Примечание: данные представлены в виде (М±SD) среднего значения и стандартного отклонения. Статистическая значимость различий: (p<0,05): * — между 1А группой и группой контроля,§ — между 2А группой и группой контроля,@ — между 2Б группой и группой контроля.
Исходные показатели СКФ в подгруппах 1А и 1Б были сопоставимы с группой сравнения, а в подгруппах 2А и 2Б СКФ была достоверно выше по отношению к группе сравнения. Через 16,0±2,5 недели наблюдения СКФ в группах изменилась разнонаправленно, для нивелирования возможного влияния сроков исследования СКФ проанализировали с пересчетом на 1 месяц наблюдения.
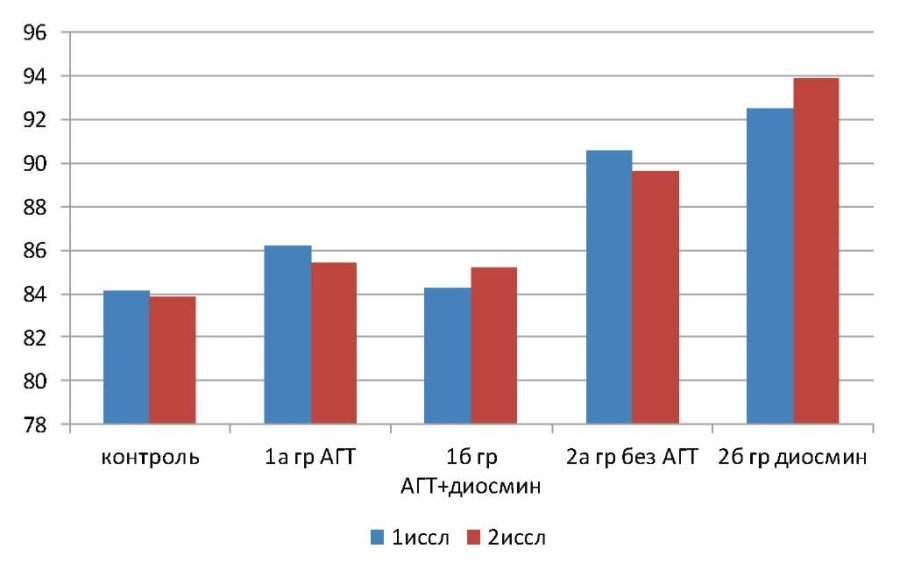
Рисунок 1. Среднемесячная динамика скорости клубочковой фильтрации в группах наблюдения и группе контроля.
В целом, по группе сравнения у больных АГ с нормальным венозным кровотоком почек на фоне традиционной АГТ СКФ снизилась на 0,3% в месяц, причем у 66,7% пациентов отмечена тенденция к ухудшению фильтрационной способности почек, а у 33,3% — тенденция к её улучшению.
В 1А подгруппе у больных АГ с двухсторонним нарушением почечного венозного кровотока на фоне традиционной АГТ скорость клубочковой фильтрации имела тенденцию к снижению — на 0,88% в месяц, из них у 82,9% больных СКФ снизилась, а у 17,1% — минимально повысилась.
В подгруппе 2А, у больных без АГТ среднемесячное снижение СКФ оказалось наибольшим и составило 1%, у одного больного СКФ не изменилась, а у остальных (97,3%) отмечена тенденция к снижению СКФ.
В целом, в подгруппе 1А у пациентов, получивших курс диосмина на фоне АГТ, СКФ улучшилась на 1,14% в месяц. У 14,7% человек СКФ минимально снизилась, у 8,8% — осталась без изменений, а у 47% отмечена тенденция к улучшению фильтрационной функции почек.
В подгруппе 2Б у пациентов, получивших курс диосмина, СКФ в среднем выросла на 1,6% в месяц, причем у 1 человека СКФ не изменилась, а у остальных (97,6%) отмечена тенденция к росту СКФ.
Обсуждение
«Артериальная гипертензия ассоциируется с повышенным риском смерти от сердечно-сосудистых осложнений и прогрессирующим нарушением функции почек» — заключение, которое в настоящее время рассматривается как постулат, не требующий дополнительных доказательств [9].
По данным китайских ученых, наблюдавшим в течение 9 лет более 500 тысяч пациентов в возрасте от 30 до 79 лет, повышение АД на каждые 10 мм рт. ст. было связано с 30%-ным ростом риска ишемической болезни сердца и ишемического инсульта. Риск геморрагического инсульта при артериальной гипертензии был в 2 раза выше в возрасте 40–49 лет, чем у больных 70–79 лет, повышенное систолическое АД положительно коррелировало с хронической болезнью почек и сахарным диабетом [10]. Почки предлагается рассматривать как ведущий орган-мишень, ограничивающий продолжительность жизни. Исследования показали, что в течение ближайших пяти лет у пациентов АГ при наличии лёгкой почечной дисфункции (при СКФ 45–59 мл/мин./1,73м2) риск сердечно-сосудистых событий возрастает на 65% [11]. Поэтому замедление скорости прогрессирования нарушений функции почек — перспективная задача здравоохранения. Нарушение функции почек при многих острых и хронических (в том числе и сердечно-сосудистых) заболеваниях традиционно связывают с преренальными причинами, такими как снижение сердечного выброса, поражение артериального русла, приводящими к гипоперфузии почки и снижению скорости клубочковой фильтрации. Однако в последние годы накапливается все больше данных о возможной связи дисфункции почек с повышением давления в венозной системе, например, при сердечной недостаточности и гиперволемии, а передача повышенного давления в почечную венозную систему становится ключевым механизмом в возникновении и прогрессировании повреждения почек [12][13][14]. По данным ряда авторов, при повышении центрального венозного давления более 6 мм рт. ст. резко снижается СКФ [15]. Почечная венозная гипертензия и связанная с этим артериальная гипертензия могут быть обусловлены не только уровнем давления в нижней полой вене, но и компрессией самих почечных вен [16][17][18][19].
В нашем предшествующем исследовании мы разработали способ оценки нарушений кровотока по магистральным венам почек (9) и обнаружили, что у больных АГ двухсторонние нарушения почечного венозного кровотока регистрируются в 7,5–8 раз чаще, чем у лиц с нормальным уровнем артериального давления [8].
Представляет интерес вопрос о возможности коррекции венозного кровотока почек под влиянием веноактивных препаратов и обратимости нарушений функции органа.
АГ нередко сочетается с патологией периферического венозного русла (в виде ХВН, варикозной болезни, геморроя, варикоцеле, расширения вен малого таза), что сопровождается с ростом риска смерти от ССЗ и других причин [20][21]. Для этих больных имеются показания к назначению препаратов, влияющих на состояние венозной стенки, причем наиболее изученным и эффективным из данной группы препаратов является диосмин [22][23][24][25][26]. На фоне терапии диосмином достоверно уменьшается выраженность симптомов ХВН нижних конечностей и улучшается качество жизни у больных ССЗ [27]. В отдельных экспериментальных работах отмечено нефропротективное действие диосмина [28].
Выполненное нами наблюдательное исследование у пациентов с АГ показало, что отсутствие антигипертензивной терапии при нестойком повышении АД определяет вероятность прогрессивного снижения функции почек даже в кратковременных наблюдениях. Приверженность к традиционной антигипертензивной терапии может корригировать формирование почечной дисфункции включая пациентов с нарушением венозного кровотока в почках. Однако при наличии доступного для широкой клинической практики выявления нарушения венозного кровотока в почечных венах использование дополнительного назначения диосмина позволяет сохранить или улучшить фильтрационную способность почек. Понимая небольшой объём и краткость наблюдения за пациентами в нашем исследовании, мы хотели бы привлечь внимание медицинской общественности о возможном дополнительном эффекте веноактивного препарата диосмина у пациентов с АГ и нарушением венозного кровотока в почках.
Выводы
Предварительные результаты исследования динамики скорости клубочковой фильтрации показали, что у больных артериальной гипертензией даже на начальных этапах заболевания в отсутствие антигипертензивной терапии имеется отчётливая тенденция к ухудшению фильтрационной функции почек.
Проводимая антигипертензивная терапия позволяет замедлить эти процессы.
Особенно отчетливо нефропротективное действие антигипертензивной терапии проявляется в случаях исходно нормального почечного венозного кровотока.
При наличии двухстороннего нарушения оттока по магистральным венам почек обнадеживающие результаты показало курсовое лечение препаратами, содержащими диосмин, который и при сочетании с проводимой антигипертензивной терапией, и в её отсутствие на ранних этапах заболевания позволяет улучшить почечную фильтрацию.
Двустороннее нарушение венозного кровотока в почках, по-видимому, может быть дополнительным самостоятельным показанием для применения препаратов, содержащих диосмин.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
1. Елисеева Л.Н.(RU), Ждамарова О.И. (RU), Тонян А.Г. (RU). Патент на изобретение № 2373856 «Способ оценки венозного кровотока по магистральным почечным венам». RU БИПМ. – 2009;33(IIч):420.
Список литературы
1. Кобалава Ж.Д., Конради А.О., Недогода С.В., Шляхто Е.В., Арутюнов Г.П., Баранова Е.И., и др. Артериальная гипертензия у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(3):3786. DOI: 10.15829/1560-4071-2020-3-3786
2. Dorobantu M, Tautu OF, Dimulescu D, Sinescu C, Gusbeth-Tatomir P, Arsenescu-Georgescu C et al. Perspectives on hypertension's prevalence, treatment and control in a high cardiovascular risk East European country: data from the SEPHAR III survey. J Hypertens. 2018;36(3):690-700. DOI: 10.1097/HJH.0000000000001572.
3. Оганов Р.Г., Симаненков В.И., Бакулин И.Г., Бакулина Н.В., Барбараш О.Л., Бойцов С.А., и др. Коморбидная патология в клинической практике. Алгоритмы диагностики и лечения. Кардиоваскулярная терапия и профилактика. 2019;18(1):5-66. DOI: 10.15829/1728-8800-2019-1-5-66
4. Derrick JR, Van Rae, Blocker TG. Constriction of the renal vein--a new concept in renal hypertension. Ann Surg. 1964;160(4):589-95. DOI: 10.1097/00000658-196410000-00004.
5. Doty JM, Saggi BH, Sugerman HJ, Blocher CR, Pin R, Fakhry I, et al. Effect of increased renal venous pressure on renal function. J Trauma. 1999;47(6):1000-3. DOI: 10.1097/00005373-199912000-00002.
6. Михеева О.М., Комиссаренко И.А., Левченко С.В. Влияние ингибиторов ангиотензинпревращающего фермента на функцию почек у больных артериальной гипертензией старших возрастных групп. Consilium Medicum. 2013;15(10):24-29. eLIBRARY ID: 21014263
7. Елисеева Л.Н., Ждамарова О.И., Хуако М.Ш.. Сравнительная характеристика допплерографических показателей кровотока в магистральных почечных артериях и венах при антигипертензивной терапии ингибиторами АПФ и бета-блокаторами. Кубанский научный медицинский вестник. 2010; 120 (6);48-51. eLIBRARY ID: 15484661
8. Елисеева Л.Н., Ждамарова О.И. Допплерографические показатели артериального и венозного кровотока в почках при гипертонической болезни. Российские Медицинские Вести. 2013;XVIII(3):63-69. eLIBRARY ID: 20220588
9. Tapia-Conyer R, Alegre-Díaz J, Gnatiuc L, Wade R, Ramirez-Reyes R, Herrington WG et al. Association of Blood Pressure With Cause-Specific Mortality in Mexican Adults. JAMA Netw Open. 2020;3(9):e2018141. DOI: 10.1001/jamanetworkopen.2020.18141.
10. Lacey B, Lewington S, Clarke R, Kong XL, Chen Y, Guo Y, et al. China Kadoorie Biobank collaborative group. Age-specific association between blood pressure and vascular and non-vascular chronic diseases in 0·5 million adults in China: a prospective cohort study. Lancet Glob Health. 2018;6(6):e641-e649. DOI: 10.1016/S2214-109X(18)30217-1.
11. Gu X, Fang X, Ji X, Tang Z, Wang C, Guan S et al. Kidney dysfunction is associated with risk of cardiovascular events in middle-aged and elderly population with hypertension: A 5-year community-based cohort study in China. ClinNephrol. 2020;93(3):130-139. DOI: 10.5414/CN109712.
12. Di Nicolò P. The dark side of the kidney in cardio-renal syndrome: renal venous hypertension and congestive kidney failure. Heart Fail Rev. 2018;23(2):291-302. DOI: 10.1007/s10741-018-9673-4.
13. Deferrari G, Cipriani A, La Porta E. Renal dysfunction in cardiovascular diseases and its consequences. J Nephrol. 2021;34(1):137-153. DOI: 10.1007/s40620-020-00842-w.
14. Husain-Syed F, Gröne HJ, Assmus B, Bauer P, Gall H, Seeger W et al. Congestive nephropathy: a neglected entity? Proposal for diagnostic criteria and future perspectives. ESC Heart Fail. 2021;8(1):183-203. DOI: 10.1002/ehf2.13118.
15. Husain-Syed F, Birk HW, Tello K, Richter MJ, Ronco C, McCullough PA et al. Alterations in Doppler-derived renal venous stasis index during recompensation of right heart failure and fluid overload in a patient with pulmonary hypertension. RevCardiovascMed. 2019;20(4):263-266. DOI: 10.31083/j.rcm.2019.04.564.
16. Wang RF, Zhou CZ, Fu YQ, Lv WF. Nutcracker syndrome accompanied by hypertension: a case report and literature review. J Int Med Res. 2021;49(1):300060520985733. DOI: 10.1177/0300060520985733.
17. Azhar AB, Zeb NT, Shah S, Khalid A. Nutcracker Syndrome with Hypertension: A Case Report. Cureus. 2019;11(5):e4781. DOI: 10.7759/cureus.4781.
18. Park SJ, Kim SM, Won JH, Lim HS. A case of secondary hypertension associated with the nutcracker phenomenon. Korean Circ J. 2014;44(6):434-6. DOI: 10.4070/kcj.2014.44.6.434.
19. Hadei SK, Badr S, Amirzargar MA. Refractory hypertension and pelvic pain associated with nutcracker phenomenon. Radiol Case Rep. 2020;15(5):519-522. DOI: 10.1016/j.radcr.2020.01.040.
20. Prochaska JH, Arnold N, Falcke A, Kopp S, Schulz A, Buch G, et al. Chronic venous insufficiency, cardiovascular disease, and mortality: a population study. Eur Heart J. 2021:ehab495. DOI: 10.1093/eurheartj/ehab495. Epub ahead of print. PMID: 34387673.
21. Matic P, Jolic S, Tanaskovic S, Soldatovic I, Katsiki N, Isenovic E, et al. Chronic Venous Disease and Comorbidities. Angiology. 2015;66(6):539-44. DOI: 10.1177/0003319714541988.
22. Zheng Y, Zhang R, Shi W, Li L, Liu H, Chen Z, et al. Metabolism and pharmacological activities of the natural health-benefiting compound diosmin. FoodFunct. 2020;11(10):8472-8492. DOI: 10.1039/d0fo01598a
23. Rodnyansky DV, Fokin AA. Diosminsoderzhashchie flebotropnye lekarstvennye preparaty pri varikoznoĭ ékzeme [Diosmin-containing phlebotropic drugs in varicose eczema]. Angiol Sosud Khir. 2019;25(3):88-92. (In Russ.) DOI: 10.33529/ANGI02019303.
24. Zubarev AR, Krivosheeva NV, Demidova aK, Rychkova IV. [Ultrasound elastography in assessing efficacy of treatment for lower limb varicose veins with a phlebotrophic drug containing a micronized purified flavonoid fraction]. Angiol Sosud Khir. 2014;20(2):90-6. (In Russian). PMID: 24961330.
25. Kalinin RE, Suchkov IA, Kamaev AA, Zvyagina VI, Krylov AA. Éndoteliotropnye éffekty venotoniziruiushchikh preparatov pri lechenii bol'nykh s varikoznoĭ bolezn'iu [Endotheliotropic effects of venotonic drugs in treatment of patients with varicose veins]. Angiol Sosud Khir. 2018;24(4):72-74. (In Russian). PMID: 30531772.
26. Feldo M, Wójciak-Kosior M, Sowa I, Kocki J, Bogucki J, Zubilewicz T, et al. Effect of Diosmin Administration in Patients with Chronic Venous Disorders on Selected Factors Affecting Angiogenesis. Molecules. 2019;24(18):3316. DOI: 10.3390/molecules24183316.
27. Serra R, Ielapi N, Bitonti A, Candido S, Fregola S, Gallo A, et al. Efficacy of a Low-Dose Diosmin Therapy on Improving Symptoms and Quality of Life in Patients with Chronic Venous Disease: Randomized, Double-Blind, Placebo-Controlled Trial. Nutrients. 2021;13(3):999. DOI: 10.3390/nu13030999.
28. El-Fawal R, El Fayoumi HM, Mahmoud MF. Diosmin and crocin alleviate nephropathy in metabolic syndrome rat model: Effect on oxidative stress and low grade inflammation. Biomed Pharmacother. 2018;102:930-937. DOI: 10.1016/j.biopha.2018.03.162.
Об авторах
О. И. ЖдамароваРоссия
Ждамарова Ольга Ильинична, к. м. н., старший лаборант кафедры факультетской терапии
Краснодар
Л. Н. Елисеева
Россия
Елисеева Людмила Николаевна, д. м. н., профессор, заведующий кафедрой факультетской терапии
Краснодар
П. И. Урбан
Россия
Урбан Полина Ивановна, к. м. н., врач-кардиоло
Краснодар
Дополнительные файлы
Рецензия
Для цитирования:
Ждамарова О.И., Елисеева Л.Н., Урбан П.И. Дополнительные эффекты диосмина в лечении артериальной гипертензии у пациентов с нарушением венозного кровотока почек. Южно-Российский журнал терапевтической практики. 2022;3(2):63-70. https://doi.org/10.21886/2712-8156-2022-3-2-63-70
For citation:
Zhdamarova O.I., Eliseeva L.N., Urban P.I. Additional effects of diosmin in the treatment of arterial hypertension in patients with impaired renal venous blood flow. South Russian Journal of Therapeutic Practice. 2022;3(2):63-70. (In Russ.) https://doi.org/10.21886/2712-8156-2022-3-2-63-70
JATS XML


























