Перейти к:
Парадоксы в эмболии: ведение молодой пациентки с дефектом межпредсердной перегородки после острого инфаркта миокарда
https://doi.org/10.21886/2712-8156-2022-3-3-97-107
Аннотация
В статье представлено описание клинического случая ведения молодой женщины с аневризмой и двумя дефектами межпредсердной перегородки после развития острого инфаркта миокарда, обсуждены аспекты дифференциального диагноза и долгосрочного ведения.
Для цитирования:
Чумаченко Н.В., Кижватова Н.В., Космачева Е.Д., Пахолков А.Н., Федорченко А.Н. Парадоксы в эмболии: ведение молодой пациентки с дефектом межпредсердной перегородки после острого инфаркта миокарда. Южно-Российский журнал терапевтической практики. 2022;3(3):91-96. https://doi.org/10.21886/2712-8156-2022-3-3-97-107
For citation:
Chumachenko N.V., Kijvatova N.V., Kosmacheva H.D., Pakholkov A.N., Fedorchenko A.N. Paradoxes in embolism: management of a young female patient with atrial septal defect after acute myocardial infarction. South Russian Journal of Therapeutic Practice. 2022;3(3):91-96. (In Russ.) https://doi.org/10.21886/2712-8156-2022-3-3-97-107
Вступление
Каждый случай острого инфаркта миокарда (ОИМ) у молодого пациента требует оценки этиологического фактора. С точки зрения эпидемиологии, ишемическая болезнь сердца (ИБС) становится причиной сосудистой катастрофы во всё более ранней возрастной группе и должна быть исключена независимо от возраста [1]. Причиной ОИМ при «интактных» коронарных артериях может быть тромбоз, эмболия, спазм, аномалия сосуда, диссекция или сочетание указанных механизмов, но нередко этиологию не удается установить [2]. ОИМ при наличии дефекта межпредсердной перегородки (ДМПП) может быть обусловлен эмболией тромботических масс из левых отделов сердца либо парадоксальной эмболией из правых отделов [3]. Впервые случай парадоксальной эмболии был описан в 1877 г. [4]. В качестве подтверждения события парадоксальной эмболии рассматриваются следующие критерии: событие артериальной эмболии при отсутствии источника в левых отделах сердца, идентификация источника в венозной системе, визуализация артерио-венозного шунта [3].
По мнению экспертов, парадоксальная коронарная эмболия составляет 10 –15% случаев всей парадоксальной эмболии и 25% острых коронарных событий у лиц моложе 35 лет, чаще у женщин [5]. Условием для возникновения парадоксальной эмболии является повышение давления в правых отделах сердца, например, тромбоэмболия лёгочной артерии, ночное апноэ, манёвр Вальсальвы [4][6]. При этом зафиксированный эпизод парадоксальной эмболии служит самостоятельным показанием для закрытия дефекта [7], так как ежегодный риск системных эмболических событий увеличивается [8].
В качестве одного из возможных и актуальных триггерных факторов ОИМ в молодом возрасте рассматривается вазоспазм, в том числе в результате употребления психотропных веществ [9][10], на первом месте среди которых для ОИМ и 1 и 2 типа, по оценке A. Singh et al., стоит алкоголь, а для инфаркта 2 типа — опиаты, марихуана, кокаин и энергетические тоники [11][12].
Описание клинического случай
Пациент, женщина 26 лет, поступила в отделение кардиологии в экстренном порядке с жалобами на одышку в покое и слабость, купированными на амбулаторном этапе. Двумя часами ранее, дома, после привычной физической нагрузки (занятий йогой и уборки по дому), отметила вышеописанные жалобы и была доставлена бригадой скорой медицинской помощи в приёмное отделение больницы. Из анамнеза известно, что в возрасте 13 лет выявлен ДМПП, пролапс митрального клапана; у кардиолога не наблюдалась. Приём медикаментозных препаратов, алкоголя, психотропных веществ, в том числе «энергетических напитков», курение отрицала. Наследственный анамнез не отягощён, включая наследственную форму гиперхолестеринемии.
При объективном осмотре индекс массы тела — 22,57 кг/м2. Частота дыхательных движений — 22 в мин. При аускультации мягкий систолический шум в точке Боткина-Эрба с проведением на верхушку, ритм правильный, частота сердечных сокращений — 62 в мин. Артериальное давление одинаково на руках — 110/70 мм рт. ст.
На электрокардиограмме (ЭКГ) зафиксирована элевация сегмента ST в отведениях II, III, avF c дискордантной депрессией сегмента ST в V1-3 (рис. 1). На эхокардиоскопии (эхоКС): фракция выброса (ФВ) левого желудочка (ЛЖ)> 55 %, без зон гипо- и акинезов; аневризма и два ДМПП диаметром 7 и 13 мм.
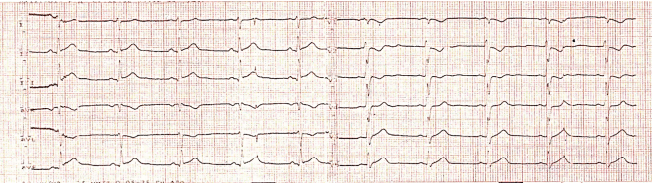
Рисунок 1. Электрокардиограмма пациента при поступлении
При контроле лабораторных показателей выявлена динамика кардиоспецифичных ферментов: повышение креатинфосфокиназы-МВ (КФК-МВ) в 3 раза, тропонина I в 2 раза, тропонина Т в 32 раза от нормы (табл. 1).
Таблица 1
Динамика кардиоспецифичных ферментов
|
Сроки забора |
При госпитализации |
Через 6 часов от поступления |
На 6-е сутки от ОИМ |
|
Показатель (референтный интервал) |
|||
|
Тропонин I (0–14 пг/мл) |
28, 23 |
3077 |
370,1 |
|
КФК-МВ (0–24 Ед/л) |
60,8 |
192,2 |
102,2 |
С учётом данных в пользу острого коронарного синдрома с элевацией сегмента ST принято решение о проведении коронароангиографии (КАГ) в неотложном порядке. Получены следующие результаты (рис. 2): правый тип кровоснабжения; ствол, передняя нисходящая артерия, диагональная ветвь, огибающая ветвь проходимы; боковая ветвь (БВ) 1-го порядка проходима; БВ 2 — дистальный стеноз 90%, БВ 3 — дистальная окклюзия, БВ 4 — окклюзия; правая коронарная артерия проходима; задняя нисходящая артерия (ЗНА) 1-го порядка — субокклюзия в средней трети, ЗНА 2 проходима.
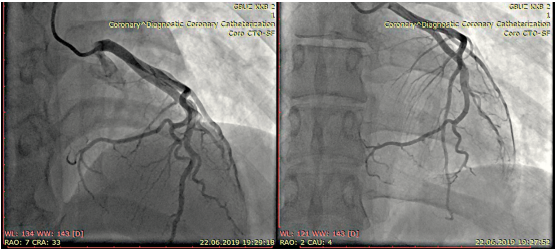
Рисунок 2. Результаты коронароангиографии
Установлен клинический диагноз «Первичный нижний Q-инфаркт миокарда от 22.06.2019. Острая сердечная недостаточность I Killip. КАГ от 22.06.2019. Врождённый порок сердца: аневризма межпредсердной перегородки (МПП) с двумя дефектами». В связи со стабильным состоянием пациентки, множественным дистальным характером поражения и малым диаметром вовлечённых коронарных артерий от реваскуляризации миокарда принято воздержаться, продолжено консервативное ведение ОИМ: ацетилсалициловая кислота 75 мг, тикагрелор 90 мг 2 р/сутки, Бисопролол 2,5 мг, Аторвастатин 10 мг. На фоне терапии расширение двигательного режима переносила удовлетворительно, ангинозные боли не рецидивировали. Выписана из отделения неотложной кардиологии на 8-е сутки (ЭКГ при выписке — на рис. 3).
Таблица 2
ПЦР-диагностика полиморфизмов генов системы свертывания крови и фолатного цикла (12 мутаций)
|
Тест |
Результат |
|
Метионин синтаза (MTR). Мутация A2756G (Asp919Gly) |
Нормальная гомозигота |
|
Метилентетрагидрофолат редуктаза (MTHFR). Мутация A1298C (Glu429Ala) |
Гетерозигота |
|
Метионин-синтаза-редуктаза (MTRR). Мутация A66G (Ile22Met) |
Патологическая (мутантная) гомозигота |
|
Фибриноген, бета-полипептид (FGB). Мутация G(-455)A (регулярная область гена) |
Нормальная гомозигота |
|
Интегрин бета-3 (бета-субъединица рецептора фибриногена тромбоцитов) (ITGB3). Мутация T1565C (Leu59Pro) |
Нормальная гомозигота |
|
Ингибитор активатора плазминогена (SERPINE1). Мутация 5G(-675)4G (регуляторная область гена) |
Патологическая (мутантная) гомозигота |
|
Фактор свертываемости крови 5 (F5). Мутация G1691A (Arg506Gln) |
Гетерозигота |
|
Интегрин альфа-2 (гликопротеин Iа/IIa тромбоцитов) (ITGA2). Мутация C807T (нарушение синтеза белка) |
Гетерозигота |
|
Фактор свертываемости крови 2, протромбин (F2). Мутация G20210A (регуляторная область гена) |
Нормальная гомозигота |
|
Фактор свертываемости крови 13, субъединица Ф1 (F13A1). Мутация G103T (Val34Leu) |
Гетерозигота |
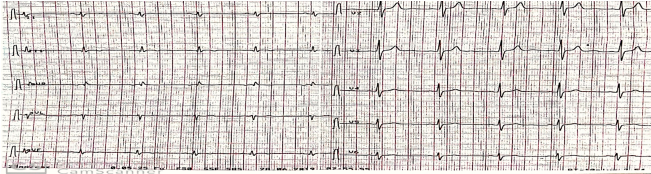
Рисунок 3. Электрокардиограмма на 8-е сутки от ОИМ
На 28-е сутки от ОИМ госпитализирована планово в отделение кардиологии для определения тактики ведения. Жалоб при поступлении не предъявляла. На ЭхоКС (рис. 4) — сохранная ФВ ЛЖ, аневризма и два дефекта МПП 13 и 15 мм, умеренное расширение правых отделов сердца.
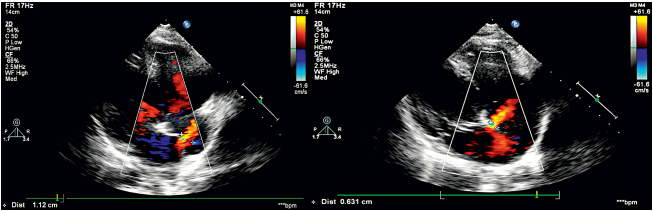
Рисунок 4. ЭхоКС на момент поступления
В ходе обследования проведена оценка наличия гиперкоагуляционных состояний как возможной причины коронарного тромбоза: антифосфолипидного и нефротического синдрома, носительства тромбофилии. Антифосфолипидный синдром был исключён в ходе инструментального и лабораторного обследований (ассоциированные показатели находились в пределах референтных интервалов): волчаночный антикоагулянт — 0.92, протромбиновое время — 12.20 сек; протромбиновое отношение —1.08, международное нормализированное отношение — 1.08; Фибриноген — 4.42 г/л, кардиолипин класса IgG — 2.3 Ед/мл, кардиолипин IgM — 1.70 Ед/мл, активность антитромбина III — 89%, Д-димер — 169 нг/мл, протеин С — 89 %, лишь отмечалась тенденция к росту протеина S — 144% (при норме до 134%). Отсутствие данных в пользу органической патологии почек наряду со стабильными показателями креатинина, мочевины, общего анализа мочи, отсутствием протеинурии позволяют исключить нефротический синдром как возможный протромбогенный фактор. Токсикологическое исследование в условиях стационара не проводилось.
Принимая во внимание признаки перегрузки правых отделов сердца, перенесённый, вероятно, эмболический ОИМ, выполнено эндоваскулярное закрытие обоих дефектов одним окклюдером «Atrial Septal Defect Occluder» (XJFS30) 28 мм (рис. 5) (инвазивно размер дефектов оценен 8 и 22 мм).

Рисунок 5. Результат эндоваскулярной окклюзии ДМПП
При проведении ультразвукового контроля — без достоверного потока сброса по цветовому допплеровскому картированию (рис. 6). При выписке назначена стандартная двойная антитромботическая терапия антиагрегантными препаратами в течение 12 месяцев [13]. При контрольном осмотре через 3, 6 и 12 месяцев после эндоваскулярного лечения имела место стабильная картина субъективного, объективного статуса и данных эхоКС. Через 12 месяцев вся терапия была отменена.
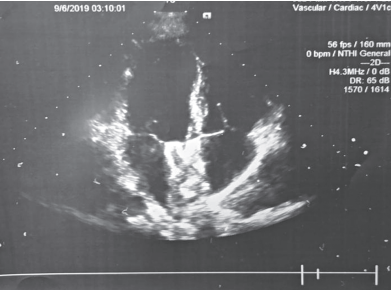
Рисунок 6. ЭхоКС после эндоваскулярной окклюзии ДМПП
Обсуждениие
Можно ли определённо установить механизм тромбоза коронарных артерий у пациента? С одной стороны, классических критериев парадоксальной эмболии не было диагностировано, но была связь с выполнением маневра Вальсальвы при занятии йогой. С другой стороны, наличие самой аневризмы МПП с зонами турбулентности и стаза крови представляется ещё одним механизмом, ведущим к формированию мелких тромбов в левом предсердии, изменению кровотока в коронарном бассейне [14-16]. В описанном клиническом случае окклюзия диагностирована в боковых ветвях и задней нисходящей артерии, то есть задействован бассейн и правой и левой коронарных артерий. «Рассыпной» характер окклюзии мелких ветвей коронарных артерий также рассматривался в качестве значимого аргумента, свидетельствующего в пользу эмболического механизма ОИМ.
В ретроспективном исследовании 195 пациентов [17] с аневризмой МПП проведена сравнительная оценка следующих факторов, предрасполагающих к кардиоэмболии: наличия предсердной тахикардии, любого эпизода аритмии в анамнезе, предсердного шунта, изолированной аневризмы МПП, пролапса митрального клапана, длины аневризмы и степени её выбухания. Наличие исключительно предсердного шунта достоверно чаще встречалось в группе с кардиоэмболическим анамнезом в сравнении с группой контроля (66 % против 43%). По мнению авторов, морфологические характеристики аневризмы МПП (длина, прогиб, частота колебаний), размер и количество дефектов МПП не помогают идентифицировать подгруппу пациентов с повышенным риском кардиальной эмболии. Однако кардиогенные эмболии значимо (р<0.05) чаще выявлены у пациентов с наличием предсердного шунта, включая открытое овальное окно, ДМПП 2 типа, дефект венозного синуса.
Изложенные клинические данные не позволяли достоверно установить источник эмболии, однако несомненной явилась связь наличия аневризмы и дефектов МПП с развитием ОИМ, что послужило причиной однозначного выбора эндоваскулярного метода лечения на момент госпитализации.
Отдельное внимание стоит уделить тактике дальнейшего ведения пациента с учётом возраста и планируемой в дальнейшем беременности. Сердечно-сосудистые заболевания встречаются у 0,4–4,1% беременных, тогда как ИБС сопровождает только 0,01% всех беременностей [18]. Пациент перенесла ОИМ 2 типа [19], вторичной профилактикой которого в данном случае служит постановка окклюдера [7], а при подтверждении парадоксальной эмболии возможен также приём антикоагулянтов. По данным рекомендаций и наблюдений, успешная имплантация окклюдера при ДМПП относит беременную в категорию I по Классификации материнских кардиоваскулярных рисков по ВОЗ и не требует особой тактики в перипартальном ведении [20]. В описанном клиническом сценарии парадоксальная эмболия не была подтверждена, поэтому пожизненный прием антикоагулянтов не был рекомендован. Однако, глядя сквозь призму повышения протромбогенных рисков во период беременности, возможно, в данной ситуации стоит иметь большую настороженность при динамической оценке параметров коагуляции на этапе планирования и ведении беременности, контроле массы тела.
Не стоит забывать об описанных случаях ранних (реже — отсроченных) тромбозов окклюдера [21]. При ретроспективном 6-тимесячном анализе данных 1000 пациентов, перенёсших чрескожное закрытие открытого овального отверстия и ДМПП, частота тромбозов во втором случае составила 1,2%. При этом вариант устройства (StarFLEX и Amplatzer) не имел статистической значимости в ряде наблюдений.
Заключение
Кардиогенная эмболия при аневризме и дефекте МПП с развитием ОИМ не всегда парадоксальная и встречается достаточно редко, однако требует углубленного диагностического поиска возможных фоновых состояний. Для предотвращения рецидива эмболии следует рассматривать эндоваскулярное закрытие ДМПП. Требуется длительное наблюдение с оценкой прогноза у обсуждаемой группы пациентов и переосмыслением тактики долгосрочного ведения, в том числе при планировании и ведении беременности, в послеродовом периоде.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Egred M, Viswanathan G, Davis GK. Myocardial infarction in young adults. Postgrad Med J. 2005;81(962):741-5. DOI: 10.1136/pgmj.2004.027532.
2. Olasinska-Wisniewska A, Grygier M. Antithrombotic/ Antiplatelet Treatment in Transcatheter Structural Cardiac Interventions-PFO/ASD/LAA Occluder and Interatrial Shunt Devices. Front Cardiovasc Med. 2019;6:75. DOI: 10.3389/fcvm.2019.00075.
3. Rovner A, Valika AA, Kovacs A, Kates AM. Possible paradoxical embolism as a rare cause for an acute myocardial infarction. Echocardiography. 2006;23(5):407-9. DOI: 10.1111/j.1540-8175.2006.00228.x.
4. Krishnamoorthy S, Osman F, Nadir A, Creamer J. Acute STelevation myocardial infarction secondary to paradoxical embolism. Int J Cardiol. 2008;127(3):406-9. DOI: 10.1016/j.ijcard.2007.04.177.
5. Hakim FA, Kransdorf EP, Abudiab MM, Sweeney JP. Paradoxical coronary artery embolism - a rare cause of myocardial infarction. Heart Views. 2014;15(4):124-6. DOI: 10.4103/1995-705X.151089.
6. Kujime S, Hara H, Enomoto Y, Yoshikawa H, Itaya H, Noro M, et al. A case of paradoxical embolic ST-segment elevation myocardial infarction triggered by sleep apnea. Intern Med. 2012;51(14):1851-5. DOI: 10.2169/internalmedicine.51.7069.
7. Baumgartner H, De Backer J, Babu-Narayan SV, Budts W, Chessa M, Diller GP, et al. 2020 ESC Guidelines for the management of adult congenital heart disease. Eur Heart J. 2021;42(6):563-645. DOI: 10.1093/eurheartj/ehaa554.
8. Wilson AM, Ardehali R, Brinton TJ, Yeung AC, Vagelos R. Successful removal of a paradoxical coronary embolus using an aspiration catheter. Nat Clin Pract Cardiovasc Med. 2006;3(11):633-6. DOI: 10.1038/ncpcardio0681.
9. Singh A, Collins B, Qamar A, Gupta A, Fatima A, Divakaran S, et al. Study of young patients with myocardial infarction: Design and rationale of the YOUNG-MI Registry. Clin Cardiol. 2017;40(11):955-961. DOI: 10.1002/clc.22774.
10. DeFilippis EM, Singh A, Divakaran S, Gupta A, Collins BL, Biery D, Qamar A, et al. Cocaine and Marijuana Use Among Young Adults With Myocardial Infarction. J Am Coll Cardiol. 2018;71(22):2540-2551. DOI: 10.1016/j.jacc.2018.02.047.
11. Singh A, Collins B, Biery D, Qamar A, Fatima A, Gupta A, et al. Prevalence of revalence of substance abuse among adults with myocardial infarction. J Am Coll Cardiol. 2018;71 (11_Supplement):A178. DOI: 10.1016/S0735-1097(18)30719-8.
12. Osula S, Bell GM, Hornung RS. Acute myocardial infarction in young adults: causes and management. Postgrad Med J. 2002;78(915):27-30. DOI: 10.1136/pmj.78.915.27.
13. Călin CD, Călin A, Lupu M, Bucşa A, Ginghină C. Acute embolic events--myocardial infarction and stroke, in the presence of an interatrial septal aneurysm. J Med Life. 2011;4(3):302-4. PMID: 22567057; PMCID: PMC3168822.
14. Kei J, Avilla JK, Cavendish JJ. Rare case of myocardial infarction in a 19-year-old caused by a paradoxical coronary artery embolism. Perm J. 2015;19(2):e107-9. DOI: 10.7812/TPP/14-186.
15. Meraj-ud Din Shah. A look at atrial septal aneurysm. E-journal of Cardiology Practice. 2012;10(17).
16. Belkin RN, Hurwitz BJ, Kisslo J. Atrial septal aneurysm: association with cerebrovascular and peripheral embolic events. Stroke. 1987;18(5):856-62. DOI: 10.1161/01.str.18.5.856.
17. Mügge A, Daniel WG, Angermann C, Spes C, Khandheria BK, Kronzon I, et al. Atrial septal aneurysm in adult patients. A multicenter study using transthoracic and transesophageal echocardiography. Circulation. 1995;91(11):2785-92. DOI: 10.1161/01.cir.91.11.2785.
18. Janion-Sadowska A, Sadowski M, Zandecki L, Kurzawski J, Polewczyk A, Janion M. Pregnancy after myocardial infarction and coronary artery bypass grafting - is it safe? Postepy Kardiol Interwencyjnej. 2014;10(1):29-31. DOI: 10.5114/pwki.2014.41464.
19. Sandoval Y, Jaffe AS. Type 2 Myocardial Infarction: JACC Review Topic of the Week. J Am Coll Cardiol. 2019;73(14):1846-1860. DOI: 10.1016/j.jacc.2019.02.018.
20. Bredy C, Mongeon FP, Leduc L, Dore A, Khairy P. Pregnancy in adults with repaired/unrepaired atrial septal defect. J Thorac Dis. 2018;10(Suppl 24):S2945-S2952. DOI: 10.21037/jtd.2017.10.130.
21. Misra S, Conte J, Resar J. Left Atrial Thrombus Associated With Interatrial Septal Occluder 5 Years After Implantation. Circ Cardiovasc Interv. 2015;8(10):e002856. DOI: 10.1161/CIRCINTERVENTIONS.115.002856.
Об авторах
Н. В. ЧумаченкоРоссия
Чумаченко Наталья Владимировна, кандидат медицинских наук, кардиолог кардиологического отделения № 3
Краснодар
Н. В. Кижватова
Россия
Кижватова Наталья Владимировна, кандидат медицинских наук, кардиолог кардиологического отделения № 3 ГБУЗ «Научно-исследовательский институт — Краевая клиническая больница № 1 им. С. В. Очаповского» Минздрава России, доцент кафедры терапии № 1 факультета повышения квалификации и профессиональной переподготовки специалистов ФГБОУ ВО КубГМУ Минздрава России
Краснодар
Е. Д. Космачева
Россия
Космачева Елена Дмитриевна, доктор медицинских наук, заместитель главного врача по лечебной части ГБУЗ «Научно-исследовательский институт — Краевая клиническая больница № 1 им. С. В. Очаповского» Минздрава России, заведующая кафедрой терапии № 1 факультета повышения квалификации и профессиональной переподготовки специалистов, ФГБОУ ВО «Кубанский государственный медицинский университет» Минздрава России
Краснодар
А. Н. Пахолков
Россия
Пахолков Андрей Николаевич, врач отделения рентгенохирургических методов диагностики и лечения
Краснодар
А. Н. Федорченко
Россия
Федорченко Алексей Николаевич, доктор медицинских наук, заведующий отделением рентгенохирургических методов диагностики и лечения
Краснодар
Дополнительные файлы
Рецензия
Для цитирования:
Чумаченко Н.В., Кижватова Н.В., Космачева Е.Д., Пахолков А.Н., Федорченко А.Н. Парадоксы в эмболии: ведение молодой пациентки с дефектом межпредсердной перегородки после острого инфаркта миокарда. Южно-Российский журнал терапевтической практики. 2022;3(3):91-96. https://doi.org/10.21886/2712-8156-2022-3-3-97-107
For citation:
Chumachenko N.V., Kijvatova N.V., Kosmacheva H.D., Pakholkov A.N., Fedorchenko A.N. Paradoxes in embolism: management of a young female patient with atrial septal defect after acute myocardial infarction. South Russian Journal of Therapeutic Practice. 2022;3(3):91-96. (In Russ.) https://doi.org/10.21886/2712-8156-2022-3-3-97-107


























