Перейти к:
Вторичная артериальная гипертония и эндогенный гиперкортицизм в общей врачебной практике
https://doi.org/10.21886/2712-8156-2022-3-4-92-99
Аннотация
Синдром артериальной гипертонии (АГ) широко распространён в клинической практике. В подавляющем большинстве случаев повышение артериального давления носит эссенциальный характер. Между тем многие клинические ситуации требуют исключения вторичной АГ вследствие ятрогений, почечной, эндокринной, сердечно-сосудистой, неврологической патологии. Особое место в структуре эндокринных АГ занимает патология, связанная с избыточной продукцией кортизола. Несмотря на неоднородность происхождения, эндогенный гиперкортицизм (ЭГ) имеет определённое сходство клинических проявлений. В статье описаны два клинических случая АГ у женщин 32-х лет с различными патогенетическими вариантами эндогенного гиперкортицизма (ЭГ). Представленные истории болезни положены в основу обсуждения особенностей клинико-лабораторных проявлений ЭГ, принципов дифференциальной диагностики и современных подходов к лечению. Целью настоящей публикации является привлечение внимания врачей различных специальностей к раннему выявлению ЭГ, своевременное устранение которого существенно улучшает качество и увеличивает продолжительность жизни больных.
Ключевые слова
Для цитирования:
Петрик Г.Г., Космачева Е.Д., Бутаева С.В., Смирнова В.Л., Мишина А.М. Вторичная артериальная гипертония и эндогенный гиперкортицизм в общей врачебной практике. Южно-Российский журнал терапевтической практики. 2022;3(4):92-99. https://doi.org/10.21886/2712-8156-2022-3-4-92-99
For citation:
Petrik G.G., Kosmacheva E.D., Butaeva S.V., Smirnova V.L., Mishina A.M. Secondary arterial hypertension and endogenous hypercortisolism in general medical practice. South Russian Journal of Therapeutic Practice. 2022;3(4):92-99. (In Russ.) https://doi.org/10.21886/2712-8156-2022-3-4-92-99
Введение
Синдром артериальной гипертонии (АГ ) широко распространён в клинической практике. В настоящее время распространённость АГ среди взрослых составляет 30–45% и, согласно прогнозу, к 2025 г. увеличится на 60%, достигнув 1,6 миллиарда человек [1][2].
В подавляющем большинстве случаев повышение артериального давления (АД ) носит эссенциальный (первичный) характер. Между тем многие клинические ситуации требуют исключения АГ в качестве одного из проявлений почечной, эндокринной, сердечно-сосудистой, неврологической патологии, ятрогений, обозначаемых как вторичные (симптоматические) артериальные гипертонии. Особое место в структуре эндокринных АГ занимают случаи эндогенного гиперкортицизма гипофизарного (болезнь Иценко-Кушинга), надпочечникового (синдром Иценко-Кушинга) и вненадпочечникового (АКТГ-эктопированный синдром) генеза. Общим для всех перечисленных вариантов, помимо устойчивой и, как правило, резистентной к монотерапии АГ, является возникновение в молодом возрасте, наличие разнообразных специфических клинических проявлений, быстрое необратимое поражение органов-мишеней и возникновение тяжёлых осложнений, приводящих при отсутствии адекватного лечения к смерти пациента в ближайшие годы.
Целью настоящей публикации является привлечение внимания врачей различных специальностей к раннему выявлению эндогенного гиперкортицизма (ЭГ ), устранение которого существенно улучшает качество и увеличивает продолжительность жизни больных.
Клинический случай 1
Пациентка С., 32 года, поступила в эндокринологическое отделение ГБУЗ «НИИ-ККБ № 1 им. проф. С.В. Очаповского» с жалобами на головные боли, связанные с повышением АД до 160/100 мм рт. ст, одышку при умеренных физических нагрузках, общую слабость, быструю утомляемость, избыточный вес с преимущественным расположением жира в области живота, постоянные боли в грудном и поясничном отделах позвоночника, уменьшение в росте, нарушение менструального цикла по типу олигоменореи, повышение гликемии натощак до 7 ммоль/л.
Из анамнеза. Считает себя больной с 2017 г., когда впервые стала отмечать нарушение менструального цикла (олигоменорея с задержками до трёх месяцев), прибавку в весе с изменением пропорций тела (увеличение подкожной клетчатки в области живота, лица, появление багровых стрий в области плеч, передней брюшной стенки). В 2020 г. появились сильные боли в спине, повышение АД до 140/100 мм рт. ст. При обследовании диагностирован низкоэнергетический перелом поясничного отдела позвоночника, остеопороз, назначена терапия бисфосфанатами, препаратами кальция, витамина D.
В 2022 г. выявлено повышение гликемии натощак до 7 ммоль/л, месяц спустя терапевтом верифицирован диагноз СД 2 типа и гипертоническая болезнь 2 ст., по поводу которых назначена терапия метформином (850 мг/с), периндоприлом (4 мг), заподозрена болезнь Иценко-Кушинга. Направлена в эндокринологическое отделение ГБУЗ «НИИ-ККБ № 1 им. проф. С.В. О чаповского» для уточнения диагноза, определения тактики лечения.
При поступлении общее состояние удовлетворительное, выглядит старше биологического возраста. При осмотре обращает на себя внимание гиперемия лица, области декольте, диспластический тип ожирения (ИМТ 38,1 кг/м²) с преимущественным отложением жира в области живота, молочных желез, VII шейного позвонка, скошенные ягодицы, широкие багровые стрии в области живота, ягодиц, плеч, тонкие щиколотки и запястья. Периферических отёков нет. В легких везикулярное дыхание. Границы сердца расширены влево, тоны сердца приглушены, ритмичные, АД 140/80 мм рт. ст., ЧСС — 76 уд. в мин. В остальном физикальные данные без существенных отклонений. Изменения внешности пациентки С. представлены на рис. 1.
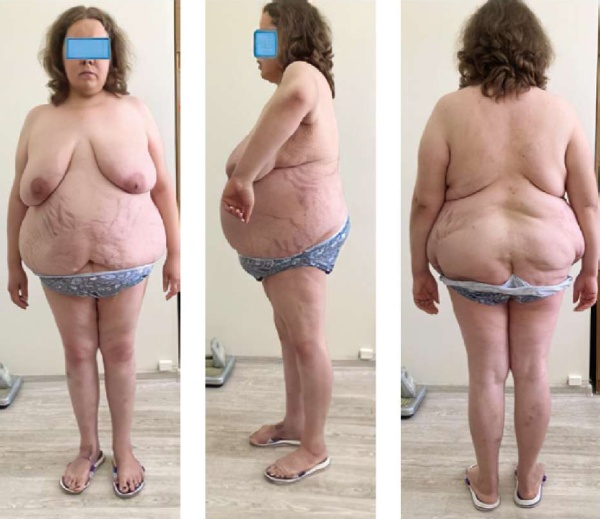
Рисунок 1. Изменения внешности пациентки С.
В лабораторных показателях — увеличение кортизола суточной мочи до 3518 нмоль/л (референсные значения — 78–589 нмоль/л), АКТГ крови в 23.00 — 104 пг/мл, в 8.00 — 89 пг/ мл (< 46 пг/мл), отсутствие подавления кортизола в ночном подавляющем тесте (НПТ ) (819 нмоль/л, <50 нмоль/л), лютеинизирующий гормон — 3,75 мМЕ /мл (0,5–76,3 мМЕ /мл), фолликулостимулирующий гормон — 5,94 мМЕ /мл (1,5–1160 мМЕ /мл), эстрадиол — 192 пмоль/л (71,6–529 пмоль/л), пролактин — 221 мМЕ / мл (59–619 мМЕ /л). Гликемический профиль (на фоне приема метформина) соответствует нормативным показателям, гликированный гемоглобин — 6,3%, липидный спектр: триглицериды — 4,2 ммоль/л (<1,69 ммоль/л), общий холестерин (ОХ С) — 5,2 ммоль/л (2,50–5,14 ммоль/л), холестерин липопротеидов низкой плотности (Хс-ЛПНП ) — 3,3 ммоль/л (0,5–3,5 ммоль/л), холестерин высокой плотности (ХС-ЛПВП ) — 1,3 ммоль/л (0,93–1,99 ммоль/л). На МРТ гипофиза турецкое седло обычной формы, размеры его не увеличены, дно и стенки имеют ровные и чёткие контуры. Гипофиз расположен интраселлярно, его высота — 5 мм, передне-задний размер — 10 мм, латеральный — 15 мм. В левой половине гипофиза определяется очаг пониженного накопления контрастного препарата, распространяющийся в структуру пещеристого синуса слева, размерами до 8×11мм, циркулярно охватывает сифон левой внутренней сонной артерии. Верхний контур гипофиза вогнутый. Воронка смещена вправо. Заключение: МР -картина макроаденомы гипофиза (рис. 2.).
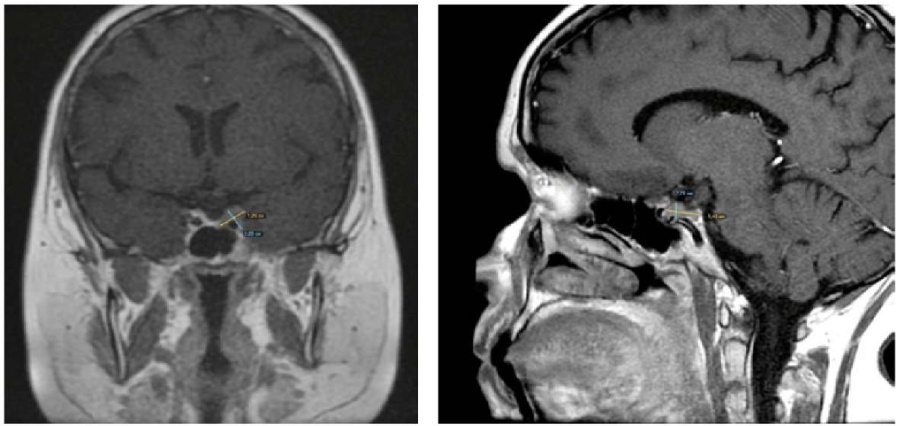
Рисунок 2. МРТ гипофиза пациентки С.
На ЭКГ : синусовая тахикардия 100 уд. в мин., QT — 316 мс, нормальное положение эл. оси. Нарушение в/предсердной проводимости. Гипоксические изменения миокарда. ЭХО КС: признаки удовлетворительной систолодиастолической функции миокарда левого желудочка (ЛЖ ), гипертрофии ЛЖ, начальные проявления дегенеративных изменений аорты и клапанов. УЗИ органов брюшной полости: признаки холецистолитиаза, диффузных изменений увеличенной печени (по типу жирового гепатоза), диффузных изменений поджелудочной железы, паренхимы почек, двухстороннего нефролитиаза.
По результатам обследования установлен диагноз: Аденома гипофиза. Болезнь ИценкоКушинга, тяжёлая форма. Осложнения основного заболевания: диспластическое ожирение (ИМТ — 38,1 кг/м²) с кожно-трофическими изменениями, стероидный остеопороз тяжёлый с компрессионными переломами тел Th10, Th12, L1, симтоматическая артериальная гипертония контролируемая, ГЛЖ, риск 4 (целевое АД < 130/80 мм рт.ст.), нейроэндокринная миокардиодистрофия ХСН 1 стадия (II ФК), стероидный сахарный диабет (целевой уровень HbA1c < 6,5%), вторичная аменорея. ГЭРБ : эрозивный рефлюкс-эзофагит. Эритематозная гастропатия. Жировой гепатоз. ЖКБ : калькулезный холецистит. МКБ. Двусторонний нефролитаз.
Таким образом на протяжении ряда лет у молодой женщины имелась АГ и манифестные признаки ЭГ в виде диспластического ожирения с кожно-трофическими изменениями, остеопорозом со спонтанными переломами, вторичной аменорей, метаболическими нарушениями, формированием желчекаменной болезни, двустороннего нефролитиаза. Причиной ЭГ в данном случае явилась аденома гипофиза (болезнь Иценко-Кушинга). Между тем в клинической практике возможны случаи избыточной продукции кортизола вследствие аденоматозной трансформации коры надпочечников (синдром Иценко-Кушинга), клинические проявления которого схожи с гиперкортицизмом гипофизарного происхождения. В этой связи представляем клинический случай 2, иллюстрирующий ЭГ надпочечникового происхождения.
Клинический случай 2
Пациентка Л., 32 года, поступила в эндокринологическое отделение ГБУЗ «НИИ-ККБ №1 им. проф. С.В. Очаповского» с жалобами на одутловатость, гиперемию лица, потливость, плохой сон, мышечную слабость, прибавку в весе на 5–6 кг за месяц с преимущественным отложением жира в области щек, живота, молочных желез, наличие стрий, истончение кожных покровов, самопроизвольное появление множественных экхимоз (синяков небольших размеров) на теле. Изменения внешности пациентки Л. представлены на рис. 3.
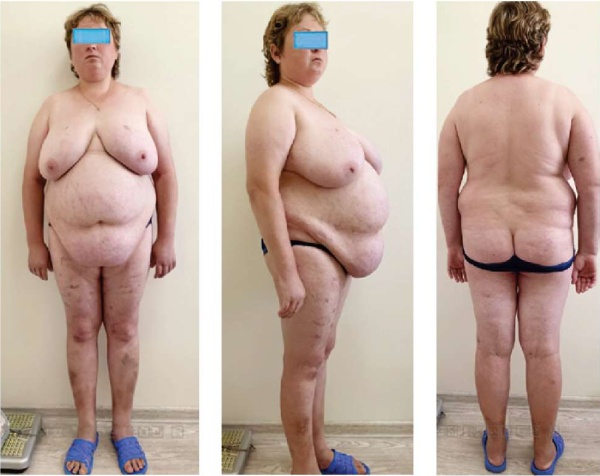
Рисунок 3. Изменения внешности пациентки Л.
Из анамнеза: считает себя больной около 2-х лет, когда стала отмечать повышение АД до 220/130 мм рт. ст., изменение внешности, одутловатость лица, увеличение массы тела с отложением жира преимущественно в области живота и лица, багровые стрии. В течение полутора лет за медицинской помощью не обращалась. Антигипертензивную терапию не получала. С февраля 2022 г. появились самопроизвольно возникающие экхимозы на теле. В апреле 2022 г. в связи с повышением АД до 250/140 мм рт. ст. госпитализирована в терапевтическое отделение ЦРБ по м/жительства, где заподозрен вторичный генез АГ, выполнено следуюзщее обследование: АКТГ < 5,00 пг/мл ( < 46 пг/ мл), альдостерон 171 пг/мл (17,6–230 пг/мл), ренин — 29,8 мкМЕ д/мл (2,8–39,9 мкМЕ д/мл). На МРТ выявлено образование правого надпочечника округлой формы с четкими и ровными контурами 2,7×2,6×2,7см. С диагнозом симптоматическая артериальная гипертензия, риск 3, ХСН I (I ФК по NY HA), Susp. Феохромоцитома надпочечника, синдром Кушинга (?), пациентка была направлена в ГБУЗ «НИИ-ККБ №1 им. проф. С.В. Очаповского».
При осмотре обращали на себя внимание гиперемия лица, области декольте, мраморность кожных покровов, диспластический тип ожирения (ИМТ — 35,9 кг/м²), скошенные ягодицы, широкие багрово-красные стрии в области живота, ягодиц, множественные экхимозы н/конечностей. В объективном статусе перкуторное расширение левой границы сердца на 1 см от срединно-ключичной линии влево, приглушённость сердечных тонов с ЧСС в 80 уд. в мин., АД — 150/80 мм рт.ст. (на фоне приема индопамида, сартанов). В остальном физикальные данные без существенных изменений. В лабораторных показателях увеличение кортизола суточной мочи до 2111нмоль/л (78,6–589 нмоль/л), при отсутствии подавления кортизола в ночном подавляющем тесте — 532 нмоль/л (<50 нмоль/л) и АКТГ в 9.00 <5,0 пг/ мл. Показатели ренина, альдостерона и метанефринов крови — в референсных значениях. Гликемический профиль 8.00 — 6,5 ммоль/л, 11.00 — 7,03 ммоль/л, 13.00 — 5,02 ммоль/л, 17.00 — 5,03 ммоль/л, 21.00 — 6,13 ммоль/л, глюкозотолерантный тест (капиллярная кровь): гликемия натощак — 5,6 ммоль/л, через 2 часа — 6,4 ммоль/л, HbA1c — 5,8%. В показателях липидного спектра ОХ С — 6,4 ммоль /л (2,5–5,1 ммоль/л), ЛПНП — 4,0 ммоль/л (0,5–3,5 ммоль/л), ЛПВП — 1,68 ммоль/л (0,93–1,99 ммоль/л), триглицериды — 1,58 ммоль/л (<1,69 ммоль/л). По данным КТ, объёмное образование правого надпочечника 32×28×25 мм в Ø, плотностью в нативе от -7 до +23 НU, неравномерно накапливающее контрастный препарат в артериальную фазу до 36–86 HU, в венозную фазу плотностью 62–128 HU, в отсроченную через 15 минут плотностью 34–52 HU. Абсолютное вымывание — 72%, относительное — 59%, Заключение: объёмное образование правого надпочечника, наиболее вероятна аденома (рис. 4).

Рисунок 4. Объёмное образование правого надпочечника пациентки Л.
На ЭКГ синусовый ритм с ЧСС в 89 уд. в мин., горизонтальное положение эл. оси. Нарушение в/предсердной проводимости. Преобладание биопотенциалов левого желудочка. По данным ЭХО -КС, уплотнение аорты и створок митрального, аортального, трикуспидального клапанов, утолщение межжелудочковой перегородки 12–13 мм (норма < 10 мм), задней стенки — до 12 мм (норма < 10 мм). Заключение: гипертрофия миокарда ЛЖ, диастолическая дисфункция ЛЖ, на УЗИ органов брюшной полости признаки диффузных изменений печени, стеатогепатоз.
Установлен диагноз: Объемное образование правого надпочечника. Синдром Иценко–Кушинга с диспластическим ожирением (ИМТ — 35,9 кг/м²), кожно-трофическими изменениями, нарушением гликемии натощак. Симптоматическая АГ, контролируемая. Гиперхолестеринемия, риск 3. Целевое АД — 120–129/70–79 мм рт.ст. ХСН I ст. II ФК по NY HA. Метаболически ассоциированная жировая болезнь печени: стеатогепатоз.
Обсуждение
Согласно литературным сведениям, заболеваемость ЭГ невысока и составляет 0,2–5 случаев на 1 млн в год [3]. В то же время распространённость АГ у пациентов с ЭГ превышает 80% [4], что обусловливает необходимость исключения избыточной продукции кортизола у пациента с АГ при наличии специфических клинических проявлений. В качестве патогномоничных для ЭГ признаков рассматриваются матронизм (лунообразное лицо с цианотическим румянцем), диспластическое ожирение (преимущественное отложение жировой клетчатки на животе, груди, спине с формированием «надключичных подушечек» и «климактерического горбика» в сочетании со скошенными ягодицами и истончением щиколоток и запястий), слабость проксимальных мышц, широкие багровокрасные стрии, зоны гиперпигментации в области трущихся поверхностей, экхимозы, возникающие даже при незначительных травмах. Кроме того, у большинства больных неблагоприятные метаболические эффекты ЭГ сопряжены с нарушениями углеводного обмена (предиабет/сахарный диабет), атерогенным типом дислипидемий и гиперкоагуляцией формирующих крайне высокий риск сердечно-сосудистых осложнений, остеопорозом со спонтанными низкоэнергетическими переломами, иммунодефицитом, обусловливающим тяжёлое течение инфекционных поражений различной локализации от рецидивирующего течения пиелонефрита, цистита, синусита до развития бактериемии и сепсиса, желчеи мочекаменной болезнью, психическими расстройствами, гирсутизмом, нарушением половых функций. Выраженность проявлений ЭГ варьируется в зависимости от тяжести и продолжительности избытка глюкокортикоидов, хотя в ряде случаев возможно появление симптоматики и при неоднократных эпизодических повышениях уровня кортизола, чередующихся с периодами нормальной секреции (циклический синдром Кушинга) [5][6][7][8].
Несмотря на яркие клинические проявления, диагностика ЭГ может откладываться на годы. Свойственные ЭГ многочисленные «клинические маски» инициируют обращение пациентов к специалистам различного профиля — терапевту, кардиологу, ортопеду-травматологу, гинекологу, дерматологу, психиатру, урологу, гастроэнтерологу, оказывающих помощь исключительно в рамках «своей» компетенции. Между тем прогноз заболевания определяется широким спектром патогенетических механизмов, поражающих практически все органы и системы и непосредственно зависит от длительности, тяжести и выраженности гиперкортицизма. Возникающие при прогрессировании изменения со стороны сердечно-сосудистой системы, костноминерального, углеводного, липидного, белкового обмена, гемостаза со временем приобретают необратимый характер и сохраняются даже в случае устранения ЭГ. В связи с этим ранняя диагностика и последующее устранение причины гиперпродукции кортизола является первоочередной задачей, сохраняющей жизнь пациентов.
Согласно рекомендациям общества эндокринологов [5][7], раннюю диагностику ЭГ целесообразно проводить в группах пациентов с высоким риском гиперкортицизма. Перед проведением лабораторных исследований необходимо исключить приём пациентом глюкокортикоидов (экзогенный гиперкортицизм) и состояния функционального гиперкортицизма (табл. 1).
Таблица 1
Состояния, приводящие к функциональному гиперкортицизму [КР, 2021]
Клинические и лабораторные изменения | Состояния или заболевания |
Клинические симптомы ЭГ сочетаются с лабораторными признаками ЭГ | - беременность; |
- депрессия или другая серьёзная психиатрическая патология; | |
- алкоголизм; | |
- резистентность к глюкокортикоидам; | |
- морбидное ожирение; | |
- плохо контролируемый сахарный диабет. | |
Клинические симптомы ЭГ, как правило, отсутствуют, в то время как лабораторно определяется ЭГ | - физический стресс (госпитализация, хирургические вмешательства, боль); |
- тяжёлые нарушения всасывания пищи, недоедание, нервная анорексия; | |
- изнуряющие интенсивные тренировки; | |
- гипоталамическая аменорея; | |
- увеличение кортизол-связывающего глобулина (повышено содержание кортизола в крови, но не в моче). |
Диагностический алгоритм ЭГ включает три этапа [5][7]: 1-й — дифференциальная диагностика с функциональным гиперкортицизмом (лабораторное подтверждение эндогенной гиперпродукции кортизола) ⟶ 2-й этап — дифференциальная диагностика АКТГ зависимого и АКТГ-независимого ЭГ ⟶ 3-ий этап — дифференциальная диагностика болезни Иценко-Кушинга и АКТГ-эктопированного синдрома.
Первоначальная лабораторная оценка факта наличия ЭГ включает выполнение как минимум двух из трёх предлагаемых тестов, включающих оценку суточных колебаний секреции кортизола с определением уровня кортизола в сыворотке или слюне в полночь, супрессивный ночной подавляющий тест (НПТ ) с низкими дозами дексаметазона (обычно 1 мг на ночь) и определение суточной продукция кортизола (суточный кортизол мочи). У пациентов с ЭГ циркадный ритм секреции кортизола нарушен, а высокий уровень кортизола в ночные часы является самым ранним и наиболее чувствительным диагностическим признаком данного состояния [7]. В обоих представляемых нами клинических случаях физиологическое подавление кортизола после введения дексаметазона отсутствовало (точка разделения < 50 нмоль/л), в суточной моче выявлено повышение свободного кортизола, что подтверждает наличие у пациенток ЭГ.
После подтверждения наличия синдрома ЭГ переходят к установлению его причины. В подавляющем большинстве случаев (~ 80%) ЭГ развивается из-за избыточного образования адренокортикотропного гормона (АКТГ зависимая форма), в 20% случаев — вследствие гиперпродукции кортизола надпочечниками (АКТГ-независимый вариант). Выполненное согласно диагностическому алгоритму исследование АКТГ у пациентки С. (клинический случай 1) превышает референсные значения в утренние и вечерние часы, что подтверждает наличие АКТГ-зависимого ЭГ и определяет необходимость проведения дифференциальной диагностики между АКТГ-продуцирующей аденомой гипофиза и АКТГ-эктопированным синдромом. В последнем случае источником избыточной продукции АКТГ или кортикотропин-рилизинггормона являются новообразования различной локализации, чаще лёгкие, тимус, поджелудочная железа, различные отделы желудочнокишечного тракта, к более редким случаям относят медуллярный рак щитовидной железы, хромаффиному, рак матки, яичников, яичек, аппендикса, мочевого пузыря, околоушных и слюнных желез и т.д. Выполненная согласно диагностическому алгоритму [5][7] МРТ гипофиза обнаружила наличие аденомы гипофиза у пациентки С (клинический случай 1). Напротив, у пациентки Л. (клинический случай 2) утренний АКТГ не превышал 10 пг/мл, что свидетельствует об АКТГ-независимом гиперкортицизме, при котором неконтролируемое высвобождение кортизола осуществляется из надпочечникового очага, чаще аденомы, реже — адренокортикального рака, АКТГ-независимой макронодулярной гиперплазии надпочечников или первичного пигментного узлового заболевания надпочечников. Последующее КТ-исследование органов брюшной полости подтвердило наличие объёмного образования правого надпочечника, соответствующее, согласно расчётным показателям вымывания контраста (абсолютное вымывание — более 60%, относительное — более 40%), аденоме.
Таким образом, АГ у обоих пациенток имеет вторичный характер, являясь, по сути, одним из многих проявлений ЭГ у пациентки С. гипофизарного генеза, а у пациентки Л. — надпочечникового. Поскольку методом выбора лечения ЭГ является резекция источника АКТГ или избытка надпочечникового генеза [9], после проведения преоперационной подготовки планируется госпитализация пациентки С. в нейрохирургическое отделение, а пациентки Л. — в отделение эндокринной хирургии для оперативного лечения.
Заключение
Представленные истории болезни двух молодых женщин 32-х лет свидетельствуют о сложностях выявления ЭГ у пациентов с АГ. С одной стороны, невысокая распространённость ЭГ и отсутствие личного опыта не позволяют врачу в ряде случаев преодолеть стереотипность клинического мышления, направленного на установление преобладающей в рутинной практике эссенциальной гипертонии, с другой — многообразная симптоматика, наличие коморбидной патологии формирует ложную дигностическую гипотезу наблюдения пациента у специалистов различного профиля в зависимости от доминирующих клинических проявлений без выявления истинной причины, лежащей в основе происходящего. Между тем тщательный сбор жалоб, анамнеза, детальный анализ совокупности патогномоничных клинических признаков (артериальная гипертония, диспластическое ожирение, гирсутизм, половые дисфункции) и сопряжённых изменений углеводного, белкового, липидного, костного метаболизма формирует клиническое подозрение на наличие ЭГ. Последующее выполнение современных диагностических алгоритмов позволяет своевременно выявить и устранить причину ЭГ, существенно улучшая прогноз заболевания.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Williams B, Mancia G, Spiering W, Agabiti Rosei E, Azizi M, Burnier M, et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J. 2018;39(33):3021-3104. doi: 10.1093/eurheartj/ehy339. Erratum in: Eur Heart J. 2019;40(5):475.
2. Kearney PM, Whelton M, Reynolds K, Muntner P, Whelton PK, He J. Global burden of hypertension: analysis of worldwide data. Lancet. 2005;365(9455):217-23. doi: 10.1016/S0140-6736(05)17741-1
3. Steffensen C, Bak AM, Rubeck KZ, Jørgensen JO. Epidemiology of Cushing's syndrome. Neuroendocrinology. 2010;92 Suppl 1:1-5. doi: 10.1159/000314297
4. Charles L, Triscott J, Dobbs B. Secondary Hypertension: Discovering the Underlying Cause. Am Fam Physician. 2017;96(7):453-461. PMID: 29094913.
5. Белая Ж.Е., Рожинская Л.Я., Вагапова Г.Р. и соавт. Клинические рекомендации Болезнь Иценко-Кушинга: Клиника, диагностика, дифференциальная диагностика, методы лечения. Москва, 2014.
6. Nieman LK. Cushing's syndrome: update on signs, symptoms and biochemical screening. Eur J Endocrinol. 2015;173(4):M33-8. doi: 10.1530/EJE-15-0464
7. Fleseriu M, Auchus R, Bancos I, Ben-Shlomo A, Bertherat J, Biermasz NR, et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. Lancet Diabetes Endocrinol. 2021;9(12):847-875. doi: 10.1016/S2213-8587(21)00235-7
8. Nieman LK, Biller BM, Findling JW, Murad MH, Newell-Price J, Savage MO, et al. Treatment of Cushing's Syndrome: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2015;100(8):2807-31. doi: 10.1210/jc.2015-1818
9. Lacroix A, Feelders RA, Stratakis CA, Nieman LK. Cushing's syndrome. Lancet. 2015;386(9996):913-27. doi: 10.1016/S0140-6736(14)61375-1
Об авторах
Г. Г. ПетрикРоссия
Петрик Галина Георгиевна, д.м.н., доцент, профессор кафедры терапии 1 ФПК и ППС; врач-эндокринолог
Краснодар
Е. Д. Космачева
Россия
Космачева Елена Дмитриевна, д.м.н., профессор, заведующий кафедрой терапии №1 ФПК и ППС; заместитель главного врача по медицинской части
Краснодар
С. В. Бутаева
Россия
Бутаева Светлана Васильевна, заведующий эндокринологическим отделением
Краснодар
В. Л. Смирнова
Россия
Смирнова Вероника Леонидовна, врач-эндокринолог эндокринологического отделения
Краснодар
А. М. Мишина
Россия
Мишина Анастасия Михайловна – врач-эндокринолог эндокринологического отделения
Краснодар
Рецензия
Для цитирования:
Петрик Г.Г., Космачева Е.Д., Бутаева С.В., Смирнова В.Л., Мишина А.М. Вторичная артериальная гипертония и эндогенный гиперкортицизм в общей врачебной практике. Южно-Российский журнал терапевтической практики. 2022;3(4):92-99. https://doi.org/10.21886/2712-8156-2022-3-4-92-99
For citation:
Petrik G.G., Kosmacheva E.D., Butaeva S.V., Smirnova V.L., Mishina A.M. Secondary arterial hypertension and endogenous hypercortisolism in general medical practice. South Russian Journal of Therapeutic Practice. 2022;3(4):92-99. (In Russ.) https://doi.org/10.21886/2712-8156-2022-3-4-92-99
JATS XML


























