Перейти к:
Сочетание гранулематоза с полиангиитом с COVID-19: трудности дифференциальной диагностики и лечения
https://doi.org/10.21886/2712-8156-2022-3-4-107-115
Аннотация
В статье представлено проспективное клиническое наблюдение с летальным исходом пациента с тяжёлым течением гранулематоз с полиангиитом (ГПА), осложнённого COVID 19 на фоне иммуносупрессии. В дебюте заболевания имелись трудности с постановкой диагноза, выставлялся диагноз «Эозинофильный гранулематоз с полиангиитом» (ЭГПА). Пациент получал глюкокортикоиды (ГК) внутрь и в режиме пульс-терапии, цитостатические препараты. Терапия была недостаточно эффективна. В процессе наблюдения диагноз «ЭГПА» был изменён на «ГПА». С учётом неэффективности проводимой терапии пациенту назначена генно-инженерная биологическая терапия ритуксимабом (РТМ). Было отмечено снижение активности заболевания, достижение деплеции В-клеток. В период пандемии пациент заболел новой коронавирусной инфекцией. Иммуносупрессия способствовала тяжёлому течению заболевания. После лечения инфекции наросла активность васкулита, что потребовало повторного введения РТМ по жизненным показаниям. На фоне терапии — кратковременная стабилизация состояния, в дальнейшем — рецидив лихорадки, нарастание дыхательной недостаточности, развитие нейтропении. С учётом исходного поражения лёгких у пациента проводилась дифференциальная диагностика между осложнениями коронавирусной инфекции и активностью основного заболевания. Несмотря на проведение противовоспалительной, антикоагулянтной, антибактериальной терапии, состояние пациента прогрессивно ухудшалось, нарастала дыхательная недостаточность, появилось кровохарканье. Был диагностирован спонтанный пневмоторакс справа, пневмомедиастинум. После неоднократных отрицательных ПЦР результатов в мазках вновь обнаружен возбудитель SARS COV-2. Непосредственной причиной смерти, по данным клинического наблюдения и патологоанатомического вскрытия, явилась тяжёлая дыхательная недостаточность, тромбообразование в мелких сосудах лёгких у больного с новой коронавирусной инфекцией на фоне иммуносупрессии по поводу ГПА.
Ключевые слова
Для цитирования:
Никитина Н.М., Александрова О.Л., Магдеева Н.А., Мелехина И.Ф., Пасечная Н.В. Сочетание гранулематоза с полиангиитом с COVID-19: трудности дифференциальной диагностики и лечения. Южно-Российский журнал терапевтической практики. 2022;3(4):107-115. https://doi.org/10.21886/2712-8156-2022-3-4-107-115
For citation:
Nikitina N.M., Aleksandrova O.L., Magdeeva N.A., Melekhina I.F., Pasechnaya N.V. Combination of granulomatosis with polyangiitis with COVID-19: difficulties in differential diagnosis and treatment. South Russian Journal of Therapeutic Practice. 2022;3(4):107-115. (In Russ.) https://doi.org/10.21886/2712-8156-2022-3-4-107-115
Введение
Cистемные васкулиты (СВ), ассоциированные с антинейтрофильными цитоплазматическими антителами (АНЦА), — это группа системных аутоиммунных заболеваний, для которых характерно развитие некротизирующего воспаления стенок преимущественно мелких сосудов, ассоциированных с наличием циркулирующих антител к цитоплазме нейтрофилов, направленных против миелопероксидазы, протеиназы 3, лактоферина [1].
Группа АНЦА-ассоциированных СВ включает в себя гранулематоз с полиангиитом (ГПА), микроскопический полиангиит (МПА) и эозинофильный гранулематоз с полиангиитом (ЭГПА).
АНЦА-СВ, в большей степени ГПА, относятся к тяжёлым жизнеугрожающим аутоиммунным заболеваниям и остаются одной из важнейших проблем современной ревматологии.
Клиническое наблюдение больного Б., 1997 г. р.
С 14-летнего возраста периодически отмечалась заложенность носа. С июля 2019 г. (с 19-летнего возраста) у пациента усилилась заложенность носа, появились слизисто-гнойные выделения из носа, фебрильная лихорадка, в связи с чем с диагнозом аллергический ринит, гайморит был впервые госпитализирован в ЛОР-клинику. В общем анализе крови была выявлена анемия (гемоглобин 92 г/л), лейкоцитоз до 14×109/л с нейтрофильным сдвигом, эозинофилия (11–22%), повышение СОЭ до 60 мм/час. При КТ диагностирован правосторонний гнойный гемисинусит, левосторонний гнойный фронтит. Были выполнены радикальные операции на правой гайморовой пазухе, двусторонняя фронтотомия, проводилась антибактериальная терапия. При биопсии слизистой носа данных в пользу СВ выявлено не было. Лечение было неэффективным: сохранялся синусит, субфебрилитет, появились боли и припухлость коленных суставов, кожные высыпания в области коленных, локтевых суставов. В сентябре 2019 г. был впервые госпитализирован в ревматологическое отделение ГУЗ «Областная клиническая больница» г. Саратова.
При обследовании в общем анализе крови (ОАК) сохранялись анемия (гемоглобин — 75,0 г/л, число эритроцитов — 2,9×1012/л), лейкоцитоз (14,0×109/л) с нейтрофильным сдвигом (7–11%), эозинофилией (11–16%), СОЭ — 50 мм/час, СРБ — 19,0 мг/л. В биохимическом анализе крови обнаружено повышение уровня АСТ, АЛТ до 2,5 норм (110 и 115 Ед/л соответственно). Маркеры вирусных гепатитов, антитела к ВИЧ-инфекции были отрицательными. Иммунологическое исследование выявило наличие положительных АНЦА. Уточнение специфичности АНЦА не было выполнено по техническим причинам. В анализах мочи обнаружена незначительная протеинурия (суточная протеинурия — 0,4 г/л), микрогематурия (в пробе Нечипоренко эритроциты — 34000). При выполнении КТ грудной клетки выявлены интерстициальные изменения в легочной ткани с двух сторон в виде участков уплотнения лёгочной ткани по типу «матового стекла». В связи с наличием фебрильной лихорадки, изменениями в крови выполнялись стернальная пункция, трёхкратный посев крови на стерильность, тест на прокальцитонин. В ходе исследования были исключены гематологические заболевания, сепсис. Обсуждался диагноз «ГПА», но с учетом эозинофилии, артрита, синусита, аллергического ринита как возможного аналога бронхиальной астмы, интерстициальных изменений в лёгких, кожного васкулита, минимальных проявлений нефрита было больше данных в пользу эозинофильного ЭГПА. Активность расценена как высокая.
Больному был назначен метилпреднизолон (МП) 48 мг/сутки внутрь, 1000 мг внутривенно в режиме пульс-терапии 1 раз в месяц в течение 6 месяцев, блокаторы протонной помпы, препараты железа, гепатопротекторы. После снижения уровня трансаминаз до 1,5 норм была сделана попытка назначения циклофосфамида в сниженных дозах (400 мг в/в капельно в режиме пульс-терапии), на фоне чего вновь отмечалось повышение уровня АЛТ, АСТ до 3 норм, что послужило основанием к отмене циклофосфамида. После нормализации уровня трансаминаз был рекомендован приём азатиоприна внутрь 50 мг в сутки. Данная терапия оказалась эффективной: купировались артрит, кожный васкулит синусит, уменьшились проявления анемии, сохранялся минимальный мочевой синдром, снизились острофазовые показатели, стойко нормализовалась температура. В течение последующих 6–8 месяцев на фоне постепенного снижения дозы МП до 8 мг в сутки и увеличения дозы азатиоприна до 150 мг в сутки состояние пациента оставалось удовлетворительным. В этот период дважды рецидивировал синусит, купирующийся на фоне антибактериальной терапии. При КТ легких от января 2020 г. отмечалась положительная динамика за счёт уменьшения зоны «матового стекла»; нарушений функции внешнего дыхания (ФВД) выявлено не было.
С мая 2020 г. при снижении дозы МП до 6 мг в сутки наблюдалось нарастание активности заболевания: рецидивы гнойного риносинусита, артрита, появление кровохарканья, коньюнктивита, СОЭ — 45 мм/час, лейкоцитоз — 13,0×109/л без нейтрофильного сдвига в отсутствии эозинофилии. Уровень прокальцитонина крови был в норме. Суточная протеинурия до 0,5 гр, без мочевого синдрома. Со слизистой носа был выделен золотистый стафилококк. Начата антибактериальная терапия. При выполнении КТ придаточных пазух носа отрицательной динамики обнаружено не было, определялось неравномерное утолщение стенок пазух за счёт внутреннего кортикального слоя. При проведении КТ лёгких выявлена отрицательная динамика в виде появления инфильтратов с обеих сторон, воздушных полостей. На фоне продолжающейся антибактериальной терапии была проведена пульс-терапия МП 1000 мг, начат приём внутрь циклофосфамида в дозе 50 мг в сутки, сульфаметаксозола/триметоприма 960 мг трижды в неделю для профилактики вторичной инфекции, проводилась коррекция гипертензии. Увеличена доза МП внутрь до 48 мг в сутки с последующим снижением до 24 мг в сутки. В связи с эпидемиологической обстановкой (карантином по COVID-19 в отделении) программная пульс-терапия не проводилась. Амбулаторно повышение дозы циклофосфамида не проводилось в связи с умеренным повышением уровня трансаминаз крови до 1,5 норм.
На фоне лечения улучшение состояния сохранялось в течение 3 месяцев. С сентября 2020 г., несмотря на прием МП 24 мг/сутки, эндоксана 50 мг/сутки, отмечалось появление гнойно-геморрагических выделений из носа, «корочек» в носу, инспираторной одышки при физической нагрузке. Окулистом был диагностирован дакриоцистит. Исследование ФВД выявило умеренные нарушения по рестриктивному типу и незначительные — по обструктивному, жизненная ёмкость лёгких (ЖЕЛ) составила 68%, объём форсированного выдоха за первую секунду (ОФВ1) — 75% от должных значений, бронходилатационный тест был отрицательным. При проведении повторной биопсии слизистой носа были выявлены гранулематозные изменения; эозинофилии тканей выявлено не было. При повторном иммунологическом исследовании обнаружены антитела к протеиназе-3. Уровень СРБ — 24 мг/л, СОЭ — 32 мм/час. В анализах мочи изменений не было. При КТ придаточных пазух деструктивных изменений не найдено. При КТ лёгких обнаружено появление «нового» участка инфильтрации в верхней доле левого лёгкого. С учётом наличия в дебюте заболевания нефрита (гематурии), поражения лёгких (инфильтраты, интерстициальное поражение лёгких), данных биопсии (гранулематозное воспаление), преходящего характера эозинофилии в крови, отсутствия эозинофилии, по данным биопсии, и бронхообструктивного синдрома при динамическом наблюдении за пациентом, а также выявления АНЦА к протеиназе 3 диагноз «ЭГПА» был изменён на «ГПА». Диагноз — «Осн.: Гранулематоз с полиангиитом, активность III степени (индекс активности BVAS — 14 баллов), положительные ANCA к протеиназе 3, хроническое течение. Хронический гнойный рецидивирующий риносинусит, хронический дакриоцистит. Радикальные операции на правой гайморовой пазухе, двусторонняя фронтотомия по поводу гнойного гемисинусита в июле 2019 г. Интерстициальное поражение лёгких. Инфильтраты обоих лёгких. В анамнезе аллергический ринит, преходящая эозинофилия, нефрит, артрит, дерматит, анемия», «Осл.: Медикаментозный синдром Иценко-Кушинга. Вторичная артериальная гипертензия. ДН I».
В связи с сохранением активности СВ на фоне приёма внутрь средних доз глюкокортикоидов (ГК), цитостатических препаратов (азатиоприна, циклофосфамида), прогрессирующим поражением лёгких в отделении проведен консилиум, определены показания к генно-инженерной биологической анти-В-клеточной терапии по жизненным показаниям. После купирования гнойного риносинусита, дакроицистита, исключения латентной туберкулезной инфекции (диаскин-тест — отрицательный) была индуцирована анти-В-клеточная терапия. 28.09.2020 г. осуществлено первое введение ритуксимаба (РТМ) (Ацеллбии) 1000 мг внутривенно капельно, введение с использованием апирогенного фильтра, через инфузомат, с премедикацией МП 500 мг. Перенёс удовлетворительно. Доза МП внутрь была снижена до 16 мг в сутки.
Оценить эффективность терапии РТМ в полной мере не представлялось возможным, так как через 2 недели после его введения отмечался рецидив дакриоцистита, а ещё через неделю присоединилась новая коронавирусная инфекция (тест ПЦР на COVID-19 был положительным, объём поражения лёгких, по данным КТ грудной клетки, — до 65%, сатурация кислородом крови (Sр О2), по данным пульсоксиметрии — 90%). Больной был переведён из ревматологического в инфекционное отделение.
Проводилось лечение антибактериальными препаратами, антикоагулянтами, доза МП составляла 16 мг в сутки. В крови СРБ — 113 мг/л, лейкоцитоз — 11,1×109/л без нейтрофильного сдвига, положительный Д-димер. Была увеличена доза МП до 48 мг/день, проведена пульс-терапия МП 1000 мг №3, введен иммуноглобулин 6,0 г.
На фоне лечения наблюдалась стойкая нормализация температуры, отмечалось снижение объёма поражения лёгких до 25%, зарегистрированы дважды отрицательные тесты на COVID-19.
Больной был выписан на амбулаторное лечение в удовлетворительном состоянии. (одышка сохранялась при физической нагрузке, SрО2 — 96%).
Через 2 недели наблюдалось ухудшение (появление кровянистых «корочек» и гнойно-некротического отделяемого из носа, кровохарканья, фебрильной лихорадки, нарастание одышки, рост острофазовых показателей крови, что было расценено как нарастание активности ГПА. Инфекция в данном случае рассматривалась как триггерный фактор. ПЦР тест на COVID оставался отрицательным, и 20.11.2020 г. больной был вновь госпитализирован в ревматологическое отделение.
При обследовании признаков интеркуррентной инфекции выявлено не было (СРБ —16,8 мг/л, СОЭ — 15 мм/час, уровень прокальцитонина дважды — в норме, повторный ПЦР тест на COVID-19 от 23.11.2022 — отрицательный). С учётом недостаточной эффективности терапии, отсутствия данных об инфекции, наличия антител к SARS-CоV-2 IgG в крови, неэффективности высоких и средних доз гормонов, цитостатических препаратов в анамнезе было принято решение о повторном введении РТМ (Ацеллбии). 24.11.2020 г. проведена терапия РТМ 1000 мг на фоне антибактериальной терапии. Состояние больного улучшилось (не было кровохарканья, уменьшилась выраженность одышки, количество корочек в носу). 26.11.2022 г. больной был переведён на амбулаторное лечение, рекомендовано снижение дозы МП с 48 мг до 16 мг в течение 3 недель. Через 26 дней после повторного введения РТМ при контрольном исследовании крови — деплеция В-лимфоцитов (CD 19–0).
Пациент был повторно госпитализирован в ревматологическое отделение с рецидивом лихорадки (до 39,1°С), нарастанием дыхательной недостаточности, выделений из носа. По данным КТ легких объём поражения составлял 35%. Было выявлено повышение уровня прокальцитонина до 0,35 нг/мл (норма — до 0,01 нг/мл), ферритина — до 1296 нг/мл (норма — 29-397 нг/мл), лейкоцитоз — 13,2×109/ л; количество лимфоцитов в ОАК находилось на нижней границе нормы (1,2–1,5×109/ л). Доза МП — 32–48 мг/сутки.
С учётом возможного сепсиса на фоне иммуносупрессии проводилась терапия антибактериальными препаратами широкого спектра действия (меропенем, левофлоксацин, тигацил), противогрибковыми препаратами (флюконазол), сульфаметоксазолом/триметопримом, антикоагулянтами (ривороксабаном). Сатурация кислородом крови (SpО2), по данным пульсоксиметрии, была в норме. Через неделю после лечения состояние незначительно улучшилось, снизилась температура до субфебрильных цифр, уменьшилась одышка, выраженность воспаления по данным острофазовых реакций крови. Показатели коагулограммы были в пределах нормы.
С 08.01.2021 г. вновь отмечалось нарастание одышки, снижение Sр О2 до 81% при дыхании атмосферным воздухом, 93% — при оксигенотерапии, появление лимфопении (0,5×109/л), нарастание уровня СРБ до 106 мг/л. ПЦР-тест на COVID-19 был отрицательным. При КТ лёгких от 09.01.2021 г. наблюдалось увеличение объёма поражения лёгких более 75%.
Больному была проведена пульс-терапия МП 1000 мг №3, к лечению был добавлен высокопоточный кислород, фавипиравир, ривороксабан был заменен на эноксапарин натрия. Несмотря на лечение, состояние оставалось тяжёлым, сохранялась дыхательная недостаточность. ПЦР-тест на COVID-19 был отрицательным.
При динамическом наблюдении были исключены инфекционный эндокардит, миокардит, сепсис (посевы крови на стерильность были трижды отрицательными, уровень кальцитонина в динамике повышался не более, чем в 1,3 раза), туберкулёз.
Несмотря на лечение, состояние оставалось тяжёлым, нарастала дыхательная недостаточность. 19.01.2021 г. в связи с резким усилением одышки (ЧДД — 30–40 в минуту), появлением боли в грудной клетке, мокроты с прожилками крови снижением SpО2 до 80% больной был переведен в ОРИТ. Острая коронарная патология была исключена. Был диагностирован спонтанный пневмоторакс справа, пневмомедиастинум, произведён торакоцентез 19.01.2021.
20.01.2021 г. уровень вч СРБ составил 136,5 мг/л, SрО2 — 90 % на фоне оксигенации 10 л/мин., что было расценено как развитие «цитокинового шторма».
С 22.01.2021 г. пациент переведен на ИВЛ, начата противовирусная терапия коронавиром в/в капельно по 1,6 г 2 раза/сутки. 22.01.2021 ПЦР-тест на COVID-19 — положительный. Несмотря на проводимую терапию, состояние больного оставалось крайне тяжёлым. 25.01.2021 г. констатирована смерть больного.
При патологоанатомическом исследовании картина соответствовала тяжёлому вирусному поражению лёгких с присоединением бактериальных и тромботических осложнений (фото 1–3).
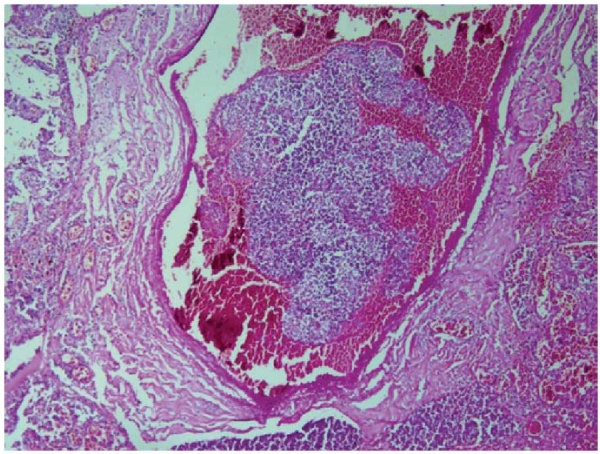
Рисунок 1. Тромб в просвете артерии (материал подготовлен И. Ю. Хоркиной)
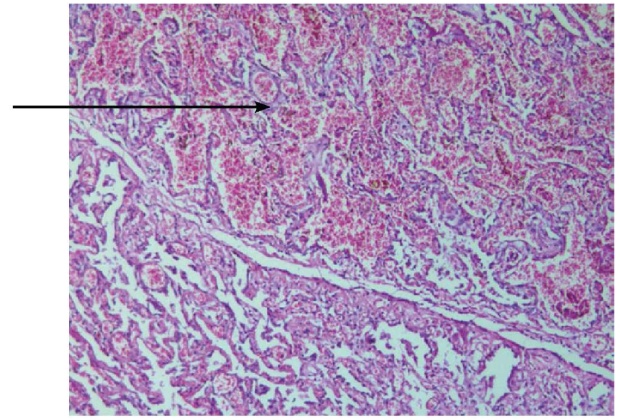
Рисунок 2. Внутриальвеолярные кровоизлияния (материал подготовлен И.Ю. Хоркиной)
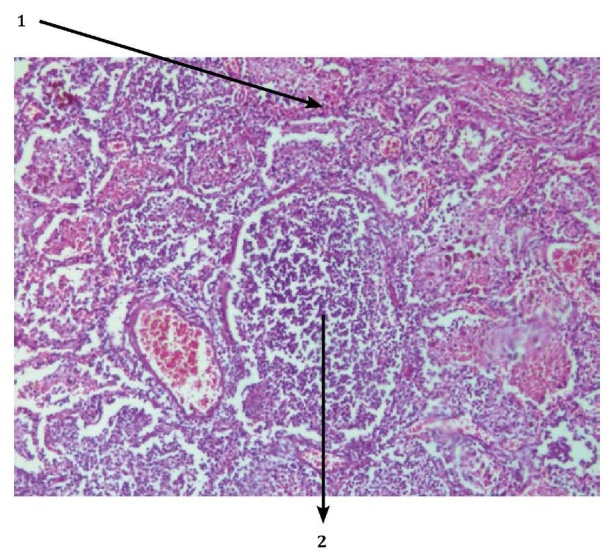
Рисунок 3. Признаки поражения лёгких при COVID-19, осложнённой инфекцией на фоне иммуносупрессии у пациента Б. (материал подготовлен Хоркиной И.Ю). 1 — внутриальвеолярные кровоизлияния, 2 — лейкоциты в стенке и в просвете вены.
Патологоанатомическое заключение
Новая коронавирусная инфекция, вирус идентифицирован, осложнённая тромбозом мелких сосудов лёгких. Вторичная гнойная инфекция, развившаяся на фоне иммуносупрессивной терапии. Гранулематоз с полиангиитом, активность I ст, ANCA (+).
Обсуждение
Постановка диагноза ГПА у данного пациента представляла сложности. Наличие АНЦА-ассоциированного васкулита не вызывало сомнений, но его нозологическую принадлежность было установить достаточно сложно. Интерстициальное поражение лёгких, нефрит, кожный васкулит, гранулематозное воспаление при биопсии слизистой носа могут быть характерными как для ГПА, так и для ЭГПА. С учётом лёгочных инфильтратов в анамнезе, преходящей эозинофилии, рецидивирующего синусита, аллергического ринита как аналога бронхиальной астмы на начальном этапе заболевания был выставлен диагноз «ЭГПА». В литературе имеются сведения о том, что бронхиальная астма не всегда возникает в дебюте заболевания [2]. Но в течение года с момента манифестации заболевания не было зафиксировано никаких проявлений бронхообструктивного синдрома: приступы экспираторной одышки отсутствовали, при спирографии отмечались незначительное снижение ОФВ1 и отрицательный результат бронходилатационного теста. Кроме того, при повторной биопсии слизистой носа не было обнаружено эозинофилии тканей, отсутствовала эозинофилия периферической крови, выявлены антитела к протеиназе-3, имелись характерные изменения в лёгких, поражение верхних дыхательных путей и нефрит в дебюте заболевания, что позволило пересмотреть диагноз с ЭГПА в пользу ГПА.
Основой лечения ЭГПА являются глюкокортикоиды, которые для индукции ремиссии назначают в дозе 0,5–1 мг/кг в пересчете на преднизолон (не более 60 мг), в то время как иммунодепрессанты, в частности циклофосфамид, применяют только при наличии неблагоприятных прогностических факторов (поражение сердца или желудочно-кишечного тракта, тяжёлая периферическая полиневропатия, альвеолярное кровотечение и/или гломерулонефрит) или отсутствии ответа на монотерапию глюкокортикоидами [3]. У пациента не было неблагоприятных прогностических признаков в дебюте заболевания. Единственным проявлением нефрита являлся минимальный мочевой синдром, поэтому назначались ГК внутрь и в режиме пульс-терапии. В связи с неполным эффектом гормональной терапии к лечению добавлены цитостатические препараты. Но повышение уровня трансаминаз не позволило использовать циклофосфамид в полных дозах, в режиме пульс-терапии.
Пересмотр диагноза в пользу ГПА с учётом быстропрогрессирующего течения заболевания с множественным поражением органов и тканей (верхних дыхательных путей, лёгких, почек, кожи, суставов, системы крови) в соответствии с международными рекомендациями по лечению АНЦА-СВ, требовало обязательного назначения внутривенного циклофосфамида или ритуксимаба для индукции ремиссии [4].
Вследствие малой эффективности и плохой переносимости применяемой ранее цитостатической терапии, развития осложнений гормональной терапии было решено инициировать генно-инженерную терапию анти-В-клеточным препаратом РТМ. Больному был введен РТМ 1000 мг с предварительной премедикацией, с кратковременной положительной динамикой.
Выбор тактики лечения активного ГПА в период пандемии коронавирусной инфекции представлял большие сложности. В 2020 г., в самом начале пандемии, были лишь единичные работы, описывающие случаи ведения пациентов с активными формами АНЦА-СВ на фоне инфекции COVID-19. Так, в статье Т.В. Бекетовой с соавт. (2020) был описан случай благоприятного исхода ГПА у пациентки, получающей терапию РТМ в период пандемии COVID-19 [5]. В условиях пандемии коронавирусной инфекции применение цитостатических препаратов, в частности циклофосфамида, у больных с СВ ассоциировалось с высоким риском развития инфекционных осложнений и более предпочтительным представлялось назначение РТМ [6].
По данным проведённых исследований, лечение РТМ часто осложняется нейтропенией, причём это осложнение встречалось чаще у пациентов с АНЦА-СВ, чем у больных ревматоидным артритом (у 23% и 3% пациентов соответственно) [7].
В описанном нами случае развитие нейтропении усугубило течение ГПА, повысило риск развития тяжёлых инфекционных осложнений, потребовало применения комбинированной антибактериальной терапии на фоне увеличения дозы ГК.
На первый план в клинической картине выходило поражение лёгких. Проведение дифференциальной диагностики между интерстициальным поражением лёгких в рамках системного васкулита, коронавирусной инфекции, пневмоцистной пневмонии, туберкулёза, грибкового поражения лёгких на фоне иммуносупрессии представляется весьма трудной задачей. Неоднократные посевы крови, мокроты на стерильность и микобактерии туберкулёза дали отрицательные результаты и позволили исключить сепсис, туберкулёз. Многократно выполненные ПЦР тесты на COVID-19 были отрицательными, но превалирующее поражение лёгких на фоне отсутствия других признаков СВ и мощная иммуносупрессивная терапия делали мысль о инфекционных осложнениях наиболее обоснованной.
Повторное усиление одышки, увеличение объёма поражения лёгких до 75%, снижение SpО2 до 80% в сочетании с нарастанием уровня острофазовых показателей, появлением лимфопении были расценены как аутоиммунное поражение лёгких с развитием повторного «цитокинового шторма» на фоне рецидивирующей коронавирусной инфекции. Отрицательные ПЦР-тесты на COVID-19 могли объясняться тяжёлой иммуносупрессией на фоне длительного применения средних и высоких доз ГК и введения РТМ по поводу СВ.
АНЦА-СВ, в том числе ГПА, несмотря на применение современных методов терапии, продолжают оставаться достаточно тяжёлыми и прогностически неблагоприятными заболеваниями [8]. Даже до пандемии SARS-Cov 2 исследователи сообщали о высоком риске смерти у больных АНЦА-СВ в первый год заболевания [9][10]. Авторы отмечали, что, несмотря на использование современной терапии, риск смерти при АНЦА-СВ в течение года заболевания был в 9 раз выше по сравнению со здоровыми лицами и был обусловлен активностью системного васкулита, тяжёлой вторичной инфекцией, почечной недостаточностью [9]. В доковидную эру наибольшее значение отводилось пневмоцистной инфекции, профилактикой которой служило патогенетически обоснованное назначение сульфаметоксазола/триметоприма [11]. Коронавирусная инфекция «бросила» новый вызов, делая невозможным использовать эффективные препараты для лечения тяжёлых форм АНЦА-ассоциированный васкулитов.
Согласно современным клиническим рекомендациям, необходимо избегать назначения РТМ в период пандемии [12].
На фоне иммуносупрессии присоединение инфекции у больного с поражением лёгких в рамках СВ привело к осложнению в виде развития вирусной пневмонии и запустила «порочный круг» — «инфекция — аутоиммунное воспаление».
В первый раз инфекция поддалась терапии, но запустила активность заболевания, а повторное введение РТМ вызвало нейтропению, не позволившую организму справиться с инфекцией. Повторное заражение COVID 19, LONG – COVID? Вопрос без ответа.
При COVID-19 часто наблюдаются нарушения системы гемостаза, приводящие к тромбозам лёгочных артерий и другим тромботическим осложнениям [13].
Непосредственной причиной смерти, по данным клинического наблюдения и патологоанатомического вскрытия, явилась тяжёлая дыхательная недостаточность вследствие тромбообразования в мелких сосудах лёгких у больного с новой коронавирусной инфекцией и присоединение вторичной бактериальной инфекции на фоне иммуносупрессии.
Выводы
- Своевременная постановка диагноза ГПА определяет не только тактику лечения, но и прогноз заболевания.
- Длительная иммуносупрессия при ГПА (высокие дозы гормональных препаратов, а также назначение анти-В-клеточной генно-инженерной терапии) наряду с прогрессированием ГПА, способствует присоединению вторичной инфекции.
- В условиях пандемии новой коронавирусной инфекции проведение дифференциальной диагностики интерстициальных изменений в лёгких и выбор тактики лечения при АНЦА-СВ с поражением лёгких представляет большие сложности.
- Сочетание ГПА с COVID-19 является неблагоприятным прогностическим фактором, особенно на фоне терапии ритуксимабом.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Jennette JC, Falk RJ, Bacon PA, Basu N, Cid MC, Ferrario F, et al. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum. 2013;65(1):1-11. doi: 10.1002/art.37715
2. Kim MY, Sohn KH, Song WJ, Park HW, Cho SH, Min KU, et al. Clinical features and prognostic factors of Churg-Strauss syndrome. Korean J Intern Med. 2014;29(1):85-95. doi: 10.3904/kjim.2014.29.1.85
3. Groh M, Pagnoux C, Baldini C, Bel E, Bottero P, Cottin V, et al. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss) (EGPA) Consensus Task Force recommendations for evaluation and management. Eur J Intern Med. 2015;26(7):545-53. doi: 10.1016/j.ejim.2015.04.022
4. Бекетова Т.В. Международные рекомендации по лечению АНЦА-ассоциированных системных васкулитов. Современная ревматология. 2019;13(1):19-25. doi: 10.14412/1996-7012-2019-1-19-25
5. Бекетова Т.В., Бланк Л.М., Лила А.М. COVID-19 у пациентки с АНЦА-ассоциированным системным васкулитом, получавшей анти-В-клеточную терапию ритуксимабом. Научно-практическая ревматология. 2020;58(4):456-462. doi: 10.47360/1995-4484-2020-456-462
6. Фролова Н.Ф., Томилина Н.А., Котенко О.Н., Подкорытова О.Л., Исхаков Р.Т., Усатюк С.С., и др. Экулизумаб в лечении АНЦА-ассоциированного васкулита, осложненного Covid-19. Клинические наблюдения. Нефрология и диализ. 2020;22(Спецвыпуск):33-45. doi: 10.28996/2618-9801-2020-Special_Issue-33-45
7. Tesfa D, Ajeganova S, Hägglund H, Sander B, Fadeel B, Hafström I, et al. Late-onset neutropenia following rituximab therapy in rheumatic diseases: association with B lymphocyte depletion and infections. Arthritis Rheum. 2011;63(8):2209-14. doi: 10.1002/art.30427
8. Семенкова Е.Н. Системные некротизирующие васкулиты. М.: Русский врач; 2001.
9. Luqmani R, Suppiah R, Edwards CJ, Phillip R, Maskell J, Culliford D, et al. Mortality in Wegener's granulomatosis: a bimodal pattern. Rheumatology (Oxford). 2011;50(4):697-702. doi: 10.1093/rheumatology/keq351
10. Little MA, Nightingale P, Verburgh CA, Hauser T, De Groot K, Savage C, et al. Early mortality in systemic vasculitis: relative contribution of adverse events and active vasculitis. Ann Rheum Dis. 2010;69(6):1036-43. doi: 10.1136/ard.2009.109389
11. Stegeman CA, Tervaert JW, de Jong PE, Kallenberg CG. Trimethoprim-sulfamethoxazole (co-trimoxazole) for the prevention of relapses of Wegener's granulomatosis. Dutch Co-Trimoxazole Wegener Study Group. N Engl J Med. 1996;335(1):16-20. doi: 10.1056/NEJM199607043350103
12. Насонов Е.Л., Лила А.М., Мазуров В.И., Белов Б.С., Каратеев А.Е., Дубинина Т.В., и др. Коронавирусная болезнь 2019 (COVID-19) и иммуновоспалительные ревматические заболевания. Рекомендации Общероссийской общественной организации «Ассоциация ревматологов России». Научно-практическая ревматология. 2021;59(3):239-254. doi: 10.47360/1995-4484-2021-239-254
13. Tang N, Li D, Wang X, Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020;18(4):844-847. doi: 10.1111/jth.14768
Об авторах
Н. М. НикитинаРоссия
Никитина Наталья Михайловна, д. м. н., профессор кафедры госпитальной терапии лечебного факультета
Саратов
О. Л. Александрова
Россия
Александрова Ольга Леонидовна, к. м. н., ассистент кафедры госпитальной терапии лечебного факультета
Саратов
Н. А. Магдеева
Россия
Магдеева Надежда Анатольевна, к. м. н., доцент кафедры госпитальной терапии лечебного факультета
Саратов
И. Ф. Мелехина
Россия
Мелехина Ирина Федоровна, заведующая ревматологическим отделением
Саратов
Н. В. Пасечная
Россия
Пасечная Наталия Вячеславовна, врач ревматолог ревматологического отделения
Саратов
Рецензия
Для цитирования:
Никитина Н.М., Александрова О.Л., Магдеева Н.А., Мелехина И.Ф., Пасечная Н.В. Сочетание гранулематоза с полиангиитом с COVID-19: трудности дифференциальной диагностики и лечения. Южно-Российский журнал терапевтической практики. 2022;3(4):107-115. https://doi.org/10.21886/2712-8156-2022-3-4-107-115
For citation:
Nikitina N.M., Aleksandrova O.L., Magdeeva N.A., Melekhina I.F., Pasechnaya N.V. Combination of granulomatosis with polyangiitis with COVID-19: difficulties in differential diagnosis and treatment. South Russian Journal of Therapeutic Practice. 2022;3(4):107-115. (In Russ.) https://doi.org/10.21886/2712-8156-2022-3-4-107-115
JATS XML


























