Перейти к:
Некоторые итоги пилотного исследования мутаций в генах ASXL1 и DNMT3A при миелодиспластическом синдроме
https://doi.org/10.21886/2712-8156-2023-4-1-97-105
Аннотация
Цель: определить распространённость мутации c.1934dupG в гене ASXL1 и мутации R882H в гене DNMT3A при миелодиспластическом синдроме и их влияние на значимые клинические характеристики. Материалы и методы: в исследование были включены 33 мужчины и 17 женщин с медианным возрастом 57 лет (18–83) и верифицированным диагнозом миелодиспластического синдрома. В качестве контроля были взяты 22 добровольца без гематологической патологии, (8 мужчин, 14 женщин, от 22 до 65 лет). Во всех исследуемых группах было проведено ПЦР-исследование венозной крови с целью детекции мутаций c.1934dupG и R882H с помощью адаптированных способов анализа эффективности амплификации и рестрикционной аллель-специфической ПЦР с референсным секвенированием по Сенгеру. Результаты: мутация R882H не была обнаружена ни в одной из исследуемых групп. Мутация c.1934dupG не была обнаружена у лиц без гематологической патологии. Из-за недостатка концентрации выделенной ДНК из клеток венозной крови не удалось произвести анализа эффективности амплификации у 7 пациентов. Мутация c.1934dupG была обнаружена у 46% пациентов и встречается во всех группах риска по шкале IPSS-R, WPSS и MDS-CI. Не найдено различий при анализе выживаемости при наличии и отсутствии мутации c.1934dupG. Выводы: исследование показало, что разработанный способ по детекции мутации c.1934dupG в клетках венозной крови позволяет совершить оптимизацию молекулярно-генетической диагностики. Ограничением для проведения адаптированных анализов эффективности амплификации и рестрикционного анализа являлась степень лейкопении крови. Не было обнаружено влияния мутации c.1934dupG на клиническое течение миелодиспластического синдрома при сравнении некоторых твёрдых и суррогатных конечных точек исследования.
Для цитирования:
Липилкин П.В., Кулаева Е.Д., Рябикина Е.В., Дегтерева Е.В., Шатохин Ю.В. Некоторые итоги пилотного исследования мутаций в генах ASXL1 и DNMT3A при миелодиспластическом синдроме. Южно-Российский журнал терапевтической практики. 2023;4(1):97-105. https://doi.org/10.21886/2712-8156-2023-4-1-97-105
For citation:
Lipilkin P.V., Kulaeva E.D., Ryabikina E.V., Degtereva E.V., Shatokhin Yu.V. Some results of a pilot study of mutations in ASXL1 and DNMT3A genes in myelodysplastic syndrome. South Russian Journal of Therapeutic Practice. 2023;4(1):97-105. (In Russ.) https://doi.org/10.21886/2712-8156-2023-4-1-97-105
Введение
Мутации эпигенетических регуляторов c.1934dupG в гене ASXL1 (мутация c.1934dupG) и R882H в гене DNMT3A (мутация R882H) при миелодиспластическом синдроме (МДС) являются ассоциированными с плохим прогнозом общей 5-тилетней выживаемости, а также повышают риск трансформации МДС в острый миелоидный лейкоз (ОМЛ) [1–3].
Мета-анализ Yun Lin и соавт., охватывающий 1689 пациентов, установил следующие данные МДС при разных мутациях в гене ASXL1 [4]:
- Различие в общей выживаемости пациентов обусловлено не наличием мутаций в гене ASXL1, а коморбидностью и местом проживания.
- Мутации в гене ASXL1 чаще встречались у мужчин в старческом возрасте и у пациентов со сравнительно низким уровнем тромбоцитов или гемоглобина.
Подобные исследования помогают анализировать влияние мутаций в гене ASXL1 при МДС, но их главным ограничением является отсутствие анализа доминирующей мутации. То есть анализу при помощи технологий секвенирования подвергаются разные мутации гена ASXL1, в то время как в клинической практике на сегодня невозможно проводить подобные молекулярно-генетические исследования всем пациентам с МДС. При этом наиболее частые мутации ASXL1 обнаружены в экзоне 12, а самой распространённой из них является дублирование гуанина в положении 1934 в области 8G-гомополимера (обозначается как «c.1934dupG; p.Gly646fs») [5–7]. Мутация c.1934dupG является самой частой в ASXL1 согласно базе данных Catalogue Of Somatic Mutations In Cancer (COSMIC) и исследованию Wang L. и соавт., включающему 6043 пациентов с гематологическими новообразованиями [8].
Мутация R882H является одной из наиболее распространённых при гемобластозах взрослых [9][10], есть данные о её негативной роли в патогенезе МДС [11]. Но на сегодня до конца не исследованы особенности клинического течения МДС при наличии мутации c.1934dupG и/или мутации R882H. Например, нет данных о зависимости этих генетических нарушений с группами риска по числовым прогностическим шкалам МДС (IPSS-R, WPSS) [12][13], фиброзом костного мозга, экспрессией CD34+, CD13/CD16, трансфузионной зависимостью и коморбидностью. Но именно такие клинические характеристики МДС достоверно предопределяют не только прогноз выживаемости или риск трансформации в ОМЛ, но и качество жизни пациента.
Цель исследования — определить распространённость мутации c.1934dupG и мутации R882H при МДС и их влияние на значимые клинические характеристики.
Материалы и методы
В исследование были включены 33 мужчины и 17 женщин с медианным возрастом 57 лет (18–83) и верифицированным диагнозом МДС, поступившие на лечение с сентября 2019 г. по июнь 2022 г. в ФГБОУ ВО РостГМУ Минздрава России и МБУЗ «Городская больница №7 г. Ростова-на-Дону». В качестве контроля были взяты 22 добровольца без гематологической патологии (8 мужчин, 14 женщин от 22 до 65 лет).
Научная работа одобрена Локальным независимым этическим комитетом на базе ФГБОУ ВО РостГМУ Минздрава России (протокол №14/20 от 21.09.2020).
Участники исследования проживали в Южном федеральном округе (Ростовская область, Краснодарский край, Республика Крым) и Северо-Кавказском федеральном округе (Ставропольский край, Кабардино-Балкарская Республика, Республика Дагестан, Республика Ингушетия, Чеченская Республика, Карачаево-Черкесская Республика). Все пациенты получали диагностику и лечение в соответствии с актуальными клиническими рекомендациями и действующими стандартами оказания медицинской помощи больным с МДС (Приказ Министерства здравоохранения РФ от 14 ноября 2007 г. № 704).
Пациенты на момент включения в исследование либо уже имели верифицированный диагноз МДС (n=11), либо это был впервые выявленный случай (n=39). Критерием для включения пациента в исследование был проведённый объём диагностических исследований, позволяющий определить вариант МДС — общий клинический анализ крови в гематологическом анализаторе с визуальным подсчётом форменных элементов крови, миелограмма с подсчётом бластов костного мозга и оценкой дисплазии, цитогенетическое исследование клеток костного мозга по выявлению изолированной аномалий кариотипа в виде утраты участка длинного плеча хромосомы 5 (5q). Также было обязательно соблюдение минимальных диагностических критериев МДС: цитопения при стойком снижении гематологических показателей ниже пороговых значений: гемоглобин крови менее 100 г/л; абсолютное число нейтрофилов менее 1,8×109 /л и/или тромбоцитов менее 100×109/л.
Источником клинических данных послужили данные из историй болезней (табл. 1). Все использованные в исследовании результаты лабораторных анализов проводились пациентам на 1–2-е сутки пребывания на стационарном лечении.
Таблица 1
Характеристика пациентов с МДС (n=50)
Характеристика | Число пациентов, абс. | Относительный показатель, % | Медиана [мин. значение/макс. значение] |
Возраст, лет | |||
<65 | 30 | 60 | 57 [ 18-83] |
≥65 | 20 | 40 | |
Пол | |||
Мужчин | 33 | 66 | |
Женщин | 17 | 34 | |
Эритроциты, абс. × 1012/л | |||
Больше 3,8 | 3 | 6 | 2,76 [ 0,1-3,95] |
Меньше 3,8 | 47 | 94 | |
Гемоглобин, г/л | |||
Больше 100 | 18 | 36 | 90 [ 26-156] |
Меньше 100 | 42 | 84 | |
Сегментоядерные лейкоциты, абс. × 109/л | |||
Больше 1,8 | 19 | 38 | 1,7 [ 0,1-3,5] |
Меньше 1,8 | 31 | 62 | |
Тромбоциты, абс. × 109/л | |||
Больше 100 | 16 | 32 | 89 [ 8-494] |
Меньше 100 | 34 | 68 | |
Бласты в периферической крови, абс. | |||
≥1 | 21 | 42 | 1 [ 0-11] |
<1 | 29 | 58 | |
Палочки Ауэра | |||
Есть | 1 | 2 | |
Нет | 49 | 98 | |
Бласты костного мозга, % | |||
0-5 | 31 | 62 | 7,8 [ 0-21] |
6%-9 | 6 | 12 | |
более 10 | 13 | 26 | |
Лактатдегидрогеназа общая, ед./л | |||
131-460 | 29 | 58 | 438 [ 189-1264] |
>460 | 21 | 42 | |
Трансфузионная зависимость (регулярная) | |||
Одна или более трансфузия донорских эритроцитов каждые 8 недель на протяжении 4 месяцев | 12 | 24 | 2 [ 0-13] |
Менее одной или отсутствие трансфузий донорских эритроцитов каждые 8 недель на протяжении 4 месяцев | 38 | 76 | |
Были определены нозологические варианты МДС согласно классификации ВОЗ от 2017 года (табл. 2).
Таблица 2
Распределение пациентов по вариантам МДС по классификации ВОЗ 2017 г. (n=50)
Вариант МДС | Число пациентов, абс. |
с линейной дисплазией | 9 |
с мультилинейной дисплазией | 16 |
c изолированной делецией 5q | 3 |
с избытком бластов I типа | 10 |
с избытком бластов II типа | 11 |
с кольцевыми сидеробластами | 1 |
В исследование были включены оценки по прогностическим шкалам IPSS-R, WPSS и MDS-CI (шкала коморбидности для больных МДС) [14] (табл. 3), которые позволяют определить индивидуальный прогноз выживаемости и трансформации МДС в ОМЛ.
Таблица 3
Распределение пациентов по группам риска шкал IPSS-R, WPSS и MDS-CI (n=50)
Шкала | Группа риска | |
Очень низкая/низкая группы риска, абс. | Промежуточная/высокая/очень высокая группы риска, абс. | |
IPSS-R | 20 | 30 |
WPSS | 11 | 39 |
MDS-CI | 11 | 39 |
За период наблюдения за пациентами (34 месяца) было зарегистрировано 10 летальных исходов и 15 случаев трансформации в ОМЛ.
У всех участников исследования был произведён забор крови в вакуумные пробирки с ЭДТА-К3 объёма 9 мл. Забор крови у пациентов производился на 1–4-е сутки пребывания на стационарном лечении. Далее вакуумные пробирки с венозной кровью в течение 1 часа помещались на хранение в низкотемпературную морозильную камеру UF V 700 (Binder, Германия) при температуре от -72 до -76 ℃ или сразу отправлялись на процедуру выделения ДНК.
Выделение ДНК из образцов клеток периферической крови проводили с помощью наборов «ДНК-ЭКСТРАН-1» (Синтол, Россия) и ExtractDNA Blood&Cells (Евроген, Россия) по протоколам производителей.
Было проведено ПЦР-исследование всех образцов ДНК по детекции мутации c.1934dupG и мутации R882H с помощью адаптированных и доработанных способов анализа эффективности амплификации и рестрикционного анализа с референсным секвенированием по Сенгеру (табл. 4). Секвенирование проводилось в научной лаборатории «Идентификация объектов биологического происхождения» Академии биологии и биотехнологии Южного федерального университета.
Таблица 4
Оптимизация дизайна праймеров для определения мутации c.1934dupG и мутации R882H
Определяемая мутация и метод | Праймеры | Результат |
R882H (рестрикционный анализ) | F: 5´-GTGATCTGAGTGCCGGGTTG-3´ R: 5´-TCTCTCCATCCTCATGTTCTTG-3´ | Неспецифический отжиг* |
F: 5´-GGTCCTGCTGTGTGGTTAGA-3´ R: 5´-GTCCCTTACACACACGCAAA-3´ | Есть детекции | |
c.1934dupG (анализа эффективности амплификации) | F (8G-праймер): 5’-CGATCGGAGGGGGGGGT-3’ F (9G-праймер): 5’-CGATCGGAGGGGGGGGGT-3’ общий R-праймер: 5’-AGCTCTGGACATGGCAGTTC-3’ | Есть детекции (высокая вероятность самокомплементарности с 3’ конца) |
общий оптимизированный R-праймер: 5’-TGACGTACACTTTCCAGGGG-3’ | Есть детекции (низкая вероятность самокомплементарности с 3’ конца) | |
c.1934dupG (секвенирование) | F: 5´-TTGATTCTGTATGCCATGACCCT-3´ R: 5´- GGCATCTCCTAGCCCATCTG-3´ | Неспецифический отжиг* |
F: 5´- CAGGACCCTCGCAGACATTA -3´ R: 5´- GCATCTCCTAGCCCATCTGT-3´ | Есть детекции |
Анализ выживаемости производился методом Каплан-Майер. Производился расчёт относительного риска (ОР), хи-квадрат и корреляции Пирсона. Значимыми считались различия на уровне p<0,05. Статистическая обработка данных проводилась c применением пакета программ Graphpad Prism, а также в пакетах Survival и Survminer (для языка программирования R v. 4.2.1).
Результаты
Мутация R882H не была обнаружена в исследуемых образцах. Мутация c.1934dupG не была обнаружена у лиц без гематологической патологии. Из-за низкой концентрации выделенной ДНК из клеток венозной крови (<5 нг/мкл), не удалось произвести ПЦР-исследование у 7 пациентов (табл. 5).
Таблица 5
Результаты определения мутации c.1934dupG и мутации R882H (n=43)
Вариант МДС | Число ПЦР-исследований, абс. | Число обнаруженной мутации c.1934dupG, абс. | Число обнаруженной мутации R882H, абс | % и ошибка показателя (m) |
МДС с унилинейной дисплазией | 7 | 4 | 0 | 57±18,7 |
МДС с мультилинейной дисплазией | 13 | 8 | 61±13,49 | |
МДС с 5q | 3 | 2 | 67±27,22 | |
МДС с избытком бластов I типа | 8 | 6 | 75±15,31 | |
МДС с избытком бластов II типа | 11 | 7 | 63±14,5 | |
МДС с кольцевыми сидеробластами | 1 | 1 | 100 |
Для оценки разработанного диагностического теста по идентификации мутации c.1934dupG был произведён расчёт чувствительности и специфичности (табл. 6).
Таблица 6
Расчёт чувствительности и специфичности диагностического теста по идентификации мутации c.1934dupG
Результат | Число пациентов, абс. |
Истинно-положительный результат — обнаружена мутация c.1934dupG при МДС | 28 |
Ложно-отрицательный результат — не обнаружена мутация c.1934dupG при МДС | 15 |
Ложно-положительный результат — мутация c.1934dupG в контрольной группе | 0 |
Истинно-отрицательный результат — респонденты контрольной группы | 22 |
Данные чувствительности, специфичности и прогностической ценности положительного и отрицательного результата теста, % | |
Чувствительность | 65,12 |
Специфичность | 100 |
Прогностическая ценность положительного теста | 100 |
Прогностическая ценность отрицательного теста | 59,46 |
Мутация c.1934dupG обнаружена у 28 мужчин и 8 женщин (хи-квадрат — 4,760; p=0,03). Медиана возраста пациентов без мутации 56 лет (18-82), а с мутацией — 56,5 (32–81).
Анализ распределения мутации c.1934dupG по группам риска шкал IPSS-R, WPSS, MDS-CI показал, что она обнаруживается во всех группах (табл. 7).
Таблица 7
Распределение мутации c.1934dupG по группам риска шкал IPSS-R, WPSS, MDS-CI
Мутация c.1934dupG | Числовые прогностические шкалы | |||||
IPSS-R | WPSS | MDS-CI | ||||
Очень низкая/низкая группы риска, абс. | Промежуточная/высокая/очень высокая группы риска, абс. | Очень низкая/низкая группы риска, абс. | Промежуточная/высокая/очень высокая группы риска, абс. | Низкая/ Промежуточная | Высокая | |
Обнаружена | 11 | 17 | 6 | 22 | 22 | 6 |
Отсутствует | 4 | 11 | 3 | 12 | 15 | 0 |
Различия между группами, p-значение | 0,408 | 0,9 | 0,054 | |||
Были построены корреляционные матрицы по методу Спирмена, включающие в себя номинативные показатели (гемоглобин крови <80 г/л, наличие бластов в периферической крови, бластоз костного мозга ≥5%, наличие мутации c.1934dupG, фиброз костного мозга, трансфузионная зависимость, лактатдегидрогеназа в сыворотке крови >450 Ед/л, экспрессия CD34+ и CD13/CD16) и количественные показатели (возраст). Корреляционные матрицы представлены на рисунке 1.
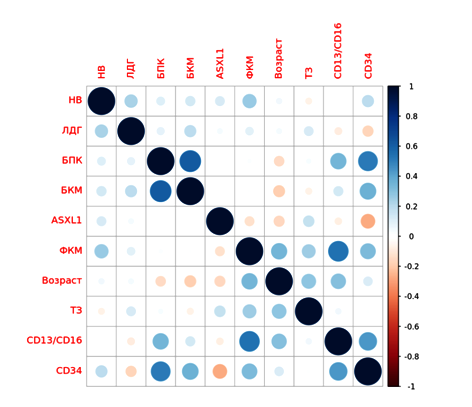
Рисунок 1. Корреляционная матрица, основанная на корреляции Пирсона
Примечание: HB — гемоглобин крови <80 г/л, ЛДГ — лактатдегидрогеназа в сыворотке крови >450 Ед/л, БПК — наличие бластов в периферической крови, БКМ — бластоз костного мозга ≥5%, ASXL1 — наличие мутации c.1934dupG, ФКМ — фиброз костного мозга, ТЗ — трансфузионная зависимость, CD34 — экспрессия CD34+, CD13/CD16 — экспрессия CD13/CD16 и количественный показатель (возраст).
Для мутации c.1934dupG наблюдается слабая отрицательная корреляция с экспрессией CD34+ и возрастом; сильная положительная корреляция наблюдается между экспрессией CD34+ и бластозом костного мозга ≥5%, фиброзом костного мозга и экспрессией CD13/CD16, бластозом костного мозга ≥5% и наличием бластов в периферической крови.
Анализ общей выживаемости в зависимости от наличия и отсутствия мутации c.1934dupG (рис. 2), показал, что выживаемость между группами пациентов не различается (p=0,92). Доля летальных случаев с наличием мутации c.1934dupG составила 17±7%, без мутации — 27±11% (ОР 0,821, 95% ДИ 0,438–1540).
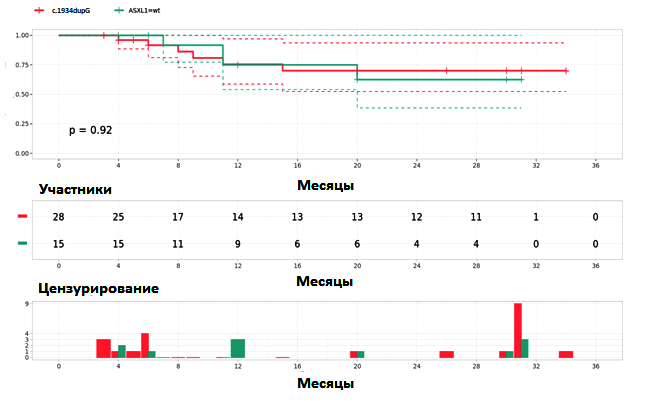
Рисунок 2. Результаты анализа общей выживаемости при МДС в зависимости от наличия и отсутствия мутации c.1934dupG методом Каплан-Майер (n=43)
OР трансфузионной зависимости при наличии мутации c.1934dupG составил 2,844 (95% ДИ 0,502–16,098, p>0,05), а трансформации в ОМЛ — 1,467 (95% ДИ 0,351–6,131, p>0,05).
Для подтверждения отсутствия мутации R882H 5 случайных образцов из выборки были секвенированы по Сэнгеру (выровненные с помощью программы BioEdit нуклеотидные последовательности области рядом с мутацией показаны на рисунке 3). В результате ни один из ампликонов не продемонстрировал наличие мутации, что подтверждает данные, полученные при использовании рестрикционного анализа.

Рисунок 3. Вид последовательностей в BioEdit. Желтым выделен рестрикционный сайт, красным — гуанин, который в случае мутации заменяется на аденин
Для подтверждения наличия или отсутствия мутации c.1934dupG 2 случайных образца из выборки (9 и 16, оба образца продемонстрировали наличие мутации по результатам анализа эффективности амплификации) были секвенированы по Сэнгеру. Хроматограммы секвенирования представлены на рисунке 4. В результате оба ампликона продемонстрировали наличие пика, свидетельствующего о низкокопийной мутации c.1934dupG.
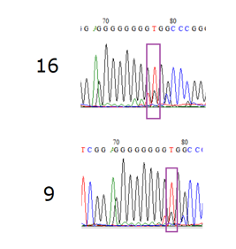
Рисунок 4. Хроматограммы секвенирования участка гена ASXL1 в двух образцах (9 и 16). Пик черного цвета под красным пиком — низкокопийная мутация c.1934dupG, представляющая собой вставку дополнительного гуанина в 8-гуаниновый участок.
Обсуждение
Мутация R882H не была обнаружена во всех исследуемых группах. Такой результат может быть обусловлен несколькими факторами (ограниченная выборка, этнографические особенности участников, наличие или отсутствие мутации в разные временные периоды МДС, ложноотрицательными результатами детекции). Недостаточный объём выборки, видимо, сыграл наибольшую роль в неуспешной детекции мутации R882H.
Исследование наличия мутации c.1934dupG при МДС впервые интерпретировано с применением рутинного ПЦР-исследования. Данный способ позволяет совершить оптимизацию молекулярно-генетической диагностики, заменив технологии секвенирования в клинической практике. Разработанный способ по детекции мутации c.1934dupG идентифицировал её в 56±7% случаев МДС с наибольшей вероятностью у пациентов с избытком бластов I типа (75±15,31%).
У способов детекции мутаций c.1934dupG и R882H было выявлено общее ограничение. Из-за лейкопении (число лейкоцитов ≤2,81×109/л) не представилось возможным получить достаточную концентрацию ДНК (≥5 нг/мкл) для дальнейшего проведения анализа эффективности амплификации или рестрикционного анализа.
Полученные данные детекции свидетельствуют о том, что мутация c.1934dupG может быть обнаружена не только в разных вариантах МДС, но и в разных группах риска численных прогностических шкал WPSS, IPSS-R и MDS-CI. Можно предположить, что мутация c.1934dupG нетождественно интерпретируется существующими численными прогностическими шкалами МДС с точки зрения установленного при помощи них значения риска.
Общая выживаемость не различалась в зависимости от наличия и отсутствия мутации c.1934dupG. Не было обнаружено, что мутация c.1934dupG повышает риск трансфузионной зависимости или трансформации МДС в ОМЛ, которые являются важными факторами для прогноза клинического течения и качества жизни пациентов. Схожие результаты продемонстрированы корреляционным анализом, где наличие у пациентов мутации c.1934dupG было статистически независимо от наличия фиброза костного мозга, бластов в периферической крови, высокой степени бластоза костного мозга, высоким уровнем лактатдегидрогеназы и экспрессией CD34+, CD13/CD16.
Таким образом, в пилотном исследовании не подтверждены данные, что мутация c.1934dupG повышает риск тяжёлого течения МДС. При этом клиническая интерпретация мутации R882H осталась невозможной, что ограничивает перспективу дальнейшего изучения этой мутации при МДС и ставит задачу поиска других значимых соматических мутаций или включением в исследования большего числа респондентов.
Выводы
Исследование показало, что разработанный способ по детекции мутации c.1934dupG в клетках венозной крови позволяет совершить оптимизацию молекулярно-генетической диагностики. Ограничением для проведения адаптированных анализов эффективности амплификации и рестрикционного анализа являлась степень лейкопении крови. Не было обнаружено влияния мутации c.1934dupG на клиническое течение МДС при сравнении некоторых твёрдых и суррогатных конечных точек исследования.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Pati H, Kundil Veetil K. Myelodysplastic Syndrome/ Myeloproliferative Neoplasm (MDS/MPN) Overlap Syndromes: Molecular Pathogenetic Mechanisms and Their Implications. Indian J Hematol Blood Transfus. 2019;35(1):3-11. doi: 10.1007/s12288-019-01084-y
2. Heuser M, Yun H, Thol F. Epigenetics in myelodysplastic syndromes. Semin Cancer Biol. 2018;51:170-179. doi: 10.1016/j.semcancer.2017.07.009
3. Ganguly BB, Kadam NN. Mutations of myelodysplastic syndromes (MDS): An update. Mutat Res Rev Mutat Res. 2016;769:47-62. doi: 10.1016/j.mrrev.2016.04.009
4. Lin Y, Zheng Y, Wang ZC, Wang SY. Prognostic significance of ASXL1 mutations in myelodysplastic syndromes and chronic myelomonocytic leukemia: A meta-analysis. Hematology. 2016;21(8):454-461. doi: 10.1080/10245332.2015.1106815
5. Gelsi-Boyer V, Brecqueville M, Devillier R, Murati A, Mozziconacci MJ, Birnbaum D. Mutations in ASXL1 are associated with poor prognosis across the spectrum of malignant myeloid diseases. J Hematol Oncol. 2012;5:12. doi: 10.1186/1756-8722-5-12
6. Katoh M. Functional and cancer genomics of ASXL family members. Br J Cancer. 2013;109(2):299-306. doi: 10.1038/ bjc.2013.281
7. Montes-Moreno S, Routbort MJ, Lohman EJ, Barkoh BA, Kanagal-Shamanna R, Bueso-Ramos CE, et al. Clinical molecular testing for ASXL1 c.1934dupG p.Gly646fs mutation in hematologic neoplasms in the NGS era. PLoS One. 2018;13(9):e0204218. doi: 10.1371/journal.pone.0204218
8. Wang L, Birch NW, Zhao Z, Nestler CM, Kazmer A, Shilati A, et al. Epigenetic targeted therapy of stabilized BAP1 in ASXL1 gain-of-function mutated leukemia. Nat Cancer. 2021;2(5):515-526. doi: 10.1038/s43018-021-00199-4
9. Walter MJ, Ding L, Shen D, Shao J, Grillot M, McLellan M, et al. Recurrent DNMT3A mutations in patients with myelodysplastic syndromes. Leukemia. 2011;25(7):1153-1158. doi: 10.1038/ leu.2011.44
10. Xu F, Wu LY, He Q, Wu D, Zhang Z, Song LX, et al. Exploration of the role of gene mutations in myelodysplastic syndromes through a sequencing design involving a small number of target genes. Sci Rep. 2017;7:43113. doi: 10.1038/srep43113
11. Xu Y, Li Y, Xu Q, Chen Y, Lv N, Jing Y, et al. Implications of mutational spectrum in myelodysplastic syndromes based on targeted next-generation sequencing. Oncotarget. 2017;8(47):82475-82490. doi: 10.18632/oncotarget.19628
12. Greenberg PL, Tuechler H, Schanz J, Sanz G, Garcia-Manero G, Solé F, et al. Revised international prognostic scoring system for myelodysplastic syndromes. Blood. 2012;120(12):2454- 2465. doi: 10.1182/blood-2012-03-420489
13. Malcovati L, Della Porta MG, Strupp C, Ambaglio I, Kuendgen A, Nachtkamp K, et al. Impact of the degree of anemia on the outcome of patients with myelodysplastic syndrome and its integration into the WHO classification-based Prognostic Scoring System (WPSS). Haematologica. 2011;96(10):1433- 1440. doi: 10.3324/haematol.2011.044602
14. Della Porta MG, Malcovati L, Strupp C, Ambaglio I, Kuendgen A, Zipperer E. Risk stratification based on both disease status and extra-hematologic comorbidities in patients with myelodysplastic syndrome. Haematologica. 2011; 96(3):441- 9. doi: 10.3324/haematol.2010.033506
Об авторах
П. В. ЛипилкинРоссия
Липилкин Павел Викторович, старший преподаватель кафедры «Биология и общая патология»
Ростов-на-Дону
Е. Д. Кулаева
Кулаева Елизавета Дмитриевна, лаборант-исследователь, научно-исследовательская лаборатория кафедры генетики «Биология развития и организации генома», НИИ биологии
Ростов-на-Дону
Е. В. Рябикина
Рябикина Елена Витальевна, к.м.н., доцент кафедры гематологии и трансфузиологии (с курсом клинической лабораторной диагностики, генетики и лабораторной генетики)
Ростов-на-Дону
Е. В. Дегтерева
Дегтерева Елена Валентиновна, к.м.н., доцент кафедры гематологии и трансфузиологии (с курсом клинической лабораторной диагностики, генетики и лабораторной генетики)
Ростов-на-Дону
Ю. В. Шатохин
Шатохин Юрий Васильевич, д.м.н., профессор кафедры гематологии и трансфузиологии (с курсом клинической лабораторной диагностики, генетики и лабораторной генетики)
Ростов-на-Дону
Рецензия
Для цитирования:
Липилкин П.В., Кулаева Е.Д., Рябикина Е.В., Дегтерева Е.В., Шатохин Ю.В. Некоторые итоги пилотного исследования мутаций в генах ASXL1 и DNMT3A при миелодиспластическом синдроме. Южно-Российский журнал терапевтической практики. 2023;4(1):97-105. https://doi.org/10.21886/2712-8156-2023-4-1-97-105
For citation:
Lipilkin P.V., Kulaeva E.D., Ryabikina E.V., Degtereva E.V., Shatokhin Yu.V. Some results of a pilot study of mutations in ASXL1 and DNMT3A genes in myelodysplastic syndrome. South Russian Journal of Therapeutic Practice. 2023;4(1):97-105. (In Russ.) https://doi.org/10.21886/2712-8156-2023-4-1-97-105
JATS XML


























