Перейти к:
Сравнительный анализ метаболических и структурных изменений в скелетных мышцах и миокарде крыс на фоне длительного введения симвастатина
https://doi.org/10.21886/2712-8156-2023-4-2-80-86
Аннотация
Цель: провести сравнительный анализ динамики изменения конечных продуктов гликолиза и изоформного состава гигантского белка (титина и небулина) в скелетной и сердечной мышцах животных с гиперхолестеринемией (ГХ) на фоне длительного введения симвастатина. Материалы и методы: исследование проводилось на крысах, которых в течение трёх месяцев содержали на высокожировом и высокоуглеводном рационе. После подтверждения ГХ животных разделили на группы: I группа получала только экспериментальный рацион; II группа два месяца получала симвастатин в виде водной суспензии из расчета 0,012 г/кг массы животного один раз в сутки. Контрольная группа животных, содержалась на общем рационе вивария. Результаты: формирование ГХ сопровождалось накоплением пирувата и молочной кислоты как в миокарде, так и в мышечной ткани. Выявленные метаболические изменения отражают структурные нарушения и свидетельствуют о формировании гипоксии. На фоне введения симвастатина как в миокарде, так и в скелетной мускулатуре отмечено уменьшение уровня пирувата и молочной кислоты и приближение этих показателей к значениям контрольной группы. Такие изменения отражают тенденцию к восстановлению интеграции внутриклеточных метаболических процессов. Однако при исследовании белков титина и небулина на фоне применения симвастатина как в миокарде, так и в скелетных мышцах были отмечены структурные изменения: накопление протеолитического Т-фрагмента, снижение содержания изоформ интактного титина. Также статин-индуцированные структурные нарушения были выявлены в более ранних исследованиях биоптатов мышечной ткани крыс. Заключение: проведённое сравнительное исследование наглядно демонстрирует, что миокард наряду со скелетной мускулатурой является органом-мишенью токсического действия статинов. Исходя из этого данные, полученные в результате исследования, важно учитывать при фармакотерапии статинами.
Для цитирования:
Белоусова Е.С., Микашинович З.И., Виноградова Е.В., Лосева Т.Д. Сравнительный анализ метаболических и структурных изменений в скелетных мышцах и миокарде крыс на фоне длительного введения симвастатина. Южно-Российский журнал терапевтической практики. 2023;4(2):80-86. https://doi.org/10.21886/2712-8156-2023-4-2-80-86
For citation:
Belousova E.S., Mikashinovich Z.I., Vinogradova E.V., Loseva T.D. Comparative analysis of metabolic and structural changes in the skeletal muscles and myocardium of rats on the background of long-term administration of simvastatin. South Russian Journal of Therapeutic Practice. 2023;4(2):80-86. (In Russ.) https://doi.org/10.21886/2712-8156-2023-4-2-80-86
Введение
На сегодняшний день практически во всех странах мира отмечается тенденция к «старению» населения. Как следствие, на первое место выходят заболевания сердечно-сосудистой системы, основным фактором риска которых являются дислипидемии [1]. Наиболее эффективными лекарственными препаратами для коррекции данной патологии признаны структурные ингибиторы фермента 3-гидрокси-3-метилглутарил-кофермента А-редуктазы «статины» [2]. Доказано, что данный класс лекарственных средств эффективно снижает ХС ЛНП и увеличивает процент выживаемости в группах пациентов с сердечно-сосудистыми заболеваниями, независимо от пола и возраста [3].
Согласно рекомендациям ВОЗ, статины являются обязательным компонентом терапии ишемической болезни сердца с высоким риском развития инфаркта миокарда и других осложнений [4].
Применение статинов в клинической практике осложнено наличием токсического действия на скелетную мускулатуру и печень. Исследованию патогенетических механизмов токсического влияния статинов на органы-мишени посвящено большое количество экспериментальных и клинических исследований.
Миокард является особой разновидностью мышечной ткани, имеющей ряд структурно-функциональных особенностей. В литературе имеется незначительное количество работ, посвященных изучению молекулярных изменений в миокарде при длительном приеме статинов [5]. Можно полагать, что дальнейший анализ этих изменений и выявление общих закономерностей патобиохимических изменений в скелетной мускулатуре и миокарде позволит существенно расширить понимание патогенеза статиновой миопатии и оптимизировать схемы терапии статинами.
Цель исследования — проведение сравнительного анализа динамики изменения конечных продуктов гликолиза и изоформного состава гигантского белка (титина и небулина) в скелетной и сердечной мышцах животных с экспериментальной гиперхолестеринемией на фоне длительного введения симвастатина.
Материалы и методы
Для проведения исследования был взят гиполипидемический препарат симвастатин (Zocor®). В эксперименте использовали 105 беспородных крыс-самцов (возраст 12–14 месяцев, масса 300–350 г). При содержании животных руководствовались правилами СП 2.2.1.3218-14 «Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)» от 29.08.2014.
Животных в течение трёх месяцев содержали на рационе с повышенным количеством животных жиров (топлённое сливочное масло) и легко усваиваемых углеводов (тростниковый сахар, манная крупа) [6]. Через три месяца крыс разделили на две группы: I группа — 35 крыс, которые получали только экспериментальный рацион, II группа — 35 крыс, которые получали в течение двух месяцев симвастатин (Zocor, 20 мг) из расчета 0,012 г/ кг массы животного один раз в сутки. Данный лекарственный препарат вводили в виде водной суспензии через пищеводный зонд, что приводило к развитию у животных статин-индуцированной миопатии [7]. Для выведения животных из эксперимента использовали метод декапитации.
Группу контроля составили интактные крысы, которые получали базовый рацион вивария и по 2 мл воды очищенной ежедневно через пищеводный зонд.
Провед`нное исследование выполнено в соответствии с этическими принципами, установленными «Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и других научных целей», принятой в Страсбурге 18.03.1986 г., подтверждённой 15.06.2006 г., и одобрена локальным этическим комитетом ГБОУ ВПО «Ростовского государственного медицинского университета» МЗ РФ (протокол №21/15 от 10.12.2015 г.).
Гомогенат тканей готовили из расчёта 1г ткани : 9мл охлаждённого физиологического раствора.
Концентрацию пирувата определяли по цветной реакции с 2,4-динитрофенилгидразином [8]. Концентрацию молочной кислоты определяли по реакции параоксидифенила с уксусным альдегидом, который образуется из молочной кислоты в присутствии серной, фосфорной кислот и ионов меди [9].
Определение содержания титина проводили с использованием ДСН-электрофореза в крупнопористом горизонтальном полиакриламидном геле с добавлением агарозы по Tatsumi R., Hattori A., (1995) [10] в модификации Vikhlyantsev I.M., Podlubnaya Z.A., (2017) [11], на базе ФГБУН Института теоретической и экспериментальной биофизики РАН (г. Пущино). При проведении исследования содержания белка титина методом ДСН-гель электрофореза руководствовались ОФС.1.2.1.0023.15 «Электрофорез в полиакриламидном геле» Государственная Фармакопея XIV [12]. Нормирование проводили по общему белку, а содержание титина и небулина оценивали по отношению к содержанию тяжелых цепей миозина.
Статистическую обработку экспериментального материала осуществляли с использованием программ STATISTICA 10.0 и Exсel Microsoft. Достоверность отличий проводили после проверки на подчинение нормальному закону распределения. В тех случаях, когда две сравниваемые выборки соответствовали нормальному закону распределения, для сравнительного анализа применяли параметрический критерий Стьюдента. В тех случаях, когда хотя бы одна из двух анализируемых выборок не подчинялась нормальному закону распределения, сравнительный анализ проводили с использованием непараметрического критерия Манна-Уитни. Статистически достоверными считали те различия, которые соответствовали ошибке вероятности р ≤ 0,05.
Результаты
Для проведения комплексного сравнительного анализа влияния статинов на сердечную и скелетную мускулатуру экспериментальных животных было выполнено исследование динамики изменения конечных продуктов гликолиза — пирувата и молочной кислоты — на фоне длительного введения симвастатина и получены следующие результаты.
У животных с индуцированной гиперхолестеринемией (I группа) было отмечено значительное синхронное увеличение концентрации пирувата на 239,13% (p<0,0001) в скелетной мускулатуре и на 141,43% (p<0,0001) в сердечной мышце относительно показателей контрольной группы (табл. 1).
Таблица 1
Концентрация пирувата в скелетных мышцах и миокарде крыс, после длительного приема симвастатина
Объект исследования | Ед. изм. | Группа контроля | I группа | II группа |
Скелетная мышца | [мкМ/мг белка] | 2,3 [ 2,3;2,3] | 8 [ 8;8]* | 3,3 [ 3;3,5]**, * |
Сердечная мышца | [мкМ/мг белка] | 0,7 ± 0,1 0,72 [ 0,9; 0,8] | 1,6 [ 1,6; 1,8]* | 0,8 [ 0,7; 0,8]** |
Примечание: * — достоверно при сравнении с группой контроля; ** — достоверно при сравнении с I группой.
Введение симвастатина животным II группы привело к снижению уровня пирувата как в скелетной мускулатуре на 58,97% (p<0,0001), так и в миокарде — на 55,62% (p<0,0001) относительно показателей I группы (табл.1).
При сравнении концентрации пирувата в исследуемых тканях животных II группы с группой контроля в скелетных мышцах наблюдалось её повышение на 39,13% (p<0,0001), а в миокарде статистически значимого отличия выявлено не было (табл. 1).
При исследовании уровня молочной кислоты было отмечено, что у животных с индуцированной гиперхолестеринемией (I группа) наблюдалось увеличение её концентрации на 71,71% (p<0,0001) в скелетных мышцах и на 98,47% (p<0,0001) в миокарде относительно контрольной группы (табл. 2).
Таблица 2
Концентрация молочной кислоты в скелетных мышцах и миокарде крыс, после длительного приема симвастатина
Объект исследования | Ед. изм. | Группа контроля | I группа | II группа |
Скелетная мышца | [мкМ/мг белка] | 3,9 [ 3,78;4,44] | 6,8±0,65 6,9 [ 6;7,3]* | 4,4 [ 4,32;5]**, * |
Сердечная мышца | [мкМ/мг белка] | 2,9 [ 2,2; 3] | 5,2 [ 5,1; 5,2]* | 4,4 [ 4,1; 4,44]**, * |
Примечание: * — достоверно при сравнении с группой контроля; ** — достоверно при сравнении с I группой.
После введения симвастатина животным с экспериментальной гиперхолестеринемией (II группа) было отмечено синхронное снижение концентрации молочной кислоты относительно I группы как в скелетных мышцах, так и в миокарде на 32,35% (p<0,0001) и 14,9% (p<0,0001) соответственно (табл. 2).
Относительно контрольной группы длительное применение симвастатина у животных с индуцированной гиперхолестеринемией (II группа) привело к увеличению концентрации молочной кислоты как в сердечной, так и в скелетной мускулатуре на 65,65% (p<0,0001) и 16,16% (p<0,0001) соответственно (табл. 2).
Для сравнительной оценки структурно-функционального состояния скелетных мышц и мышц миокарда животных с индуцированной гиперхолестеринемией, длительное время получавших симвастатин, было проведено изучение изоформного состава гигантского белка титина и небулина в m. biceps и ventriculus sinister cordis крыс исследуемых групп (рис. 1).
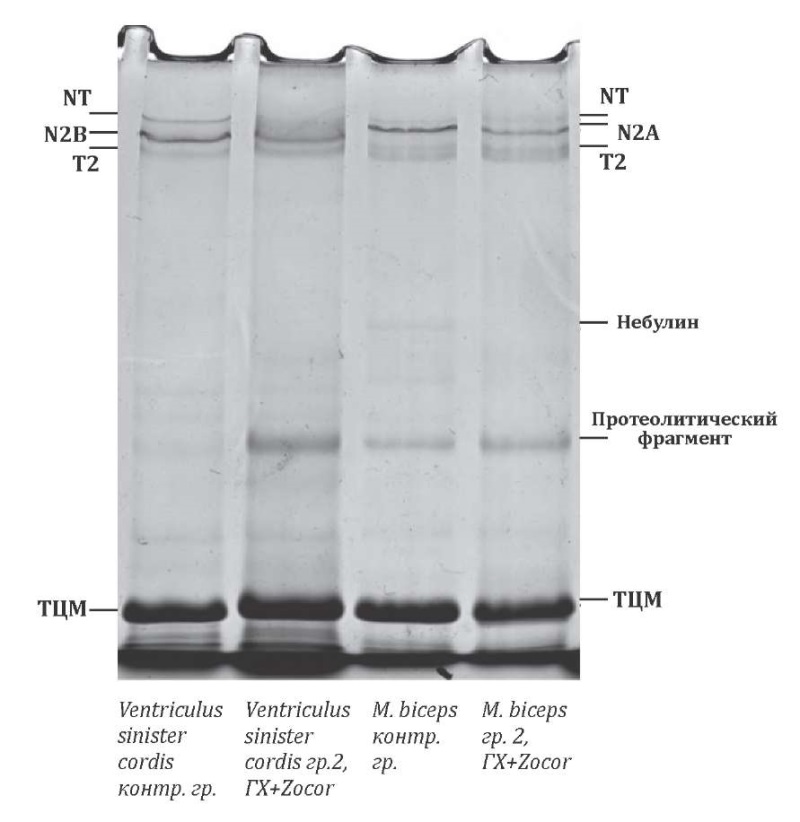
Рисунок 1. Изменение содержания титина и небулина в скелетных мышцах и миокарде экспериментальных животных
При сравнении электрофореграмм m. biceps и ventriculus sinister cordis животных II группы были выявлены аналогичные изменения изоформного состава титина и небулина на фоне длительного применения симвастатина.
Так было отмечено увеличение фракции протеолитического фрагмента Т2 на 94,45% (p<0,001) в сердечной мышце и на 21,24% (p<0,001) в скелетной мышце по сравнению с контрольной группой.
Кроме того, у животных данной группы было выявлено снижение содержания N2В-изоформы в 1,45 раз в миокарде и N2А-изоформы титина в 1,44 раза в скелетной мышце относительно контрольной группы. Также было зафиксировано снижение содержания высокомолекулярных NТ-изоформ интактного титина в m. biceps в 1,6 раз, а в ventriculus sinister cordis отмечено практически их полное отсутствие. Важно отметить, что у животных на фоне длительного применения симваститина небулин в скелетной мышце практически полностью отсутствует.
Примечательно, что у крыс, которым вводили статины на электрофореграмме, был отмечен протеолитический фрагмент (полоса белка с молекулярной массой ~300–400кДа).
Обсуждение
Известно, что пируват является важным промежуточным продуктом метаболизма клеток, источником энергии для митохондрий. Нарушение обмена пирувата делает невозможным их нормальную работу, что может приводить к повреждению тканей, в том числе и мышечной. Важно отметить, что сердечная мышца высоко окислительная ткань, которая 90% энергии производит за счёт митохондриального дыхания [13].
Повышение уровня пирувата как в скелетной, так и в сердечной мышце у животных с индуцированной гиперхолестеринемией (I группа), с одной стороны, может быть связано с избытком легко усваиваемых и быстро окисляющихся углеводов в рационе крыс данной группы. С другой стороны, столь значительное увеличение концентрации пирувата может свидетельствовать о дезинтеграции метаболизма на уровне регуляторных ферментов и блокированию вступления пирувата в энергетические циклы, что провоцирует накопление веществ радикальной природы [14].
Молочная кислота является конечным продуктом гликолиза. Известно, что уровень лактата может являться маркером тканевой гипоксии. В условиях кислородного голодания обменные реакции перестраиваются с аэробного на анаэробный путь утилизации глюкозы и основным становится гликолитический путь, что приводит к накоплению молочной кислоты [13].
Выявленное значительное увеличение концентрации молочной кислоты как в скелетной, так сердечной мышце у животных с гиперхолестеринемией (I группа), согласно данным литературы, приводит к закислению среды, накоплению кининов и активации защитно-приспособительного процесса (воспаления в тканях) [15].
Согласно данным литературы, уже двухнедельная ГХ характеризуется манифестацией дистрофических процессов в клетках, которые проявляются набуханием митохондрий, нарушением поперечно-полосатой исчерченности [16]. Выявленные метаболические изменения отражают структурные нарушения и свидетельствуют о формировании гипоксии, нарушении вовлечения промежуточных узловых метаболитов в общие пути окисления. Учитывая особенности метаболизма мышечной ткани и миокарда, необходимо отметить, что лактоацидоз способствует сдвигу креатинкиназной реакции вправо и усилению распада креатинфосфата, что способствует усугублению нарушения биоэнергетики миоцитов.
В литературе имеются достаточно неоднозначные данные о влиянии статинов на энергетический обмен в органах-мишенях. В обзоре, представленном Broniarek I., Jarmuszkiewicz W. (2016), приводятся данные, что токсическое действие на митохондрии оказывают симвастатин и ловастатин (гидрофобные статины), тогда как аторвастатин и правастатин (гидрофильные статины) такими эффектами не обладают [17]. В тоже время Лакомкин В.Л. и соавт. приводят данные, что введение аторвастатина в эксперименте способствовало снижению сократительной активности миокарда и нарушало процессы антиоксидантной защиты у крыс [18].
После введения симвастатина (II группа) в миокарде и скелетных мышцах было выявлено снижение уровня пирувата и в сердечной мышце показатель приблизился к таковому у контрольной группы. Также было выявлено синхронное снижение уровня молочной кислоты как в скелетных мышцах, так и в миокарде относительно I группы, это позволяет предположить, что ингибирование ГМГ-КоА редуктазы, сопровождающееся снижением синтеза эндогенного холестерина, способствовало нивелированию гиперметаболизма глюкозы. Относительно группы контроля уровень молочной кислоты оставался повышенным. Можно полагать, что сохраняющийся лактоацидоз оказывает дизрегуляторное влияние на активность большинства регуляторных ферментов [19][20]. В то же время, согласно данным литературы, повышение уровня лактата в условиях острого стресса, обусловленного введением высокой дозы симвастатина, что можно интерпретировать, как фактор метаболического перепрограммирования организма, который существенно уменьшает потребление кислорода и оптимизирует продукцию энергии в процессе митохондриального окислительного фосфорилирования [21].
При анализе электрофореграмм животных исследуемых групп можно сделать следующие выводы. Выявленное увеличение фракции протеолитического фрагмента Т2 в скелетной мускулатуре и миокарде крыс, получавших симвастатин, вероятно обусловлено активацией протеолиза интактного титина кальций-зависимыми кальпаинами.
Кроме того, было выявлено существенное снижение N2А, N2В, NТ-изоформ, обусловленное введением симвастатина, как в сердечной, так и в скелетной мускулатуре.
Исследования, проведённые Грицыной Ю.В. и соавт., доказывают, что именно снижение NТ-изоформ титина играет значительную роль в нарушении сократительной способности мышц [22]. А практически полное отсутствие небулина на электрофореграмме в скелетных мышцах животных данной группы лишь усугубляет ситуацию, так как данный белок не выполняет своих функций: стабилизации тонких нитей и регуляции взаимодействия актина и миозина. Также можно предположить, что выявленный на электрофореграмме протеолитический фрагмент вероятно, является продуктом протеолиза высокомолекулярных белков [23].
В более ранних исследованиях в биоптатах мышечной ткани крыс с экспериментальной ГХ после введения симвастатина было выявлено нарушение упорядоченного расположения клеток, наличие гипотрофированных клеток с узкими веретеновидными ядрами, отсутствие поперечно-полосатой исчерченности, наличие сильно просветлённых участков (снижение количества миофибрилл и миоглобина) [24].
Заключение
Таким образом, проведённое нами сравнительное исследование показывает, что миокард наряду со скелетной мускулатурой является органом-мишенью токсического действия статинов, что необходимо учитывать при назначении агрессивных доз гидрофобных лекарственных средств этой группы. Полученные данные ставят вопрос о включении в схемы терапии лекарственных средств, обеспечивающих метаболическую поддержку мышечной ткани и миокарда при длительном приёме статинов.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Гуревич В.С., Козиолова Н.А., Ежов М.В., Сергиенко И.В., Алиева А.С., Вавилова Т.В., и др. Нерешенные проблемы дислипидемии и резидуального сердечно-сосудистого риска. Атеросклероз и дислипидемии. 2022;1(46):31–39. doi: 10.34687/2219-8202.JAD.2022.01.0003
2. Дзугкоев С.Г., Гармаш О.Ю., Дзугкоева Ф.С. Патогенетическое обоснование примененеия ингибитора 3-гидрокси-3-метилглутарил-коэнзим А редуктазы и антиоксиданта коэнзима Q10 в лечении и профилактике сердечно-сосудистой патологии. Кардиоваскулярная терапия и профилактика. 2021;20 (6):127-133. doi:10.15829/1728-8800-2021-2793.
3. Colhoun H.M., Betteridge D.J., Durrington P.N., Hitman G.A., Neil H.A., Livingstone S.J., et al. Primary prevention of cardiovascular disease with atorvastatin in type 2 diabetes in the Collaborative Atorvastatin Diabetes Study (CARDS): multicentre randomized placebo-controlled trial. Lancet. 2004;364 (9435):685-96. doi: 10.1016/S0140-6736(04)16895-5
4. Зыков М.B. Проблема безопасности липидснижающей терапии. Кардиология. 2019;59(5S):13-26. doi: 10.18087/cardio.2505
5. Okuyama H., Langsjoen P.H., Hamazaki T., Ogushi Y., Hama R., Kobayashi T., et al. Statins stimulate atherosclerosis and heart failure: pharmacological mechanisms. Expert Rev Clin Pharmacol. 2015;8(2):189-199. doi: 10.1586/17512433.2015.1011125.
6. Микашинович З.И., Белоусова Е.С., Семенец И.А., Ромашенко А.В., Кантария А.В., патент на изобретение №2733693, РФ, G09B 23/28, 2020. eLIBRARY ID: 44701732
7. Микашинович З.И., Белоусова Е.С., Саркисян О.Г., Вихлянцев И.М., Виноградова Е.В., патент РФ на изобретение №2632624, РФ, G09B 23/28, 2017. eLIBRARY ID: 38271454
8. Камышников В.С. Справочник по клинико-биохимическим исследованиям и лабораторной диагностике. 2-е изд., перераб. и доп. М.: МЕДпресс-информ. 2004:911.
9. Данилова Л.А., Башарина О.Б., Красникова Е.Н., Литвиненко Л.А., и др. Справочник по лабораторным исследованиям. СПб.: Питер. 2003:733.
10. Tatsumi R, Hattori A, Detection of giant myofibrillar proteins connectin and nebulin by electrophoresis in 2 % polyacrylamide slab gels strengthened with agarose. Anal. Biochem. 1995; 224(1):28-31. doi: 10.1006/abio.1995.1004
11. Vikhlyantsev IM, Podlubnaya ZA. Nuances of electrophoresis study of titin/connectin. Biophys Rev, 2017; 9(3):189-199. doi: 10.1007/s12551-017-0266-6
12. ОФС.1.2.1.0023.15 «Электрофорез в полиакриламидном геле». Государственная Фармакопея Российской Федерации. XIV изд. Т.1.М.; 2018. С.650-668.
13. Устьянцева И.М., Хохлова О.И. Новые представления о роли лактата при шоке (обзор литературы). Политравма. 2009;2:70-73. eLIBRARY ID: 12849391
14. Микашинович З.И., Белоусова Е.С., Саркисян О.Г. Нарушение энергозависимых процессов в мышечной ткани как один из патогенетических механизмов статиновой миопатии. Бюллетень экспериментальной биологии и медицины. 2016;162(10):426-429. eLIBRARY ID: 26737499
15. Колотьева Н.А., Потехина В.И., Горбачева И.В., Козлов А.В. Лактат: есть ли тупик метаболизма? Наука молодых (Еruditio juvenium) 2016;1:28-32. eLIBRARY ID: 25738143
16. Благодаров В.Н., Данилишина М.В., Лагода Н.Н., Рудницкая О.Г., Иванова М.Д. цитохимические аспекты энергетического дефицита миокарда в условиях атерогенной дислипопротеидемии. Свiт медицини та бiологii. 2011;7(4):20-23.
17. Broniarek I., Jarmuszkiewicz W. Statins and mitochondria. Postepy Biochemii. 2016;62(2):77-84. PMID: 28132458
18. Лакомкин В.Л., Капелько В.И., Ланкин В.З., Коновалова Г.Г. Каминный А.И. Влияние ингибитора β-гидрокси-β-метилглутарил коэнзим А-редуктазы аторвастатина на сократимость изолированного сердца крыс в норме и при окислительном стрессе. Бюллетень экспериментальной биологии и медицины. 2007;143 (4):383-385. doi: 10.1007/s10517-007-0142-7.
19. Минигалин А.Д., Шумаков А.Р., Баранова Т.И., Данилова .А., Калинский М.И., Морозов В.И. Срочные и отдаленные биохимические и физиологические эффекты предельной силовой нагрузки. Физиология человека. 2011; 37(2):86-91. eLIBRARY ID: 16311535.
20. Huang J., Du J., Lin W., Long Z., Zhang N., Huang X., et al. Regulation of lactate production through p53/β-enolase axis contributes to statin-associated muscle symptoms. EBioMedicine. 2019;45:251-260. doi: 10.1016/j.ebiom.2019.06.003
21. Чепур С.В., Плужников Н.Н., Чубарь О.В., Фатеев И.В., Бакулина Л.С., Литвиненко И.В. и др. Молочная кислота: динамика представлений о биологии лактата. Успехи современной биологии. 2021; 141(3):227-247. doi: 10.31857/S0042132421030042
22. Грицына Ю.В., Салмов Н.Н., Вихлянцев И.М., Уланова А.Д., Шарапов М.Г., Теплова В.В. и др. Изменение экспрессии гена и содержания тайтина (коннектина) в поперечно-полосатых мышцах хронически алкоголизированных крыс. Молекулярная биология. 2013; 47(6): 996-1003. doi: 10.1134/s0026893313060058.
23. Вихлянцев И.М., Подлубная З.А. Изоформный состав тайтина в мышцах при патологических процессах. Биофизика. 2008;53(6):1058-1065. doi: 10.1134/s0006350908060237
24. Белоусова Е.С., Микашинович З.И., Саркисян О.Г., Мажугин В.Ю. Морфо-молекулярные изменения в мышечной ткани крыс после длительного введения симвастатина. Международный журнал прикладных и экспериментальных исследований. 2017;9:96-100. eLIBRARY ID: 30056219
Об авторах
Е. С. БелоусоваРоссия
Белоусова Елена Сергеевна – кандидат биологических наук, доцент, заведующая кафедрой фармацевтической химии и фармакогнозии.
Ростов-на-Дону
З. И. Микашинович
Россия
Микашинович Зоя Ивановна - доктор биологических наук, профессор, профессор кафедры общей и клинической биохимии №1.
Ростов-на-Дону
Е. В. Виноградова
Россия
Виноградова Елена Викторовна - кандидат медицинских наук, доцент кафедры фармацевтической химии и фармакогнозии.
Ростов-на-Дону
Т. Д. Лосева
Россия
Лосева Татьяна Дмитриевна - кандидат медицинских наук, доцент кафедры химии подготовительного факультета по обучению иностранных граждан.
Ростов-на-Дону
Дополнительные файлы
Рецензия
Для цитирования:
Белоусова Е.С., Микашинович З.И., Виноградова Е.В., Лосева Т.Д. Сравнительный анализ метаболических и структурных изменений в скелетных мышцах и миокарде крыс на фоне длительного введения симвастатина. Южно-Российский журнал терапевтической практики. 2023;4(2):80-86. https://doi.org/10.21886/2712-8156-2023-4-2-80-86
For citation:
Belousova E.S., Mikashinovich Z.I., Vinogradova E.V., Loseva T.D. Comparative analysis of metabolic and structural changes in the skeletal muscles and myocardium of rats on the background of long-term administration of simvastatin. South Russian Journal of Therapeutic Practice. 2023;4(2):80-86. (In Russ.) https://doi.org/10.21886/2712-8156-2023-4-2-80-86


























