Перейти к:
Исследование субхронической токсичности при пероральном введении оловоорганических соединений, содержащих фрагмент 2,6-ди-трет-бутилфенола
https://doi.org/10.21886/2712-8156-2023-4-2-109-114
Аннотация
Цель: оценка субхронической токсичности бис-(3,5-ди-трет-бутил-4-гидроксифенил)тиолат диметилолова (Ме-3) и (3,5-ди-трет-бутил-4-гидроксифенил)тиолат трифенилолова (Ме-5) с выявлением внешних признаков токсичности и изменением показателей функционального состояния печени и почек крыс линии Wistar (самки) при 14-кратном ежедневном внутрижелудочном введении для моделирования метрономного режима химиотерапии. Материалы и методы: исследование проведено на 24 крысах Wistar (самки) весом 190–210 г. Тестируемые соединения вводили четырнадцатикратно ежедневно внутрижелудочно в суммарной дозе для Ме-3 2000 мг/кг, для Ме-5 - 954 мг/кг. Результаты: для субстанций, относящихся к классу органических производных олова, выявлены особенности протекания токсического процесса и показатели функционального состояния органов детоксикации (печень и почки) при субхроническом введении. Введение в суммарных дозах, составляющих полулетальную дозу при четырнадцатикратном введении, не вызвало гибели животных и развития внешних признаков токсичности. Изменение показателей функционального состояния печени и почек не отмечено. Вывод: анализ результатов исследования позволит разработать оптимальные схемы введения оловоорганических соединений, содержащих фрагмент 2,6-ди-трет-бутилфенола, в метрономном режиме химиотерапии.
Ключевые слова
Для цитирования:
Алхусейн-Кулягинова М.С., Аркания И.И., Трепель В.В., Могушкова С.А., Киртанасова Е.Я., Додохова М.А., Гулян М.В., Шпаковский Д.Б., Милаева Е.Р., Котиева И.М. Исследование субхронической токсичности при пероральном введении оловоорганических соединений, содержащих фрагмент 2,6-ди-трет-бутилфенола. Южно-Российский журнал терапевтической практики. 2023;4(2):109-114. https://doi.org/10.21886/2712-8156-2023-4-2-109-114
For citation:
Alkhusein-Kulyaginova M.S., Arkaniya I.I., Trepel V.V., Mogushkova S.A., Kirtanasova E.Y., Dodokhova M.A., Gulyan M.V., Shpakovsky D.B., Milaeva E.R., Kotieva I.M. Research of subchronic oral toxicity after the injection of organotin compounds containing a fragment of 2,6-di-tert-butylphenol. South Russian Journal of Therapeutic Practice. 2023;4(2):109-114. (In Russ.) https://doi.org/10.21886/2712-8156-2023-4-2-109-114
Введение
Оловоорганические соединения широко изучаются в качестве перспективных кандидатов в противоопухолевые лекарственные средства [1][2]. Высокая системная цитотоксическая активность является ограничением in vivo исследований, в связи с чем более распространённым оказываются in vitro исследования [3]. Создание гибридных молекул, включающих биоцидный (олово) и протекторный (фенольный) фрагменты, является многообещающей стратегией синтеза фармакологически активных соединений. В ранее опубликованных исследованиях был установлен умеренный противоопухолевый, высокий антиметастатический эффект введения бис-(3,5-ди-трет-бутил-4-гидроксифенил)тиолат диметилолова (Ме-3) и (3,5-ди-трет-бутил-4-гидроксифенил)тиолат трифенилолова (Ме-5) на двух видах перевиваемых опухолей мышей [4][5], при чём системная токсичность была снижена в несколько раз.
В настоящее время остается высоким процент выявления злокачественных новообразований на III и IV стадиях развития опухолевого процесса [6]. Для таких пациентов основным методом лечения остается химиотерапия, а введение противоопухолевых лекарственных средств приобретает паллиативный характер. Метротрономный режим введения противоопухолевых и антиметастатических химиотерапевтических агентов представляет собой регулярное на протяжении длительного периода времени назначение цитотоксических препаратов в дозах, значительно меньших максимально переносимых [7]. Преимуществами данной методики введения являются минимальные побочные эффекты и минимальная вероятность развития приобретенной лекарственной устойчивости.
Для дальней доклинической разработки гибридных оловоорганических соединений, содержащих фрагмент 2,6-ди-трет-бутилфенола, в качестве кандидатов в противоопухолевые лекарственные средства целесообразным является моделирование метрономного режима введения с целью выяснения возможных побочных эффектов при химиотерапии.
Цель исследования — оценка субхронической токсичности бис-(3,5-ди-трет-бутил-4-гидроксифенил)тиолат диметилолова (Ме-3) и (3,5-ди-трет-бутил-4-гидроксифенил)тиолат трифенилолова (Ме-5) с выявлением внешних признаков токсичности и изменения показателей функционального состояния печени и почек крыс линии Wistar (самки) при 14-кратном ежедневном внутрижелудочном введении для моделирования метрономного режима химиотерапии.
Материалы и методы
В качестве объектов исследования использовали два оловоорганических соединения: ((3,5-ди-трет-бутил-4-гидроксифенилтиолат)трифенилолова (Ме-5) и бис(3,5-ди-трет-бутил-4-гидроксифенилтиолат) диметилолова (Ме-3), синтезированные соавторами по известной методике [8].
Исследование субхронической токсичности проведили на 24 крысах Wistar (самки) весом 190–210 г, в контрольной группе 6 особей, в опытных группах — по 8 особей. Исследования выполняли в соответствии с Международными и Российскими требованиями проведения научных исследований с использованием лабораторных животных. После окончания срока карантинного изолирования (14 суток) животные были рандомизированы. Для достижения целей работы животные были разделены на 3 группы: первая — контрольная, вторая — опытная с введением Ме-3, третья — опытная с введением Ме-5. Тестируемые соединения вводили 14-кратно ежедневно внутрижелудочно через зонд в виде взвеси, полученной путем суспензирования в 1% водном растворе желатина, объемом не более 2 мл. Животным из контрольных групп был введен 1% водный раствор желатина в аналогичных объёмах. Суммарная доза была равна численному значению LD50, определённому при изучении острой токсичности (для Ме-3 — 2000 мг/кг, для Ме-5 — 954 мг/кг).
Согласно методическим рекомендациям для доклинических исследований на животных [9], на токсикологическом этапе в течение всего срока эксперимента каждая особь осматривалась ежедневно на протяжении 14 суток. При осмотре оценивали общее состояние животных по следующим показателям:
- Летальность.
- Динамика изменения массы тела.
- Клиническая картина интоксикации.
Экспериментальную часть работы проводили в соответствии с принципами Хельсинкской декларации, дизайн исследования одобрен локальным независимым этическим комитетом Федерального государственного бюджетного образовательного учреждения высшего образования «Ростовский государственный медицинский университет» Министерства здравоохранения Российской Федерации (протокол № 15/22 от 06 октября 2022).
Для биохимической оценки функционально-метаболического состояния органов животных проводили анализ изменения показателей крови (общий белок, альбумин, мочевина, креатинин, общий и конъюгированный билирубин, активность АсАт-аспартатаминотрансферазы (КФ 2.6.1.1), АлАт-аланинаминотрансферазы (КФ 2.6.1.2)). Для определения были использованы автоматический биохимический анализатор ACCENT 300 и стандартные наборы фирмы CORMAY (Польша).
Для анализа всех результатов применяли описательную статистику. Статистическую обработку полученных данных проводили с использованием пакета компьютерных программ версии «Statistica 6.0». Нормальность распределения оценивали с помощью модифицированной версии метода Колмогорова-Смирнова, а именно по методике Андерсона-Дарлинга. Оценка достоверности различий между сравниваемыми параметрами проведена помощью t-критерия Стьюдента. Различия считали статистически значимыми при p≤0,05. Сравнение групп производили попарно.
Результаты
По истечении срока наблюдения (14 суток) произведена оценка общего состояния животных (табл. 1).
Таблица 1
Результаты изучения общего состояния животных после 14-кратного ежедневного внутрижелудочного введения гибридных оловоорганических соединений Ме-3 и Ме-5.
Исследуемые показатели | Группы животных | ||
Контроль (1) | Me-3 (2) | Me-5 (3) | |
Летальные эффекты (пало / всего) | 0/6 | 0/8 | 0/8 |
Средний вес животных в группе, г исходный / перед эвтаназией | 196,3±4,6/ 217,2±7,2 | 198,2±3,5/ 214,8±2,4 | 199,1±2,9/ 213,2±6,1 |
Клиническая картина интоксикации | нет | нет | нет |
Изменения массы тела животных не имели достоверных различий и колебались в пределах физиологических норм для данного вида животных.
Клиническая картина отравления отсутствовала на всех этапах эксперимента: рефлекс переворачивания и отдергивания хвоста, груминг, кормовой и питьевой режим сохранены в полном объёме, внешний вид животных опрятный, шерсть блестящая, патологические самопроизвольные движения в конечностях и судороги отсутствуют.
Результаты изменение показателей функционального состояния печени и почек в крови животных, получавших субстанции Me-3 и Me-5, приведены на рисунке 1 и 2.
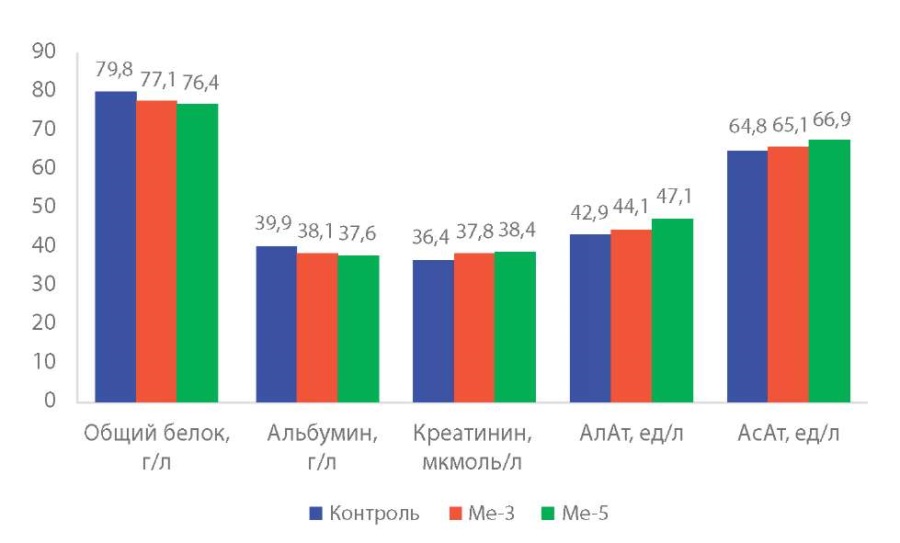
Рисунок 1. Биохимические показатели крови животных (M±m, p) после 14-кратного ежедневного внутрижелудочного введения гибридных оловоорганических соединений Ме-3 и Ме-5 (общий белок, альбумин, креатинин, АлАт, АсАт).
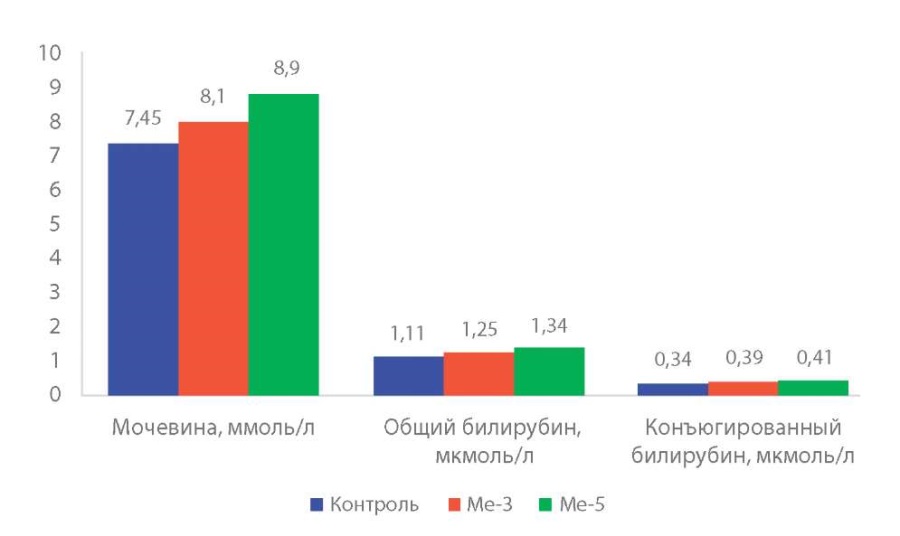
Рисунок 2. Биохимические показатели крови животных (M±m, p) после 14-кратного ежедневного внутрижелудочного введения гибридных оловоорганических соединений Ме-3 и Ме-5 (мочевина, общий и коньюгированный билирубин).
В основной массе значения показателей функционального состояния печени и почек в крови животных в контрольной и опытных группах не имеют достоверных различий, синтетическая функция печени сохранена в полном объёме (общий белок, альбумин, мочевина, коньюгированный билирубин). Тенденция к снижению содержания альбумина и повышение уровня мочевины и коньюгированного билирубина при введении Ме-5 имеет незначительный характер.
Обсуждение
Инновационные диагностические подходы и современные методы лечения злокачественных новообразований, бесспорно, повлияли на увеличение продолжительности жизни больных, однако до сих пор не привели к возможности полного излечения пациентов с диссеминированными формами опухолей [10]. У данных пациентов химиотерапевтическое лечение должно иметь паллиативный характер и быть максимально щадящим [11]. Отличительной особенностью подавляющего большинства препаратов, применяемых в химиотерапии онкологических заболеваний, является их исходная цитотоксичность. Это в значительной степени определяет гепато- и нефротоксический потенциал противоопухолевых препаратов, принимая во внимание центральную роль печени в их метаболизме [12][13]. Выраженное повреждение органов детоксикации препятствует проведению в полном объёме противоопухолевой терапии, требует пересмотра ее курса, что, несомненно, влияет на прогноз развития заболевания [14]. В этой связи разработка метрономного режима введения противоопухолевых лекарственных средств в перспективе может существенно повысить продолжительность и качество жизни пациентов со злокачественными новообразованиями III и IV стадий онкологического процесса. В клинике наиболее изучена данная методика при лечении диссеминированного колоректального рака и метастатического гормонозависимого HER2-негативного рака молочной железы [15][16]. В схему доклинического исследования лидерных соединений из тестируемых перспективных кандидатов в противоопухолевые лекарственные средства необходимо включать изучение их действия при метрономном режиме введения [17].
В проведённом нами исследовании при введении гибридных оловоорганических соединений, содержащих фрагмент 2,6-ди-трет-бутилфенола - Ме-3 и Ме-5, в суммарных дозах, составляющих полулетальную дозу при однократном введении, не вызывало гибели животных и развития внешних признаков токсичности, изменение показателей функционального состояния печени и почек не отмечено.
Заключение
Для субстанций, относящихся к классу органических производных олова — бис-(3,5-ди-трет-бутил-4-гидроксифенил)тиолат диметилолова (Ме-3) и (3,5-ди-трет-бутил-4-гидроксифенил)тиолат трифенилолова (Ме-5) — не выявлены внешние признаки токсичности и изменения показателей функционального состояния печени и почек крыс линии Wistar (самки) при 14-кратном ежедневном внутрижелудочном введении. Таким образом, успешно проведено моделирование метрономного режима введения с целью выяснения возможных побочных эффектов при химиотерапии. Исследование показало целесообразность дальнейшей разработки гибридных оловоорганических соединений, содержащих фрагмент 2,6-ди-трет-бутилфенола, в качестве кандидатов в противоопухолевые лекарственные средства для паллиативной химиотерапии.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Devi J, Boora A, Rani M, Arora T. Recent Advancements in Organotin(IV) Complexes as Potent Cytotoxic Agents. Anticancer Agents Med Chem. 2023;23(2):164-191. doi: 10.2174/1871520622666220520095549
2. Nikitin EA, Shpakovsky DB, Tyurin VY, Kazak AA, Gracheva YA, Vasilichin VA, et al. Novel organotin complexes with phenol and imidazole moieties for optimized antitumor properties. Journal of Organometallic Chemistry. 2022;959;122212. Doi: 10.1016/j.jorganchem.2021.122212
3. Додохова М.А., Сафроненко А.В., Котиева И.М., Сухорукова Н.В., Ганцгорн Е.В., Алхусейн-Кулягинова М.С., и др. Оценка фармакотерапевтического потенциала оловоорганических соединений in vivo. Биофармацевтический журнал. 2021;13(3):30-34. DOI: 10.30906/2073-8099-2021-13-3-30-34
4. Dodokhova MA, Safronenko AV, Kotieva IМ, Alkhuseyn-Kulyaginova MS, Shpakovsky DB, Milaev ER. Evaluation of the pharmacological activity of hybrid organotin compounds in a B16 melanoma model in the classical and metronomic administration modes. Research Results in Pharmacology. 2022;8(1):85–93. Doi: 10.3897/rrpharmacology.8.76363
5. Dodokhova M.A., Safronenko A.V., Kotieva I.M., Alkhuseyn-Kulyaginova M.S., Shpakovsky D.B., Milaeva E.R. Impact of organotin compounds on the growth of epidermoid Lewis carcinoma. Research Results in Pharmacology. 2021;7(4):81-88. Doi: 10.3897/rrpharmacology.7.71455
6. Состояние онкологической помощи населению России в 2020 году. Под. ред. Каприна А.Д., Старинского В.В., Петровой Г.В. М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2021.
7. Федянин М.Ю., Покатаев И.А., Тюляндин С.А. Метрономные режимы химиотерапии в онкологии. Тазовая хирургия и онкология. 2016;6(1):27-35. Doi: 10.17650/2220-3478-2016-6-1-27-35
8. Мухатова Е.М., Осипова В.П., Коляда М.Н., Мовчан Н.О., Шпаковский Д.Б., Грачева Ю.А., и др. Синтез и антиоксидантная активность новых оловоорганических соединений, содержащих фрагмент 2,6-ди-трет-бутилфенола. Доклады Академии наук. 2013;451(1):46. Doi: 10.7868/S0869565213190134
9. Авдеева О.И., Макарова М.Н., Калатанова А.В., Ковалева М.А. Биоэтические и экономические аспекты в основе выбора метода изучения токсичности лекарственных средств при однократном введении. Лабораторные животные для научных исследований. 2018;1. Doi: 10.29296/2618723X-2018-01-01
10. Карабина Е.В. Насущные вопросы лекарственной терапии и возможности их решения. Практическая онкология. 2020;21(2):106-122. Doi: 10.31917/2102106
11. Хачатрян Л.А., Щербаков А.П., Чиквина И.И., Николаева Д.М. Новые подходы к решению старой проблемы. Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2022;21(1):122-135. Doi: 10.24287/1726-1708-2022-21-1-122-135
12. Ткаченко П.Е., Ивашкин В.Т., Маевская М.В. Клинические рекомендации по коррекции гепатотоксичности, индуцированной противоопухолевой терапией. Злокачественные опухоли. 2020;10(3s2-2):52-65. Doi: 10.18027/2224-5057-2020-10-3s2-40
13. Ивашкин В.Т., Райхельсон К.Л., Пальгова Л.К., Маевская М.В., Герасимова О.А., Кондрашина Э.А., и др. Лекарственные поражения печени у онкологических пациентов. Онкогематология. 2020;15(3):80-94. Doi: 10.17650/1818-8346-2020-15-3-80-94
14. Лазебник Л.Б., Голованова Е.В., Хлынова О.В., Алексеенко С.А., Арямкина О.Л., Бакулин И.Г., и др. Лекарственные поражения печени (ЛПП) у взрослых. Экспериментальная и клиническая гастроэнтерология. 2020;174(2):29-54. Doi: 10.31146/1682-8658-ecg-174-2-29-54
15. Стрельцова О.В. Лечение пациентов с диссеминированным колоректальным раком с использованием метрономной химиотерапии. Медицинский журнал. 2020;1(71):123-128. eLIBRARY ID: 42399441
16. Фролова М.А., Глазкова Е.В., Стенина М.Б. Клинический случай применения перорального винорелбина в метрономном режиме при метастатическом гормонозависимом Her2-негативном раке молочной железы. Медицинский Совет. 2021;(9):148-153. Doi: 10.21518/2079-701X-2021-9-148-153
17. Сивак К.В., Стосман К.И., Саватеева-Любимова Т.Н. Нефро- и гепатотоксические эффекты уранила ацетата при хроническом 18-недельном введении крысам. Токсикологический вестник. 2021;(2):51-58. Doi: 10.36946/0869-7922-2021-2-51-58
Об авторах
М. С. Алхусейн-КулягиноваРоссия
Алхусейн-Кулягинова Маргарита Стефановна - ассистент кафедры патологической физиологии.
Ростов-на-Дону
И. И. Аркания
Россия
Аркания Ираклий Ильич - обучающийся лечебно-профилактического факультета.
Ростов-на-Дону
В. В. Трепель
Россия
Трепель Валерия Вартановна - обучающийся лечебно-профилактического факультета.
Ростов-на-Дону
С. А. Могушкова
Россия
Могушкова Самира Аюповна - обучающийся лечебно-профилактического факультета.
Ростов-на-Дону
Е. Я. Киртанасова
Россия
Киртанасова Елена Яковлевна - обучающийся лечебно-профилактического факультета.
Ростов-на-Дону
М. А. Додохова
Россия
Додохова Маргарита Авдеевна – кандидат медицинских наук, доцент кафедры патологической физиологии.
Ростов-на-Дону
М. В. Гулян
Россия
Гулян Марина Владимировна - кандидат медицинских наук, доцент кафедры патологической физиологии.
Ростов-на-Дону
Д. Б. Шпаковский
Россия
Шпаковский Дмитрий Борисович – кандидат химических наук, старший научный сотрудник кафедры медицинской химии и тонкого органического синтеза.
Москва
Е. Р. Милаева
Россия
Милаева Елена Рудольфовна - доктор химических наук, профессор, заведующая кафедрой медицинской химии и тонкого органического синтеза.
Москва
И. М. Котиева
Россия
Котиева Инга Мовлиевна - доктор медицинских наук, проректор по научной работе, профессор кафедры патологической физиологии.
Ростов-на-Дону
Дополнительные файлы
Рецензия
Для цитирования:
Алхусейн-Кулягинова М.С., Аркания И.И., Трепель В.В., Могушкова С.А., Киртанасова Е.Я., Додохова М.А., Гулян М.В., Шпаковский Д.Б., Милаева Е.Р., Котиева И.М. Исследование субхронической токсичности при пероральном введении оловоорганических соединений, содержащих фрагмент 2,6-ди-трет-бутилфенола. Южно-Российский журнал терапевтической практики. 2023;4(2):109-114. https://doi.org/10.21886/2712-8156-2023-4-2-109-114
For citation:
Alkhusein-Kulyaginova M.S., Arkaniya I.I., Trepel V.V., Mogushkova S.A., Kirtanasova E.Y., Dodokhova M.A., Gulyan M.V., Shpakovsky D.B., Milaeva E.R., Kotieva I.M. Research of subchronic oral toxicity after the injection of organotin compounds containing a fragment of 2,6-di-tert-butylphenol. South Russian Journal of Therapeutic Practice. 2023;4(2):109-114. (In Russ.) https://doi.org/10.21886/2712-8156-2023-4-2-109-114
JATS XML


























