Перейти к:
Фармакологические аспекты каннабиноидов
https://doi.org/10.21886/2712-8156-2023-4-3-27-35
Аннотация
В настоящем обзоре представлена имеющаяся информация за последнее время о свойствах эндогенных и экзогенных каннабиноидов, возможных механизмах их действия и эффектах. В работе отражен зарубежный опыт использования препаратов (каннабиноидов) по рекомендованным показаниям, а также возможное перспективное действие для расширения их клинического применения.
Ключевые слова
Для цитирования:
Сафроненко А.В., Саенко Н.Ю., Землякова В.П., Кварацхелия С.К., Дольникова М.В. Фармакологические аспекты каннабиноидов. Южно-Российский журнал терапевтической практики. 2023;4(3):27-35. https://doi.org/10.21886/2712-8156-2023-4-3-27-35
For citation:
Safronenko A.V., Saenko N.Yu., Zemliakova V.P., Kvaratskheliia S.K., Dolnikova M.V. Pharmacological aspects of cannabinoids. South Russian Journal of Therapeutic Practice. 2023;4(3):27-35. (In Russ.) https://doi.org/10.21886/2712-8156-2023-4-3-27-35
Введение и историческая справка
Каннабиноиды — группа соединений, содержащихся в растениях рода каннабис. Каннабис знаком миру под такими терминами, как марихуана, гашиш (смола индийской конопли), ганджа, анаша и др. Он выращивается во многих странах земного шара и наиболее известен по своему влиянию на сознание человека.
Помимо своего психодислептического действия, каннабиноиды обладают рядом интересных свойств. Еще с древних времён люди использовали коноплю для изготовления волокон, проведения религиозных обрядов, а также в качестве лекарственного средства.
Первые упоминания о лечебных свойствах каннабиса были найдены в Древнем Китае: в фармакопее «Пен-дзяо-чин» (2700 г. до н.э.) есть сведения о применении каннабиса в лечении ревматических болей, расстройств женской репродуктивной системы, малярии и т. д. В Индии коноплю использовали для лечения невралгии, головной и зубной боли, конвульсий, ревматизма, спазмов, бронхиальной астмы и т. д. [1]. Учёным Римской империи (Плиний Старший и Диоскорид), стран Ближнего и Среднего Востока (Авиценна) также было известно об анальгетическом и противовоспалительном эффектах каннабиса [2].
Значительный вклад в изучение терапевтического потенциала каннабиса внесли европейские медики. В конце первой половины XIX в. ирландский врач Уильям Брук О’Шонесси во время своей службы в Индии (1833–1841) провёл ряд исследований и установил, что каннабис может оказывать положительный эффект при лечении ревматизма, болевых синдромов, судорог, спазмов и скованности при рассеянном склерозе и т. д. [2]. В 1890 г. британский врач Джон Рассел Рейнольдс описал свой опыт работы с каннабисом и установил положительный эффект конопли при лечении невралгии, мигрени, дисменореи и др. [2].
Ключевым моментом в истории изучения каннабиса стало определение структуры основных его химических компонентов. В 1940 г. американский ученый Роджер Адамс выделил каннабидиол (КБД), а в 1964 г. израильский биохимик Рафаэль Мешулам определил структуру дельта-9-тетрагидроканнабинола (ТГК) [3][4]. В 1988 г. профессор Аллин Хаулетт и аспирант Уильям Дивейн обнаружили первый каннабиноидный рецептор — CB1 [5]. Наличие рецепторов к фитоканнабиноидам в организме человека предполагает существование и эндогенных лигандов. В связи с этим в 1992 г. был выделен первый эндогенный каннабиноид — N-арахидоноилэтаноламин, или анандамид [6]. Спустя год был открыт второй тип каннабиноидных рецепторов — CB2, — а в 1995 г. Рафаэль Мешулам с командой учёных идентифицировал второй эндогенный лиганд CB1 и CB2 рецепторов — 2-арахидоноилглицерин (2-АГ) [7][8]. Немаловажным событием в истории медицинского каннабиса стало появление препаратов синтетических каннабиноидов в США: в 1985 г. — дронабинола (Маринол®), в 1992 г. — набилона (Цесамет®) [9].
Таким образом, в настоящее время можно выделить следующие группы каннабиноидов по происхождению:
- экзогенные или растительные (ТГК, КБД и др.);
- эндогенные каннабиноиды (производные арахидоновой кислоты — анандамид и 2-арахидонилглицерин (2-АГ);
- синтетические каннабиноиды (дронабилон, набилон) — вещества, обладающие высоким афиннитетом к каннабиноидным рецепторам.
Выделение ТГК и КБД наряду с открытием эндоканнабиноидной системы и её функций позволило точнее определить механизмы развития различных эффектов каннабиса и оценить их терапевтический потенциал.
Эндоканнабиноидная система
Эндоканнабиноидная система включает в себя четыре звена:
- Рецепторы нескольких видов.
- Вещества эндогенного происхождения (возможные эндогенные лиганды).
- Ферменты, которые участвуют в синтезе и разрушении этих веществ.
- Белковый транспортер эндогенных лигандов.
Каннабиноидные рецепторы
Каннабиноидные рецепторы — это трансмембранные рецепторы, сопряжённые с G-белками нескольких типов (Gi/o, Gs, Gq), которые в свою очередь имеют связь с аденилатциклазой (АЦ) и регулируют преимущественно кальциевые и калиевые каналы [10].
Протеины вида Gi/o, Gs рецепторов СВ1 и СВ2 модулируют количество циклического аденозинмонофосфата (цАМФ) посредством положительного или отрицательного действия на АЦ соответственно. В свою очередь цАМФ регулирует протеинкиназу А, которая отвечает за координацию контроля клеточных функций и имеет отрицательную связь с К-каналами. Протеин вида Gq положительно связан с Са-каналами, регулируя транспорт ионов кальция (рис. 1).
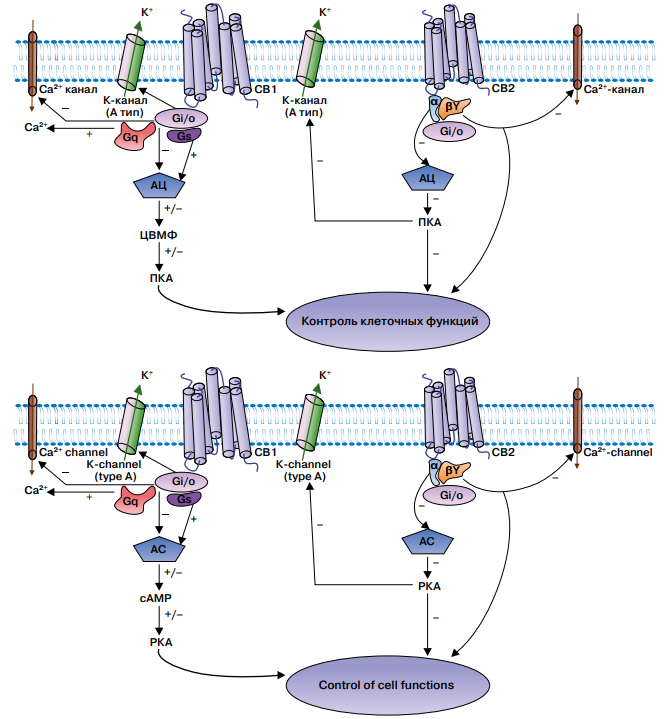
Рисунок 1. Устройство каннабиноидного комплекса. CB1 — каннабиноидный рецептор первого типа, CB2 — каннабиноидный рецептор второго типа, Gi/o, Gs, Gq — фракции G-протеинов, АЦ — аденилатциклаза, цАМФ — циклический аденозинмонофосфат, ПКА — протеинкиназа A, K⁺ — калиевые каналы, Ca²⁺ — кальциевые каналы [10].
Благодаря связи трансмембранных рецепторов с ионными каналами регулируется высвобождение как тормозных, так и активирующих медиаторов проведения нервного импульса. В настоящее время, известно о трёх типах каннабиноидных рецепторов: СВ1, СВ2, СВ3 (GPCR55) [10]. В литературе более широко описаны рецепторы двух видов — это СВ1 и СВ2, которые являются наиболее изученными в структуре эндоканнабиноидной системы. В настоящее время появилась информация и о СВ3 (GPCR55), который в экспериментах проявляет себя как типичный рецептор каннабиноидного типа. Кроме этого, имеются сведения о каналах виннилоидного и анкиринового типов, которые играют роль в работе эндоканнабиноидной системы [10].
Рецепторы первого типа располагаются преимущественно в центральной нервной системе (ЦНС) в таких образованиях, как гиппокамп, кора большого мозга, средний мозг, а также мозжечок [11]. Кроме этого, низкое, но значимое их количество было обнаружено на нейронных соматах и дендритах.
Наиболее часто СВ1 расположены на ГАМКергических интернейронах. Тем не менее рецептор первого типа может встречаться в множестве других нейронов, например, в холинергических, глицинергических, серотонинергических и т.д. [12].
Многие «отрицательные» когнитивные расстройства, о которых сообщают люди, использующие каннабиноиды в «рекреационных» целях, и есть следствие воздействия активных веществ на рецепторы первого типа. Это такие последствия, как головные боли, нарушение памяти, тошнота, рвота, потеря ориентации и равновесия в пространстве [13].
Рецепторы второго типа преимущественно расположены на иммунных клетках и в основном направлены на иммуносупрессивный ответ [11]. Но в некоторых исследованиях появилась информации о том, что рецепторы данного типа базируются не только на иммунных клетках, но ещё и могут быть расположены в мозжечке у крыс, костях, жировых клетках, лёгких, яичках и желудочно-кишечном тракте [14].
Более того, недавние исследования подтверждают наличие в организме у крыс так называемых рецепторов 3 типа или GPСR55. Данный рецептор может быть активирован эндоканнабиноидами как экзогенного, так и эндогенного происхождения. Также в новых исследованиях говорится о том, что сродство таких веществ как ТГК и анандамид выше к рецептору GPСR55, чем к CB1 и CB2. Исследования, направленные на изучение происхождения СВ3, а также его функций поможет лучше понять его роль в функционировании эндоканнабиноидной системы (ЭКС) [10].
Кроме этого, огромный интерес представляет изучение взаимодействия каннабиноидных рецепторов с функционированием каналов винилоидного и анкиринового типов. Возможно, при взаимодействии эндогенных каннабиноидов, а также каннабиноидов растительного происхождения с каналами меняется заряд мембраны и происходит либо десенсибилизация, либо деполяризация мембраны [10].
Эндоканнабиноиды
После определения мест для связывания растительных каннабиноидов в организме нашли вещества эндогенного происхождения, которые взаимодействуют с этими рецепторами. Эти вещества называются эндоканнабиноидами или эндогенными каннабиноидами, таким образом, возможно, они являются претендентами на роль эндогенных лигандов.
Все эндоканнабиноиды являются веществами липидной природы, а именно производными арахидоновой кислоты. В данном обзоре важно рассказать о двух типах веществ, которые представляют из себя продукты метаболизма арахидоновой кислоты — анандамид (или арахидонилэтаноламид) и 2-АГ. Их синтез необычен, так как эти вещества не синтезируются постоянно, а лишь «по требованию» из липидных предшественников. Под действием специфических ферментов они преобразовываются в тем самые эндоканнабиноиды. Это связано с тем, что эндогенные каннабиноиды, как и классические нейротрансмиттеры, высоколипофильны и растворяются в липидном слое мембраны везикул. В исследованиях говорится о том, что преобразование предшественников в эндогенные вещества происходит под влиянием G белка и большого количества кальция внутри клетки, так как некоторые ферменты, ответственные за синтез эндоканнабиноидов, чувствительны к ионам кальция [14]. Полярная природа эндоканнабиноидов предотвращает их прохождение через клеточные мембраны путем простой диффузии [12]. После высвобождения ЭКБ захватываются специфичным белковым транспортером, который именуется эндоканнабиноидным мембранным транспортёром (ЭМТ), а уже после этого метаболизируются под действием двух основных ферментов. Первый из них — это гидролаза амида жирных кислот или сокращенно FAAH (fatty acid amide hydrolase), преимущественно он расщепляет анандамид. Для 2-АГ существует фермент под названием моноацил-глицерол липаза или MAGL (monoacyl-glycerol lipase). Также важно сказать, что эндоканнабиноиды могут метаболизироваться ферментом циклооксигеназа-2 (ЦОГ-2), наиболее известным ферментом в механизме воспаления.
Именно с действием данных специфичных ферментов связано то, что экзогенные каннабиноиды, такие как КБД и ТГК, могут действовать в организме намного дольше, чем ЭКБ, а также иметь эффекты не похожие на эффекты эндогенных каннабиноидов [14].
Более того, те механизмы по которым работают анандамид и 2-АГ разнятся именно из-за их различного синтеза. Как показывают исследования, синтез 2-АГ тесно связан с диацилглицерин липазой (ДАГ), которая существует в двух формах: ДАГ-альфа и ДАГ-бета. Оба соединения играют большую роль в микроглиальном образовании 2-АГ. В свою очередь синтез анадамида происходит на пресинаптической мембране, так как специфический фермент и субстрат находятся именно на пресинаптической мембране.
Именно поэтому ретроградный механизм действия больше присущ 2-АГ, чем анандамиду, который зачастую действует по неретроградному механизму [12].
Несмотря на то, что каннабиноиды эндогенного происхождения направлены на одни и те же рецепторы, их действия разнятся между собой, что и показывает их проявления в различных тестах и экспериментах. 2-АГ был открыт значительно позже, чем анандамид, но именно он является главенствующим веществом в данной системе.
Именно 2-АГ является полным агонистом рецептором как первого, так и второго типа, в отличие от анандамида. Анандамид является частичным агонистом рецепторов первого типа и малоактивен по отношению к рецепторам второго типа [14].
Механизм и принцип действия каннабиноидов на рецепторы
Как сказано ранее, известно о модулирующей роли ЭКБ в высвобождении нейротрансмиттеров. Выделено 3 механизма регуляции данного процесса:
- Ретроградный.
- Неретроградный.
- Нейрон-астроцитарный.
Все эти механизмы влияют на определенные клетки по определенному механизму (рис. 2).
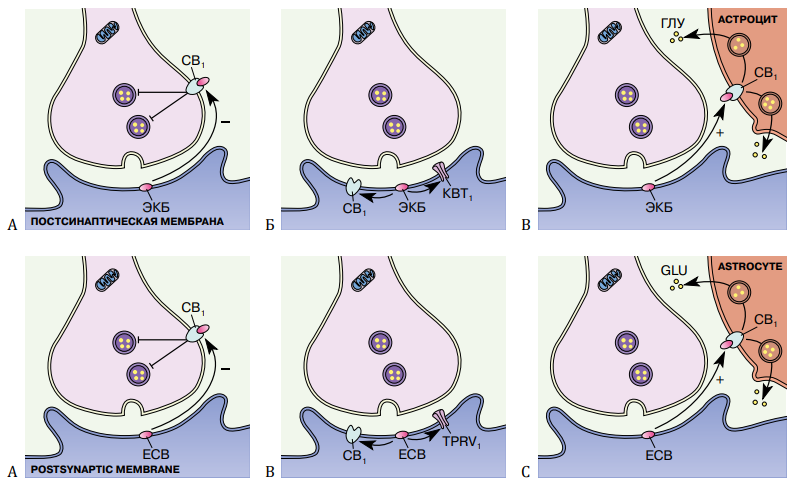
Рисунок 2. Механизмы регуляции высвобождения нейромедиаторов: A — ретроградный механизм, Б — не ретроградный механизм, В — нейрон-астроцитарный механизм. ЭКБ — участок синтеза эндоканнабиноида, CB1 — каннабиноидный рецептор первого типа, КВТ1 — каналы винилоидного типа 1, ГЛУ — глутаминовая кислота [14].
Ретроградный механизм назван в честь того, что рецептор, на который действуют эндоканнабиноиды, находится на пресинаптической мембране, а не на постсинаптической (рис. 2А). В свою очередь выделение ЭКБ происходит с постсинаптической мембраны. Данный механизм интересен с точки зрения токсического влияния нейротрансмиттеров на клетки организма. Такая сигнализация вызывает тип краткосрочной синаптической нейрональной пластичности, выключая выход трансмиттера от нескольких секунд до минуты. ЭКБ являются ингибиторами токсического возбуждения — гибели нейронов, которая происходит из-за увеличения содержания в них Са2+ за счёт повышения выделения глутаминовой кислоты и чрезмерной активации глутаматергических механизмов.
Кроме этого, каннабиноиды, агонисты СВ1, ингибируют вольтаж-зависимые кальциевые каналы, снижают активность глутаматергической передачи, тем самым действуя по принципу нейрональной пластичности или нейропластичности. Угнетение передачи нейротрансмиттера агонистами СВ1 лежит в основе нейропротекторного действия каннабиноидной системы [15].
Неретроградный тип действия работает только на постсинаптической мембране, тем самым действуя на рецептор СВ1 и канал винилоидного типа (КВТ1) на той же мембране (рис. 2Б). Данный механизм особенно актуален для анандамида.
Наконец, необычный способ передачи сигнала, при котором эндоканнабиноиды активируют каннабиноидные рецепторы на мембранах близлежащих астроцитов, что приводит к высвобождению глутамата из глиальных клеток, называется нейрон-астроцитарным (рис. 2В) [14].
Действия каннабиноидов по какому-либо из трёх механизмов приводят к «классической» тетраде каннабиноидов, состоящей из (1) снижения локомоторной активности, (2) гипотермии, (3) каталепсии, и (4) гипоалгезии. Эти эффекты опосредуются в основном рецепторами CB1, поскольку они блокируются антагонистами данного типа рецепторов и активируются при введении селективного агониста СВ1. Они практически отсутствуют у мышей с нокаутом CB1 [16].
Каннабидиол и тетрагидроканнабинол, их сходства и различия
КБД и ТГК относятся к группе экзогенных фитоканнабиноидов. Данная группа каннабиноидов обладают высокой липофильностью и имеют низкую биодоступность при приёме внутрь по сравнению с ингаляционными методом. При ингаляционном методе употребления КБД и, в особенности ТГК, не подвергаются первичному прохождению через печень, благодаря чему их концентрация в плазме крови возрастает намного быстрее [17].
О фитоканнабиноидах важно говорить в сравнении с действием ЭКБ, так как в экспериментах с фитоканнабиноидами ТГК показал себя как эндоканнабиноид с проявлением классической каннабиноидной тетрады. Важным фактом в фармакодинамике ТГК является то, что он является психоактивным веществом в отличие от КБД. Этот факт является следствием того, что точки приложения ТГК И КБД имеют различия.
ТГК в основном действует на каннабиноидные рецепторы СВ1, расположенные в ЦНС: стриатум, миндалина, парагиппокампальная извилина и передняя поясная префронтальная кора. Это было доказано нейровизуалиционными исследованиями, которые показали увеличение кровообращения в данных зонах при приёме ТГК.
В свою очередь КБД не является ни агонистом, ни антагонистом каннабиноидных рецепторов. Имеется два предположения о его механизме действия.
Первый механизм. Каннабидиол действует как негативный аллостерический регулятор рецепторов. Именно поэтому каннабидиол может регулировать действие психоактивных влияний ТГК. Вероятно, связываясь с рецепторами, ТГК в отличие от КБД вызывает те самые негативные психоактивные проявления, который ингибирует это действие через аллостерический центр, не связываясь с самим рецептором. Именно поэтому КБД является перспективным направлением во многих клинических задачах. Поэтому, предположительно, концентрация КБД в медицинской конопле должна коррелироваться с концентрацией ТГК для достижения оптимального терапевтического эффекта.
Второй механизм. КБД, вероятно, тормозя гидролиз эндогенных каннабиноидов (в особенности анандамида), вызывает удлинение фазы распада веществ и удлинение действия этих веществ в синапсе [14].
ТГК и ЭКБ взаимодействуют с рецепторами CB1 и CB2 в своих ортостерических сайтах. Однако большой размер каннабиноидного комплекса дает широкие возможности для сайтов, где другие молекулы могут связываться и регулировать функцию рецептора. Хотя мало что известно об аллостерической модуляции рецепторов CB2, было описано несколько положительных и отрицательных аллостерических модуляторов рецепторов CB1.
Классически аллостерические модуляторы могут влиять на кинетику ортостерического связывания лигандов, на эффективность активации рецепторов или на то, и другое одновременно. Аллостерический модулятор может изменять сигнализацию ТГК, но не эндогенную каннабиноидную сигнализацию. Важным отрицательным аллостерическим модулятором рецепторов CB1 является КБД, который ослабляет активацию CB1 ТГК и эндогенными каннабиноидами в нескольких анализах in vitro. Отрицательная аллостерическая модуляция CB1 КБД может объяснить, почему некоторые (но не все) исследования, обнаружили, что штаммы каннабиса, содержащие КБД (или КБД совместно с ТГК) могут вызывать менее экстремальную психоактивность и почему частое потребление каннабиса с высоким содержанием КБД может быть менее вредным, чем аналогичное потребление каннабиса с низким КБД [12].
Клиническое применение и перспективы продолжающихся исследований эндоканнабиноидной системы
На сегодняшний день в Российской Федерации клиническое применение препаратов каннабиса и его производных не легализовано, так как лекарственные средства (ЛС) на основе ТГК относятся к списку I запрещенных веществ1. Но, несмотря на на продолжающиеся дискуссии о рисках применения медицинского каннабиса, существует несколько групп ЛС, которые применяются в лечебной практике в ряде стран (США, Канада, Австралия, Дания и др.).
Таким образом, известны такие группы ЛС, как:
- Высокоочищенные растительные каннабиноиды (набиксимолс, КБД).
- Синтетические изомеры ТГК (дронабинол, набилон).
На сегодняшний день наиболее используемыми в клинической практике являются несколько ЛС, а именно набилон (Цесамет®), КБД (Эпидиолекс®), набиксимолс (Сативекс®) и дронабинол (Маринол® и Синдрос®).
Набиксимолс (Сативекс®) представляет собой экстракт цельного растения, который был очищен до активных компонентов КБД и ТГК. Данное ЛС используется в таких странах как Австралия2, Канада3, Бразилия4, Германия5, Дания6, Великобритания7, Швейцария 8 Сативекс® доступен в соотношении ТГК и КБД, равное 1:1, в виде спрея для слизистой оболочки полости рта, используемого для лечения болевого синдрома при рассеянном склерозе и раке. Также в 2001 г. в Британском Медицинском Журнале были представлены исследования, в которых была установлена относительная эффективность ЛС по отношению к мышечным спазмам при рассеянном склерозе [18]. Стоит упомянуть о его побочном действии (головокружение и усталость), в то время как психические симптомы, такие как тревога, изменения настроения и параноидальные идеи, наблюдаются редко [19].
Эпидиолекс® является лекарственным средством, содержащим исключительно КБД [20]. Начиная с апреля 2018 г., данный препарат одобрен консультативной группой Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) (США) и в Швейцарии для лечения синдрома Леннокса-Гасто и синдрома Драве (тяжелые и редкие формы эпилепсии) [18]. Побочных эффектов несколько: сонливость, снижение аппетита, диарея, усталость, недомогание [21].
Дронабинол (Маринол®) представляет собой синтетическую форму ТГК. Благодаря своим показаниям в качестве стимулятора аппетита и противорвотного средства дронабинол одобрен для лечения анорексии, связанной с потерей веса у пациентов со СПИДом, тошноты и рвоты, связанных с химиотерапией рака в США9. Долгое применение дронабинола может вызвать привыкание. У пациентов, принимающих дронабинол, могут отслеживать изменения сердечного ритма, артериального давления, а также перепады настроения и изменения в поведении. Приём пероорально в форме таблеток или в жидкой форме [22].
Набилон (Цесамет®) одобрен в США, Канаде, а также в Великобритании. Цесамет® представляет собой синтетическую форму ТГК. Он имитирует фармакологическую активность ТГК за счёт слабой частичной агонистической активности в отношении каннабиноидных рецепторов первого и второго типов. Считается, что данное ЛС в два раза активнее ТГК. Набилон одобрен FDA для лечения тошноты и рвоты, связанных с химиотерапией рака, у пациентов, которые не ответили адекватно на классическую противорвотную терапию [23]. Набилон может вызывать головокружение, сонливость, сухость во рту, атаксию, зрительные расстройства, проблемы с концентрацией внимания, эйфория, нарушение сна, деперсонализация, дезориентация, дисфория, головная боль, гипотония, тошнота [23].
Таким образом, исследования показали, что каннабиноиды обладают широким диапазоном терапевтических эффектов. Наиболее доказано действие каннабиоидов против тошноты и рвоты, которые возникают при химиотерапии онкозаболеваний [18][24]. Говоря о нежелательных эффектах каннабиноидов и их производных, стоит упомянуть, что они подразделяются на краткосрочные и долгосрочные. Краткосрочные включают в себя интоксикацию, тревожность, замедление реакций, долгосрочные — зависимость, нарушение мозговой деятельности, повышение вероятности раковых заболеваний [25].
Необходимо отметить, что применение синтетических каннабиноидов менее опасно по сравнению с использованием натуральных продуктов конопли. Это связано с меньшим риском возникновения зависимости и злоупотребления среди пациентов. Многочисленные клинические исследования показывают, что подобные осложнения встречаются достаточно редко. Однако вопрос об употреблении синтетических препаратов каннабиса остается открытым в связи с его главным психодислептическим компонентом ТГК [26].
Несмотря на использование медицинского каннабиса в ряде стран, перспектива использования каннабиноидов в клинической практике в настоящее время всё ещё остаётся достаточно широкой и разнообразной для исследований. Это связано с их большим профилем влияния на организм человека. Именно поэтому можно выделить несколько направлений в потенциальном применении каннабиноидов:
- Применение при различных расстройствах ЦНС (шизофрения, эпилепсия и т. д.).
- Применение при расстройствах восприятия проведения боли (преимущественно, нейропатической боли).
Перспективным действием эндогенных каннабиноидов является их действие на различные нейротрансмиттерные системы организма, такие как глутаматергическая, серотониновая, дофаминовая, глициновая и т. д. В особенности ЭКБ действуют на высвобождение глутамата, серотонина и дофамина, связываясь с соответствующими рецепторами, что играет большую роль в образовании депрессии, эпилепсии, шизофрении и гиперальгезии. Также одним из интересных влияний ЭКБ, как уже говорилось ранее, является глутамат-зависимая нейрональная пластичность, которая играет огромную роль в токсическом действии глутамата на клетки [12][15].
Кроме этого, существенную роль ЭКБ играют в восприятии боли различного генеза. Антиноцицептивные свойства агонистов каннабиноидных рецепторов первого типа продемонстрированы в экспериментах с использованием моделей острой боли и воспаления. При периферическом нанесении анандамид подавляет гиперальгезию, вызванную инъекцией каррагенина, за счёт стимуляции CB1 рецепторов [15].
Также ЭКБ система показывает положительную динамику при обезболивании невропатических болей. При повреждении седалищного нерва у крыс образовался стойкий болевой синдром, но после введения каннабиноидов наблюдалась обезболивание до трёх недель. Похожие эксперименты были проведены с перевязкой спинного нерва, а также сдавлением тройничного нерва у крыс. После введения КБД наблюдалось снижение болевых ощущений [27].
Помимо перспективного действия агонистов рецептора первого типа, не менее интересным профилем обладают агонисты рецепторов второго типа. Например, такое вещество, как JWH133. По своей структуре данное вещество является синтетическим веществом с высоким аффинитетом к каннабиноидному рецептору второго типа, лишённым психогенной активности. JWH133 демонстрирует кардиопротекторный, гепатопротекторный, гастропротекторный, а также иммуномодулирующий и противогиперальгетический профили [28–32].
Важно упомянуть, что использование каннабиса в медицинских целях зачастую подразумевает под собой адъювантную терапию. Согласно исследованиям, некоторые каннабиноиды показывают наибольшую эффективность в комбинации с другими лекарственными средствами, когда предыдущая линия терапии не дала нужного результата или не помогла совсем [25][33].
Заключение
Несмотря на неоднозначность и спорность применения групп каннабиноидов, дискуссионность их практического применения, с точки зрения фармакологической активности, они представляют высокий научно-практический интерес. На наш взгляд, целесообразно проведение дальнейших исследований для детализации их свойств, изучения возможностей расширения их применения, в том числе в условиях национального здравоохранения.
1. Федеральный закон от 08.01.1998 N 3-ФЗ (ред. от 28.04.2023) "О наркотических средствах и психотропных веществах" (с изм. и доп., вступ. в силу с 09.05.2023)
2. Australian Government. Department of Health and Aged Care. Guidance for the use of medicinal cannabis in Australia: Patient information. Dec 2017.
3. Health Canada. Review of cannabidiol. Report of the Science Advisory Committee on Health Products Containing Cannabis. Jul 2022.
4. Agência Nacional de Vigilância Sanitária (ANVISA) RDC n. 335. Jan 2020.
5. Federal Institute for Drugs and Medical Devices. Annual Report 2017/18.
6. Danish Medicines Agency (DKMA). Medicinal Cannabis Pilot Programme. Mar 2022.
7. Advisory Council on the Misuse of Drugs (ACMD).Cannabis-based products for medicinal use (CBPMs) in humans. Nov 2020.
8. Swiss Confederation, Federal Office of Public Health. Medical cannabis for treating various symptoms in Switzerland. Aug 2020.
9. U.S. Department of Health and Human Services. Food and Drug Administration (FDA). FDA Approved Cannabis-derived or Synthetic Cannabis-related Products. Feb 2022.
Список литературы
1. Pantoja-Ruiz C, Restrepo-Jimenez P, Castañeda-Cardona C, Ferreirós A, Rosselli D. Cannabis and pain: a scoping review. Braz J Anesthesiol. 2022;72(1):142-151. DOI: 10.1016/j.bjane.2021.06.018
2. Crocq MA. History of cannabis and the endocannabinoid system. Dialogues Clin Neurosci. 2020;22(3):223-228. DOI: 10.31887/DCNS.2020.22.3/mcrocq
3. Adams R, Hunt M, Clark JH. Structure of Cannabidiol, a Product Isolated from the Marihuana Extract of Minnesota Wild Hemp. J. Am. Chem. Soc. 1940;62(1):196-200. DOI: 10.1021/ja01858a058
4. Gaoni Y, Mechoulam R. Isolation, Structure, and Partial Synthesis of an Active Constituent of Hashish. J. Am. Chem. Soc. 1964;86(8):1646-1647. DOI: 10.1021/ja01062a046
5. Devane WA, Dysarz FA 3rd, Johnson MR, Melvin LS, Howlett AC. Determination and characterization of a cannabinoid receptor in rat brain. Mol Pharmacol. 1988;34(5):605-613. PMID: 2848184
6. Devane WA, Hanus L, Breuer A, Pertwee RG, Stevenson LA, Griffin G, et al. Isolation and structure of a brain constituent that binds to the cannabinoid receptor. Science. 1992;258(5090):1946-1949. DOI: 10.1126/science.1470919
7. Munro S, Thomas KL, Abu-Shaar M. Molecular characterization of a peripheral receptor for cannabinoids. Nature. 1993;365(6441):61-65. DOI: 10.1038/365061a0
8. Sugiura T, Kondo S, Sukagawa A, Nakane S, Shinoda A, Itoh K, et al. 2-Arachidonoylglycerol: a possible endogenous cannabinoid receptor ligand in brain. Biochem Biophys Res Commun. 1995;215(1):89-97. DOI: 10.1006/bbrc.1995.2437
9. Ahmad A. Endocannabinoid system: An untold story in hypertensive nephropathy. Electron J Gen Med. 2023;20(3):em481. DOI: 10.29333/ejgm/13055
10. Amin MR, Ali DW. Pharmacology of Medical Cannabis. Adv Exp Med Biol. 2019;1162:151-165. DOI: 10.1007/978-3-030-21737-2_8
11. Morris G, Walder K, Kloiber S, Amminger P, Berk M, Bortolasci CC, et al. The endocannabinoidome in neuropsychiatry: Opportunities and potential risks. Pharmacol Res. 2021;170:105729. DOI: 10.1016/j.phrs.2021.105729
12. Lu HC, Mackie K. Review of the Endocannabinoid System. Biol Psychiatry Cogn Neurosci Neuroimaging. 2021;6(6):607-615. DOI: 10.1016/j.bpsc.2020.07.016
13. Palmisano M, Gargano A, Olabiyi BF, Lutz B, Bilkei-Gorzo A. Hippocampal Deletion of CB1 Receptor Impairs Social Memory and Leads to Age-Related Changes in the Hippocampus of Adult Mice. Int J Mol Sci. 2022;24(1):26. DOI: 10.3390/ijms24010026
14. Meyer JS, Farrar AM. Marijuana and the Cannabinoids. In: Biezonski D, Yates JR, editors. Psychopharmacology. Drugs, the brain, behavior. 4th ed. Sunderland, Massachusetts, USA: Oxford University Press; 2023. p. 445-482.
15. Scarante FF, Vila-Verde C, Detoni VL, Ferreira-Junior NC, Guimarães FS, Campos AC. Cannabinoid Modulation of the Stressed Hippocampus. Front Mol Neurosci. 2017;10:411. DOI: 10.3389/fnmol.2017.00411
16. Moore CF, Weerts EM. Cannabinoid tetrad effects of oral Δ9-tetrahydrocannabinol (THC) and cannabidiol (CBD) in male and female rats: sex, dose-effects and time course evaluations. Psychopharmacology (Berl). 2022;239(5):1397-1408. DOI: 10.1007/s00213-021-05995-5
17. Lucas CJ, Galettis P, Schneider J. The pharmacokinetics and the pharmacodynamics of cannabinoids. Br J Clin Pharmacol. 2018;84(11):2477-2482. DOI: 10.1111/bcp.13710
18. Fraguas-Sánchez AI, Torres-Suárez AI. Medical Use of Cannabinoids. Drugs. 2018;78(16):1665-1703. DOI: 10.1007/s40265-018-0996-1
19. Prieto González JM, Vila Silván C. Safety and tolerability of nabiximols oromucosal spray: a review of more than 15 years" accumulated evidence from clinical trials. Expert Rev Neurother. 2021;21(7):755-778. DOI: 10.1080/14737175.2021.1935879
20. Abu-Sawwa R, Stehling C. Epidiolex (Cannabidiol) Primer: Frequently Asked Questions for Patients and Caregivers. J Pediatr Pharmacol Ther. 2020;25(1):75-77. DOI: 10.5863/1551-6776-25.1.75
21. Georgieva D, Langley J, Hartkopf K, Hawk L, Margolis A, Struck A, et al. Real-world, long-term evaluation of the tolerability and therapy retention of Epidiolex® (cannabidiol) in patients with refractory epilepsy. Epilepsy Behav. 2023;141:109159. DOI: 10.1016/j.yebeh.2023.109159
22. Tagen M, Klumpers LE. Review of delta-8-tetrahydrocannabinol (Δ8 -THC): Comparative pharmacology with Δ9 -THC. Br J Pharmacol. 2022;179(15):3915-3933. DOI: 10.1111/bph.15865
23. Legare CA, Raup-Konsavage WM, Vrana KE. Therapeutic Potential of Cannabis, Cannabidiol, and Cannabinoid-Based Pharmaceuticals. Pharmacology. 2022;107(3-4):131-149. DOI: 10.1159/000521683
24. Badowski ME. A review of oral cannabinoids and medical marijuana for the treatment of chemotherapy-induced nausea and vomiting: a focus on pharmacokinetic variability and pharmacodynamics. Cancer Chemother Pharmacol. 2017;80(3):441-449. DOI: 10.1007/s00280-017-3387-5
25. Cohen K, Weizman A, Weinstein A. Positive and Negative Effects of Cannabis and Cannabinoids on Health. Clin Pharmacol Ther. 2019;105(5):1139-1147. DOI: 10.1002/cpt.1381
26. Rock EM, Parker LA. Constituents of Cannabis Sativa. Adv Exp Med Biol. 2021;1264:1-13. DOI: 10.1007/978-3-030-57369-0_1
27. Mlost J, Bryk M, Starowicz K. Cannabidiol for Pain Treatment: Focus on Pharmacology and Mechanism of Action. Int J Mol Sci. 2020;21(22):8870. DOI: 10.3390/ijms21228870
28. Yu W, Jin G, Zhang J, Wei W. Selective Activation of Cannabinoid Receptor 2 Attenuates Myocardial Infarction via Suppressing NLRP3 Inflammasome. Inflammation. 2019;42(3):904-914. DOI: 10.1007/s10753-018-0945-x
29. Wu HM, Kim TH, Kim A, Koo JH, Joo MS, Kim SG. Liver X Receptor α-Induced Cannabinoid Receptor 2 Inhibits Ubiquitin-Specific Peptidase 4 Through miR-27b, Protecting Hepatocytes From TGF-β. Hepatol Commun. 2019;3(10):1373-1387. DOI: 10.1002/hep4.1415
30. Tartakover Matalon S, Ringel Y, Konikoff F, Drucker L, Pery S, Naftali T. Cannabinoid receptor 2 agonist promotes parameters implicated in mucosal healing in patients with inflammatory bowel disease. United European Gastroenterol J. 2020;8(3):271-283. DOI: 10.1177/2050640619889773
31. Zhu M, Yu B, Bai J, Wang X, Guo X, Liu Y, et al. Cannabinoid Receptor 2 Agonist Prevents Local and Systemic Inflammatory Bone Destruction in Rheumatoid Arthritis. J Bone Miner Res. 2019;34(4):739-751. DOI: 10.1002/jbmr.3637
32. Cabañero D, Ramírez-López A, Drews E, Schmöle A, Otte DM, Wawrzczak-Bargiela A, et al. Protective role of neuronal and lymphoid cannabinoid CB2 receptors in neuropathic pain. Elife. 2020;9:e55582. DOI: 10.7554/eLife.55582
33. Krzyżewska A, Baranowska-Kuczko M, Mińczuk K, Kozłowska H. Cannabinoids—A New Perspective in Adjuvant Therapy for Pulmonary Hypertension. Int. J. Mol. Sci. 2021;22(18):10048. DOI: 10.3390/ijms221810048
Об авторах
А. В. СафроненкоРоссия
Сафроненко Андрей Владимирович - доктор медицинских наук, доцент, заведующий кафедрой фармакологии и клинической фармакологии.
Ростов-на-Дону
Н. Ю. Саенко
Россия
Саенко Наталья Юрьевна - кандидат медицинских наук, доцент кафедры фармакологии и клинической фармакологии.
Ростов-на-Дону
В. П. Землякова
Россия
Землякова Владислава Павловна - студентка 3 курса лечебно-профилактического факультета.
Ростов-на-Дону
С. К. Кварацхелия
Россия
Кварацхелия Саломе Кобаевна - студентка 3 курса лечебно-профилактического факультета.
Ростов-на-Дону
М. В. Дольникова
Россия
Дольникова Мария Владиславовна - студентка 3 курса лечебно-профилактического факультета.
Ростов-на-Дону
Дополнительные файлы
Рецензия
Для цитирования:
Сафроненко А.В., Саенко Н.Ю., Землякова В.П., Кварацхелия С.К., Дольникова М.В. Фармакологические аспекты каннабиноидов. Южно-Российский журнал терапевтической практики. 2023;4(3):27-35. https://doi.org/10.21886/2712-8156-2023-4-3-27-35
For citation:
Safronenko A.V., Saenko N.Yu., Zemliakova V.P., Kvaratskheliia S.K., Dolnikova M.V. Pharmacological aspects of cannabinoids. South Russian Journal of Therapeutic Practice. 2023;4(3):27-35. (In Russ.) https://doi.org/10.21886/2712-8156-2023-4-3-27-35
JATS XML


























