Перейти к:
Анализ ростового фактора дифференцировки-15 у больных острым инфарктом миокарда с подъёмом сегмента ST на госпитальном этапе лечения
https://doi.org/10.21886/2712-8156-2023-4-4-51-59
Аннотация
Цель: динамическое изучение клинико-лабораторных данных, уровня ростового фактора дифференцировки 15 (GDF-15) в течение госпитального лечения у больных острым инфарктом миокарда с подъёмом сегмента ST (ИМпST). Материалы и методы: проведён анализ клинико-лабораторных данных, параметров эхокардиографии (ЭхоКГ), оценён прогноз госпитальной летальности больных ИМпST по шкале GRACE. Выявлены клинико-лабораторные особенности больных ИМпST с учётом значений GDF-15. Статистическая обработка проводилась с применением пакета статистических программ «Statistica 10.0 for Windows». Результаты: данные клинико-лабораторной характеристики больных ИМпST в первые сутки заболевания предопределяли прогноз. Значения GDF-15 повышались в первые сутки развития ИМпST и зависели от степени риска госпитальной летальности шкалы GRACE. Значения GDF-15 имели тенденцию к снижению в течение стационарного этапа лечения. Больные ИМпST с концентрацией GDF-15 ≥ 1200 нг/мл не достигали референтных значений в динамике госпитального лечения, имели более высокие значения маркеров некроза миокарда, отражая влияние на прогноз. Заключение: показатель GDF-15 возможно использовать в качестве маркера прогноза ИМпST в сочетании с оценкой шкалы GRACE. Высокие значения GDF-15 в течение госпитального этапа лечения пациентов отражают прогноз больных ИМпST.
Для цитирования:
Хоролец Е.В., Ахвердиева М.К., Шлык С.В. Анализ ростового фактора дифференцировки-15 у больных острым инфарктом миокарда с подъёмом сегмента ST на госпитальном этапе лечения. Южно-Российский журнал терапевтической практики. 2023;4(4):51-59. https://doi.org/10.21886/2712-8156-2023-4-4-51-59
For citation:
Khorolets E.V., Akhverdieva M.K., Shlyk S.V. Analysis of growth differentiation factor-15 at the hospital stage of treatment of patients with acute myocardial infarction. South Russian Journal of Therapeutic Practice. 2023;4(4):51-59. (In Russ.) https://doi.org/10.21886/2712-8156-2023-4-4-51-59
Введение
Поиск новых факторов риска, маркеров прогноза, оптимальной тактики ведения больных острым инфарктом миокарда с подъёмом сегмента ST (ИМпST) продолжается и по настоящее время. Успех консервативной терапии и хирургического лечения острого коронарного синдрома (ОКС) зависит от многих факторов, среди которых важнейшую роль, помимо успешного восстановления коронарного кровотока, играет выраженность эндотелиальной дисфункции, сосудистого воспаления, нарушения структуры и функции кардиомиоцитов. Поэтому поиск предикторов неблагоприятного течения сосудистых катастроф, маркеров прогнозопределяющих патологических процессов является актуальной задачей. В фокусе научных изысканий находится оценка современных маркеров прогноза течения острого инфаркта миокарда (ОИМ) в экспериментальных и клинических работах. Активно изучается вклад в развитие и прогрессирование сердечно-сосудистых заболеваний (ССЗ) так называемых новых цитокинов, среди которых особе место занимает ростовой фактор дифференцировки — 15 (РДФ или GDF-15). Известно, что GDF-15 является членом суперсемейства белков трансформирующего фактора роста β. Трансформирующий фактора роста β осуществляет контроль над пролиферацией, клеточной дифференцировкой, участвует в иммуно -, ангио-, фиброгенезе [1][2]. GDF-15 в свою очередь через различные механизмы принимает опосредованное участие в повышении защитного потенциала кардиомиоцитов. Установлено, что GDF-15 отвечает за регуляцию активации макрофагов, что способствует снижению перерождения макрофагов в пенистые клетки. Увеличение концентрации GDF-15 определяется и в атеросклеротических бляшках [3]. По мнению Kempf T. et al., показатель GDF-15 обладает высоким цитопротективными потенциалом и увеличивает защитные механизмы сердца [3, 4]. В литературе представлены данные об участии показателя GDF-15 в развитии апоптоза, интерлейкин-6-зависимого воспаления сосудистой стенки, процессе атеросклероза [5]. Острое повреждение, стресс гипоксия, воспаление приводят к увеличению уровня GDF-15, тогда как при стабилизации состояния отмечается тенденция к снижению данного показателя [6]. Известно, что снижение уровня GDF-15 соотносится с уменьшением атерогенеза, снижением инфильтрации бляшки макрофагами, уменьшением некротического ядра и увеличением количества образования коллагена, что способствует стабилизации атеросклеротической бляшки. В экспериментальной работе с моделированием ОИМ показано повышение экспрессии GDF-15 в тканях сердца мышей [4].
Установлено, что концентрация GDF-15 в крови коррелирует с факторами риска ССЗ. В частности, доказана роль GDF-15 в увеличении риска развития сердечной недостаточности [7]. Показатель GDF-15 является не просто одним из факторов риска, но и маркером прогноза при ССЗ [8]. В ряде исследований (GUSTO-IV, FRISC-2, ASSENT-2, AMI) значения GDF-15 изучались у больных ОКС с целью стратификации риска [9][10]. Доказано, что при высоких цифрах GDF-15 у больных ОКС увеличивается риск смерти и количество осложнений [11]. Показатель GDF-15 у больных ОИМ является маркером риска развития повторных сердечно-сосудистых событий [12].
Как известно, ИМпST имеет более высокий риск ранних и летальных осложнений на госпитальном этапе лечения. На наш взгляд, является актуальным изучение клинико-лабораторного «портрета» пациентов с ИМпST в первые сутки от начала заболевания, когда риск ранних осложнений выше, когда формируются состояния, влияющие на риск возникновения поздних осложнений и повторных сердечно-сосудистых событий.
Цель исследования — динамическое изучение клинической характеристики, GDF-15 в течение госпитального лечения больных острым инфарктом миокарда с подъёмом сегмента ST.
Материал и методы
В исследование включено 150 больных ИМпST. Учитывая клинические рекомендации (Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы, 2020), диагноз «ИМпST» устанавливали на основании данных жалоб, клинических показателей, ЭКГ критериев, лабораторных биомаркеров некроза миокарда: тропонина I, кретининфосфокиназы (КФК), МВ фракции креатининфосфокиназы (МВ-КФК).
Согласно стандартам надлежащей клинической практики (GoodClinicalPractice) и принципам Хельсинской Декларации, все пациенты ознакомились и подписали информированное согласие до включения в исследование. Критерии включения в исследование: ИМпST в первые сутки заболевания, острая сердечная недостаточность (ОСН) классификации T.Killip II-IV степени, пациенты среднего и пожилого возраста (по данным Всемирной организации здравоохранения (2017) 45 лет и старше), известная в анамнезе артериальная гипертония. Пациенты соответствовали критериям включения для изучения более однородной группы. Критериями исключения явились известные в анамнезе или документированные нарушения углеводного обмена (сахарный диабет первого и второго типа), печеночная недостаточность, почечная недостаточность (при расчётной скорости клубочковой фильтрации (СКФ) менее 30 мл/мин/1,73м2), ранее верифицированные системные заболевания соединительной ткани, онкологические заболевания, инфекционные заболевания. Также в исследование не включались женщины фертильного возраста [10].
Проведён анализ объективных данных пациентов: измерялось систолическое (САД), диастолическое артериальное давление (ДАД), определялась частота сердечных сокращений (ЧСС). Анализировались биохимические параметры крови: биомаркеры некроза миокарда, аспартатаминотрансфераза (АСЛ), аланинаминотрансфераза (АЛТ), уровень мочевины креатинина, рассчитывалась СКФ по формуле CKD-EPI. Иммуноферментным методом (стандартные наборы реактивов Human GDF-15/MIC-1 ELISA (BioVendor, Чехия) определяли значения GDF-15 в крови. Согласно клиническим рекомендациям (Острый инфаркт миокарда с подъёмом сегмента ST электрокардиограммы, 2020), ЭхоКГ у больных ОИМ выполнена в первые сутки заболевания. Оценивались геометрия полостей, локальная и глобальная сократимость сердца, наличие возможных осложнений. В частности, оценивались такие параметры ЭХО-КГ, как размеры левого предсердия (ЛП), правого предсердия (ПП), ЛЖ, правого желудочка (ПЖ), ударный объём (УО), фракция выброса (ФВ) ЛЖ, конечно-систолический объём (КСО) ЛЖ, конечно-диастолический объём (КДО) ЛЖ, давление в лёгочной артерии (ЛА), пик Е, пик А, соотношение E/A. В течение стационарного лечения больных ИМпST проведены визиты наблюдения: 1-й — при госпитализации, 2-й — при выписке из отделения. По шкале Global registry of acute coronary events (GRACE) подсчитан прогноз госпитальной летальности пациентов: при < 126 баллов риск расценивался как низкий (до 2% госпитальной летальности), от 126 до 154 баллов — как средний, (2–5%), более 154 баллов — высокий риск (более 5%). Представлены данные общей характеристики больных ИМпST, проанализированы показатели в группах в зависимости от уровня GDF-15 менее 1200 нг/мл (референсные значения) и GDF-15 ≥ 1200 нг/мл.
Статистическая обработка изучаемого материала выполнялась с применением пакета статистических программ «Statistica 10.0 for Windows». Для оценки статистических различий использовались непараметрические критерии Mann-Whitney, Wilcoxon. Рассчитывали коэффициент корреляции Спирмена и уровня его значимости. В статье полученные данные представлены средними значениями и ошибкой средней (M±m). Методом бинарной логистической регрессии построена прогностическая модель вероятности наличия события. Для расчёта разделяющего значения количественного признака в точке «cut-off» при прогнозировании применялся метод ROC-анализа. Значение точки «cut-off» определялось по наивысшему значению индекса Юдена. Статистически значимыми различия считали при р<0,05.
Результаты
При проведении клинико-лабораторного анализа и оценке показателей ЭЪХО-КГ в общей группе получены характерные для ИМпST данные. Гемодинамически больные ИМпST были стабильны, имели повышенные маркеры некроза миокарда, сохраненную СКФ (81,17±1,98 мл/мин/1,73 м2). Согласно данным ЭхоКГ, у больных ИМпST выявлено снижение систолической функции миокарда ЛЖ (ФВ ЛЖ 46,11±0,50%), увеличение давления в малом круге кровообращения (32,46 ± 0,59 мм. рт. рт.) с тенденцией к увеличению пика А (60,40 ± 1,12 см/с).
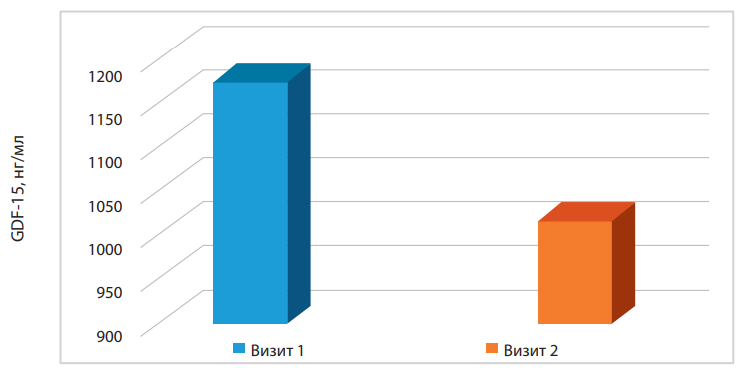
Рисунок 1. Динамика уровня GDF-15 в общей группе больных ИМпST в течение госпитального лечения (р>0,05).
Примечание: визит 1 — госпитализация, визит 2 — выписка пациента из стационара.
В общей группе больных уровень GDF-15 на визите 1 статистически значимо не отличается от такового на визите 2 (р>0,05) (рис. 1). Согласно данным литературы, у пациентов с ОИМ уровень GDF-15 увеличивается в первые сутки заболевания и вносит свой вклад в прогноз.
Представляется интересной оценка на момент поступления в стационар клинико-лабораторных данных у больных ИМпST с нормальным и превышающим референсные значения уровнем GDF-15. В таблице 1 приведена сравнительная характеристика клинико-лабораторных данных в группах больных с уровнем GDF-15<1200 и GDF-15≥1200 нг/мл на момент поступления в стационар.
Таблица 1
Характеристика больных ИМпST в зависимости от уровня GDF-15 (нг/мл)
|
Показатель |
GDF-15<1200, нг/мл |
GDF-15≥1200, нг/мл |
р |
|
Возраст, лет |
60,10±1,50 |
64,09±1,34 |
р<0,05 |
|
САД, мм рт. Ст. |
136,09±23,63 |
133,93±31,13 |
р>0,05 |
|
ДАД, мм рт. Ст. |
82,95±12,62 |
81,34±16,80 |
р>0,05 |
|
ЧСС, ударов в минуту |
80,53±15,29 |
83,10±21,14 |
р>0,05 |
|
Риск госпитальной летальности по шкале GRACE, баллы |
157,69±25,49 |
170,57±36,60, |
р<0,05 |
|
КФК, ЕД/л |
275,24±46,07 |
355,25±52,27 |
р<0,05 |
|
МВ-КФК, ЕД/л |
44,22±6,60 |
78,87±24,54 |
р<0,05 |
|
Креатинин, мкмоль/л |
84,92±3,80 |
84,56±3,72 |
р>0,05 |
|
СКФ, мл/мин/1,73 м2 |
80,29±3,21 |
80,0±2,94 |
р>0,05 |
Группа пациентов с уровнем GDF-15≥1200 нг/мл, была старше по возрасту, имела большее количество баллов по шкале GRACE, что соответствует высокому риску госпитальной летальности по сравнению с группой пациентов, где уровень GDF-15 <1200 нг/мл (р<0,05). Изучаемые показатели гемодинамики (САД, ДАД, ЧСС), а также уровень креатинина и СКФ сопоставимы между собой и не зависят уровня GDF-15 (р>0,05). Больные ИМпST с уровнем GDF-15≥1200 нг/мл имели более высокие значения маркеров некроза миокарда (КФК и МВ-КФК), что отражает больший объём поражения миокарда. Получена положительная корреляция GDF-15 (визит 1) с значениями МВ-КФК r=0,35 (р<0,05).
На рисунке 2 представлены средние значения GDF-15 в группах с уровнем GDF-15<1200 и GDF-15≥1200 нг/мл в течение госпитального лечения больных ИМпST. Получены данные о снижении значений GDF-15 в течение лечения в отделении в группах больных с GDF-15<1200 нг/мл и GDF-15≥1200 нг/мл (р<0,05). При этом обращает внимание, что у больных ИМпST с концентрацией GDF-15≥1200 нг/мл на момент поступления данный показатель не достигал нормальных значений к моменту выписки из стационара, что может свидетельствовать о неблагоприятном прогнозе пациентов.
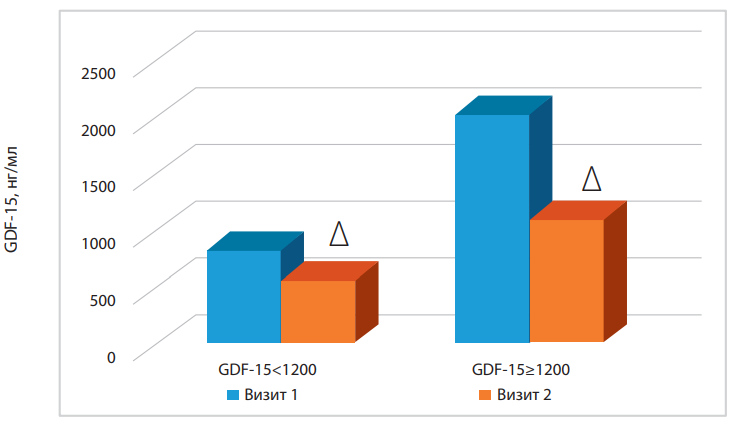
Рисунок 2. Оценка динамики концентрации GDF-15 в группах с уровнем GDF-15<1200 и GDF-15≥1200 нг/мл в течение госпитального лечения больных ИМпST.
Примечание: ∆ — р<0,05 при динамике 1 и 2 визита в изучаемых группах.
По нашим данным, больные ИМпST из группы с уровнем GDF-15≥1200 нг/мл были старше по возрасту, имели более высокие значения маркеров некроза миокарда и самые высокие баллы по шкале GRACE, что соответствует высокому риску госпитальной летальности. При этом в данной группе показатель GDF-15 не достигал референсных значений на этапе выписки из стационара.
Нами получены положительные корреляции значений GDF-15 на визите 1 со значениями GDF-15 визита 2 (r=0,42; р<0,05). Рассчитана отрицательная корреляция между уровня GDF-15 визита 1 с СКФ r=-0,39; (р<0,05). Проведён корреляционный анализ лабораторного маркера GDF-15 с параметрами ЭХО-КГ. Так, уровень GDF-15 на визите 2 имел положительные корреляции с параметрами ПП (r=0,37; р<0,05), ПЖ (r=0,29; р<0,05), давлением в ЛА (r=0,31; р<0,05). Показатели GDF-15 имели отрицательную корреляционную связь со сниженной ФВ ЛЖ как на визите 1 (r=-0,21; р<0,05), так на визите 2 ((r=-0,21; р<0,05). В таблице 2 представлены данные ЭхоКГ больных ИМпST в зависимости от значений GDF-15<1200 и GDF-15≥1200 нг/мл.
Таблица 2
Показатели ЭхоКГ у больных ИМпST в зависимости от значений GDF-15 (нг/мл)
|
Показатель |
GDF-15 <1200, нг/мл |
GDF-15 ≥1200, нг/мл |
р |
|
M±SE |
M±SE |
||
|
Размер ЛП, мм |
42,43 ± 0,97 |
42,01 ± 0,96 |
>0,05 |
|
ЛЖ КСР, мм |
41,76 ± 0,94 |
41,64 ± 0,96 |
>0,05 |
|
ЛЖ КДР, мм |
54,33 ± 0,77 |
53,88 ± 0,80 |
>0,05 |
|
КСО, мл |
75,36 ± 2,13 |
75,42 ± 1,94 |
>0,05 |
|
КДО, мл |
141,43 ± 2,48 |
138,82 ± 2,71 |
>0,05 |
|
ФВ ЛЖ, % |
47,01 ± 0,95 |
46,77 ± 1,14 |
>0,05 |
|
Давление ЛА, мм рт. Ст. |
33,68 ± 1,28 |
33,20 ± 1,29 |
>0,05 |
|
Е, см\с |
52,2 ± 1,53 |
49,58 ± 1,58 |
>0,05 |
|
А, см\с |
61,59 ± 1,64 |
60,37 ± 1,71 |
>0,05 |
|
E\A |
2,33 ± 1,41 |
2,35 ± 1,45 |
>0,05 |
|
Размер ПП, мм |
33,61 ± 1,01 |
34,00 ± 1,01 |
>0,05 |
|
Размер ПЖ, мм |
30,76 ± 1,04 |
31,17 ± 1,04 |
>0,05 |
Полученные данные ЭхоКГ больных ИМпST в зависимости от уровня GDF-15<1200 и GDF-15≥1200 нг/мл статистически значимых различий не имеют. В двух анализируемых группах больных ИМпST выявлено снижение ФВ ЛЖ и увеличение давления в ЛА.
На госпитальном этапе лечения пациенты получали базисную терапию, включая реперфузионную, антитромбоцитарную, гиполипидемическую терапию, b-адреноблокаторы, ингибиторы ренин-ангиотензин-альдостероновой системы. Современные шкалы прогноза позволяют определить риск летальности пациентов с ОИМ в стационаре, одной из которой является шкала госпитальной летальности GRACE.
С учётом риска госпитальной летальности шкалы GRACE (низкий, средний и высокий) нами рассчитан средний уровень GDF-15 на визите госпитализации в стационар и при визите выписке пациента (рис. 3).
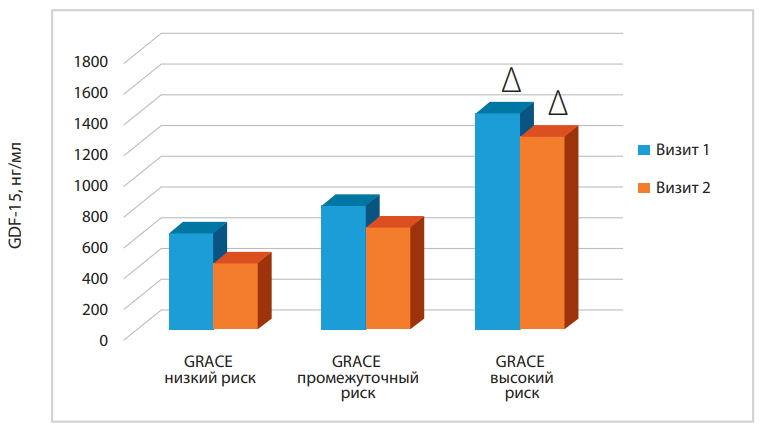
Рисунок 3. Концентрация GDF-15 в группах с различным риском госпитальной летальности шкалы GRACE.
Примечание: ∆ — р<0,05 увеличение концентрации GDF-15 на фоне повышения риска госпитальной летальности шкалы GRACE на 1 и 2 визитах; р>0,05 — при динамике 1 и 2 визита в изучаемых группах.
На рисунке 3 представлены данные увеличения концентрации GDF-15 на визите поступления больных ИМпST на фоне прогрессивного повышения риска госпитальной летальности по шкале GRACE (р<0,05). Не получено статистически значимых различий динамики уровня GDF-15 у больных ИМпST в зависимости от шкалы риска госпитальной летальности GRACE. У пациентов высокого риска по шкале GRACE на визите выписки из стационара уровень GDF-15 сохранялся высоким по сравнению с группой больных ИМпST низкого риска.
Необходимо отметь, что больные ИМпST высокого риска госпитальной летальности по шкале GRACE имеют максимальный уровень GDF-15 уже в первые сутки ОИМ и не достигают нормальных значений при выписке больных на этап амбулаторного лечения.
Известно, что прогноз болных ИМпST на госпитальном этапе обусловлен развитием ранних осложнений, одним из которых является острая левожелудочковая недостаточность. Была разработана прогностическая модель для определения вероятности развития острой левожелудочковой недостаточности у больных ИМпST в зависимости от таких показателей, как возраст, размер ЛП (по данным ЭхоКГ), баллы по шкале риска госпитальной летальности GRACE.
Наблюдаемая зависимость описывается уравнением
P = 1 / (1 + e-z) × 100%
z = -38,642 - 0,231XВозраст + 0,357XЛП + 0,204XGRACE (баллы)
где P — вероятность острой левожелудочковой недостаточности, XВозраст — возраст пациента (лет), XЛП — размер левого предсердия (мм, по данным ЭХОКГ), XGRACE (баллы) — оценка риска госпитальной летальности шкалы GRACE (баллы).
При оценке зависимости вероятности острой левожелудочковой недостаточности от значения логистической функции P с помощью ROC-анализа получена кривая (рис. 4)
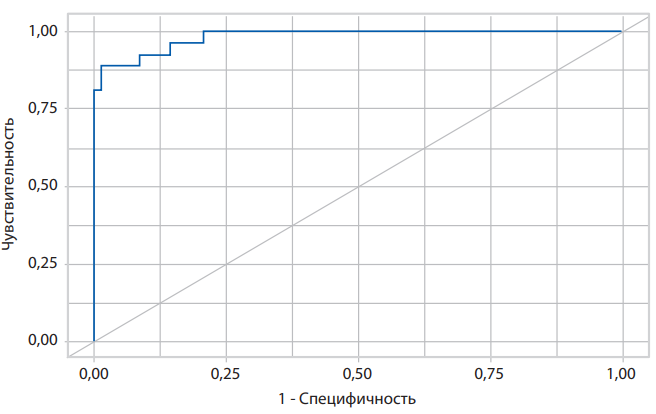
Рисунок 4. ROC-кривая, характеризующая зависимость вероятности показателя «острая левожелудочковая недостаточность» от значения логистической функции P.
Площадь под ROC-кривой составила 0,983±0,018 с 95% ДИ: 0,947–1,000. Полученная модель статистически значима (p<0,001). Пороговое значение логистической функции P в точке «cut-off», которому соответствовало наивысшее значение индекса Юдена, составило 0,144 (вероятность — 14,4%). Острая левожелудочковая недостаточность прогнозировалась при значении логистической функции P выше данной величины или равном ей. Чувствительность и специфичность модели составили 92,6% и 91,2% соответственно. Полученная модель оценки вероятности имеет параметры, которые широко используются в клинической практике, позволяет определить риск развитие острой левожелудочковой недостаточности на госпитальном этапе лечения больных ИМпST.
Обсуждение
Продолжается поиск новых факторов риска, клинических и лабораторных маркеров, влияющих и предопределяющих прогноз больных ИМпST в течение госпитального этапа лечения. Актуальной задачей является изучение лабораторного показателя GDF-15, внедрение новых критериев прогноза в клиническую практику.
Известно, что высокие значения концентрации GDF-15 связаны со снижением СКФ, более высоким уровнем С-реактивного белка, тропонина Т [11]. У изучаемых нами больных ИМпST, СКФ была сопоставима в группах с нормальным и повышенным уровнем GDF-15, при этом высокие значения маркеров некроза миокарда выявлены в группе пациентов с высоким уровнем GDF-15.
У изучаемых пациентов в первые сутки ИМпST выявлено увеличение уровня GDF-15 и отсутствие его динамики в течение госпитального этапа наблюдения пациентов в общей группе, что соответствует источникам литературы [6]. Повышение концентрации GDF-15≥1200 нг/мл у больных ИМпST в первые сутки заболевания предопределяют дальнейший прогноз [10]. Таким образом, возможно выделить группу больных ИМпST с уровнем GDF-15>1200 нг/мл, в которой не отмечается снижение концентрации GDF-15 до нормальных значений в стационаре, что в свою очередь предопределяет прогноз пациентов на госпитальном этапе лечения.
В экспериментальных работах на мышах доказано антигипертрофическое и антиремоделирующее действие уровня GDF-15 [13]. По данным исследования PIVUS, высокий уровень GDF-15 был выявлен при выраженных изменениях ремоделирования миокарда и гипертрофии миокарда ЛЖ [14]. Известно, что уровень GDF-15 коррелирует с параметрами ЭхоКГ (индексом массы миокарда ЛЖ, диастолической дисфункцией ЛЖ, индексом объема ЛП, соотношением E/e’) [15]. Полученные результаты ЭхоКГ больных ИМпST подтверждают снижение сократительной способности миокарда ЛЖ, тенденцию к увеличению давления в малом круге кровообращения и пика А [16]. Согласно литературным данным [17], увеличение уровня GDF-15 связано с увлечением фиброза миокарда, процессами ремоделирования миокарда, что в свою очередь способствует развитию сердечной недостаточности. GDF-15 коррелирует с маркерами повреждения миокарда, больные с ИМпST имеют выше уровень GDF-15 вне зависимости от локализации инфаркта [18].
Нами установлены факторы прогрессирования сердечной недостаточности, такие как тенденция к снижению ФВ, перегрузка правых отделов сердца, признаки лёгочной гипертензии, что подтверждено данными научной литературы [19]. Известно, что у больных с хронической сердечной недостаточностью (ХСН) со сниженной ФВ ЛЖ наблюдаются более высокие значения GDF-15 по сравнению с таковыми у больных с промежуточной ФВ ЛЖ.
Установлено, что уровень GDF-15 более выраженно повышается у пациентов с ХСН с низкой ФВ по сравнению с пациентами с сохранной и промежуточной ФВ. Логично, что данный маркер может быть использован в качестве диагностики типов сердечной недостаточности. Высокая концентрация GDF-15 при ХСН с низкой ФВ ЛЖ является маркером неэффективного лечения и повышения смертности пациентов [20]. Полученные нами результаты позволяют выделить группу с высоким риском развития осложнений, в том числе и сердечной недостаточности.
По результатам нашего исследования, группа больных ИМпST с уровнем GDF-15≥1200 нг/мл имела более высокий риск госпитальной летальности по шкале GRACE, а также, более высокие значения маркеров некроза миокарда.
Заключение
Больные ИМпST с концентрацией GDF-15≥1200 нг/мл в первые сутки заболевания госпитального лечения не достигают нормального уровня GDF-15, имеют более высокие показатели маркеров некроза миокарда, больше баллов по шкале GRACE, что соответствует высокому риску госпитальной летальности. Идентификация больных ИМпST с значениями GDF-15≥1200 нг/мл позволяют своевременно оценить прогноз развития сердечной недостаточности и выбрать правильную тактику ведения. Разработана модель оценки риска развития острой левожелудочковой недостаточности у больных ИМпST на госпитальном этапе лечения.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Zimmers TA, Jin X, Hsiao EC, McGrath SA, Esquela AF, Koniaris LG. Growth differentiation factor-15/macrophage inhibitory cytokine-1 induction after kidney and lung injury. Shock. 2005;23(6):543-8. PMID: 15897808.
2. Алиева А.М., Резник Е.В., Пинчук Т.В., Аракелян Р.А., Валиев Р.К., Рахаев А.М., и др. Фактор дифференцировки роста-15 (GDF-15) как биологический маркер при сердечной недостаточности. Архивъ внутренней медицины. 2023;13(1):14-23. DOI: 10.20514/2226-6704-2023-13-1-14-23
3. Kempf T, Zarbock A, Widera C, Butz S, Stadtmann A, Rossaint J, et al. GDF-15 is an inhibitor of leukocyte integrin activation required for survival after myocardial infarction in mice. Nat Med. 2011;17(5):581-8. DOI: 10.1038/nm.2354
4. de Jager SC, Bermúdez B, Bot I, Koenen RR, Bot M, Kavelaars A, et al. Growth differentiation factor 15 deficiency protects against atherosclerosis by attenuating CCR2-mediated macrophage chemotaxis. J Exp Med. 2011;208(2):217-25. DOI: 10.1084/jem.20100370
5. Bonaterra GA, Zügel S, Thogersen J, Walter SA, Haberkorn U, Strelau J, et al. Growth differentiation factor-15 deficiency inhibits atherosclerosis progression by regulating interleukin-6-dependent inflammatory response to vascular injury. J Am Heart Assoc. 2012;1(6):e002550. DOI: 10.1161/JAHA.112.002550
6. Wesseling M, de Poel JHC, de Jager SCA. Growth differentiation factor 15 in adverse cardiac remodelling: from biomarker to causal player. ESC Heart Fail. 2020;7(4):1488-1501. DOI: 10.1002/ehf2.12728
7. Norozi K, Buchhorn R, Yasin A, Geyer S, Binder L, Seabrook JA, et al. Growth differentiation factor 15: an additional diagnostic tool for the risk stratification of developing heart failure in patients with operated congenital heart defects? Am Heart J. 2011;162(1):131-5. DOI: 10.1016/j.ahj.2011.03.036
8. Wollert KC, Kempf T, Wallentin L. Growth Differentiation Factor 15 as a Biomarker in Cardiovascular Disease. Clin Chem. 2017;63(1):140-151. DOI: 10.1373/clinchem.2016.255174
9. Argmann CA, Van Den Diepstraten CH, Sawyez CG, Edwards JY, Hegele RA, Wolfe BM, et al. Transforming growth factor-beta1 inhibits macrophage cholesteryl ester accumulation induced by native and oxidized VLDL remnants. Arterioscler Thromb Vasc Biol. 2001;21(12):2011-8. DOI: 10.1161/hq1201.099426
10. Xu J, Kimball TR, Lorenz JN, Brown DA, Bauskin AR, Klevitsky R, et al. GDF15/MIC-1 functions as a protective and antihypertrophic factor released from the myocardium in association with SMAD protein activation. Circ Res. 2006;98(3):342-50. DOI: 10.1161/01.RES.0000202804.84885.d0
11. Bonaca MP, Morrow DA, Braunwald E, Cannon CP, Jiang S, Breher S, et al. Growth differentiation factor-15 and risk of recurrent events in patients stabilized after acute coronary syndrome: observations from PROVE IT-TIMI 22. Arterioscler Thromb Vasc Biol. 2011;31(1):203-10. DOI: 10.1161/ATVBAHA.110.213512
12. Сабирзянова А.А., Галявич А.С., Балеева Л.В., Галеева З.М. Прогностическое значение фактора дифференцировки роста-15 у пациентов с инфарктом миокарда. Российский кардиологический журнал. 2021;26(2):4288. DOI: 10.15829/1560-4071-2021-4288
13. Lind L, Wallentin L, Kempf T, Tapken H, Quint A, Lindahl B, et al. Growth-differentiation factor-15 is an independent marker of cardiovascular dysfunction and disease in the elderly: results from the Prospective Investigation of the Vasculature in Uppsala Seniors (PIVUS) Study. Eur Heart J. 2009;30(19):2346-53. DOI: 10.1093/eurheartj/ehp261
14. Хоролец Е.В., Шлык С.В. Оценка прогноза сердечной недостаточности у пациентов с острым инфарктом миокарда в период стационарного лечения. Современные проблемы науки и образования. 2018;4:162. eLIBRARY ID: 36344974; EDN: YMHAAX
15. Хоролец Е.В., Шлык С.В. Особенности ростового фактора дифференцировки-15 у пациентов с острым инфарктом миокарда. Международный журнал сердца и сосудистых заболеваний. 2021;9(30): 28-33. eLIBRARY ID: 46490650; EDN: WTNZGY
16. Хавинсон В.Х., Кузник Б.И., Линькова Н.С., Колчина Н.В. Роль цитокина MIC-1/GDF15 в развитии заболеваний у лиц пожилого возраста (обзор литературы и собственных данных). Успехи физиол. наук. 2015;46(4):38–52. eLIBRARY ID: 25686015; EDN: VQCGQN
17. Сабирзянова А.А., Галявич А.С., Балеева Л.В., Галеева З.М. Фактор дифференцировки роста-15 у пациентов в острой стадии инфаркта миокарда. Кардиология. 2020;60(11):42–48. DOI: 10.18087/cardio.2020.11.n1251
18. Wu CK, Su MM, Wu YF, Hwang JJ, Lin LY. Combination of Plasma Biomarkers and Clinical Data for the Detection of Myocardial Fibrosis or Aggravation of Heart Failure Symptoms in Heart Failure with Preserved Ejection Fraction Patients. J Clin Med. 2018;7(11):427. DOI: 10.3390/jcm7110427
19. Bouabdallaoui N, Claggett B, Zile MR, McMurray JJV, O'Meara E, Packer M, et al. Growth differentiation factor-15 is not modified by sacubitril/valsartan and is an independent marker of risk in patients with heart failure and reduced ejection fraction: the PARADIGM-HF trial. Eur J Heart Fail. 2018;20(12):1701-1709. DOI: 10.1002/ejhf.1301
20. Li J, Cui Y, Huang A, Li Q, Jia W, Liu K, et al. Additional Diagnostic Value of Growth Differentiation Factor-15 (GDF-15) to N-Terminal B-Type Natriuretic Peptide (NT-proBNP) in Patients with Different Stages of Heart Failure. Med Sci Monit. 2018;24:4992-4999. DOI: 10.12659/MSM.910671
Об авторах
Е. В. ХоролецРоссия
Хоролец Екатерина Викторовна - к.м.н., доцент кафедры терапии с курсом поликлинической терапии.
Ростов-на-Дону
М. К. Ахвердиева
Россия
Ахвердиева Милана Камиловна - к.м.н., доцент кафедры терапии с курсом поликлинической терапии.
Ростов-на-Дону
С. В. Шлык
Россия
Шлык Сергей Владимирович - д.м.н., заведующий кафедрой терапии с курсом поликлинической терапии.
Ростов-на-Дону
Дополнительные файлы
Рецензия
Для цитирования:
Хоролец Е.В., Ахвердиева М.К., Шлык С.В. Анализ ростового фактора дифференцировки-15 у больных острым инфарктом миокарда с подъёмом сегмента ST на госпитальном этапе лечения. Южно-Российский журнал терапевтической практики. 2023;4(4):51-59. https://doi.org/10.21886/2712-8156-2023-4-4-51-59
For citation:
Khorolets E.V., Akhverdieva M.K., Shlyk S.V. Analysis of growth differentiation factor-15 at the hospital stage of treatment of patients with acute myocardial infarction. South Russian Journal of Therapeutic Practice. 2023;4(4):51-59. (In Russ.) https://doi.org/10.21886/2712-8156-2023-4-4-51-59


























