Перейти к:
Оценка маркеров апоптотических процессов и пероксидного окисления липидов митохондриальной фракции печени животных-носителей эпидермоидной карциномы Lewis на разных стадиях развития опухолевого процесса при введении оловоорганических соединений с протекторным фрагментом
https://doi.org/10.21886/2712-8156-2023-4-4-89-94
Аннотация
Цель: оценка изменения маркеров апоптотических процессов и пероксидного окисления липидов (ПОЛ) по накоплению малонового диальдегида (МДА) митохондриальной фракции печени животных-носителей эпидермоидной карциномы Lewis на разных стадиях развития опухолевого процесса при введении бис-(3,5-ди-трет-бутил-4-гидроксифенил)тиолат диметилолова (Ме-3) и (3,5-ди-трет-бутил-4-гидроксифенил)тиолат трифенилолова (Ме-5). Материалы и методы: работа выполнена с использованием лабораторных животных (мыши-самки линии C57Bl/6). Через 48 часов после перевивки штамма эпидермоидной карциномы Lewis субстанции Ме-3 и Ме-5 вводили 1 раз в сутки в течение 5 дней внутрибрюшинно в максимально-эффективной дозе 375 мг/кг и 250 мг/кг соответственно. Животным контрольной группы вводили носитель в аналогичных режимах и объёмах. Результаты: при введении Ме-3 в максимально эффективной дозе на 7-е и 21-е сутки отмечено снижение уровня всех исследуемых показателей, что свидетельствует о высокой актиоксидантной активности гибридного оловоорганического соединения, содержащих один оловосодержащий [-Sn(CH3)2] и два протекторных антиоксидантных фрагмента (3,5-ди-трет-бутил-4-гидроксифенил). Соединение Ме-5 обладает более выраженным прооксидантным потенциалом, о чём свидетельсвуют высокие уровни повреждения митохондриальной ДНК (8–гидрокси–2'–дезоксигуанозина) и малонового диальдегида. Выводы: при введении соединений бис-(3,5-ди-трет-бутил-4-гидроксифенил)тиолат диметилолова (Ме-3) и (3,5-ди-трет-бутил-4-гидроксифенил)тиолат трифенилолова (Ме-5) выявлено изменение про/антиоксидантного состояния и запуск апоптотических процессов в клетках печени.
Ключевые слова
Для цитирования:
Алхусейн-Кулягинова М.С., Додохова М.А., Агаризаева С.З., Старостин С.И., Климова Л.Ю., Силин Н.С., Гулян М.В., Шпаковский Д.Б., Милаева Е.Р., Котиева И.М. Оценка маркеров апоптотических процессов и пероксидного окисления липидов митохондриальной фракции печени животных-носителей эпидермоидной карциномы Lewis на разных стадиях развития опухолевого процесса при введении оловоорганических соединений с протекторным фрагментом. Южно-Российский журнал терапевтической практики. 2023;4(4):89-94. https://doi.org/10.21886/2712-8156-2023-4-4-89-94
For citation:
Alhusein-Kulyaginova M.S., Dodokhova M.A., Agarizaeva S.Z., Starostin S.I., Klimova L.Y., Silin N.S., Gulyan M.V., Shpakovsky D.B., Milaeva E.R., Kotieva I.M. Evaluation of markers of apoptotic processes and peroxide oxidation of lipids of the mitochondrial fraction of the liver of animals carrying Lewis epidermoid carcinoma at different stages of the development of the tumor process with the introduction of organotin compounds with a tread fragment. South Russian Journal of Therapeutic Practice. 2023;4(4):89-94. (In Russ.) https://doi.org/10.21886/2712-8156-2023-4-4-89-94
Введение
Злокачественные новообразования по-прежнему остаются одной из основных причин смертности в мире, что определяет необходимость поиска альтернативных терапевтических стратегий для разработки новых противоопухолевых лекарственных средств. Одной из важных терапевтических мишеней являются субклеточные единицы митохондрии. Митохондрии необходимы для роста и прогрессирования опухоли. Сбалансированные процессы динамического равновесия метаболизма митохондрий координируют форму, размер, количество митохондрий, энергетический метаболизм, клеточный цикл, митофагию и апоптоз [1]. Высокая потребность в митохондриальной активности при злокачественных новообразованиях приводит к увеличению продукции митохондриальных активных форм кислорода (mtROS), накоплению мутаций в митохондриальной ДНК и развитию митохондриальной дисфункции [2]. Доказано, что митохондриальная дисфункция способствует агрессивности рака, метастазированию и резистентности к терапии [3]. Таким образом данный процесс может быть предложен в качестве потенциальной терапевтической мишени для лечения злокачественных новообразований.
В последнее время большое число соединений, изучаемых на доклиническом этапе в качестве кандидатов в лекарственные средства, исследованы на предмет влияния на митохондриальный метаболизм на различных модельных системах in vitro и in vivo.
Например, матаирезинол, относящийся к группе лигнанов, запускает апоптоз и вызывает митохондриальные нарушения в репрезентативных клеточных линиях рака поджелудочной железы человека (MIA PaCa-2 и PANC-1), о чём свидетельствуют деполяризация митохондриальной мембраны, изменение содержания кальция и подавление клеточной миграции и связанных с ней внутриклеточных сигнальных путей [4]. Ингибирование митохондриальной функции анизомицином эффективно против тройного негативного рака молочной железы (TNBC) и происходит по механизму индукции каспазозависимого апоптоза, ингибирования митохондриального дыхания и снижения потенциала митохондриальной мембраны и уровня аденозинтрифосфата (АТФ) [5]. Пикеатаннол, природное фенольное соединение растительного происхождения (стильбеноид), обладает широким спектром биологической активности — антипролиферативной, антиоксидантной, противовоспалительной и проапоптотической, что показано в различных исследованиях рака человека in vitro и in vivo с доказанным нарушением работы митохондрий [6].
Оловоорганические соединения широко изучаются в настоящее время как перспективные кандидаты в противоопухолевые лекарственные средства [7][8]. В проведённых нами ранее исследованиях доказано, что развитие векторного направления активности при влиянии гибридных оловоорганических соединений на про/антиоксидантное состояние клетки и апоптотический потенциал митохондрий зависит от соотношения оловосодержащих и антиоксидантных фрагментов и вводимой дозы [9][10]. Изменение состояния митохондрий под влиянием лидерных гибридных оловоорганических соединений в зависимости от степени развития опухолевого процесса требует дополнительного изучения.
Цель исследования — оценка маркеров апоптотических процессов и ПОЛ по накоплению МДА митохондриальной фракции печени животных-носителей эпидермоидной карциномы Lewis на разных стадиях развития опухолевого процесса при введении бис-(3,5-ди-трет-бутил-4-гидроксифенил)тиолат диметилолова (Ме-3) и (3,5-ди-трет-бутил-4-гидроксифенил)тиолат трифенилолова (Ме-5).
Материалы и методы
Работа выполнена с использованием лабораторных животных (мыши-самки линии C57Bl/6). Животные получены из питомника НИЦ «Курчатовский институт» («ПЛЖ «Рапполово»). Все особи прошли карантинное изолирование в течение 14 суток. После истечения срока изоляции животные были осмотрены на отсутствие внешних признаков заболеваний, стандартизированы по полу, возрасту и весу и рандомизированы с помощью таблицы случайных чисел. Исследование одобрено локальным независимым этическим комитетом ФГБОУ ВО «РостГМУ» Минздрава России (протокол №.10/20 от 28.05.2020).
Штамм эпидермоидной карциномы Lewis (LLC) мышей получен из банка опухолевых материалов Научно-исследовательского института экспериментальной диагностики и терапии опухолей РОНЦ им. Н.Н. Блохина. Для поддержания штамма инокулировали в мышцу бедра по 0,3 мл измельченных фрагментов опуxолевой ткани LLC в физиологическом pаcтвоpе xлоpида натpия, а перевивку опухоли опытным животным производили тем же количеством инокулума, но подкожно в правую подмышечную область [11, 12, 13]. Через 48 часов после перевивки соединения Ме-3 и Ме-5 вводили 1 раз в сутки в течение 5 дней внутрибрюшинно в максимально-эффективной дозе 375 мг/кг и 250 мг/кг соответственно. Животным контрольной группы вводили носитель в аналогичных режимах и объёмах. Количество особей во всех группах было одинаковым (n=12). Животных выводили из эксперимента на 7-е и 21-е сутки развития опухолевого процесса. Из ткани печени были выделены митохондрии по классической методике [14]. В митохондриальных образцах с помощью тест-систем методом ИФА определяли концентрацию цитохрома С (нг/г белка), каспазы–9 (нг/г белка), 8–гидрокси–2'–дезоксигуанозина (8–OHdG) (нг/г белка), МДА (нМ/г белка), а количество белка (мг/мл) — биуретовым методом.
Для анализа всех первичных результатов применяли описательную статистику. Статистическую обработку полученных данных проводили с использованием пакета компьютерных программ версии «Statistica 6.0». Нормальность распределения оценивали с помощью модифицированной версии метода Колмогорова-Смирнова, а именно по методике Андерсона-Дарлинга. В качестве количественной характеристики показателей в работе проанализированы среднее арифметическое и среднеквадратическое отклонение (M±m), а также изменение показателя в процентах. Сравнение групп производили попарно.
Субстанции гибридных оловоорганических соединений: ((3,5-ди-трет-бутил-4-гидроксифенилтиолат) трифенилолова (Ме-5) и бис(3,5-ди-трет-бутил-4-гидроксифенилтиолат) диметилолова (Ме-3), содержащих антиоксидантный фрагмент 2,6-ди-трет-бутилфенола, синтезированы в МГУ имени М.В.Ломоносова и предоставлены для исследований.
Результаты
Результаты изменения показателей апоптотических процессов и содержания МДА в митохондриальной фракции печени животных-носителей эпидермоидной карциномы Lewis при введении Ме-3 и Ме-5 приведены на рисунках 1 и 2. На 7-е сутки развития опухолевого процесса в печени, напрямую не задействованной в его росте, отмечено увеличение всех показателей, косвенно свидетельствующих о активации продукции активных форм кислорода, возрастании повреждения митохондриальной ДНК и активации проапоптотического маркера (каспаза-9), что в свою очередь указывает на активацию митохондриального звена апоптоза.
При дальнейшем развитии опухолевого процесса (21-е сутки) повышение показателей сохраняется по сравнению с интактной группой, но отмечено снижение по сравнению с предыдущим этапом развития процесса.
При введении Ме-3 в максимально эффективной дозе на 7-е и 21-е сутки отмечено снижение уровня всех исследуемых показателей, что позволяет доказать высокую актиоксидантную активность гибридного оловоорганического соединения (Ме-3), содержащего один оловосодержащий и два протекторных антиоксидантных фрагмента.
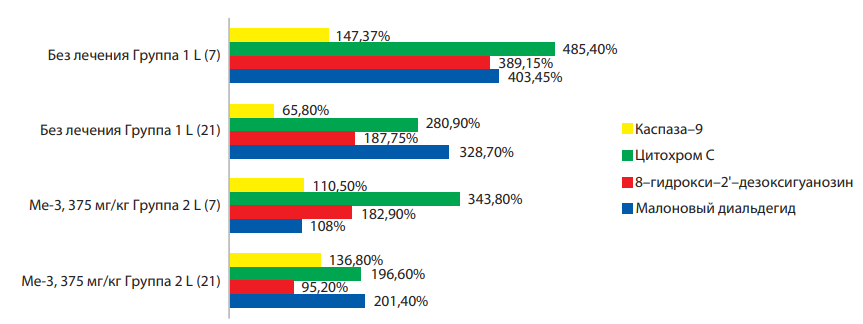
Рисунок 1. Изменение маркеров апоптотических процессов и содержания МДА в митохондриальной фракции печени животных-носителей эпидермоидной карциномы Lewis на 7-е и 21-е сутки развития опухолевого процесса при введении Ме-3.
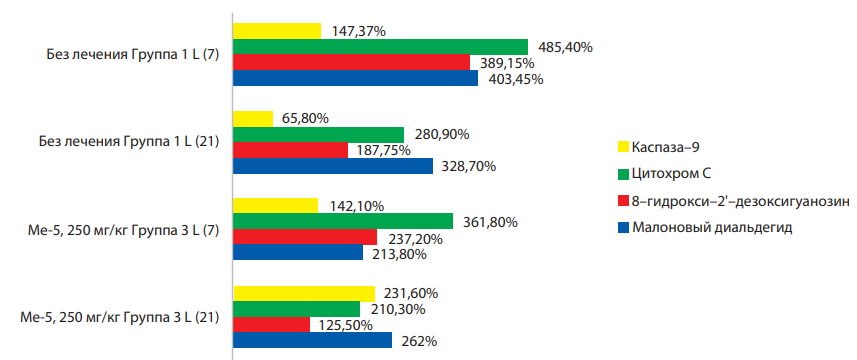
Рисунок 2. Изменение маркеров апоптотических процессов и МДА в митохондриальной фракции печени животных-носителей эпидермоидной карциномы Lewis на 7-е и 21-е сутки развития опухолевого процесса при введении Ме-5.
Следует отметить, что соединение Ме-5 обладает более выраженным прооксидантным потенциалом в сравнении с Ме-3, о чём свидетельсвует более высокий уровень повреждения митохондриальной ДНК. Таким образом, оба соединения проявляют свойства антиоксидантов, но соединение с двумя фенольными группами является более активным антиоксидантом.
Обсуждение
Печень является основным метаболическим органом, регулирующим энергетический обмен всего организма, включая метаболизм глюкозы, жирных кислот и аминокислот, и играет центральную роль в гомеостазе питательных веществ [15]. Основываясь на количестве и плотности митохондрий в печени, метаболические пути в митохондриях, включая β-окисление, цикл трикарбоновых кислот, кетогенез, дыхательную активность и синтез АТФ посредством окислительного фосфорилирования, могут изменяться при физиологических и патологические состояния, включая рак [16].
Амфифильная структура противоопухолевых агентов способствует его накоплению в митохондриях раковых клеток [17], что вызывает накопление окислительных нуклеиновых кислот в цитоплазме [18]. Опухолевая агрессия увеличивает продукцию митохондриальных АФК, ПОЛ, снижая потенциал митохондриальной мембраны [19]. Митохондриальный путь был запущен путём повышения экспрессии белка каспазы 9, более выраженный при влиянии Ме-5. В клетках, подвергающихся апоптозу, высвобождение цитохрома С из митохондрий в цитоплазму и активация каспазы-9, ключевого фермента для стадии апоптотического пути, используются в качестве биомаркеров клеточной гибели (апоптоза) [20][21].
Механизмы реализации противоопухолевого и антиметастатического действия лидерных гибридных органических производных олова [22] на модели солидного роста эпидермоидной карциномы Lewis связаны с изменением активности про/антиоксидантного состояния и запуска апоптотических процессов в клетках печени, напрямую не связанных с опухолевым процессом.
Заключение
При введении соединений бис-(3,5-ди-трет-бутил-4-гидроксифенил)тиолат диметилолова (Ме-3) и (3,5-ди-трет-бутил-4-гидроксифенил)тиолат трифенилолова (Ме-5) выявлено изменение активности про/антиоксидантного состояния и запуска апоптотических процессов в клетках печени, что требует дальнейшей химической модификации тестируемых соединений с повышением уровня их селективности по отношению к опухолевой и условно здоровой клетке.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Kumar S, Ashraf R, C K A. Mitochondrial dynamics regulators: implications for therapeutic intervention in cancer. Cell Biol Toxicol. 2022;38(3):377-406. Erratum in: Cell Biol Toxicol. 2022. PMID: 34661828. DOI: 10.1007/s10565-021-09662-5.
2. Inigo JR, Chandra D. The mitochondrial unfolded protein response (UPRmt): shielding against toxicity to mitochondria in cancer. J Hematol Oncol. 2022;15(1):98. DOI: 10.1186/s13045-022-01317-0.
3. Greier MC, Runge A, Dudas J, Pider V, Skvortsova II, Savic D, et al. Mitochondrial dysfunction and epithelial to mesenchymal transition in head neck cancer cell lines. Sci Rep. 2022;12(1):13255. DOI: 10.1038/s41598-022-16829-5.
4. Lee W, Song G, Bae H. Matairesinol Induces Mitochondrial Dysfunction and Exerts Synergistic Anticancer Effects with 5-Fluorouracil in Pancreatic Cancer Cells. Mar Drugs. 2022;20(8):473. DOI: 10.3390/md20080473.
5. Yang W, Zhou C, Sun Q, Guan G. Anisomycin inhibits angiogenesis, growth, and survival of triple-negative breast cancer through mitochondrial dysfunction, AMPK activation, and mTOR inhibition. Can J Physiol Pharmacol. 2022;100(7):612-620. DOI: 10.1139/cjpp-2021-0577.
6. Çınar Ayan İ, Güçlü E, Vural H, Dursun HG. Piceatannol induces apoptotic cell death through activation of caspase-dependent pathway and upregulation of ROS-mediated mitochondrial dysfunction in pancreatic cancer cells. Mol Biol Rep. 2022;49(12):11947-11957. DOI: 10.1007/s11033-022-08006-8.
7. Devi J, Boora A, Rani M, Arora T. Recent Advancements in Organotin(IV) Complexes as Potent Cytotoxic Agents. Anticancer Agents Med Chem. 2023;23(2):164-191. DOI: 10.2174/1871520622666220520095549
8. Attanzio A, Ippolito M, Girasolo MA, Saiano F, Rotondo A, Rubino S, et al. Anti-cancer activity of di- and tri-organotin(IV) compounds with D-(+)-Galacturonic acid on human tumor cells. J Inorg Biochem. 2018;188:102-112. DOI: 10.1016/j.jinorgbio.2018.04.006
9. Додохова М.А., Сафроненко А.В., Котиева И.М., Милаева Е.Р., Шпаковский Д.Б., Трепель В.Г., и др. Вторичная митохондриальная дисфункция как механизм противоопухолевого и антиметастатического действия гибридных оловоорганических соединений. Вопросы биологической, медицинской и фармацевтической химии. 2021;24(11):28-33. DOI: 10.29296/25877313-2021-11-05
10. Додохова М.А., Котиева И.М., Сафроненко А.В., Трепель В.Г., Алхусейн-Кулягинова М.С., Шпаковский Д.Б., и др. Гибридные оловоорганические соединения - модуляторы апоптотических процессов в печени при однократном и многократном введении крысам линии Wistar. Уральский медицинский журнал. 2021;20(4):18-23. DOI: 10.52420/2071-5943-2021-20-4-18-23
11. Котиева И.М., Франциянц Е.М., Каплиева И.В., Бандовкина В.А., Козлова Л.С., Трепитаки Л.К., и др. Влияние хронической боли на некоторые метаболические процессы в коже самок мышей. Российский журнал боли. 2018;4(58):46-54. DOI: 10.25731/RASP.2018.04.027
12. Кит О.И., Франциянц Е.М., Котиева М.М., Каплиева И.В., Трепитаки Л.К., Бандовкина В.А., и др. Динамика тканевой системы регуляторов плазминогена при меланоме кожи на фоне хронической боли у самок мышей. Трансляционная медицина. 2018;5(2):38-46. DOI: 10.18705/2311-4495-2018-5-2-38-46
13. Кит О.И., Котиева И.М., Франциянц Е.М., Каплиева И.В., Трепитаки Л.К., Бандовкина В.А., и др. Нейромедиаторные системы головного мозга самок мышей в динамике роста злокачественной меланомы, воспроизведенной на фоне хронической боли. Патогенез. 2017;15(4):49-55. DOI: 10.25557/GM.2018.4.9749
14. Егорова М.В., Афанасьев С.А. Выделение митохондрий из клеток и тканей животных и человека: современные методические приемы. Сибирский медицинский журнал (г. Томск). 2011;26(1-1):22-28. eLIBRARY ID: 15778989; EDN: NHHOZX
15. Auger C, Alhasawi A, Contavadoo M, Appanna VD. Dysfunctional mitochondrial bioenergetics and the pathogenesis of hepatic disorders. Front Cell Dev Biol. 2015;3:40. DOI: 10.3389/fcell.2015.00040
16. Lee HY, Nga HT, Tian J, Yi HS. Mitochondrial Metabolic Signatures in Hepatocellular Carcinoma. Cells. 2021;10(8):1901. DOI: 10.3390/cells10081901
17. Jayawardhana AMDS, Zheng YR. Interactions between mitochondria-damaging platinum(IV) prodrugs and cytochrome c. Dalton Trans. 2022;51(5):2012-2018. DOI: 10.1039/d1dt03875c.
18. Song WJ, Jiang P, Cai JP, Zheng ZQ. Expression of Cytoplasmic 8-oxo-Gsn and MTH1 Correlates with Pathological Grading in Human Gastric Cancer. Asian Pac J Cancer Prev. 2015;16(15):6335-8. DOI: 10.7314/apjcp.2015.16.15.6335.
19. Chauhan AK, Mittra N, Singh G, Singh C. Mitochondrial Dysfunction Contributes To Zinc-induced Neurodegeneration: a Link with NADPH Oxidase. J Mol Neurosci. 2022;72(6):1413-1427. DOI: 10.1007/s12031-022-02008-8.
20. Sun X, Zhang T, Cai Y, Yang K, Peng T, Liu R, et al. Tonkinensine B induces apoptosis through mitochondrial dysfunction and inactivation of the PI3K/AKT pathway in triple-negative breast cancer cells. J Pharm Pharmacol. 2021;73(10):1397-1404. DOI: 10.1093/jpp/rgab108.
21. Avrutsky MI, Troy CM. Caspase-9: A Multimodal Therapeutic Target With Diverse Cellular Expression in Human Disease. Front Pharmacol. 2021;12:701301. DOI: 10.3389/fphar.2021.701301.
22. Dodokhova M.A., Safronenko A.V., Kotieva I.M., Alkhuseyn-Kulyaginova M.S., Shpakovsky D.B., Milaeva E.R. Impact of organotin compounds on the growth of epidermoid Lewis carcinoma. Research Results in Pharmacology. 2021;7(4):81-88. Doi: 10.3897/rrpharmacology.7.71455
Об авторах
М. С. Алхусейн-КулягиноваФГБОУ ВО «Ростовский государственный медицинский университет» МЗ РФ
Россия
Алхусейн–Кулягинова Маргарита Стефановна - ассистент кафедры патологической физиологии.
Ростов-на-Дону
М. А. Додохова
Россия
Додохова Маргарита Авдеевна - д.м.н., доцент кафедры патологической физиологии.
Ростов-на-Дону
С. З. Агаризаева
Россия
Агаризаева Сабрина Залумхановна - обучающийся педиатрического факультета.
Ростов-на-Дону
С. И. Старостин
Россия
Старостин Сергей Игоревич - обучающийся лечебно-профилактического факультета.
Ростов-на-Дону
Л. Ю. Климова
Россия
Климова Лариса Юрьевна - обучающийся отделения «Лабораторная диагностика», колледж.
Ростов-на-Дону
Н. С. Силин
Россия
Силин Никита Сергеевич - обучающийся педиатрического факультета.
Ростов-на-Дону
М. В. Гулян
Россия
Гулян Марина Владимировна - к.м.н., доцент кафедры патологической физиологии.
Ростов-на-Дону
Д. Б. Шпаковский
Россия
Шпаковский Дмитрий Борисович - к.х.н., старший научный сотрудник научно-исследовательской лаборатории биоэлементоорганической химии кафедры медицинской химии и тонкого органического синтеза.
Москва
Е. Р. Милаева
Россия
Милаева Елена Рудольфовна - д.х.н., профессор, заведующая кафедрой медицинской химии и тонкого органического синтеза МГУ имени М.В. Ломоносова, Химический факультет.
Москва
И. М. Котиева
Россия
Котиева Инга Мовлиевна - д.м.н., проректор по научной работе, профессор кафедры патологической физиологии.
Ростов-на-Дону
Рецензия
Для цитирования:
Алхусейн-Кулягинова М.С., Додохова М.А., Агаризаева С.З., Старостин С.И., Климова Л.Ю., Силин Н.С., Гулян М.В., Шпаковский Д.Б., Милаева Е.Р., Котиева И.М. Оценка маркеров апоптотических процессов и пероксидного окисления липидов митохондриальной фракции печени животных-носителей эпидермоидной карциномы Lewis на разных стадиях развития опухолевого процесса при введении оловоорганических соединений с протекторным фрагментом. Южно-Российский журнал терапевтической практики. 2023;4(4):89-94. https://doi.org/10.21886/2712-8156-2023-4-4-89-94
For citation:
Alhusein-Kulyaginova M.S., Dodokhova M.A., Agarizaeva S.Z., Starostin S.I., Klimova L.Y., Silin N.S., Gulyan M.V., Shpakovsky D.B., Milaeva E.R., Kotieva I.M. Evaluation of markers of apoptotic processes and peroxide oxidation of lipids of the mitochondrial fraction of the liver of animals carrying Lewis epidermoid carcinoma at different stages of the development of the tumor process with the introduction of organotin compounds with a tread fragment. South Russian Journal of Therapeutic Practice. 2023;4(4):89-94. (In Russ.) https://doi.org/10.21886/2712-8156-2023-4-4-89-94


























