Перейти к:
Случай развития мембранозной нефропатии на фоне атипичного гемолитико-уремического синдрома, активированного в результате острой респираторно-вирусной инфекции
https://doi.org/10.21886/2712-8156-2023-4-4-101-106
Аннотация
В статье рассмотрен клинический случай атипичного гемолитико-уремического синдрома, который явился стартовым механизмом для развития мембранозной нефропатии. У больного Х., 23 лет года, после острой респираторно-вирусной инфекции появились признаки нефротического синдрома, артериальной гипертензии, нарушения функции почек. Была выполнена пункционная нефробиопсия, и морфологическая картина соответствует иммунокомплексному гломерулонефриту, вероятнее всего, мембранозной нефропатии с наличием сегментарного гломерулосклероза, клеточных полулуний. Параллельно у больного верифицированы признаки тромботической микроангиопатии в виде микроангиопатической анемии, тромбоцитопении, повышения уровня лактатдегидрогеназы как признака цитолиза (прежде всего, внутрисосудистого гемолиза). При проведении дифференциальной диагностики остановились на диагнозе атипичного гемолитико-уремического синдрома. Уникальность описываемого клинического случая состоит в том, что случаи развития гломерулонефрита на фоне атипичного гемолитико-уремического синдрома крайне редки, а мембранозная нефропатия описана впервые.
Для цитирования:
Батюшин М.М., Белобородова Т.П., Коробка В.Л., Нестеренко И.Н., Синельник Е.А., Броновицкая Н.А., Бондаренко Н.Б., Батюшина А.М. Случай развития мембранозной нефропатии на фоне атипичного гемолитико-уремического синдрома, активированного в результате острой респираторно-вирусной инфекции. Южно-Российский журнал терапевтической практики. 2023;4(4):101-106. https://doi.org/10.21886/2712-8156-2023-4-4-101-106
For citation:
Batiushin M.M., Beloborodova T.P., Korobka V.L., Nesterenko I.N., Sinelnik E.A., Bronovitskaya N.A., Bondarenko N.B., Batiushina A.M. A case of development of membranous nephropathy against the background of atypical hemolytic-uremic syndrome activated as a result of acute respiratory viral infection. South Russian Journal of Therapeutic Practice. 2023;4(4):101-106. (In Russ.) https://doi.org/10.21886/2712-8156-2023-4-4-101-106
Вступление
Атипичный гемолитико-уремический синдром (аГУС) является наследственно обусловленным проявлением патологии системы комплемента, активирующейся по альтернативному пути и сопровождающейся развитием тромботическом микроангиопатии. Описано большое количество мутаций, приводящих к развитию аГУС, при этом наиболее частой является мутация гена фактора Н [1]. При этом поражение почек является одним из ярких клинических проявлений аГУС [2]. Триггером активизации системы комплемента с развитием тромботической микроангиопатии при аГУС чаще являются разнообразные инфекционные процессы, в том числе COVID-19, но могут являться также беременность и роды, отравления и интоксикации, травмы [3][4]. Помимо типичных вариантов поражения почек, при аГУС возможны и более редкие формы в виде С3-гломерулопатий, которые являются самостоятельными проявлением наследственной патологии системы комплемента, но также в редких случаях могут быть в структуре клинических проявлений аГУС. Крайне редким является манифестация почечных проявлений в виде гломерулонефрита, не относящегося к категории С3-гломерулопатий или С3-доминантных форм [5]. Представляем клинический случай манифестации мембранозной нефропатии в рамках аГУС.
Описание клинического случая
Больной Х. 23 года, до апреля 2022 г. считал себя здоровым человеком. В апреле переболел острой респираторно-вирусной инфекцией (не известно, был ли COVID-19) и в мае стал отмечать появление симметричных отёков нижних конечностей, повышение артериального давления до 160/100 мм рт. ст. При обследовании была выявлена протеинурия нефротического уровня, повышение уровней мочевины (14 ммоль/л) и креатинина крови (232 мкмоль/л), гипопротеинемия (51 г/л). Пациенту была выполнена пункционная нефробиопсия. Морфологическая картина соответствует иммунокомплексному гломерулонефриту, вероятнее всего, мембранозной нефропатии с наличием сегментарного гломерулосклероза, клеточных (38%), фиброзно-клеточных (7,5%) экстракапиллярных полулуний. Также выявлены явления тубулоинтеристициального воспаления и фиброза с атрофией до 30% площади (рис.1–5). Отмечался слабо выраженный гипертрофический тип ремоделирования артерий мышечного и резистивного типов. При проведении иммунофлюоресцентного анализа выявлена cубэпителиальная умеренная мелкогранулярная экспрессия IgG, каппа- и лямбда-цепей иммуноглобулинов ++, в участках сегментарного гломерулосклероза — выраженная экспрессия С3-компонента комплемента +++. При электронной микроскопии выявляются электронноплотные субэпителиальные депозиты, диффузное распластанные малых отростков подоцитов.
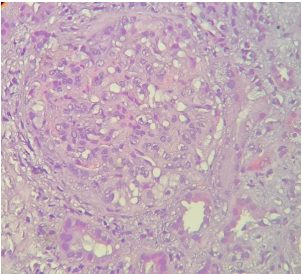
Рисунок 1. Почечный клубочек, в котором отмечается массивная глобулярная гипертрофия и гиперплазия гломерулярного эпителия. Окраска гематоксилином и эозином, увеличение ×400.
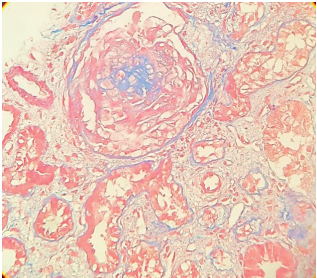
Рисунок 2. Почечный клубочек, в котором отмечается обширный склероз коллабированных капиллярных петель в центральной части (зоны склероза окрашены в синий цвет) и выраженная гиперплазия гломерулярного эпителия. Окраска по Маллори, увеличение ×200.
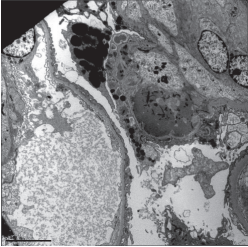
Рисунок 3. Капиллярные петли почечного клубочка. Микротромб в просвете капиллярной петли с участком сегментарного гломерулосклероза. Электронограмма, увеличение ×1000.
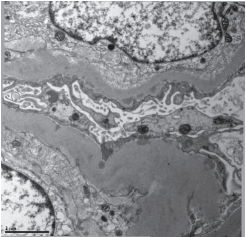
Рисунок 4. Капиллярные петли почечного клубочка. Редкие мелкие электронно-плотные субэпителиальные депозиты. Электронограмма, увеличение ×2500.
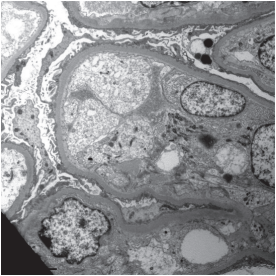
Рисунок 5. Капиллярные петли почечного клубочка. Гидропическая дистрофия эндотелия. Электронограмма, увеличение ×1000.
Пациенту проведена пульс-терапия (метил-преднизолон в сочетании с циклофосфамидом) с последующим применением преднизолона по классической схеме в дозе 60 мг/сут. Учитывая быстрое прогрессирование почечной дисфункции (мочевина — 36 ммоль/л, креатинин — 587 мкмоль/л) применялись процедуры гемодиализа на временном сосудистом доступе. На протяжении последующих трёх месяцев сохранялись признаки нефротического синдрома, острой болезни почек, трансформировавшейся в итоге в хроническую болезнь почек С5А3 (мочевина — 42 ммоль/л, креатинин — 490 мкмоль/л), продолжалась терапия гемодиализом, проводилась антигипертензивная терапия, лечение анемии. В августе 2022 г. перенёс инфекцию COVID-19. В последующем было принято решение о постепенной отмене терапии преднизолоном.
В отношении лабораторной диагностики тромботической микронгиопатии были проведены исследования крови и выявлены признаки миккроангиопатической анемии (60, 68, 72, 90 г/л), не имеющей признаков иммунноопосредованности в своем развитии (непрямая реакция Кумбса отрицательна), тромбоцитопении (80, 120, 98, 124 *109/л), повышения уровня лактатдегидрогеназы (766 МЕ/л) как признака цитолиза (прежде всего внутрисосудистого гемолиза). Отмечалось умеренное снижение уровня С3-компонента комплемента (0,79 г/л), отрицательные значения тестов, свидетельствующих о возможном наличии аутоиммунных заболеваний (ANCA screen — 0,036; 0,04 при норме менее 1,0; антитела к кардиолипину — 7,9 ед/мл при норме менее 10; антитела к двухспиральной ДНК — 9,7; 5,0 ед/мл при норме менее 25). Отмечался повышенный уровень антител к β2-гликопротеину (4,1 ед/мл при норме менее 1). Активность ADAMS-13 составила 52%, что позволило наряду с некоторыми клиническими проявлениями (выраженная почечная дисфункция, отсутствие тяжёлой тромбоцитопении, тяжёлого поражения головного мозга) исключить тромботическую тромбоцитопеническую пурпуру. С учётом наличия тромботической микроангиопатии больному проводились плазмообмены с замещением свежезамороженной плазмы. Применение плазмообменов способствовало стабилизации состояния пациента. Решение о терапии экулизумабом принято не было, поскольку не было полной уверенности в наличии аГУС в качестве причины развития тромботической микроангиопатии, не исключался антифосфолипидный синдром. У больного на фоне заболевания развился генерализованный судорожный припадок, который был расценен неврологами после проведения дополнительного обследования (электроэнцефалография, магнитно-резонансная томография головного мозга) как симптоматическая эпилепсия в рамках дисциркуляторной и дисметаболической энцефалопатии на фоне основного заболевания. Следует заметить, что брат пациента умер в детском возрасте, страдая эпилепсией. Это определяет вероятную наследственную предрасположенность к её развитию. Также у больного была выявлена экссудативно-геморрагическая хориоретинопатия обоих глаз, отслойка сетчатки в правом глазу, в генезе которой не наблюдалось тромбозов ветвей глазной артерии. В настоящее время пациент продолжает получать лечение гемодиализом, антикоагулянтами, антигипертензивную, противоэпилептическую и симптоматическую терапию.
Обсуждение
Развитие у больного тромботической микроангиопатии (неиммунная гемолитическая анемия, тромбоцитопения, признаки цитолиза в виде повышения уровня лактатдегидрогеназы) не вызывает сомнения. При проведении дифференциальной диагностики были исключены тромботическая тромбоцитопеническая пурпура и гемолитико-уремический синдром и вторичные формы тромботической микроангиопатии. Из оставшихся в диагностической корзине патологических процессов были аГУС и антифосфолипидный синдром.
У пациента отмечался повышенный уровень антител к β2-гликопротеину. Повышение данного показателя может быть признаком антифосфолипидного синдрома, однако показано повышение его уровня в крови у больных с инфекцией COVID-9 в 73,9% случаев (в особенности IgA), которую пациент перенес [6]. Также есть наблюдения о повышении уровня антител к β2-гликопротеину при ряде других бактериальных и вирусных инфекций [7]. Выявление волчаночного антикоагулянта однократно также может свидетельствовать в пользу антифосфолипидного синдрома. Однако следует помнить, что пациенту его определяли на фоне применения низкомолекулярного гепарина, а, как известно, в такой ситуации возможны ложно-положительные результаты теста [8]. Также следует учитывать, что повышение уровня волчаночного антикоагулянта наблюдается не только при антифосфолипидном синдроме и системной красой волчанке, но и при различных инфекциях, в том числе инфекции COVID-19 и ряде иммунных заболеваний [9]. В пользу антифосфолипидного синдрома также должны свидетельствовать явления тромбозов, в большей степени артериальных, которых у пациента не наблюдалось. Это в полной мере не может служить критерием исключения антифосфолипидного синдрома, но свидетельствует не в пользу данного патологического процесса. Поскольку в генезе антифосфолипидного синдрома предполагается развитие аутоиммунной агрессии, применение глюкокортикоидов должно было положительно сказаться на течении процесса, чего замечено не было. В связи с вышеперечисленным наиболее вероятным является наличие у больного аГУС, в связи с чем предполагается применение патогенетической терапии в виде экулизумаба при условии активации процесса.
Таким образом, нам представляется развитие патологического процесса следующим образом: на фоне вирусной инфекции, выступившей триггером, произошла активация системы комплемента с развитием тромботической микроангиопатии по причине аГУС. В рамках этого процесса наблюдалось развитие гломерулонефрита, имевшего быстропрогрессирующее течение, в исходе которого у больного сформировалась ХБП 5Д стадии, и он стал получать лечение гемодиализом.
Атипичным нам представляется в данном случае развитие гломерулонефрита (мембранозной нефропатии) на фоне аГУС. Характерными видами поражения почек при этом патологическом процессе является поражение сосудов мелкого калибра с эндотелиозом, фибриноидным пропитыванием и некрозом стенок, микротромбозом, развитием ишемической нефропатии, а также поражением тубулоинтерстициальной ткани в виде канальцевого некроза. Также характерно обильное отложение депозитов, содержащих С3-компонент комплемента, в стенках артериол [10]. Развитие гломерулонефрита при атипичном гемолитико-уремическом синдроме крайне редко возможно, но, как правило, речь идёт о С3-гломерулопатии в виде болезни плотных депозитов или С3-гломрерулонефрита [11]. Однако у нашего пациента нет признаков этих процессов. Вместе с тем в биоптате отмечается свечение депозитов С3-компонента комплемента в зоне сегментарного клероза, что свидетельствует о вовлечённости системы комплемента в развитие поражения почек в виде его активации по альтернативному пути, а зоны склероза вероятно явились результатом репарации в зонах клубочковых капиллярных микротромбозов вследствие тромботической микроангиопатии. Вероятно, данный процесс мог привести к аутоиммунизации и запуску механизма выработки IgG4 против PLA2R (рецептора фосфолипазы А2) или других молекул, запуская механизм развития мембранозной нефропатии.
По данным литературы примерно, в 3% случаев при мембранозной нефропатии обнаруживаются антитела, связывающие фактор H, которые нацелены на С-концевую область распознавания фактора Н [12]. При аутоиммунной форме аГУС также вырабатываются антитела против C-концевой области связывания фактора H, что блокирует его поверхностное действие в реакции активации системы комплемента по альтернативному пути [13]. Такая схожесть в патогенезе двух патологических процессов может определять общность развития их проявлений. Также на участие системы комплемента в патогенезе мембранозной нефропатии указывают данные недавно проведенного китайского исследования, где было показано, что повышение уровней C3a и C5a соотносится с ростом титра антител против PLA2R, принимающих непосредственное участие в патогенезе мембранозной нефропатии [14]. Также было высказано предположение, что комплемент может активироваться через лектиновый путь у пациентов мембранозной нефропатией с высоким титром антител к PLA2R и через альтернативный путь у пациентов с нормальным титром антител к PLA2R. Описан ряд мутаций генов факторов системы комплемента при мембранозной нефропатии, что также может свидетельствовать о возможном участии расстройств её активации в развитии мембранозной нефропатии [15]. Было показано, что уровни C3a в плазме повышаются практически у всех больных с мембранозной нефропатией, наблюдается повышенная экспрессия рецептора C3a на подоцитах, что коррелирует с уровнями сывороточного креатинина и протеинурии [16]. При этом применение антагониста рецептора C3a сопровождалось снижением протеинурии, что подтверждает точку зрения о том, что анафилатоксин C3a является основным эффектором опосредованного комплементом повреждения подоцитов при мембранозной нефропатии.
Эти обстоятельства, в частности, явились основой для изучения возможности использования блокаторов системы комплемента при мембранозной нефропатии. В настоящее время проводятся два исследования, в которых будет оцениваться эффективность двух антикомплементарных препаратов при этом заболевании. Первым препаратом является иптакопан, пероральный селективный ингибитор фактора B (NCT04154787, https://clinicaltrials.gov/study/NCT04154787). Вторым препаратом является нарсоплимаб, гуманизированное моноклональное антитело IgG4-λ, ингибирующее маннан-связывающую лектинсериновую протеазу 2 (MASP-2), сериновую протеазу, ответственную за расщепление компонентов комплемента C2 и C4. Продолжающееся исследование этого препарата направлено на оценку безопасности препарата у пациентов с мембранозной нефропатией и другими заболеваниями клубочков (NCT02682407, https://clinicaltrials.gov/study/NCT02682407).
Заключение
Таким образом, в рамках рассмотренного клинического случая представлена клиническая картина аГУС, активированного на фоне острой респираторно-вирусной инфекции, который явился вероятным триггером для развития гломерулонефрита в виде мембранозной нефропатии, протекавшей с быстрым прогрессированием. Уникальность случая состоит в том, что в литературе практически не имеется описаний клинических случаев развития мембранозной нефропатии на фоне аГУС, несмотря на то что в генезе мембранозной нефропатии отчетливо просматривается активация системы комплемента по альтернативному или лектиновому пути.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Yerigeri K, Kadatane S, Mongan K, Boyer O, Burke LLG, Sethi SK, et al. Atypical Hemolytic-Uremic Syndrome: Genetic Basis, Clinical Manifestations, and a Multidisciplinary Approach to Management. J Multidiscip Healthc. 2023;16:2233-2249. DOI: 10.2147/JMDH.S245620
2. Козловская Н.Л., Коротчаева Ю.В., Демьянова К.А., Шифман Е.М. Сравнительная характеристика акушерского и «общепопуляционного» атипичного гемолитико-уремического синдрома у взрослых. Нефрология и диализ. 2022;24(1):52-61. DOI: 10.28996/2618-9801-2022-1-52-61
3. Козловская Н.Л. Атипичный гемолитико-уремический синдром: современные представления о патогенезе, клинике, подходах к диагностике и лечению. Тромбоз, гемостаз и реология. 2019;4(8):13-20. DOI: 10.25555/THR.2019.4.0895
4. Tiwari V, Bhandari G, Gupta A, Gupta P, Bhargava V, Malik M, et al. Atypical HUS Triggered by COVID-19: A Case Report. Indian J Nephrol. 2022;32(4):367-370. DOI: 10.4103/ijn.ijn_196_21
5. Manickam N, Agrawal V, Prasad P, Jain M, Prasad N. Clinico-Histological Features of Thrombotic Microangiopathy in Renal Biopsies: A Retrospective Study. Turk Patoloji Derg. 2022;38(1):1-8. DOI: 10.5146/tjpath.2021.01536
6. Garcia-Arellano G, Camacho-Ortiz A, Moreno-Arquieta IA, Cardenas-de la Garza JA, Rubio-Torres DC, Garza-Gonzalez E, et al. Anticardiolipin and anti-beta-2 glycoprotein I antibodies in patients with moderate or severe COVID-19. Am J Med Sci. 2023;365(2):215-217. DOI: 10.1016/j.amjms.2022.10.012
7. de Groot PG, Meijers JC. β(2) -Glycoprotein I: evolution, structure and function. J Thromb Haemost. 2011;9(7):1275-84. DOI: 10.1111/j.1538-7836.2011.04327.x
8. Devreese KMJ, de Groot PG, de Laat B, Erkan D, Favaloro EJ, Mackie I, et al. Guidance from the Scientific and Standardization Committee for lupus anticoagulant/antiphospholipid antibodies of the International Society on Thrombosis and Haemostasis: Update of the guidelines for lupus anticoagulant detection and interpretation. J Thromb Haemost. 2020;18(11):2828-2839. DOI: 10.1111/jth.15047
9. Gazzaruso C, Mariani G, Ravetto C, Malinverni L, Tondelli E, Cerrone M, et al. Lupus anticoagulant and mortality in patients hospitalized for COVID-19. J Thromb Thrombolysis. 2021;52(1):85-91. DOI: 10.1007/s11239-020-02335-w
10. Chua JS, Zandbergen M, Wolterbeek R, Baelde HJ, van Es LA, de Fijter JW, et al. Complement-mediated microangiopathy in IgA nephropathy and IgA vasculitis with nephritis. Mod Pathol. 2019;32(8):1147-1157. DOI: 10.1038/s41379-019-0259-z
11. Goodship TH, Cook HT, Fakhouri F, Fervenza FC, Frémeaux-Bacchi V, Kavanagh D, et al. Atypical hemolytic uremic syndrome and C3 glomerulopathy: conclusions from a "Kidney Disease: Improving Global Outcomes" (KDIGO) Controversies Conference. Kidney Int. 2017;91(3):539-551. DOI: 10.1016/j.kint.2016.10.005
12. Prodinger WM, Hellwage J, Spruth M, Dierich MP, Zipfel PF. The C-terminus of factor H: monoclonal antibodies inhibit heparin binding and identify epitopes common to factor H and factor H-related proteins. Biochem J. 1998;331 ( Pt 1)(Pt 1):41-7. DOI: 10.1042/bj3310041
13. Józsi M, Oppermann M, Lambris JD, Zipfel PF. The C-terminus of complement factor H is essential for host cell protection. Mol Immunol. 2007;44(10):2697-706. DOI: 10.1016/j.molimm.2006.12.001
14. Zhang MF, Huang J, Zhang YM, Qu Z, Wang X, Wang F, et al. Complement activation products in the circulation and urine of primary membranous nephropathy. BMC Nephrol. 2019;20(1):313. DOI: 10.1186/s12882-019-1509-5
15. Saleem M, Shaikh S, Hu Z, Pozzi N, Java A. Post-Transplant Thrombotic Microangiopathy due to a Pathogenic Mutation in Complement Factor I in a Patient With Membranous Nephropathy: Case Report and Review of Literature. Front Immunol. 2022;13:909503. DOI: 10.3389/fimmu.2022.909503
16. Gao S, Cui Z, Zhao MH. Complement C3a and C3a Receptor Activation Mediates Podocyte Injuries in the Mechanism of Primary Membranous Nephropathy. J Am Soc Nephrol. 2022;33(9):1742-1756. DOI: 10.1681/ASN.2021101384
Об авторах
М. М. БатюшинРоссия
Батюшин Михаил Михайлович - д.м.н., профессор, профессор кафедры внутренних болезней №2.
Ростов-на-Дону
Т. П. Белобородова
Россия
Белобородова Татьяна Петровна - врач-нефролог отделения гемодиализа.
Ростов-на-Дону
В. Л. Коробка
Россия
Коробка Вячеслав Леонидович - д.м.н., доцент, заведующий кафедрой реконструктивной, сердечно-сосудистой, торакальной, челюстно-лицевой хирургии и трансплантологии.
Ростов-на-Дону
И. Н. Нестеренко
Россия
Нестеренко Ирина Николаевна - ассистент кафедры реконструктивной, сердечно-сосудистой, торакальной, челюстно-лицевой хирургии и трансплантологии.
Ростов-на-Дону
Е. А. Синельник
Россия
Синельник Елена Александровна - заведующая патолого-анатомическим отделением.
Ростов-на-Дону
Н. А. Броновицкая
Россия
Броновицкая Наталья Александровна - к.м.н., врач-нефролог центра урологии-нефрологии.
Ростов-на-Дону
Н. Б. Бондаренко
Россия
Бондаренко Николай Борисович - к.м.н., врач-нефролог центра урологии-нефрологии.
Ростов-на-Дону
А. М. Батюшина
Россия
Батюшина Алла Михайловна - студентка 4 курса педиатрического факультета.
Ростов-на-Дону
Дополнительные файлы
Рецензия
Для цитирования:
Батюшин М.М., Белобородова Т.П., Коробка В.Л., Нестеренко И.Н., Синельник Е.А., Броновицкая Н.А., Бондаренко Н.Б., Батюшина А.М. Случай развития мембранозной нефропатии на фоне атипичного гемолитико-уремического синдрома, активированного в результате острой респираторно-вирусной инфекции. Южно-Российский журнал терапевтической практики. 2023;4(4):101-106. https://doi.org/10.21886/2712-8156-2023-4-4-101-106
For citation:
Batiushin M.M., Beloborodova T.P., Korobka V.L., Nesterenko I.N., Sinelnik E.A., Bronovitskaya N.A., Bondarenko N.B., Batiushina A.M. A case of development of membranous nephropathy against the background of atypical hemolytic-uremic syndrome activated as a result of acute respiratory viral infection. South Russian Journal of Therapeutic Practice. 2023;4(4):101-106. (In Russ.) https://doi.org/10.21886/2712-8156-2023-4-4-101-106
JATS XML


























