Перейти к:
Влияние регуляторных пептидов на нейрогенную дисфункции нижних мочевых путей при рассеянном склерозе. Данные одного центра
https://doi.org/10.21886/2712-8156-2024-5-2-79-90
Аннотация
Цель исследования: Клиническая оценка эффективности и безопасности влияния регуляторного полипептидного препарата на нейрогенную гиперактивность мочевого пузыря у пациентов с рассеянным склерозом (РС).
Материалы и методы: 41 пациент с РС и уродинамически подтверждёенной детрузорной гиперактивностью включёен в проспективное моноцентровое простое сравнительное с последовательной сменой лекарственного препарата клиническое исследование. Исходную функцию нижних мочевых путей (НМП) и её динамические изменения на фоне терапии изучали посредством заполнения дневника мочеиспускания и анкетирования (опросники EDSS, NBSS, SF-Qualiveen, I-QOL). Контрольный препарат Солифенацин (1 группа пациентов) —- специфический конкурентный ингибитор мускариновых рецепторов подтипа Мз, вызывающих сокращение детрузора. Исследуемый препарат (2 группа пациентов) - — комплекс регуляторных полипептидов с органотропным действием в отношении мочевого пузыря. Дозирование: Солифенацин — 4 недели, затем период наблюдения 4 недели, после чего - приёем исследуемого препарата 30 дней. Контроль результатов —– сравнение с исходными данными непосредственно после окончания приёема препаратов. Статистический анализ проведен программой Statistica 10 (StatSoft Inc., USA), использован непараметрический анализ данных с проведением медианного анализа, теста Вилкоксона и поиском U-критерия Манна-Уитни. Результаты различий считали статистически значимыми при вероятности ошибки < 5% (р<0,05).
Результаты: Ддневник мочеиспускания: (недержание мочи (НМ) нивелировано у 14,6% и 24,4% пациентов I1 и 2II групп соответственно; ноктурия - в 31,7% и 56,1% случаев для I1 и 2II групп соответственно, частота суточных мочеиспусканий нормализовалась у 53,6% и 70,7% пациентов I1 и 2II групп соответственно). Анкета NBSS: снижение общего балла анкеты на 29,2% и 47,4% для 1I и 2II групп соответственно. Опросник SF-Qualiveen: повышение общего оценочного балла на 42,3% для I1 группы против +66,5% для II2 группы. Анкета I-QOL: улучшение качества жизни на 56,0% и 80,4% для I1 и II 2 групп соответственно. Исследуемый препарат в сравнении с Солифенацином имеет более высокий профиль безопасности.
Заключение: Эффективность исследуемого препарата в коррекции нейрогенной гиперактивности мочевого пузыря в сравнении с Солифенацином выше, что отражается в снижении ургентности, поллакиурии, количестве эпизодов НМ и значимом улучшении качества жизни этих пациентов. Исследуемый препарат демонстрирует высокий профиль безопасности в исследовании.
Ключевые слова
Для цитирования:
Абдуллах Н., Белоусов И.И., Гончарова З.А., Руденко О.Ю., Белоусова М.Е. Влияние регуляторных пептидов на нейрогенную дисфункции нижних мочевых путей при рассеянном склерозе. Данные одного центра. Южно-Российский журнал терапевтической практики. 2024;5(2):79-90. https://doi.org/10.21886/2712-8156-2024-5-2-79-90
For citation:
Abdallah N., Belousov I.I., Goncharova Z.A., Rudenko O.Yu., Belousova M.E. Influence of regulatory peptides on neurogenic lower urinary tract dysfunction in multiple sclerosis. Data of one center. South Russian Journal of Therapeutic Practice. 2024;5(2):79-90. (In Russ.) https://doi.org/10.21886/2712-8156-2024-5-2-79-90
Введение
Рассеянный Склероз (РС) — хроническое, прогрессирующее, демиелинизирующее заболевание, при котором имеются множественные очаговые и диффузные поражения ЦНС. Как следствие, инвалидизация пациентов и значительное снижение качества их жизни1 [1]. Известно, что клиническое течение РС в большинстве случаев сопровождается нарушением акта мочеиспускания, совокупность клинических признаков которого определяется как «нейрогенная дисфункция нижних мочевых путей» (НДНМП) [2].
По оценкам разных авторов, в какой-то момент течения РС более 80% пациентов начинает испытывать НДНМП [3-4]. Превалирующими оказываются симптомы, связанные с накопительной фазой мочевого цикла, при этом наиболее распространённым патологическим уродинамическим паттерном определяется нейрогенная детрузорная гиперактивность (НДГ) с частотой выявления до 37–98% случаев [5-7]. НДГ характеризуется неконтролируемыми сокращениями детрузора, что отражается в поллакиурии, императивности и ургентном недержании мочи (НМ) с частотой представления этих состояний в интервале 19–99%. При этом нарушение комплаентности детрузора встречается в 6–12% случаев [4][6][8]. Примечательно, что расстройства акта мочеиспускания могут являться дебютом РС и причиной первичного обращения пациента к профильному специалисту [9].
Согласно положениям актуальных Российских Клинических Рекомендаций (РКР) по ведению РС, лечение нарушений функции НМП является компетенцией уролога1. Терапевтическая концепция в таких случаях подразумевает сохранение функции верхних мочевых путей, достижение «социального» удержания мочи (0–1 урологическая прокладка в сутки при имеющемся НМ) и сведение к минимуму осложнений со стороны НМП. В тех случаях, когда НДНМП проявляется только частыми императивными позывами к мочеиспусканию и / или НМ, коррекция симптомов проводится М-холиноблокаторами (М-ХБ) (первая линия лечения, уровень убедительности рекомендаций С, уровень достоверности доказательств 5)1 [1].
Актуальными РКР Российского общества урологов по НДНМП приводится большой спектр разрешённых к применению в практике М-холиноблокаторов (М-ХБ): Солифенацин (5 и 10 мг), Троспия хлорид (15 мг), Оксибутинин (5 мг), Толтеродин (2 мг) и Фезотеродин (8 мг). Из этого перечня выделен Солифенацин как предпочтительный препарат для стартовой терапии в связи с большей селективностью к М-3 мускариновым рецепторам и модифицированным пролонгированным высвобождением2.
Проблема заключается в том, что в главенствующем документе (РКР по лечению РС Российского общества неврологов) к применению разрешены только Оксибутинин и Толтеродин1. При этом в списке «Жизненно необходимых и важнейших лекарственных средств» в качестве средства лечения учащенного мочеиспускания и НМ указан только Солифенацин3. Также стоит отметить тот факт, что в современной мировой литературе однозначного мнения о полезности М-холинолитической терапии при НДНМП именно при РС нет, поскольку отсутствует достаточное количество качественных крупных рандомизированных исследований с различными типами ослепления, на которые могли бы опираться национальные КР по терапии РС в различных странах.
Вместе с тем накоплены данные, свидетельствующие о появлении при длительном применении М-ХБ различных побочных эффектов, основными из которых являются сухость ротовой полости, слизистой глаз, обстипация и задержка мочи [10-11]. Выраженность побочных эффектов значимо снижает приверженность пациентов к лечению, что приводит к преждевременному его прекращению в 43–83% случаев уже в первый месяц терапии в общей популяции пациентов [12].
Относительно недавно появились публикации о негативном влиянии М-ХБ на когнитивные и психические функции пациентов через М1,2,5-холинорецепторы ЦНС, поскольку М-ХБ проникают через гематоэнцефалический барьер. Выражается это в появлении галлюцинаций, формировании возбуждения/сонливости или спутанности сознания, раздражительности, головной боли и прочее. Также имеется негативное влияние на зрение через М5-холинрецепторы ЦНС, проявляющееся ухудшением зрительной функции посредством центрального действия и вследствие воздействия на цилиарную мышцу, вызывая паралич аккомодации [13-14].
Крайне важным это является потому, что у пациентов с РС когнитивный дефицит и зрительные нарушения являются неотъемлемой частью течения заболевания в связи с прогрессирующим поражением и последующей атрофией корковых структур, таламуса, гиппокампа и повреждением затылочной коры наряду со зрительными нервами [15-16]. Соответственно длительный перманентный приём М-ХБ при РС имеет повышенный риск потенцирования и усугубления вышеописанных нарушений, особенно при прогрессирующих типах течения и в пожилом возрасте.
Основываясь на этих данных, мы можем утверждать, что поиск новых лекарственных средств, обладающих либо лучшей, либо сравнимой эффективностью в коррекции НДНМП при РС, но отличающихся большей безопасностью для пациента, является актуальным исследовательским направлением.
Цель исследования — клиническая оценка эффективности и безопасности влияния регуляторного полипептидного препарата на нейрогенную гиперактивность мочевого пузыря у пациентов с РС.
Материалы и методы
В период с октября 2022 г. до февраля 2024 г. кафедрой урологии и репродуктивного здоровья человека (с курсом детской урологии-андрологии) совместно с кафедрой нервных болезней и нейрохирургии РостГМУ проведено проспективное моноцентровое простое сравнительное с последовательной сменой лекарственного препарата клиническое исследование. Клинический протокол одобрен ЛНЭК при РостГМУ (протоколы №13/22 от 08.09.22 г. и №3/23 от 09.02.23 г.
В качестве исследуемого препарата применяли лекарственное средство «Везустен», представляющее собой комплекс регуляторных полипептидов (КРПП), выделенных из мочевого пузыря крупного рогатого скота. Данное лекарственное средство (далее по тексту — КРПП) обладает органотропным действием в отношении мочевого пузыря. КРПП демонстрирует тканеспецифическую активность в отношении мочевого пузыря, оказывая стимулирующее действие на рост клеток, при отсутствии влияния на культуры тканей других органов. Режим приёма и дозирование: внутримышечная инъекция 5 мл утром каждого третьего дня. Всего 10 инъекций, лечебный период — 30 дней4.
Контрольный препарат — Солифенацин, специфический конкурентный ингибитор мускариновых рецепторов подтипа Мз, вызывающих сокращение детрузора, имея при этом низкое или отсутствие сродства к различным другим рецепторам и ионным каналам. Режим приема и дозирование: 10 мг (1 таб) per os ежедневно утром после первого приёма пищи. Лечебный период — 28 дней5.
На этапе скрининга у пациентов изучены жалобы, анамнез, проведена объективная оценка физикального статуса, выполнены общеклинические и лабораторные тесты, консультации специалистов, после чего проведено соответствие критериям включения, исключения и невключения.
Критерии включения: подписанное согласие на участие в исследовании; подтвержденный диагноз РС; наличие подтвержденной при уродинамическом исследовании нейрогенной детрузорной гиперактивности; возраст пациентов 18–50 лет.
Критерии исключения: применение пациентом катетеризации мочевого пузыря; наличие злокачественного образования любой этиологии или подозрения на это; наличие любой патологии, ассоциируемой с симптомами нижних мочевых путей (СНМП), по мнению врача-исследователя; ментальный статус пациента, не позволяющий принимать участие в исследовании; невозможность заполнения дневника мочеиспускания и анкет-опросников исследования; сахарный диабет; перенесённые операции на органах малого таза; хроническая инфекция мочевой системы; беременность и грудное вскармливание; конкременты мочевой системы любой локализации; инфравезикальная обструкция, подтверждённая уродинамически; наличие тяжёлых заболеваний ЖКТ; myasthenia gravis; закрытоугольная глаукома; дефицит лактазы, непереносимость лактозы, глюкозо-галактозная мальабсорбция; тяжёлая неконтролируемая АГ (систолическое давление 180 мм рт. ст. и выше и/или диастолическое давление 110 мм рт. ст. и выше).
Критерии невключения: наличие инфекции мочевой системы; наличие объёма остаточной мочи более 100 мл; заключение невролога о невозможности участия пациента в исследовании; превышение нормативных показателей в сыворотке крови креатинина, АлТ, АсТ, билирубина и его фракций.
По результатам скрининга, в исследование включён 41 пациент с подтверждённым диагнозом «РС». Всеми исследуемыми добровольно подписана Форма Информированного Согласия участника исследования. Процедуры исследования представлены на рисунке 1.
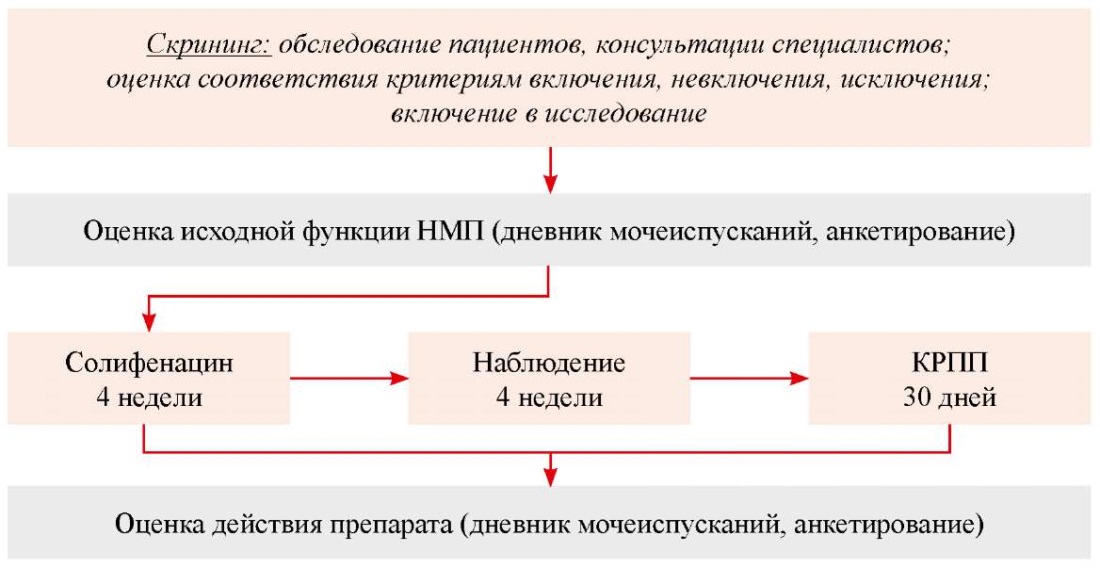
Рисунок 1. Процедуры исследования.
Figure 1. Study procedures.
Для проведения сравнительного анализа результатов введены следующие обозначения групп: I группа — оценочные данные пациентов после приема Солифенацина; II группа — то же после при`ма КРПП. Сравнение полученных результатов проводили с исходными параметрами. Длительность плацебо-периода определена указаниями о длительности последействия Солифенацина5.
Возраст исследуемых составил 40,0 [ 32,0; 42,0] лет (19–50 лет). Половая дифференцировка: мужчины — 36,6%, женщины — 63,4%. Индекс массы тела (ИМТ) — 23,9 [ 20,7; 27,4] (12,7–35,6) кг/см², при этом низкий и нормальный ИМТ отмечены в 9,8 и 48,8% случаев соответственно; избыточная масса тела, ожирение первой и второй степеней регистрированы в 31,7%, 7,3% и 2,4% случаев соответственно.
Длительность течения РС в когорте составила 6,0 [ 2,0; 10,0] лет (0,5 года–17 лет), протяжённость периода «Первый симптом — Диагноз РС» — 2,5 [ 1,0; 6,0] года (0,5 года–11 лет). Частота определения рецидивирующих типов течения заболевания, ремитирующего РС и вторично-прогрессирующего РС, установлена как 73,2% и 9,8% соответственно. Прогрессирующие формы, дебют и первично-прогрессирующий РС, определялись с частотой 12,2% и 4,9% соответственно.
По данным УЗИ мочевого пузыря, объём остаточной мочи исходно не превышал 22,5 [ 12,5; 38,0] (0,0–85,0) мл, в 15,6% случаев объём остаточной мочи превысил 50 мл. 58,5% пациентов имели ноктурию (более одного мочеиспускания в период ночного сна), 43,9% больных сообщило об имеющемся НМ. 95,1% пациентов отметили более 8 мочеиспусканий в сутки (симптом нейрогенного ГМП), при этом частота нейрогенного ГМП с эпизодами НМ достигала 43,6%.
Оценка исходной функции НМП проведена путём заполнения пациентами в течение трёх суток дневника мочеиспусканий (в анализ брали усреднённые за три дня значения) и анкетирования по валидированным опросникам, согласно протоколу исследования. Использованы следующие анкеты:
- EDSS — расширенная шкала оценки степени инвалидизации при РС (Expanded Disability Status Scale), является базовым инструментом оценки инвалидизирующих нарушений [17-18].
- NBSS — шкала симптомов нейрогенного мочевого пузыря (Neurogenic Bladder Symptom Score), используется для оценки СНМП у пациентов с приобретённым или врождённым нейрогенным мочевым пузырем [19-20].
- SF-Qualiveen — краткая форма оценки влияния нейрогенных нарушений мочеиспускания на качество жизни пациента (Short Form-Incontinence Quality of Life Questionnaire) [21-22].
- I-QOL — опросник оценки качества жизни, связанного с недержанием мочи (Incontinence Quality of Life Questionnaire) [23].
Безопасность проводимой терапии оценивали частотой побочных действий, развившихся за время исследования исходя из перечня возможных нежелательных явлений/побочных действий, указанных производителем в соответствующих инструкциях по применению данных лекарственных средств4,5.
Согласно анализу анкеты EDSS, 29,3% исследуемых имело малоподвижный статус и инвалидизацию по РС, оценочный бал составил 4,0 [ 3,0; 5,0] (1,5–7,5 баллов).
Исходные данные оценки функции НМП дневником мочеиспусканий представлены в таблице 1.
Таблица 1
Дневник мочеиспусканий: исходная функция нижних мочевых путей
Voiding diary: baseline lower urinary tract function
Параметры дневника мочеиспускания | Me [ LQ; UQ] (мин.-макс.) |
Суточное количество мочеиспусканий | 13,0 [ 11,3; 14,3] (5,7–19,0) |
Количество мочеиспусканий днем | 11,3 [ 10,0; 12,7] (5,0–15,3) |
Количество мочеиспусканий ночью | 1,7 [ 0,7; 2,7] (0,0–4,7) |
Объем мочи за одно мочеиспускание, мл | 95,0 [ 79,2; 128,3] (36,5–225,0) |
Количество ургентных позывов в сутки | 6,3 [ 5,0; 8,3] (0,3–10,7) |
Количество эпизодов НМ в сутки | 2,2 [ 1,7; 3,7] (0,7–5,0) |
Количество использованных прокладок в сутки | 2,0 [ 1,3; 3,0] (0,7–4,3) |
Примечание: Me — медиана, LQ — нижний квартиль, UQ — верхний квартиль,
мин-макс — крайние значения признака; НМ — недержание мочи.
Статистический анализ результатов проведён на ПК (Microsoft Windows 10 Pro) программами Microsoft Office 365 (Word/Excel; Microsoft Corporation, USA) и Statistica 10 (StatSoft Inc., USA). Анализ соответствия вида распределения признака закону нормального распределения выполнен критерием Шапиро-Уилка; использован непараметрический анализ данных. Качественные данные представлены в виде абсолютных и относительных частот (%); количественные признаки выражены медианным анализом (медиана (Me), 25 и 75 процентилли), полярные значения признаков — интервалом «минимум-максимум», в тексте представлено как Me [LQ; UQ] (мин-макс). Сравнение зависимых переменных проведено тестом Вилкоксона, независимых — поиском U-критерия Манна-Уитни. Результаты различий считали статистически значимыми при вероятности ошибки < 5% (р<0,05).
Результаты
1. Параметры дневника мочеиспусканий
Исследуемый препарат показал большую эффективность в улучшении функции НМП перед контрольным. Это отмечено при оценке изменений частоты недержания мочи, ноктурии и симптомов нейрогенного ГМП. Так, отсутствие НМ отметило 24,4% пациентов (против 14,6% для I группы), ночные мочеиспускания перестало отмечать 56,1% больных (против 31,7% для I группы). Соответственно, этим изменениям во II группе от нейрогенного ГМП избавилось 70,7% пациентов против 53,6% в I группе (табл. 2).
Таблица 2
Дневник мочеиспусканий: изменение функции нижних мочевых путей
на фоне лечения и при последующем наблюдении
Urination diary: changes in lower urinary tract function
during treatment and at follow-up
Частота выраженности признака, % | Исходные данные | I группа | II группа |
Недержание мочи | 43,9 | 29,3 | 19,5 |
Ноктурия | 58,5 | 26,8 | 2,4 |
Нейрогенный ГМП | 95,1 | 41,5 | 24,4 |
Примечание: ГМП — гиперактивный мочевой пузырь.
При оценке количественных параметров функции НМП оказалось, что Солифенацин (I группа) в сравнении с исходными данными снижает поллакиурию на 38,5%, тем самым повышая эффективный объём мочевого пузыря на 86,4%. Количество ургентных позывов при этом снижается более чем в два раза. Наряду с этими эффектами отмечено снижение числа эпизодов НМ и обусловленное этим снижение количества используемых прокладок, на 86,4 и 50,0% соответственно.
Влияние КРПП на функцию НМП оказалась более значительна. Так, поллакиурия уменьшилась на 48,5%, эффективный объём мочевого пузыря увеличился на 97,8%, число ургентных позывов снизилось в 3,2 раза. В то же время влияние препарата на потери мочи и количество используемых прокладок было несколько меньше в сравнении с Солифенацином, 68,2% и 35,0% соответственно. Следует отметить, что все данные имели статистическую значимость, кроме прямого сравнения эффективного объёма мочевого пузыря, эпизодов недержания мочи и количества прокладок. По этим параметрам отсутствие значимости обусловлено сравнимым медианным размахом, в то время как медианы имели явные различия (табл. 3).
Таблица 3
Дневник мочеиспусканий: сравнительный анализ
эффективности действия Солифенацина и КРПП
Urination diary: comparative analysis
of the effectiveness of action Solifenacin and CRPP
Параметры | Исходные данные | I группа | II группа | р между 1–2, 1–3, 2–3 |
Me [ LQ; UQ] (мин.-мак.с) | ||||
Суточное количество мочеиспусканий | 13,0 [ 11,3; 14,3] (5,7-19,0) | 8,0 [ 7,0; 9,7] (4,0-12,7) | 6,7 [ 6,3; 8,0] (4,3-9,7) | <0,001 <0,001 0,003 |
Количество мочеиспусканий днем | 11,3 [ 10,0; 12,7] (5,0-15,3) | 7,3 [ 6,3; 8,0] (4,0-11,0) | 6,0 [ 5,7; 7,0] (4,3-9,7) | <0,001 <0,001 0,008 |
Количество мочеиспусканий ночью | 1,7 [ 0,7; 2,7] (0,0-4,7) | 1,0 [ 0,3; 1,3] (0,0-3,0) | 0,3 [ 0,3; 1,0] (0,0-1,3) | <0,001 <0,001 0,020 |
Объём мочи за одно мочеиспускание, мл | 95,0 [ 79,3; 128,3] (36,5-225,0) | 177,1 [ 134,6; 232,7] (72,3-400,6) | 187,7 [ 159,5; 213,0] (129,8-384,3) | <0,001 <0,001 0,263 |
Количество ургентных позывов в сутки | 6,3 [ 5,0; 8,3] (0,3-10,7) | 3,0 [ 2,0; 3,7] (0,0-8,3) | 2,0 [ 1,0; 2,7] (0,0-7,3) | <0,001 <0,001 0,003 |
Количество эпизодов НМ в сутки | 2,2 [ 1,7; 3,7] (0,7-5,0) | 0,3 [ 0,3; 0,8] (0,3-2,0) | 0,7 [ 0,3; 0,8] (0,3-1,0) | 0,002 0,011 0,624 |
Количество использованных прокладок в сутки | 2,0 [ 1,3; 3,0] (0,7-4,3) | 0,5 [ 0,3; 0,8] (0,3-2,0) | 0,7 [ 0,3; 0,8] (0,3-1,0) | 0,002 0,011 0,792 |
Примечание: Me — медиана, LQ — нижний квартиль, UQ — верхний квартиль,
мин-макс — крайние значения признака; НМ — недержание мочи.
2. Анкета NBSS (шкала симптомов нейрогенного мочевого пузыря)
Данные анкетирования по этому опроснику показали достаточно малое влияние Солифенацина, поскольку снижение общего балла анкеты не превысило 29,2%. от исходного значения, хотя пациенты отметили улучшение качества жизни на фоне лечения до 50,0%.
Терапия КРПП, напротив, показала оптимистичные результаты. Снижение общего балла анкеты в сравнении с исходным достигло 47,4%. Динамика терапевтического эффекта по домену «Накопление/Опорожнение» была для исследуемых настолько существенна, что сподвигла их к максимально позитивной оценке домена «Качество жизни», хотя достигнутые изменения по домену «Осложнения» были сопоставимы с таковыми в I группе (табл. 4).
Таблица 4
Анкета NBSS: оценка эффективности действия Солифенацина и КРПП
NBSS questionnaire: assessment of the effectiveness of Solifenacin and CRPP
Параметры | Исходные данные | I группа | II группа | р между 1–2, 1–3, 2–3 |
Me [ LQ; UQ] (мин.-макс.) | ||||
Суммарный бал доменов | 24,0 [ 19,0; 33,0] (11,0-48,0) | 17,0 [ 13,0; 21,0] (7,0-35,0) | 11,0 [ 8,0; 14,0] (6,0–27,0) | <0,001 <0,001 <0,001 |
Домен «Недержание» | 0,0 [ 0,0; 14,0] (0,0–22,0) | 0,0 [ 0,0; 9,0] (0,0–15,0) | 0,0 [ 0,0; 0,0] (0,0–9,0) | 0,135 0,738 0,332 |
Домен «Накопление / Опорожнение» | 14,0 [ 11,0; 16,0] (7,0–21,0) | 10,0 [ 9,0; 13,0] (5,0–17,0) | 6,0 [ 6,0; 7,0] (4,0–13,0) | <0,001 <0,001 <0,001 |
Домен «Осложнения» | 5,0 [ 3,0; 7,0] (3,0–9,0) | 4,0 [ 2,0; 5,0] (2,0-9,0) | 4,0 [ 2,0; 5,0] (2,0-7,0) | <0,001 <0,001 0,512 |
Домен «Качество жизни» | 4,0 [ 3,0; 4,0] (1,0–4,0) | 2,0 [ 1,0; 3,0] (0,0–3,0) | 0,0 [ 0,0; 1,0] (0,0-2,0) | <0,001 0,014 <0,001 |
Примечание: Me — медиана, LQ — нижний квартиль, UQ — верхний квартиль,
мин-макс — крайние значения признака.
3. Опросник SF-Qualiveen (оценка влияния нарушений мочеиспускания на качество жизни больных нейрогенным мочевым пузырем)
Терапия Солифенацином в целом оказала хорошее влияние на качество жизни исследуемых, повысив исходный оценочный балл на 42,3%. Наибольшие позитивные изменения (+50,0%) отмечены в доменах «Ощущения» и «Частота ограничений», +33,3% — в домене «Беспокойство из-за ограничений». Но, несмотря на такую высокую степень улучшений, в домене «Страхи» изменения не превысили 25,0%.
Действие КРПП в сравнении оказалось более эффективным, поскольку прирост общего оценочного балла достиг 66,5% от исходного значения. Вероятно, на это изменение в основном повлияла оценка в домене: «Частота ограничений» (+83,3%), поскольку в доменах «Беспокойство из-за ограничений» и «Ощущения» улучшения были не столь значительные в сравнении (+33,3%). В данном контексте прирост +50,0% в домене «Страхи» был ожидаемым (табл. 5).
Таблица 5
Опросник SF-Qualiveen: сравнительный анализ
эффективности действия Солифенацина и КРПП
SF-Qualiveen questionnaire: comparative analysis
of the effectiveness of action Solifenacin and CRPP
Параметры | Исходные данные | I группа | II группа | р между 1–2, 1–3, 2–3 |
Me [ LQ; UQ] (мин.-макс.) | ||||
Суммарный бал доменов | 2,63 [ 2,00; 3,00] (1,00–4,00) | 1,50 [ 1,0; 1,88] (0,13–3,13) | 0,88 [ 0,50; 1,25] (0,25–2,50) | <0,001 <0,001 0,001 |
Домен «Беспокойство из-за ограничений» | 3,00 [ 2,00; 3,50] (0,00–4,00) | 2,00 [ 1,00; 2,00] (0,00–3,50) | 1,00 [ 0,50; 1,50] (0,00–2,50) | <0,001 <0,001 <0,001 |
Домен «Страхи» | 2,00 [ 1,50; 2,50] (1,00–4,00) | 1,50 [ 1,00; 2,00] (0,00–2,50) | 1,00 [ 1,00; 1,50] (0,50–2,00) | <0,001 <0,001 0,038 |
Домен «Ощущения» | 3,00 [ 2,00; 3,00] (0,50-4,00) | 1,50 [ 1,00; 2,00] (0,50-3,50) | 1,00 [ 0,50; 1,50] (0,00-3,00) | <0,001 <0,001 0,012 |
Домен «Частота ограничений» | 3,00 [ 2,00; 3,50] (0,50-4,00) | 1,50 [ 0,50; 2,50] (0,00-3,50) | 0,50 [ 0,00; 1,00] (0,00-3,50) | <0,001 <0,001 0,006 |
Примечание: Me — медиана, LQ — нижний квартиль, UQ — верхний квартиль,
мин.-макс. — крайние значения признака.
4. Анкета I-QOL (качество жизни, связанное с недержанием мочи)
Согласно оценке по данному опроснику, все исследуемые, имеющие НМ, исходно показали существенное отрицательное влияние этого состояния на качество жизни. Вполне ожидаемым был тот факт, что достигнутое на фоне проводимой терапии снижение количества эпизодов НМ привело к статистически значимому улучшению оценочного балла анкеты в обеих группах. Но более весомые результаты отмечены у пациентов, получавших КРПП (II группа): 80,4% улучшения исходного показателя против 56,0% при терапии Солифенацином. Но даже на фоне таких результатов этот показатель оказался ниже состояния полного комфорта (табл. 6).
Таблица 6
Анкета I-QOL: изменения качества жизни
пациентов с недержанием мочи на фонепроводимой терапии
I-QOL questionnaire: changes in the quality of life
of patients with urinary incontinencedue to ongoing therapy
Параметры | Исходные данные | I группа | II группа | р между 1–2, 1–3, 2–3 |
Me [ LQ; UQ] (мин.-макс.) | ||||
Оценочный балл | 37,3 [ 29,1; 45,5] (11,8–73,6) | 58,2 [ 49,1; 69,1] (32,7–78,2) | 67,3 [ 57,3; 71,8] (35,5–78,2) | <0,001 <0,001 0,015 |
Примечание: Me — медиана, LQ — нижний квартиль, UQ — верхний квартиль,
мин.-макс. — крайние значения признака.
6. Побочное действие/нежелательные явления
Типы и частота выявления побочных действий/нежелательных явлений исследуемых препаратов в нашем исследовании соответствовали заявленным производителями в инструкциях к применению данных лекарственных средств. Если опираться на многообразие побочных эффектов, то безусловное «лидерство» принадлежит группе с препаратом Солифенацин. Фактически половина пациентов отметила затруднения мочеиспускания в сравнении с исходными данными, до четверти больных жаловалось на сухость слизистой рта и глаз. Частота остальных отрицательных эффектов была сравнительно низка. Напротив, препарат КРПП показал более высокий профиль безопасности, так как количество и частота выявления нежелательных явлений были значительно ниже (рис. 2).
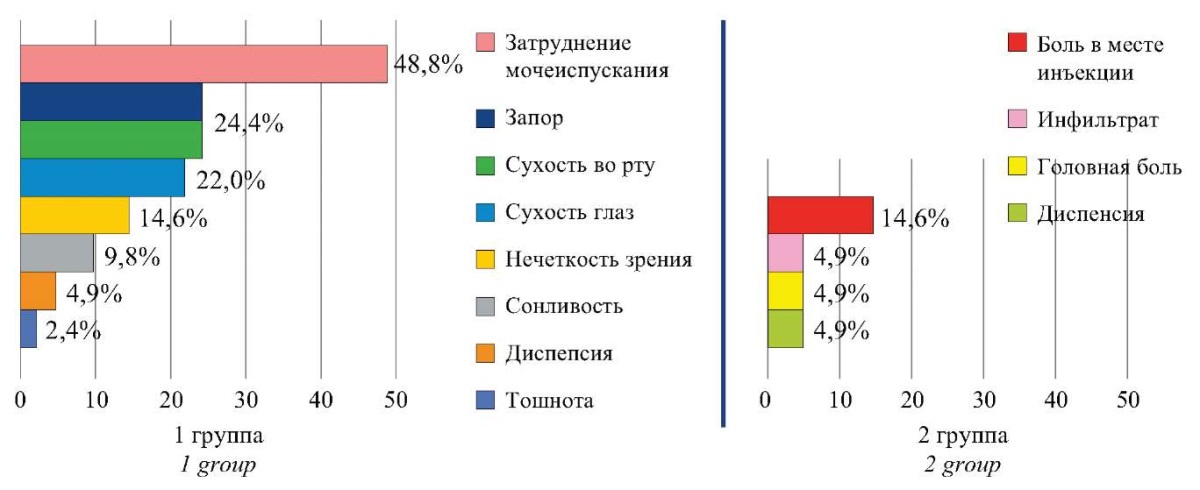
Рисунок 2. Сравнительный анализ побочного действия Солифенацина и КРПП.
Figure 2. Comparative analysis of side effects of Solifenacin and Study Drug.
Обсуждение
Известно, что наиболее частым осложнением РС является НДНМП, что клинически отображается преимущественно ирритативными СНМП. По данным сводной статистики докладов GENULF (Groupe de Neuro-urologie de Langue Française) и NARCOMS (North American Research Committee on Multiple Sclerosis), наличие СНМП отмечает 19–96% пациентов. В том случае, когда длительности заболевания более десяти лет, нижний предел этого интервала достигает уже 90% случаев [4][24-25].
Для адекватного воздействия на НДНМП необходимо придерживаться некоторых правил. Во-первых, коррекция нарушений функции НМП находится в компетенции уролога. Во-вторых, лечение должно быть максимально консервативным и направлено на обеспечение свободного оттока мочи из мочевого пузыря; выбор медикаментов определяется выявленными при комплексном уродинамическом исследовании патологическими паттернами1,2,4. Кроме того, следует учитывать наличие характерных для РС когнитивных расстройств и инвалидизацию.
В настоящем исследовании принимали участие пациенты с нейрогенным ГМП, поллакиурией и ургентным недержанием мочи, где целевыми препаратами первой линии терапии, согласно РКР, являются М-ХБ1. Эта группа препаратов имеет неоднозначную эффективность и выраженные побочные эффекты, что не позволяет считать их оптимальными и накладывает определённые ограничения в использовании в когорте пациентов с РС [15-16][26-28].
Вторая линия терапии гораздо «тяжелее», поскольку представлена исключительно хирургическим лечением, где пациентам на регулярной основе проводятся интравезикальные инъекции препарата ботулинического токсина типа А1. В настоящее время доказано, что эффективность второй линии терапии значимо выше первой [29], однако обратно пропорциональна частоте и тяжести побочных эффектов и хирургических осложнений. Также выше и экономическая составляющая лечения. Кроме того, данный тип терапии требует периодичности [30-31].
С 2012 по 2017 гг в России проведён комплекс экспериментальных (доклинических) исследований лекарственного средства, представляющего собой комплекс регуляторных полипептидов с молекулярной массой менее 10 кДа, показавшего тканеспецифическую активность в отношении мочевого пузыря и крайне высокий профиль безопасности в виде отсутствия токсичности, канцерогенности и иммунотоксичности. Препарат не обладает эмбриотоксичностью, мутагенностью и тератогенностью. Уже в 2022 г. были опубликованы результаты многоцентрового рандомизированного клинического исследования данного лекарственного средства, показавшие его высокую эффективность в снижении ургентности и эпизодов ургентного НМ при синдроме идиопатического ГМП [32].
Принимая во внимание обнадеживающие клинические результаты пептидной терапии идиопатического ГМП, представленные нашими коллегами, и учитывая подобие уродинамических паттернов при идиопатической и нейрогенной гиперактивности мочевого пузыря, мы посчитали возможным инициировать представленный исследовательский протокол.
Исследование было направлено исключительно на клиническую оценку эффективности/безопасности нового препарата в коррекции нейрогенной гиперактивности мочевого пузыря при РС. В качестве инструментов оценки функции НМП были выбраны, с одной стороны, дневник мочеиспусканий как объективный способ контроля за водным режимом, частотой мочеиспусканий, эффективным объёмом мочевого пузыря, ургентностью, недержанием мочи и количеством единиц используемых защитных прокладок. С другой стороны, применено анкетирование — заполнение специфических анкет-опросников для нейрогенного мочевого пузыря, что, на наш взгляд, позволило оценить субъективное отношение пациентов к изменениям своего мочеиспускания на фоне проводимого лечения и, самое главное, оценить, насколько это лечение влияет на качество жизни касательно функции НМП.
Полученные данные имеют статистическую значимость и демонстрируют выраженный клинический эффект исследуемого препарата в сравнении с лекарственным средством первой линии лечения нейрогенных СНМП при РС. Снижение частоты поллакиурии и ургентности, увеличение эффективного объёма мочевого пузыря, уменьшение количества эпизодов недержания мочи, снижение физической и психологической зависимости от симптомов нейрогенного мочевого пузыря и обусловленное этими изменениями статистически значимое улучшение качества жизни пациентов — это те преимущества, которые демонстрирует КРПП перед Солифенацином в коррекции нейрогенной гиперактивности мочевого пузыря.
Сильной стороной настоящего исследования считается участие в нём одних и тех же пациентов, что определяет безусловный идентичный исходный клинически статус. Соответственно, следует считать полученные данные более значимыми.
Ограничением исследования, вероятно, можно было бы считать то, что приём исследуемого препарата пациенты осуществляли после завершения этапа лечения контрольным препаратом. Теоретически могло моделироваться психологическое завышение позитивной оценки КРПП на фоне более слабой клинической эффективности Солифенацина. В то же время имеющиеся статистически значимые различия в терапевтических эффектах обоих препаратов по данным дневника мочеиспускания, как более объективного теста, позволяют считать это предположение сомнительным.
Более вероятным ограничением исследования является относительно короткий период наблюдения между сменой терапевтического агента. Возможно, что более высокий клинический ответ исследуемого препарата определяется частично сохранившимся остаточным эффектом контрольного препарата.
Однако выделенные нами ограничения всё-таки являются только предположением. Полученные результаты и сформулированные на их основе выводы и заключения являются текущими. Исследования в данном направлении, безусловно, нуждаются в продолжении.
Выводы
- Солифенацин является терапевтическим агентом с доказанной клинической эффективностью в коррекции НГМП: от исходных данных частота НМ снижается в 1,5 раза, ноктурии — в 2,2 раза, нормализация частоты суточных мочеиспусканий отмечена у 53,6% исследуемых.
КРПП демонстрирует по этим же показателям более сильный клинический эффект. Так, в сравнении с исходными данными частота НМ снижается в 2,3 раза, ноктурии — в 24,4 раза, количество суточных мочеиспусканий нормализовало 70,7% исследуемых. - Солифенацин и КРПП обладают сравнимым клиническим эффектом, равнозначно увеличивая эффективный объём мочевого пузыря, 86,4% и 97,6% соответственно (p=0,263).
В снижении ургентности КРПП эффективнее Солифенацина на 15,9%. Однако Солифенацин в сравнении с КРПП более результативен в снижении количества эпизодов недержания мочи (-15,9%) и защитных прокладок (-18,2%). - По данным анкеты NBSS (опросник симптомов нейрогенного мочевого пузыря), КРПП на 25,0% эффективнее Солифенацина в комплексной оценке, нормализуя качество жизни фактически у всех исследуемых против 50,0% для Солифенацина. Более специфичные по этому показателю анкеты SF-Qualiveen (оценка влияния нарушений мочеиспускания на качество жизни больных нейрогенным мочевым пузырем) и I-QOL (качество жизни, связанное с недержанием мочи) также демонстрируют очевидные преимущества КРПП в сравнении с Солифенацином: -66,5% против -43,0%, согласно анкете SF-Qualiveen; +80,4% против +56,0%, согласно анкете I-QOL.
- Перечень выявленных побочных действий для обоих препаратов соответствует указанным в инструкции к применению. При этом КРПП имеет более высокий профиль безопасности, поскольку частота представления признака ниже в сравнении с Солифенацином.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
1. Клинические рекомендации РФ 2022. Рассеянный склероз. Доступно по ссылке: https://cr.minzdrav.gov.ru/schema/739, дата обращения: 04.04.24.
2. Клинические рекомендации РФ 2020. Нейрогенная дисфункция нижних мочевыводящих путей. Доступно по ссылке: https://cr.minzdrav.gov.ru/schema/588_2, дата обращения: 04.04.24.
3. Клинические рекомендации РФ 2022. Рассеянный склероз. Доступно по ссылке: https://cr.minzdrav.gov.ru/schema/739, дата обращения: 04.04.24.
4. Распоряжение Правительства РФ от 12.10.2019 N 2406-р (ред. от 24.12.2022) «Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов, а также перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи». Доступно по ссылке: https://www.consultant.ru/document/cons_doc_LAW_335635/9eafb39fff8190c66b51355b212e9af18073c8d4, дата обращения: 04.04.2024
5. Инструкция по применению Везустена. Доступно по ссылке: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=eb3ebc7f-4c4e-40d5-a200-c89b3eed6bab, дата обращения: 04.04.24.
Список литературы
1. Montalban X., Gold R., Thompson A.J., Otero-Romero S., Amato M.P., Chandraratna D. et al. ECTRIMS/EAN guideline on the pharmacological treatment of people with multiple sclerosis. Eur J Neurol. 2018;25(2):215-237. DOI: 10.1111/ene.13536
2. Abrams P., Cardozo L., Fall M., Griffiths D., Rosier P., Ulmsten U. et al.; Standardisation Sub-committee of the International Continence Society. The standardisation of terminology of lower urinary tract function: report from the Standardisation Sub-committee of the International Continence Society. Neurourol Urodyn. 2002;21(2):167-178. DOI: 10.1002/nau.10052
3. Wintner A., Kim M.M., Bechis S.K., Kreydin E.I. Voiding Dysfunction in Multiple Sclerosis. Semin Neurol. 2016;36(1):34-40. DOI: 10.1055/s-0035-1571212
4. Aharony S.M., Lam O., Corcos J. Evaluation of lower urinary tract symptoms in multiple sclerosis patients: Review of the literature and current guidelines. Can Urol Assoc J. 2017;11(1-2):61-64. DOI: 10.5489/cuaj.4058
5. de Sèze M., Ruffion A., Denys P., Joseph P.A., Perrouin-Verbe B.; GENULF. The neurogenic bladder in multiple sclerosis: review of the literature and proposal of management guidelines. Mult Scler. 2007;13(7):915-928. DOI: 10.1177/1352458506075651
6. Amarenco G., de Sèze M., Ruffion A., Sheikh Ismael S. Clinical and urodynamic evaluations of urinary disorders in multiple sclerosis. Ann Phys Rehabil Med. 2014;57(5):277-287. DOI: 10.1016/j.rehab.2014.05.006
7. Panicker J.N., Fowler C.J. Lower urinary tract dysfunction in patients with multiple sclerosis. Handb Clin Neurol. 2015;130:371 381. DOI: 10.1016/B978-0-444-63247-0.00021-3
8. Зырянов А.В., Баженов И.В., Филиппова Е.С., Устинов Г.С., Турова Е.Л., Тореев И.О., и др. Эпидемиология и характер расстройств мочеиспускания у больных рассеянным склерозом. Вестник урологии. 2020;8(2):29-36. DOI: 10.21886/2308-6424-2020-8-2-29-36
9. Jaekel A.K., Winterhagen F.I., Zeller F.L., Butscher A.L., Knappe F.K., Schmitz F. et al. Neurogenic Lower Urinary Tract Dysfunction in Asymptomatic Patients with Multiple Sclerosis. Biomedicines. 2022;10(12):3260. DOI: 10.3390/biomedicines10123260
10. Fonseca A.M., Meinberg M.F., Monteiro M.V., Roque M., Haddad J.M., Castro R.A. The Effectiveness of Anticholinergic Therapy for Overactive Bladders: Systematic Review and Meta-Analysis. Rev Bras Ginecol Obstet. 2016;38(11):564-575. DOI: 10.1055/s-0036-1594289
11. Stoniute A., Madhuvrata P., Still M., Barron-Millar E., Nabi G., Omar M.I. Oral anticholinergic drugs versus placebo or no treatment for managing overactive bladder syndrome in adults. Cochrane Database Syst Rev. 2023;5(5):CD003781. DOI: 10.1002/14651858.CD003781.pub3
12. Abrams P., Andersson K.E., Buccafusco J.J., Chapple C., de Groat W.C., Fryer A.D. et al. Muscarinic receptors: their distribution and function in body systems, and the implications for treating overactive bladder. Br J Pharmacol. 2006;148(5):565-578. DOI: 10.1038/sj.bjp.0706780
13. Bridgeman M.B., Friia N.J., Taft C., Shah M. Mirabegron: β3-adrenergic receptor agonist for the treatment of overactive bladder. Ann Pharmacother. 2013;47(7-8):1029-1038. DOI: 10.1345/aph.1S054
14. Szczurowska E., Szánti-Pintér E., Chetverikov N., Randáková A., Kudová E., Jakubík J. Modulation of Muscarinic Signalling in the Central Nervous System by Steroid Hormones and Neurosteroids. Int J Mol Sci. 2022;24(1):507. DOI: 10.3390/ijms24010507
15. Rocca M.A., Amato M.P., De Stefano N., Enzinger C., Geurts J.J., Penner I.K. et al.; MAGNIMS Study Group. Clinical and imaging assessment of cognitive dysfunction in multiple sclerosis. Lancet Neurol. 2015;14(3):302-317. DOI: 10.1016/S1474-4422(14)70250-9
16. Dhanapalaratnam R., Markoulli M., Krishnan A.V. Disorders of vision in multiple sclerosis. Clin Exp Optom. 2022;105(1):3-12. DOI: 10.1080/08164622.2021.1947745
17. Kurtzke J.F. Rating neurologic impairment in multiple sclerosis: an expanded disability status scale (EDSS). Neurology. 1983;33(11):1444-1452. DOI: 10.1212/wnl.33.11.1444
18. Collins C.D., Ivry B., Bowen J.D., Cheng E.M., Dobson R., Goodin D.S. et al. A comparative analysis of Patient-Reported Expanded Disability Status Scale tools. Mult Scler. 2016;22(10):1349-1358. DOI: 10.1177/1352458515616205
19. Welk B., Morrow S., Madarasz W., Baverstock R., Macnab J., Sequeira K. The validity and reliability of the neurogenic bladder symptom score. J Urol. 2014;192(2):452-457. DOI: 10.1016/j.juro.2014.01.027
20. Филиппова Е.С., Баженов И.В., Волкова Л.И., Москвина Е.Ю., Турова Е.Л., Попова Ю.В. Русскоязычная версия шкалы симптомов нейрогенного мочевого пузыря (NBSS). Урология. 2018;(6):5-13. DOI: 10.18565/urology.2018.6.5-13
21. Bonniaud V., Parratte B., Amarenco G., Jackowski D., Didier J.P., Guyatt G. Measuring quality of life in multiple sclerosis patients with urinary disorders using the Qualiveen questionnaire. Arch Phys Med Rehabil. 2004;85(8):1317-1323. DOI: 10.1016/j.apmr.2003.09.029
22. Philippova E.S., Bazhenov I.V., Ziryanov A.V., Moskvina E.Y. Evaluation of Lower Urinary Tract Dysfunction Impact on Quality of Life in Multiple Sclerosis Patients: Russian Translation and Validation of SF-Qualiveen. Mult Scler Int. 2020;2020:4652439. DOI: 10.1155/2020/4652439
23. Patrick D.L., Martin M.L., Bushnell D.M., Yalcin I., Wagner T.H., Buesching D.P. Quality of life of women with urinary incontinence: further development of the incontinence quality of life instrument (I-QOL). Urology. 1999;53(1):71-76. DOI: 10.1016/s0090-4295(98)00454-3
24. Al Dandan H.B., Coote S., McClurg D. Prevalence of Lower Urinary Tract Symptoms in People with Multiple Sclerosis: A Systematic Review and Meta-analysis. Int. J. MS Care. 2020;22:91–99. DOI: 10.7224/1537-2073.2019-030.
25. Seddone S., Marturano M., Bientinesi R., Lucchini M., Bassi P., Mirabella M. et al. Lower urinary tract disorders in multiple sclerosis patients: prevalence, clinical features, and response to treatments. Neurourol Urodyn. 2021;40(6):1500-1508. DOI: 10.1002/nau.24687.
26. Nicholas RS, Friede T, Hollis S, Young CA. WITHDRAWN: Anticholinergics for urinary symptoms in multiple sclerosis. Cochrane Database Syst Rev. 2015;2015(6):CD004193. doi: 10.1002/14651858.CD004193.pub3
27. Phé V., Schneider M.P., Peyronnet B., Abo Youssef N., Mordasini L., Chartier-Kastler E. et al. Desmopressin for treating nocturia in patients with multiple sclerosis: A systematic review: A report from the Neuro-Urology Promotion Committee of the International Continence Society (ICS). Neurourol Urodyn. 2019;38(2):563-571. DOI: 10.1002/nau.23921
28. DeLuca J., Chiaravalloti N.D., Sandroff B.M. Treatment and management of cognitive dysfunction in patients with multiple sclerosis. Nat Rev Neurol. 2020;16(6):319-332. DOI: 10.1038/s41582-020-0355-1.
29. Xu R, Yang TX, Fang KW, Wang G, Li P. Efficacy, according to urodynamics, of OnabotulinumtoxinA compared with antimuscarinic drugs, for neurogenic detrusor overactivity: a systematic review and network meta-analysis. Sci Rep. 2022;12(1):17905. Published 2022 Oct 25. DOI: 10.1038/s41598-022-22765-1
30. Cheng T., Shuang W.B., Jia D.D., Zhang M., Tong X.N., Yang W.D. et al. Efficacy and Safety of OnabotulinumtoxinA in Patients with Neurogenic Detrusor Overactivity: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. PLoS One. 2016;11(7):e0159307. DOI: 10.1371/journal.pone.0159307
31. Yuan H., Cui Y., Wu J., Peng P., Sun X., Gao Z. Efficacy and Adverse Events Associated With Use of OnabotulinumtoxinA for Treatment of Neurogenic Detrusor Overactivity: A Meta-Analysis. Int Neurourol J. 2017;21(1):53-61. DOI: 10.5213/inj.1732646.323.
32. Пушкарь Д.Ю., Куприянов Ю.А., Гамидов С.И., Кривобородов Г.Г., Спивак Л.Г., Аль-Шукри С.Х. и др. Оценка безопасности и эффективности лекарственного препарата Везустен® у пациентов с гиперактивным мочевым пузырем. Урология. 2022;3:42–51. DOI: 10.18565/urology.2022.3.42-51
Об авторах
Немер М.Н. АбдуллахРоссия
Абдуллах Немер М.Н. - аспирант кафедры урологии и репродуктивного здоровья человека (с курсом детской урологии-андрологии), ФГБОУ ВО «Ростовский ГМУ» Минздрава России.
Ростов-на-Дону
И. И. Белоусов
Россия
Белоусов Игорь Иванович - д.м.н., доцент, профессор кафедры урологии и репродуктивного здоровья человека (с курсом детской урологии-андрологии), ФГБОУ ВО «Ростовский ГМУ» Минздрава России.
Ростов-на-Дону
З. А. Гончарова
Россия
Гончарова Зоя Александровна - д.м.н., доцент, профессор кафедры нервных болезней и нейрохирургии, ФГБОУ ВО «Ростовский ГМУ» Минздрава России, заведующая центром неврологическим Клиники ФГБОУ ВО РостГМУ Минздрава России.
Ростов-на-Дону
О. Ю. Руденко
Россия
Руденко Ольга Юрьевна - к.м.н., ассистент кафедры нервных болезней и нейрохирургии.
Ростов-на-Дону
М. Е. Белоусова
Россия
Белоусова Марина Евгениевна - к.м.н., ассистент кафедры анестезиологии и реаниматологии.
Ростов-на-Дону
Рецензия
Для цитирования:
Абдуллах Н., Белоусов И.И., Гончарова З.А., Руденко О.Ю., Белоусова М.Е. Влияние регуляторных пептидов на нейрогенную дисфункции нижних мочевых путей при рассеянном склерозе. Данные одного центра. Южно-Российский журнал терапевтической практики. 2024;5(2):79-90. https://doi.org/10.21886/2712-8156-2024-5-2-79-90
For citation:
Abdallah N., Belousov I.I., Goncharova Z.A., Rudenko O.Yu., Belousova M.E. Influence of regulatory peptides on neurogenic lower urinary tract dysfunction in multiple sclerosis. Data of one center. South Russian Journal of Therapeutic Practice. 2024;5(2):79-90. (In Russ.) https://doi.org/10.21886/2712-8156-2024-5-2-79-90


























