Перейти к:
Морфологические характеристики легких при COVID-19 у пациентов с заболеваниями системы крови
https://doi.org/10.21886/2712-8156-2024-5-4-64-72
Аннотация
Цель: изучить варианты морфологических изменений в лёгких, используя материал патологоанатомических вскрытий пациентов с заболеваниями системы крови, умерших от COVID-19.
Материалы и методы: выполнен ретроспективный морфологический анализ гистологических препаратов лёгочной ткани у когорты пациентов с заболеваниями системы крови с применением стандартной гистологической окраски гематоксилином и эозином и оценки состояния альвеолоцитов 1 и 2 типа, окраска по Маллори и Ван-Гизону для оценки состояния соединительной ткани. С помощью иммуногистохимического анализа изучен лейкоцитарный профиль лёгочной ткани, для чего использованы антитела клонов дифференцировки (CD) 4, 8, 20, 34 и выяснено содержание коллагена IV типа.
Результаты: проанализированы 22 случая летальных исходов пациентов c заболеваниями системы крови, умерших от COVID-19 (13 мужчин и 9 женщин), средний возраст — 63 года. Выбранная когорта включала неопухолевые (миелодиспластический синдром с мультилинейной дисплазией) и опухолевые заболевания крови (хронический лимфолейкоз, острый миелоидный лейкоз, острый лимфобластный лейкоз, множественная миелома).
Согласно данным морфометрического анализа, получены определённые различия в состоянии лёгочной ткани. В группе с миелодисплазией морфологическая картина повреждения лёгочной ткани при COVID-19 характеризуется разрушением альвеолярной ткани, наличием единичных альвеолоцитов и отсутствием нейтрофилов и макрофагов. При хроническом лимфолейкозе (В и С стадии по Binet) выявлено нарушение в образовании гиалиновых мембран и развитие мицетом, появление лимфоцитов разных размеров. При лимфомах (диффузной В-крупноклеточной и лимфомах зоны мантии) отмечено развитие тромбообразования на фоне деколлагенизации стенки сосудов.
При множественной миеломе обнаружены формирования из многоядерных альвеолоцитов, образованных вследствие вирусного метаморфоза. У нелеченых пациентов в дебюте острых миелоидных лейкозов выявлено присутствие бластов.
Несмотря на разнообразность когорты, в иммунном отклике обнаружена универсальность ответа в виде исчезновения CD4- и экспрессии CD8- и CD34- лейкоцитов во всех рассмотренных случаях. Индивидуальная особенность определена при множественной миеломе в виде положительной экспрессии к CD20+лейкоцитов лёгочной ткани.
Заключение: поражение лёгких при СOVID-19 характеризуется различиями в состоянии морфологической картины в зависимости от онкогематологического заболевания и универсальностью иммунного отклика с отличием у пациентов с множественной миеломой в виде усиленной экспрессии CD20+, вероятно, обусловленной патогенезом миеломы и накоплением патологических клонов лейкоцитов.
Ключевые слова
Для цитирования:
Невзорова В.А., Талько А.В., Коцюрбий Е.А., Паринов В.Ю., Путий З.Е. Морфологические характеристики легких при COVID-19 у пациентов с заболеваниями системы крови. Южно-Российский журнал терапевтической практики. 2024;5(4):64-72. https://doi.org/10.21886/2712-8156-2024-5-4-64-72
For citation:
Nevzorova V.A., Tal'ko A.V., Kotsyurbiy E.A., Parinov V.Yu., Putiy Z.E. Morphological characteristics of the lungs in COVID-19 patients with diseases of the blood system. South Russian Journal of Therapeutic Practice. 2024;5(4):64-72. (In Russ.) https://doi.org/10.21886/2712-8156-2024-5-4-64-72
Введение
Заболевания системы крови, несмотря на многообразие возможностей проведения таргетной терапии и трансплантации костного мозга, являются группой, угрожающей по риску возникновения осложнений и летального исхода [1][2]. Пандемия COVID-19 значительно ухудшила прогноз у гематологических пациентов, особенно среди лиц с мульти- и полиморбидностью, а именно при сочетании с хронической обструктивной болезнью лёгких, ожирением, сахарным диабетом, артериальной гипертензией, ишемической болезнью сердца, хроническими заболеваниями почек, солидными опухолями иной локализации [3][4][5][6]. Известно, что главной мишенью для SARS-CoV-2 являются лёгкие [7][8], а основным морфологическим субстратом их поражения считается достаточно специфическое диффузное альвеолярное повреждение (ДАП) в комплексе с вовлечением в патологический процесс сосудистого русла лёгких и развития альвеолярно-геморрагического синдрома [9][10].
Данные о морфологических вариантах поражения лёгких при COVID-19 у пациентов гематологического профиля в изучаемой литературе практически не описаны, также как отсутствуют сведения об особенностях формирования местного иммунного ответа у лиц с заболеваниями системы крови и COVID19.
Цель исследования — выяснить особенности морфологических изменений в лёгких у пациентов с заболеваниями системы крови, умерших от COVID-19, с учётом состояния альвеолоцитов 1 и 2 типов, содержания коллагена IV типа и вариантов Т-и В- иммунного отклика в исследуемом материале.
Материалы и методы
Проведён выборочный анализ аутопсийных данных (фрагменты лёгких) 22 пациентов с заболеваниями системы крови (опухолевого и неопухолевого характера), находившихся на лечении в инфекционном госпитале на базе ГБУЗ «Краевая клиническая больница №2» г. Владивостока по поводу коронавирусной инфекции COVID-19 в период с 2020 по 2022 годы. Проведено морфологическое исследование гистологических препаратов легочной ткани с применением окрашивания гематоксилином-эозином (г/э), иммуногистохимических (ИГХ) маркеров: CD4 (clon 4B12), CD8 (clon CD8\144B), CD20(clon L26), CD34 (class II clon QBEnd 10), коллагена IV типа (clon CIV22) с помощью Autostainer 360. Исследуемые объекты фиксировались в 10% забуференном формалине. Окрашивание проводилось с помощью Thermo. Для ИГХ-реакций серийные парафиновые срезы обрабатывали по общепринятой методике с использованием моноклональных антител («Dako Inc.» Дания). Система визуализации того же производителя. Для проведения качественной реакции на соединительную ткань использовали гистохимические реакции по Маллори и Ван-Гизону. Применён описательный метод полученных результатов без статистической обработки. Морфологическое исследование полученных микропрепаратов выполнено с помощью микроскопа OLYMPUS BX 41 и цифровой видеокамеры OLYMPUS DP 12 (OLYMPUS Corp., Япония).
Гистологическое и иммуногистохимическое исследования проведены на кафедре патологической анатомии и судебной медицины ФГБОУ ВО ТГМУ Минздрава России.
Результаты
Подвергнутая анализу когорта пациентов гематологического профиля, умерших от COVID-19 включала 22 случая, из которых 13 составили мужчины, 9 — женщины в возрасте от 51 до 74 лет (средний возраст — 63 года). В изученной группе были представлены следующие заболевания системы крови: миелодиспластический синдром (МДС) с мультилинейной дисплазией (2 пациента), хронический лимфолейкоз (ХЛЛ) (8 пациентов), острый миелоидный лейкоз (ОМЛ) (4 пациента), острый лимфоидный лейкоз (ОЛЛ) (2 пациента), множественная миелома (ММ) (3 пациента), лимфомы (1 пациент с диффузной В-крупноклеточной лимфомой (ДБККЛ), 2 — с мантийно-клеточной лимфомой (МКЛ). Все пациенты имели как минимум одно сопутствующее заболевание - гипертоническую болезнь (ГБ), артериальную гипертензию (АГ); сахарный диабет, ожирение или хроническую болезнь почек (ХБП) .
При использовании рутинного окрашивания гематоксилином и эозином выявлены следующие особенности морфологической картины повреждения лёгких.
В исследуемых полях зрения в группе лиц с МДС наблюдается нарушение гистоархитектоники альвеол за счёт утолщения и частичного разрыва стенок. Увеличение толщины межальвеолярных перегородок обусловлено в первую очередь, коллагенезацией стромы последних, о чём свидетельствует положительная экспрессия антител к коллагену IV-го типа. На этом фоне отмечена отрицательная экспрессия к клонам дифференцировки 4-го, 8-го и 20-го типов с положительной реакцией к 34-му клону (CD34+). В просвете альвеол среди гомогенных розовых масс локализуются единичные альвеолоциты. Вдоль внутренней поверхности стенок альвеол располагаются полоски гиалиновых мембран,разной толщины и формы (рис.1а, б).
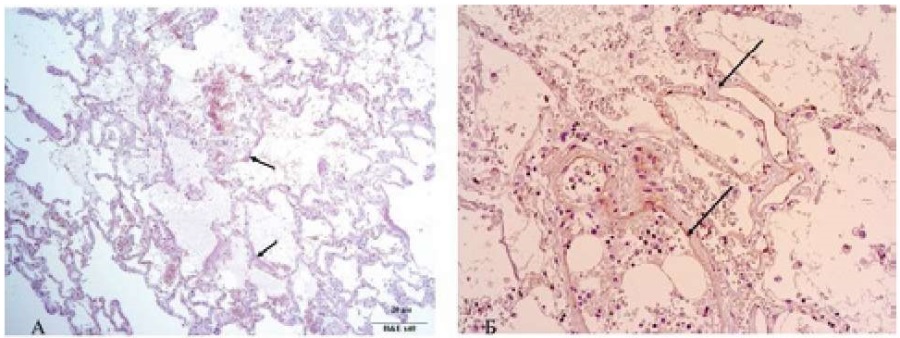
Рисунок 1А. Гиалиновые мембраны на внутренней поверхности стенок альвеол. ×400. Окраска гематоксилином и эозином. Б. Коллагенезация стромы стенок альвеол. ИГХ реакция. Положительная экспрессия к коллагену IV типа.
Figure 1A. Hyaline membranes on the inner surface of the alveolar walls. ×400. Hematoxylin and eosin staining. B. Collagenesis of the stroma of the alveolar walls. IHC reaction. Positive expression of type IV collagen.
В группе пациентов с лимфомами (ДБККЛ и МКЛ) все пациенты были в процессе специфической противоопухолевой терапии, в том числе анти-CD20 моноклональным антителом «Ритуксимаб». Просветы терминальных бронхов заполнены массами розового цвета, сплошь клетками лимфоидного ряда с преобладанием сегментоядерных лейкоцитов и десквамированным эпителием бронха. В респираторной части имеет место чередование полей дистелектазов и небольших участков с эмфизематозными изменениями лёгочной ткани. В стенках альвеол неравномерные утолщения за счёт коллагенезации и фиброза (положительная экспрессия к коллагену IV типа). Гиалиновые мембраны отмечены в отдельных альвеолоцитах. В клетках лимфоидного ряда преобладает кластер дифференцировки 34-й и 8-й (CD8+; CD34+), при отрицательной реакции с антителами 4-го и 20-го типа (рис. 2).
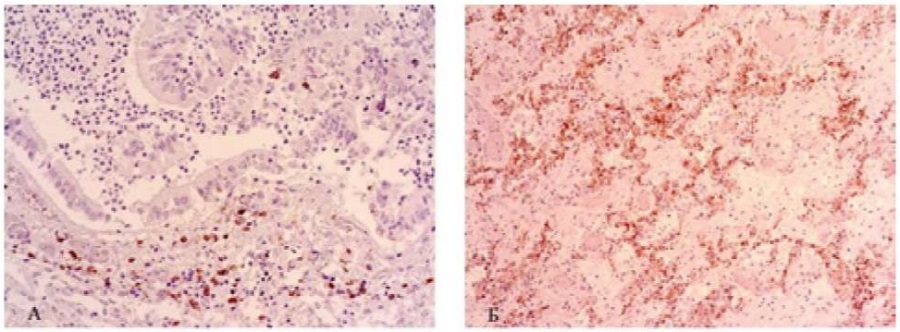
Рисунок 2. ДБКЛ иммуногистохимическая реакция. А - экспрессия CD8+; ×400. Б - экспрессия CD34+; ×100
Figure 2. DBCL immunohistochemical reaction. A - expression of CD8+; ×400. B - expression of CD34+; ×100.
Очевидно, в этой когорте установлен неадекватный иммунной ответ. Вероятно, полученные результаты ассоциированы с неадекватным противовирусным ответом у данной категории больных, который обусловлен работой клеточного иммунного ответа и с быстрым истощением Т-клеток (истощенные инфильтрированные Т-клетки вызывают снижение количества неисчерпаемых CD8+ Т-клеток у пациентов с тяжелой формой COVID-19).
Более разнообразным по течению коронавирусной инфекции COVID-19 оказалась группа пациентов с ХЛЛ. В группе пациентов с ХЛЛ, умерших от COVID-19, для описания выбрано два пациента с разными стадиями заболевания и разными статусами по специфической терапии.
В группе пациентов с ХЛЛ, умерших от COVID-19, для описания выбрано два пациента с разными стадиями заболевания и разными статусами по проводимой специфической терапии.
Пациент с ХЛЛ, стадия «В» по Binet, молодого возраста (50 лет) поступил с впервые выявленным заболеванием, лейкоцитозом 60×10⁹ за счёт абсолютного лимфоцитоза. На диагностическом этапе установлено инфицирование коронавирусной инфекцией COVID-19, лечение ХЛЛ не проводилось. Согласно проведённому морфометрическому обследованию аутопсийного материала в лёгочной ткани, преобладают процессы альтеративно-деструктивного характера. Утолщение межальвеолярных перегородок обусловлено пролиферацией альвеолоцитов и развитием очагового склероза, о последнем свидетельствует положительная экспрессия к антителам коллагена IV типа. Имеет место чередование полей дистелектазов и эмфизематозной трансформации альвеол с разрывом стенок (рис. 3). В стенках отмечена экспрессия антител к CD8+ и СD34+ при отсутствии экспрессии к клонам дифференцировки 4-го и 20-го типа. В просвете альвеол сплошь регистирируются массы эритроцитов с четкими контурами ярко-розового цвета.
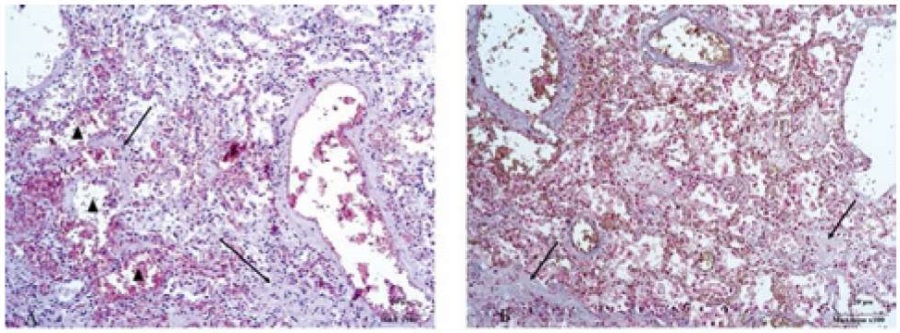
Рисунок 3 А. Утолщение стенок альвеол за счет коллагеноза (отмечено стрелками). Фигурой отмечены эритроциты в просветах альвеол. Окраска гематоксилином и эозином. ×100
Б. Окраска по Маллори. Отмечены стрелками стенки альвеол с коллагенезацией. ×100.
Figure 3 A. Thickening of the alveolar walls due to collagenosis (marked with arrows). The figure marks the erythrocytes in the alveolar lumens. Hematoxylin and eosin staining. ×100
B. Mallory staining. The alveolar walls with collagenosis are marked with arrows. ×100.
Второй пациент, 71 год, с ХЛЛ «C» стадии по Binet, длительным анамнезом заболевания (6 лет), стадией рецидива, наличием сопутствующих хронических заболеваний (СД, ГБ, ФП, ХОБЛ, ожирение). На момент инфицирования COVID-19 находился в процессе противорецидивной терапии (курс иммунохимиотерапии в режиме «RCD» — ритуксимаб, дексаметазон, циклофосфамид).
Морфологическая картина лёгочной ткани умершего характеризовалась преобладанием процессов деструктивного и некротического характеров. Так, в гистологических препаратах регистрировались стенки альвеол с нарушением целостности структур за счёт разрыва на фоне истончения и некроза. Среди некротических масс обнаружены мицелии гриба, расценённые как проявления мицетомы (рис. 4).
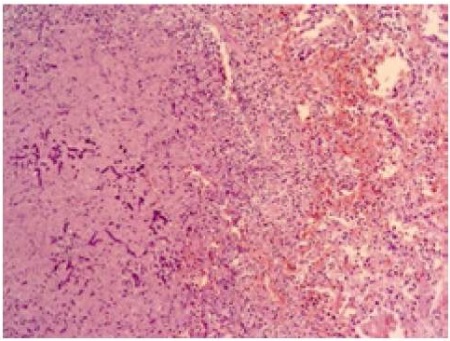
Рисунок 4. Среди тканевого детрита друзы гриба типа мукор. Окраска H&E Ув. ×400.
Figure 4. Among the tissue detritus, fungal-type mucor drusen. H&E, inc: ×400.
Зоны повреждения чередовались с участками утолщения за счёт пролиферирующих фибробластов и, как следствие, реактивного фиброматоза лёгочной ткани. В описанных зонах получена положительная экспрессия к коллагену IV типа. Клетки лимфоидного ряда, в данном случае, представлены 8-м и 34-м клонами (CD8+; CD34+) дифференцировки и имеют негативную экспрессию к CD4- и СD20-. По внутреннему контуру альвеол расположены гиалиновые мембраны. В просвете альвеол среди гомогенных розовых масс наблюдаются сидерофаги, нагруженные гемосидерином и десквамированные альвеолоциты.
В случае с множественной миеломой 3 пациента получали специфическое лечение на начальном этапе, без достижения её эффективности, все имели наличие сопутствующих заболеваний.
Структурные повреждения, описываемой легочной ткани, затронули терминальные бронхи и респираторный отдел легких. Стенка бронха циркулярно утолщена за счёт фиброза. Наблюдаются коллагенезация диффузного характера и расширение базальной мембраны. В просвете бронхов среди масс фибрина обнаруживается сплошь десквамированный эпителий. На всём протяжении отмечено утолщение межальвеолярных перегородок за счёт неравномерного фиброза (рис. 5 А; стрелкой отмечена стенка бронха; фигурой – межалвеолярные перегородки). На внутренней поверхности альвеол лоцируются гиалиновые мембраны в виде прерывающихся полосок разной толщины. Зарегистрированы многоядерные альвеолоциты, расцениваемые как феномен COVID-19 ассоциированного вирусного метаморфоза [12].
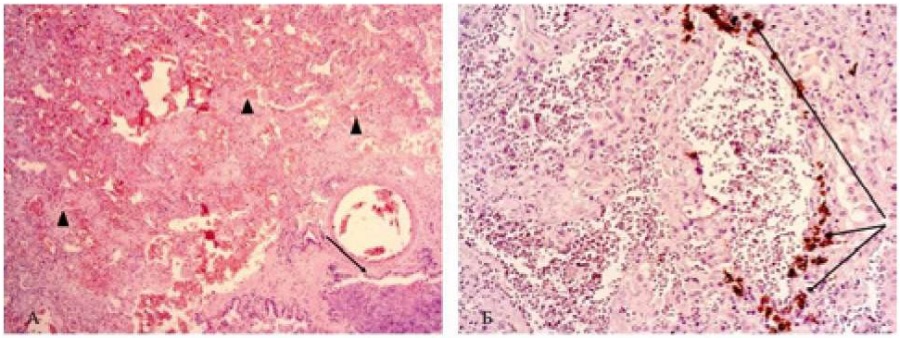
Рисунок 5 Множественная миелома. А Окраска гематоксилином и эозином. ×100. Б. ИГХ реакция с антителами к CD20+. ×400
Figure 5 Multiple myeloma. A. Hematoxylin and eosin staining. ×100. B. IHC reaction with antibodies to CD20+. ×400
Пациенты с острыми лейкозами, умершие от коронавирусной инфекции, были вне ремиссии основного заболевания, получали разную специфическую терапию. Описание микропрепарата лёгких представлено у пациента с развитием COVID-19 в дебюте ОМЛ, которому специфическая терапия не была проведена.
В микропрепаратах лёгочной ткани отмечены морфологические критерии повреждения кондукторного и респираторного отдела лёгких. Имеет место гиперсекреция эпителиоцитов бронха с частичной десквамацией последних. В респираторной части лёгких преобладают фокусы дистелектазов с зонами реактивного фиброматоза в стенке, о чём свидетельствует положительная экспрессия к коллагену IV типа. В расширенных участках лёгочной ткани на поверхности альвеол локализуются гиалиновые массы. В просвете альвеол наблюдаются многоядерные симпласты альвеолоцитов, что расценено как вариант вирусного метаморфоза. В лимфоидной ткани преобладает экспрессия к клону CD8+ и CD34+ при содружественной отрицательной реакции к CD4- и CD20- (рис. 6).
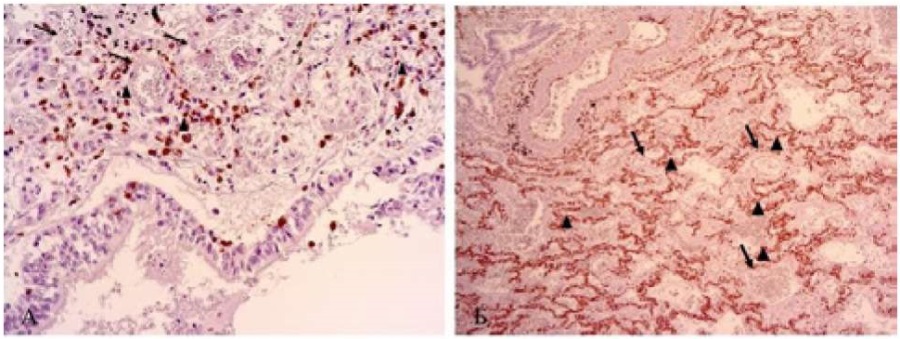
Рисунок 6. А. ОМЛ. В стенках альвеол, в периваскулярном пространстве ( помечено стрелкой) экспрессия к рецептору CD8+(помечено фигурой). Б. В стенках альвеол, в периваскулярном пространстве ( помечено стрелкой) экспрессия к рецептору CD34+(помечено фигурой).
Figure 6. A. AML. In the alveolar walls, in the perivascular space (marked with an arrow) there is expression of the CD8+ receptor (marked with a figure). B. In the alveolar walls, in the perivascular space (marked with an arrow) there is expression of the CD34+ receptor (marked with a figure).
Во всех случаях проанализированных историй не было выявлено экспрессии на коллаген IV типа в стенках сосудов и капилляров. Такой феномен можно расценивать как вирусное повреждение и причину тромбообразования (рис. 7,8).
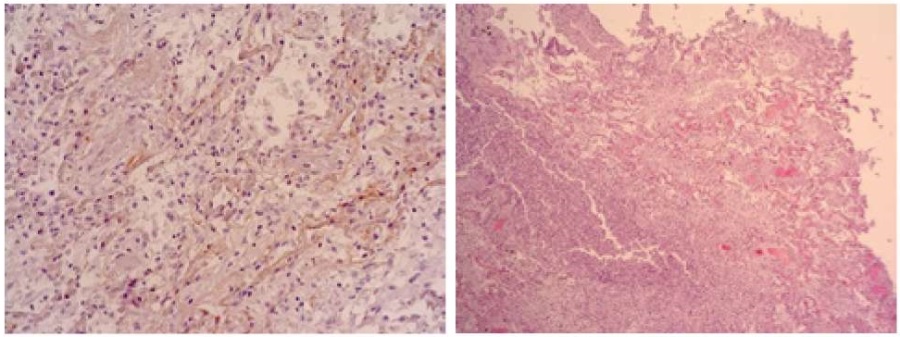
Рисунок 7, 8. Слева окраска по Ван-Гизон: деколлагенизация внутренней оболочки стенки сосудов аэрогематического барьера (ув. ×400). Справа — тот же случай, окраска H&E; (ув. ×100). В просвете сосудов микроциркуляторного русла фибриновые тромбы.
Figure 7, 8. On the left, Van Gieson: decollagenization of the inner lining of the vascular walls of the air-hematic barrier (inc: ×400). On the right the same case, H&E staining (inc: ×100). Fibrin clotsi are visible in the lumen of the microvascular vessels.
Обсуждение
Согласно мнению большинства исследователей, основным морфологическим субстратом поражения лёгких при COVID-19 является диффузное альвеолярное повреждение (ДАП) [8][10][13], которое имеет определённую стадийность в течении в зависимости от сроков процесса [10]. Тем не менее анализ 2000 патологоанатомических вскрытий, умерших от COVID-19 в г. Москве показал, что, несмотря на сохранение признаков условной стадийности в течении ДАП, в ряде случаев изменения лёгких, характерные для ранней или экссудативной стадии, наблюдались спустя 14 суток от начала заболевания [13], в то время как изменения, характерные для поздней пролиферативной стадии, отсутствовали или сочетались с признаками ранней стадии [13]. Несмотря на разнообразие коморбидной патологии умерших от COVID-19, данные о морфологических изменениях в лёгких у пациентов с гематологическими заболеваниями нам не встретились. Несмотря на различные сроки до наступления летального исхода (от 3-х до 46 дней) и отдельные специфические черты ДАП, в обследованной нами когорте морфологические изменения в кондукторных и респираторных отделах лёгких были однотипны и характеризовались заполнением просветов терминальных бронхов различным по составу клеточным детритом, содержащим десквамированный эпителий, циркулярное утолщение стенки бронхов вследствие фиброза. Исследование аутопсийного материала лёгочной ткани подтвердило преобладание процессов альтеративно-деструктивного характера независимо от сроков наступления летального исхода и характера гематологического заболевания. Особенностью нашего исследования является выявление неравномерно утолщённых альвеолярных стенок и межальвеолярных перегородок за счёт процессов избыточной коллагенизации, что подтверждено положительной экспрессией коллагена IV типа. У всех обследованных в легочной ткани наблюдались признаки присутствия гиалиновых мембран в отдельных альвеолоцитах и многоядерные альвеолоциты как проявление вирусного метаморфоза при COVID-19. Подобные процессы для общих воспалительных процессов в легочной ткани также описывают Chen Zhang и Jeffrey L. Myers [14]. В нашей работе мы получили данные, касающиеся уникального поражения лёгочной ткани при COVID-19 с заболеваниями системы крови. В отличие от других когорт пациентов с различной коморбидной патологией в нашем исследовании нам не удалось проследить стадийность развития ДАП или ОРДС в зависимости от сроков болезни. Изменения в лёгких характеризовались смешанной картиной, содержащей вышеперечисленные признаки вплоть до признаков избыточной коллагенизации и фиброза, что можно отметить как специфическую черту тонатогенеза у гематологических пациентов. Важным составляющим компонентом ДАП при COVID-19 являются сосудистые повреждения [5][8]. В нашем исследовании они были типичными для всех обследованных. Ни в одном случае нам не удалось проследить экспрессию на коллаген IV типа в стенках сосудов и капилляров, что можно рассматривать как важный фактор тромбообразования. У пациентов с различными гематологическими заболеваниями наблюдаются особенности местного иммунного ответа в лёгких, характеризующиеся преобладанием либо Т-клеточных (для лимфом), либо В-клеточных (для ХЛЛ и множественной миеломы) клонов при истощении противоположного звена иммунитета. Указанные особенности иммунного ответа могут являться причиной более тяжёлого течения COVID-19 и быть связанными с выявленными морфологическими изменениями независимо от сроков летального исхода у данной категории больных.
Заключение
Морфологическая картина повреждения лёгочной ткани при COVID-19 у пациентов гематологического профиля характеризуется разрушением альвеолярной ткани в группе с миелодисплазией, формированием мицетом при хроническом лимфолейкозе, тромбообразованием при лимфомах на фоне деколлагенизации стенок капилляров, формированием многоядерных альвеолоцитов вследствие вирусного метаморфоза при множественных миеломах и в дебюте острых миелоидных лейкозов.
Местная клеточная реакция лёгочной ткани характеризуется при МДС наличием единичных альвеолоцитов и отсутствием нейтрофилов и макрофагов, при ХЛЛ — появлением лимфоцитов разных размеров с отрицательной экспрессией к CD4-, CD20- и присутствием бластов у нелеченых пациентов с ОМЛ.
В иммунном отклике обнаружена универсальность ответа в виде исчезновения CD4- и экспрессии CD8- и CD34- во всех рассмотренных случаях. Индивидуальная особенность определена при множественной миеломе в виде экспрессии CD20+. Реакция к коллагену IV типа положительна в респираторном и кондукторном отделах лёгких с частичной потерей вплоть до полного исчезновения в сосудах и капиллярах у всех обследованных.
Полученные данные отражают нюансы в повреждении лёгких у пациентов гематологического профиля при COVID-19 и требуют дальнейшего изучения на большей когорте пациентов.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Borah P, Mirgh S, Sharma SK, Bansal S, Dixit A, Dolai TK, et al. Effect of age, comorbidity and remission status on outcome of COVID-19 in patients with hematological malignancies. Blood Cells Mol Dis. 2021;87:102525. DOI: 10.1016/j.bcmd.2020.102525
2. Dai M, Liu D, Liu M, Zhou F, Li G, Chen Z, et al. Patients with Cancer Appear More Vulnerable to SARS-CoV-2: A Multicenter Study during the COVID-19 Outbreak. Cancer Discov. 2020;10(6):783-791. DOI: 10.1158/2159-8290.CD-20-0422
3. Фатеева А.В., Гурина Л.И. COVID-19 у онкологических пациентов в Приморском крае: заболеваемость и летальность. Тихоокеанский медицинский журнал. 2020;(4):5-9. DOI: 10.34215/1609-1175-2020-4-5-9
4. Шатохин Ю.В., Снежко И.В., Рябикина Е.В. Нарушение гемостаза при коронавирусной инфекции. Южно-Российский журнал терапевтической практики. 2021;2(2):6-15. DOI: 10.21886/2712-8156-2021-2-2-6-15
5. Teimury A, Khameneh MT, Khaledi EM. Major coagulation disorders and parameters in COVID-19 patients. Eur J Med Res. 2022;27(1):25. DOI: 10.1186/s40001-022-00655-6
6. Каприн А.Д., Гамеева Е.В., Поляков А.А., Корниецкая А.Л., Рубцова Н.А., Феденко А.А. Влияние пандемии COVID-19 на онкологическую практику. Сибирский онкологический журнал. 2020;19(3):5-22. DOI: 10.21294/1814-4861-2020-19-3-5-22
7. Ильенкова Н.А., Конуркина Н.С., Соколовская Е.С., Пастухова С.Ю., Колодина А.А., Герасимова Т.А. Клинико-лабораторные особенности течения патологии нижних дыхательных путей, вызванной новой коронавирусной инфекцией, и пневмонии бактериальной этиологии у детей. Тихоокеанский медицинский журнал. 2021;(4):56-61. DOI: 10.34215/1609-1175-2021-4-56-61
8. Зарубин Е.А., Коган Е.А. Патогенез и морфологические изменения в легких при COVID-19. Архив патологии. 2021;83(6):54‑59. DOI: 10.17116/patol20218306154
9. Богорад А.Е., Розинова Н.Н., Мизерницкий Ю.Л., Лев Н.С., Костюченко М.В., Дьякова С.Э., и др. Альвеолярный геморрагический синдром у детей. Российский вестник перинатологии и педиатрии. 2018;63(1):57-65. DOI: 10.21508/1027-4065-2018-63-1-57-65
10. Забозлаев Ф.Г., Кравченко Э.В., Галлямова А.Р., Летуновский Н.Н. Патологическая анатомия легких при новой коронавирусной инфекции (COVID-19). Предварительный анализ аутопсийных исследований. Клиническая практика. 2020;11(2):21-37. DOI: 10.17816/clinpract34849
11. Рыбакова М.Г., Карев В.Е., Кузнецова И.А. Патологическая анатомия новой коронавирусной инфекции COVID-19. Первые впечатления. Архив патологии. 2020;82(5):5‑15. DOI: 10.17116/patol2020820515
12. Зайратьянц О.В., Самсонова М.В., Черняев А.Л., Мишнев О.Д., Михалёва Л.М., Крупнов Н.М., и др. Патологическая анатомия COVID-19: опыт 2000 аутопсий. Судебная медицина. 2020;6(4):10-23. DOI: 10.19048/fm340
13. Dolina JS, Van Braeckel-Budimir N, Thomas GD, Salek-Ardakani S. CD8+ T Cell Exhaustion in Cancer. Front Immunol. 2021;12:715234. DOI: 10.3389/fimmu.2021.715234
14. Zhang C, Jeffrey L. Myers Atlas of Anatomic Pathology. 2018. DOI: 10.1007/978-1-4939-8689-7
Об авторах
В. А. НевзороваРоссия
Невзорова Вера Афанасьевна, д.м.н., профессор, директор института терапии и инструментальной диагностики
Владивосток
А. В. Талько
Россия
Талько Ангелина Владимировна, врач-гематолог; ассистент института терапии и инструментальной диагностики
Владивосток
Е. А. Коцюрбий
Россия
Коцюрбий Евгений Анатольевич, к.м.н., доцент, заведующий кафедрой патологической анатомии и судебной медицины
Владивосток
В. Ю. Паринов
Россия
Путий Захар Евгеньевич, медицинский брат отделения гематологии
Владивосток
З. Е. Путий
Россия
Путий Захар Евгеньевич, медицинский брат отделения гематологии; студент 6 курса
Владивосток
Дополнительные файлы
Рецензия
Для цитирования:
Невзорова В.А., Талько А.В., Коцюрбий Е.А., Паринов В.Ю., Путий З.Е. Морфологические характеристики легких при COVID-19 у пациентов с заболеваниями системы крови. Южно-Российский журнал терапевтической практики. 2024;5(4):64-72. https://doi.org/10.21886/2712-8156-2024-5-4-64-72
For citation:
Nevzorova V.A., Tal'ko A.V., Kotsyurbiy E.A., Parinov V.Yu., Putiy Z.E. Morphological characteristics of the lungs in COVID-19 patients with diseases of the blood system. South Russian Journal of Therapeutic Practice. 2024;5(4):64-72. (In Russ.) https://doi.org/10.21886/2712-8156-2024-5-4-64-72


























