Перейти к:
Взаимосвязь клубочковых и канальцевых повреждений с клиническим течением, морфо-функциональными параметрами сердца и показателями гемодинамики у больных ишемической болезнью сердца, постинфарктным кардиосклерозом и артериальной гипертензией
https://doi.org/10.21886/2712-8156-2025-6-1-27-37
Аннотация
Цель: изучение особенностей кардио-ренальных взаимоотношений у больных ишемической болезнью сердца (ИБС), перенёсших инфаркт миокарда, в сочетании с хронической болезнью почек (ХБП).
Материалы и методы: в исследование были включены 110 пациентов ИБС, перенёсших острый инфаркт миокарда (ОИМ) в сочетании с артериальной гипертензией 1–2 степени, которые также имели ХБП 1–3Б стадий. Клиническое исследование включало уточнение функционального класса хронической сердечной недостаточности (ХСН) с помощью теста 6-минутной ходьбы (ТШХ), оценку тяжести ХСН по шкале ШОКС, электрокардиографию (ЭКГ), эхокардиографию (ЭХОКГ), суточное мониторирование артериального давления (СМАД), холтеровское мониторирование ЭКГ. Функциональное состояние почек оценивалось по уровню скорости клубочковой фильтрации (СКФ) (формула CKD-EPI), отношению альбумина к креатинину в суточной моче (АУ), а также по уровню N-ацетил-β-D-глюкозаминидазы (NAG) в моче.
Результаты: превышение уровня референсных значений NAG в моче продемонстрировало тесную связь с повреждением эпителия проксимальных канальцев. Уровни NAG и АУ тесно связаны. При анализе значений ТШХ было установлено, что по мере снижения значения ТШХ происходило повышение уровня АУ. Повышение балла по шкале ШОКС ассоциировалось со снижением СКФ. Значимой корреляционной связи данного параметра с АУ и NAG в моче выявлено не было. По мере дилатации левых отделов сердца, а также снижения систолической функции и прогрессирования гипертрофии миокарда происходило статистически значимое снижение СКФ. Значения NAG в моче и АУ были выше в подгруппе пациентов с концентрической гипертрофией. В ходе анализа взаимосвязей показателей СМАД и параметров, отражающих повреждение почечной ткани, было отмечено нарастание среднесуточного систолического АД (САД) по мере прироста уровня NAG в моче и снижения СКФ. Повышение уровня NAG в моче также ассоциируется с усилением вариабельности САД, ростом индекса времени гипертензии и скорости утреннего подъёма АД. Изменения значений СКФ и АУ имеют меньшее число связей с параметрами СМАД. При анализе результатов холтеровского мониторирования ЭКГ было установлено, что по мере снижения СКФ растет вероятность выявления случаев ишемии миокарда (СИМ), а также продолжительность всех эпизодов ишемии миокарда.
Выводы: канальцевые повреждения в виде повышения уровня NAG в моче, клубочковые повреждения в виде АУ и снижение фильтрационной способности почек (снижение СКФ) при ХБП ассоциируются с процессами ремоделирования миокарда у больных с ИБС, ПИКС и АГ в равной мере, однако высокая вариабельность АГ, патологические суточные профили АГ в большей степени ассоциируются с наличием канальцевых повреждений, а возникновение эпизодов ишемии миокарда и продолжительность безболевой ишемии — с наличием клубочковых и канальцевых повреждений.
Для цитирования:
Битарова З.В., Ремизов О.В., Астахова З.Т. Взаимосвязь клубочковых и канальцевых повреждений с клиническим течением, морфо-функциональными параметрами сердца и показателями гемодинамики у больных ишемической болезнью сердца, постинфарктным кардиосклерозом и артериальной гипертензией. Южно-Российский журнал терапевтической практики. 2025;6(1):27-37. https://doi.org/10.21886/2712-8156-2025-6-1-27-37
For citation:
Bitarova Z.V., Remizov O.V., Astakhova Z.T. Relationship between glomerular and tubularile kidney injuries and clinical course, morpho-functional parameters of the heart and hemodynamic indicators in patients with coronary heart disease, postinfarction cardiosclerosis and arterial hypertension. South Russian Journal of Therapeutic Practice. 2025;6(1):27-37. (In Russ.) https://doi.org/10.21886/2712-8156-2025-6-1-27-37
Вступление
Высокая распространённость сердечно-сосудистых заболеваний, высокие темпы инвалидизации и смертности, а также снижение качества жизни определяют бремя сердечно-сосудистых заболеваний [1]. Несмотря на стабилизацию смертности бремя сердечно-сосудистых заболеваний возрастает по мере постарения населения и роста индекса коморбидности [2].
В Российской Федерации в общей структуре смертности населения сердечно-сосудистые заболевания по-прежнему занимают первое место. Вместе с тем существует понимание того, какие аспекты требуют первостепенного внимания со стороны системы здравоохранения [3]. Помимо ряда управленческих и экономических направлений, важным является достижение высокого уровня ранней диагностики и эффективного лечения сердечно-сосудистых заболеваний, а также борьба с коморбидными патологическими процессами, такими как сахарный диабет, ожирение и хроническая болезнь почек (ХБП) [4–6].
Известно, что сочетание сердечно-сосудистых заболеваний с хронической болезнью почек (ХБП) является важной проблемой ввиду роста сердечно-сосудистой смертности у данной категории пациентов, а поскольку распространённость ХБП незначительно уступает распространённости болезней сердца, то данная проблема является актуальной для терапевтической клиники в целом [7–8].
Актуальным является проведение полномасштабных исследований в области кардио-ренальных взаимоотношений у больных, перенёсших инфаркт миокарда (ИМ), а также страдающих артериальной гипертензией (АГ), хронической сердечной недостаточностью (ХСН) [9][10]. У данной категории пациентов наиболее часто развиваются сердечно-сосудистые осложнения [11][12]. Важным является понимание того, повреждение каких структур почечной ткани ассоциируется в наибольшей степени с негативным влиянием на сердечно-сосудистые исходы, поскольку позволит осуществлять патогенетически обоснованную дифференцированную кардио- и ренопротективную терапию.
Цель исследования — изучение особенностей кардио-ренальных взаимоотношений у больных ишемической болезнью сердца (ИБС), перенёсших инфаркт миокарда в сочетании с ХБП.
Материалы и методы
В исследование были включены 110 пациентов ИБС, перенёсших острый инфаркт миокарда (ОИМ) в сочетании с АГ 1–2 степени, которые также имели ХБП 1–3Б стадий. Были включены пациенты в возрасте старше 40 лет, страдающих ИБС, перенёсших ОИМ в сроки более 12 месяцев до включения в исследование. ХБП имела кардиогенное происхождение (гипертоническая, ишемическая нефропатия, нефропатия вследствие хронической сердечной недостаточности (ХСН)), в исследование не включались пациенты с первичными заболеваниями почек а также сахарным диабетом, симптоматическими АГ, злокачественным течением АГ, нестабильной стенокардией, гемодинамически значимыми врождёнными или приобретенными пороками сердца и иными некоронарогенными заболеваниями сердца, нарушениями ритма сердца, требующими специального лечения, ХСН выше III функционального класса (ФК) (NYHA), тяжелой лёгочной, печёночной патологией, ОНМК в анамнезе.
Большинство пациентов мужского пола (83,4%) относилось к категории курящих. Все пациенты получали антигипертензивную терапию, однако повышение АД выше 130/80 (то есть медикаментозно не контролируемое) наблюдалось в 82,7% случаях. У 55,1% пациентов отмечалось повышение уровня общего холестерина (ОХЛ) и составляло в среднем 5,81 ммоль/л.
Клиническое исследование включало в себя изучение жалоб, анамнеза, физикального статуса. Выявлялись клинические признаки сердечной недостаточности (одышка при физической нагрузке и в покое, общая слабость, сердцебиение, «перебои» в работе сердца, застойные явления в легких, гепатомегалия, периферические отёки). ФК ХСН устанавливали в соответствии с классификацией ХСН ОССН. Для уточнения функционального класса ХСН был использован тест 6-минутной ходьбы (ТШХ), оценку тяжести ХСН проводили по шкале оценки клинического состояния больных ХСН ШОКС1. Для изучения морфофункционального состояния сердца у пациентов использовался комплекс неинвазивных инструментальных методов исследования, включая электрокардиографию (ЭКГ), эхокардиографию (ЭХОКГ), суточное мониторирование АД (СМАД) на аппарате ABPM-05 (Медитех, Венгрия), холтеровское мониторирование ЭКГ на аппарате CardioClip (Медитех, Венгрия). Функциональное состояние почек оценивалось по уровню креатинина сыворотки крови, скорости клубочковой фильтрации (СКФ) (формула CKD-EPI), отношения альбумина к креатинину в суточной моче (АУ), а также по уровню N-ацетил-β-D-глюкозаминидазы (NAG) в моче. Суточную экскрецию альбумина до 30 мг/г принимали за нормоальбуминурию; от 30 и более считали альбуминурией (АУ)2. Наличие альбуминурии рассматривали как проявление гломерулярных повреждений почек.
Определение NAG в моче проводили количественным методом с помощью иммуноферментного анализа с применением тест-системы Биохиммак. Диапазон измерений — 0,61–100 нг/мл, аналитическая чувствительность — 0,61 нг/мл. Повышение уровня NAG в моче более 3,16 нг/мл расценивали как проявление повреждения эпителия проксимальных канальцев.
Статистическая обработка проводилась с применением программ Microsoft Office Excel 2010 (Microsoft) и «STATISTICA 10.0» (StatSoft). С целью оценки характера распределения количественных показателей в группах использовали анализ нормальности распределения Колмогорова-Смирнова. При значениях p≥0,05 распределение значений показателя считалось не отличающимся от нормального.
При нормальном распределении, а также при сравнении двух независимых выборок использовали критерий Стьюдента, при отличном от нормального при сравнении двух независимых выборок использовали критерий Манна-Уитни (Вилкоксона). Различия считались статистически значимыми при р<0,05. Для ранговых признаков при анализе связей между признаками использовали критерий Фишера с расчетом χ². Корреляционный анализ проводили с помощью коэффициента Спирмена. Коэффициент корреляции (r) считали статистически значимым при р<0,05. Использовали также логистический регрессионный анализ с расчётом относительных рисков (OR) и оценкой χ²; при значении р<0,05 связь считалась статистически значимой.
Для достижения необходимой статистической мощности результатов рассчитаны минимальные объёмы выборок. Расчёт объёма выборки в группах проводили с использованием расчёта по формуле Миняева В.А. и Вишнякова Н.И.
Результаты
Превышение уровня референсных значений NAG в моче продемонстрировало тесную связь с повреждением эпителия проксимальных канальцев. В исследованной группе число больных с уровнем NAG более 3,16 нг/мл составило 96 пациентов (87,3%). Соответственно, можно предположить, что в подавляющем большинстве случаев при ХБП на фоне ИБС, ПИКС и АГ имеют место канальцевые повреждения, а не только гломерулярные.
В целом было показано, что уровни NAG и АУ тесно связаны (r=0,86, р=0,001) (рис. 1).
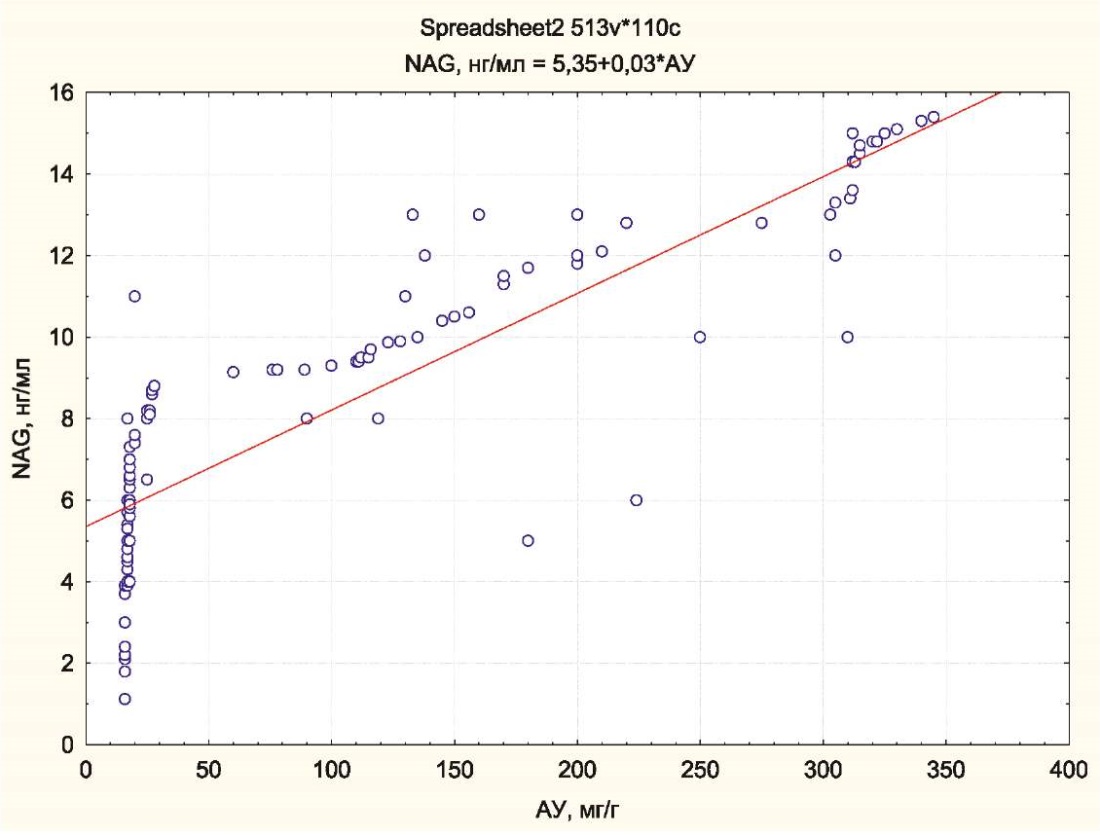
Рисунок 1. Взаимосвязь уровней АУ и NAG в исследованной группе
Figure 1. The relationship of AU and NAG levels in the studied group
При анализе средних значений NAG в подгруппах больных с АУ и без неё было показано, что в подгруппе с АУ её уровень NAG в моче доходил до 11,54±2,47 нг/мл, тогда как в подгруппе без АУ он составлял 5,05±2,49 (р<0,001) (рис. 2).
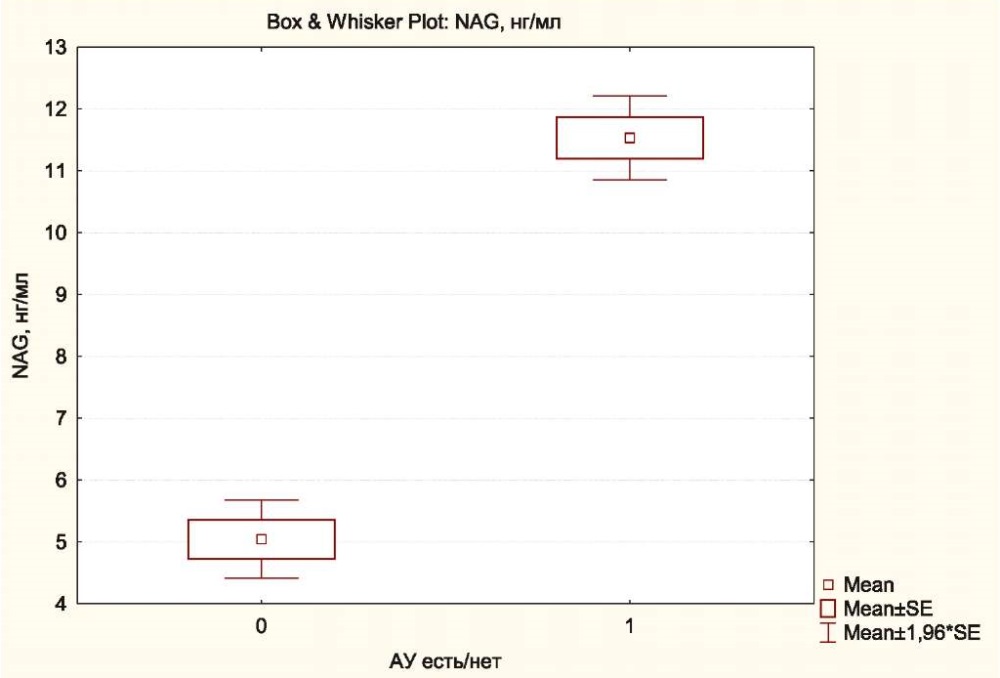
Рисунок 2. Значения NAG в моче в подгруппах больных с АУ и без АУ
Figure 2. Urinary NAG values in subgroups of patients with and without AU
Если принять среднее арифметическое NAG по основной группе 9,14 нг/мл за значение, отделяющее более выраженные (≥9,14 нг/мл) и менее выраженные проявления канальцевой дисфункции (<9,14 нг/мл), то можно с помощью логит-регрессионного анализа построить кривую вероятности выявления более выраженных канальцевых повреждений в зависимости от уровня АУ (рис. 3). А с помощью уравнения регрессии можно прогнозировать уровень NAG в моче у больного с ИБС ПИКС и ХБП при известном значении АУ, то есть прогнозировать наличие выраженных канальцевых повреждений:
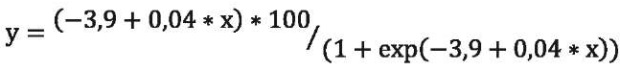
где у — вероятность выраженных канальцевых повреждений (%), х — значение АУ, мг/г.

Рисунок 3. Кривая влияния выраженности АУ на вероятность возникновения выраженных канальцевых повреждений
Figure 3. The curve of the influence of AU severity on the probability of severe tubular lesions
По результатам этого анализа нами была построена номограмма, упрощающая процесс расчета и позволяющая применять её в реальной клинической практике (табл. 1).
Таблица / Table 1
Номограмма расчета прогнозируемого риска выраженных канальцевых повреждений в зависимости от уровня АУ в исследуемой группе
Nomogram for calculating the predicted risk of severe tubular damage depending on the level of AU in the study group
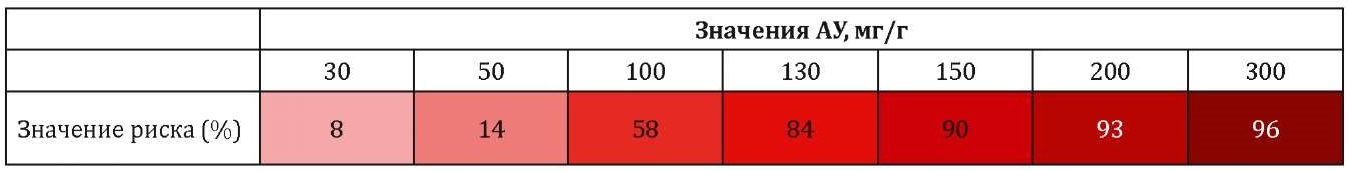
К примеру, при значении АУ в 50 мг/г риск выявления выраженных канальцевых расстройств составляет 14%, а при значении АУ в 130 мг — уже 84%.
При анализе значений ТШХ была установлена корреляционная связь между ТШХ и уровнем АУ. По мере снижения значения ТШХ происходило повышение уровня АУ (r=0,34, р<0,05), также было показано наличие корреляционной связи с уровнем креатинина крови (r=0,39, р<0,05) и СКФ (r=-0,42, р<0,05). Вместе с тем, статистически значимой корреляционной связи ТШХ с уровнем NAG в моче выявлено не было (r=0,23, р=0,07). То есть выявлена связь между ТШХ с тяжестью ХБП и клубочковыми повреждениями при ней.
Произведена оценка связи клинических проявлений ХСН по шкале ШОКС со значениями СКФ, АУ и NAG. Было показано, что повышение балла по шкале ШОКС ассоциировалось со снижением СКФ (r=-0,44, р<0,05). Значимой корреляционной связи данного параметра с АУ и NAG в моче выявлено не было (АУ - r=0,13, р=0,13, NAG - r=0,20, р=0,10).
При анализе взаимосвязи основных структурно-функциональных показателей сердца по данным эхокардиографии с параметрами, отражающими повреждение почек в основной группе были выявлены следующие особенности (табл. 2).
Таблица / Table 2
Корреляционные взаимосвязи структурно-функциональных показателей миокарда и АУ, NAG, СКФ
Correlations of structural and functional parameters of the myocardium and AU, NAG, GFR
Показатель | АУ, мг/г | NAG, нг/мл | СКФ, мл/мин./1,73м² |
ФВ, % | -0,40* | -0,47* | 0,42* |
ЛП, см | 0,56* | 0,57* | -0,52* |
КДР, см | 0,52* | 0,58* | -0,50* |
КСР, см | 0,18 | 0,10 | 0,12 |
МЖП, см | 0,40* | 0,42* | -0,20 |
ЗС ЛЖ, см | 0,37* | 0,43* | -0,21 |
ОТС | 0,12 | 0,20 | -0,20 |
ММЛЖ, г | 0,33* | 0,40* | -0,39* |
ИММЛЖ, | 0,34* | 0,43* | -0,42* |
Е, м/с | 0,21 | 0,20 | 0,18 |
А м/с | 0,22 | 0,19 | -0,19 |
Е/А | -0,38* | -0,41* | -0,23 |
DT, мс | 0,13 | 0,19 | 0,22 |
IVRT, мс | 0,36* | 0,39* | -0,21 |
Примечание: ФВ — фракция выброса, ЛП — левое предсердие, КДР — конечный диастолический размер, КСР — конечный систолический размер, ЗС ЛЖ — задняя стенка ледового желудочка, ОТС — относительная толщина стенки ЛЖ, ММЛЖ — масса миокарда левого желудочка, DT — время замедления, IVRT — время изоволюмического расслабления.
Note: EF — ejection fraction, LA — left atrium, EDD — end-diastolic dimension, ESD — end-systolic dimension, PVW — LV ice posterior wall thickness, LVRT — relative LV wall thickness, LVM — left ventricular myocardial mass, DT — deceleration time, IVRT — isovolumic relaxation time.
Фильтрационная способность почек (определяется величиной СКФ) в большей степени была связана с фракцией выброса (ФВ), показателями, отражающими размеры левого предсердия (ЛП) и левого желудочка (ЛЖ) в период диастолы (ЛП, КДР), а также с индексом массы миокарда левого желудочка (ИММЛЖ). То есть по мере дилатации левых отделов сердца, а также снижения систолической функции и прогрессирования гипертрофии миокарда происходит статистически значимое снижение СКФ.
Гломерулярные повреждения, проявляющиеся преимущественно АУ, и канальцевые повреждения в виде повышения уровня NAG в моче, также усугублялись по мере прогрессирования дилатации левых отделов сердца, снижения систолической функции и прогрессирования гипертрофии миокарда левого желудочка. Помимо этого, было показано, что рост значений АУ и NAG в моче ассоциировался с диастолической дисфункцией по типу замедления релаксации.
Нами предложены формулы линейной регрессии, позволяющие прогнозировать значения ФВ у больных с ИБС, ПИКС, АГ и ХБП при известных значениях NAG в моче и АУ:
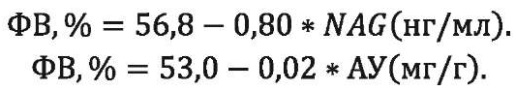
Также сконструирована формула для расчёта СКФ при известной ФВ у больных с ИБС, ПИКС, АГ и ХБП:
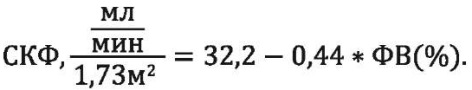
Данные формулы имеют в большей степени научный интерес, поскольку демонстрируют силу связи между параметрами, отражающими ФВ и состояние почечного повреждения, что является доказательной основой кардио-ренальных взаимоотношений у больных с ИБС, ПИКС, АГ и ХБП.
Далее нами анализировались типы структурно-функциональной перестройки ЛЖ в их взаимосвязи с показателями, отражающими состояние почечной ткани (рис. 4).
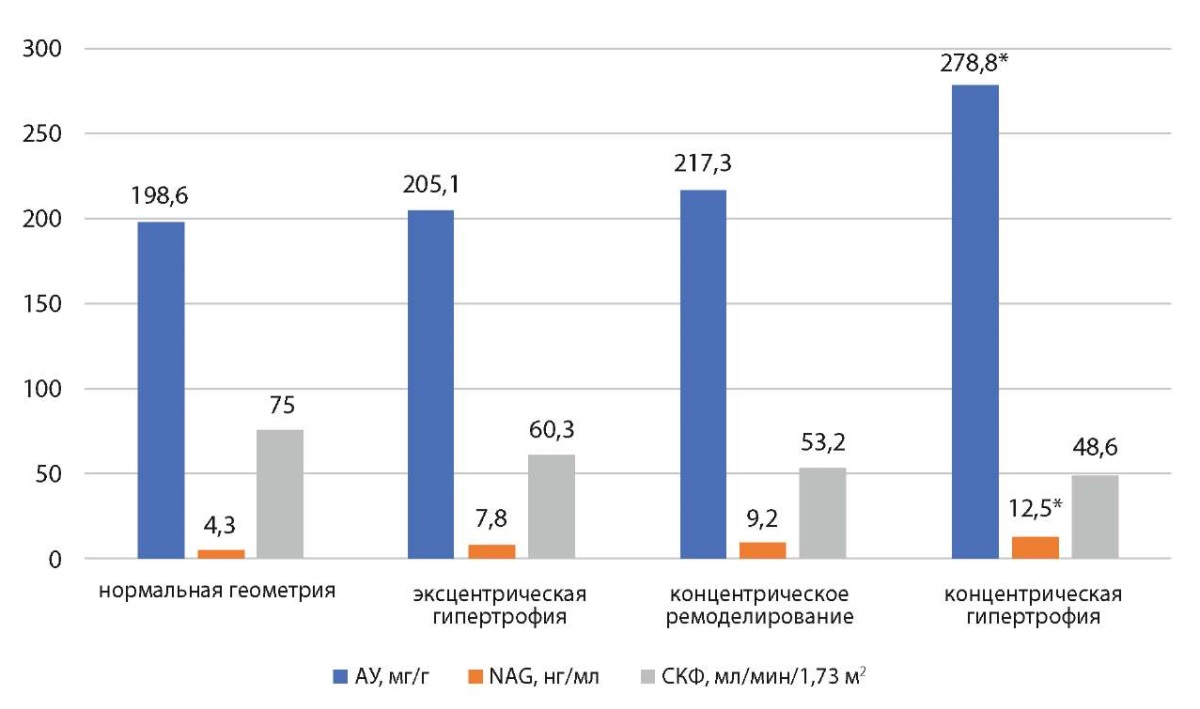
Рисунок 4. Средние значения показателей почечного повреждения в зависимости от типов ремоделирования миокарда
Figure 4. Average values of renal damage indicators depending on the types of myocardial remodeling
Примечание: * — статистически значимая разница между концентрической гипертрофией и суммарно другими формами ремоделирования (р<0,05).
Note: * — statistically significant difference between concentric hypertrophy and total other forms of remodeling (p<0.05).
Было показано, что значения NAG в моче и АУ были выше в подгруппе пациентов с концентрической гипертрофией. При этом значения СКФ имели тенденцию к снижению при данном типе ремоделирования, но статистически значимо не отличались от других типов ремоделирования.
В ходе анализа взаимосвязей показателей СМАД и параметров, отражающих повреждение почечной ткани, было отмечено нарастание среднесуточного САД по мере прироста уровня NAG в моче и снижения СКФ (табл. 3). Повышение уровня NAG в моче также ассоциируется с усилением вариабельности САД, ростом индекса времени гипертензии и скорости утреннего подъёма АД. Изменения значений СКФ и АУ имеют меньшее число связей с параметрами СМАД. В частности, помимо связи с уровнем среднесуточного САД, СКФ также ассоциирована со скоростью утреннего подъема САД, а АУ — с суточной вариабельностью САД и индексом времени САД. Из этого следует, что плохой контроль АГ и высокие показатели её вариабельности сопровождаются более выраженными канальцевыми повреждениями, маркером которых является повышение NAG в моче, и менее выраженными клубочковыми повреждениями.
Таблица / Table 3
Корреляционные взаимосвязи показателей суточного мониторирования артериального давления и параметров, отражающих почечное повреждение
Correlations of daily blood pressure monitoring and parameters reflecting renal damage
Показатель | АУ, мг/г | NAG, нг/мл | СКФ, мл/мин/1,73м² |
Среднесуточное САД (мм рт. ст.) | 0,12 | 0,40* | -0,45* |
Среднесуточное ДАД (мм рт. ст.) | 0,14 | 0,11 | -0,17 |
Суточная вариабельность САД (мм рт. ст.) | 0,42* | 0,38* | -0,17 |
Суточная вариабельность ДАД (мм рт. ст.) | 0,17 | 0,12 | -0,14 |
Индекс времени гипертензии САД за 24 часа (%) | 0,43* | 0,41* | -0,12 |
Индекс времени гипертензии ДАД за 24 часа (%) | 0,19 | 0,38* | -0,18 |
Скорость утреннего подъёма САД, мм рт. ст/ч | 0,21 | 0,51* | -0,38* |
Скорость утреннего подъёма ДАД, мм рт. ст/ч | 0,20 | 0,51* | -0,12 |
При анализе профилей снижения АД было отмечено, что физиологический профиль («дипперы») наблюдался при более низких значениях NAG в моче в сравнении и нефизиологическими профилями («нон-дипперы» и «найт-пикеры») (табл. 4).
Таблица / Table 4
Суточные профили АД и значения параметров, отражающих повреждение почечной ткани
Daily blood pressure profiles and values of parameters reflecting damage to renal tissue
«Нон-диппер», n=72 | «Найт-пикер», n=21 | «Диппер», n=16 | |
NAG, нг/мл | 9,45±1,12* | 10,11±1,11* | 4,12±1,51 |
АУ, мг/г | 234±18,3 | 217,3±20,1 | 200±45,3 |
СКФ, мл/мин./1,73 | 54,3±8,2 | 57,5±9,1 | 62,3±15,1 |
Примечание: * — значение р<0,05 в сравнении с значением в группе «дипперов».
Note: * — the value of p<0.05 in comparison with the value in the group of “dippers”.
Следовательно, можно предположить, что именно канальцевые повреждения играют определённую роль в формировании патологических суточных профилей АГ, которые в свою очередь являются факторами риска развития сердечно-сосудистых событий. Возможно, что данная ассоциация имеет и обратный характер, подразумевая то обстоятельство, при котором гемодинамические расстройства при АГ сопровождаются более частыми канальцевыми повреждениями почечной ткани в рамках формирующейся гипертонической нефропатии.
При анализе результатов холтеровского мониторирования ЭКГ было установлено, что по мере снижения СКФ растёт вероятность выявления случаев ишемии миокарда (СИМ), а также продолжительность всех эпизодов ишемии миокарда (табл. 5). Повышение концентрации NAG в моче ассоциируется с ростом вероятности возникновения СИМ, а также продолжительности эпизодов безболевой ишемии миокарда (ББИМ). Ассоциация ангинальных коронарогенных проявлений с канальцевыми повреждениями почечной ткани свидетельствует о наличии общих механизмов повреждения миокарда и почки в рамках кардио-ренального синдрома.
Таблица / Table 5
Корреляционные взаимосвязи данных холтеровского мониторирования ЭКГ и параметров, отражающих состояние почечной ткани
Correlations of Holter ECG monitoring data and parameters reflecting the state of renal tissue
Показатель | АУ, мг/г | NAG, нг/мл | СКФ, мл/мин./1,73м² |
СИМ, n/% | 0,15 | 0,37* | -0,44* |
Продолжительность, мин. · всех эпизодов · БИМ · ББИМ | 0,14 0,16 0,19 | 0,20 0,18 0,34* | -0,35* -0,21 -0,22 |
Глубина депрессии ST, мм · средняя · максимальная | 0,09 0,11 | 0,13 0,15 | 0,10 0,09 |
Примечание: * — р<0,05, СИМ — ишемия миокарда за сутки, ББИМ — безболевая ишемия миокарда, БИМ — болевая ишемия миокарда.
Note: * — p<0.05, SIM-myocardial ischemia per day, BBIM-painless myocardial ischemia, BIM-painful myocardial ischemia.
Далее нами был проведён логит-регрессионный анализ с выбором в качестве прогнозируемого параметра значения средней арифметической NAG мочи в группе, то есть значения более 9,14 нг/мл, как свидетельства выраженной канальцевой дисфункции. Прогнозирование выявления выраженной канальцевой дисфункции проводили с формированием пар факторов, которые в предыдущих анализах продемонстрировали свою взаимосвязь с NAG.
В частности, в ходе анализа было показано совместное влияние уровня АУ и наличия или отсутствия СИМ у больных с ИБС ПИКС и ХБП на вероятность выявления выраженных канальцевых изменений (Const.B0=-4,55, OR=1, 1,99, χ²=106,3, df=2, р<0,001). Также было показано совместное влияние уровня АУ и наличия или профиля «нон-диппер» у больных с ИБС ПИКС и ХБП на вероятность выявления выраженных канальцевых изменений (Const.B0=-4,55, OR=7*105, 8*10, χ²=109,1, df=2, р<0,001). Поскольку не только уровень АУ влияет на вероятность выявления канальцевых расстройств, но и уровень СКФ, нами была подтверждена зависимость риска развития выраженных канальцевых расстройств в зависимости от уровня СКФ и ИММЛЖ (Const.B0=-27,6, OR=6*10-5, 3*105, χ²=109,8, df=2, р<0,001). Также было подтверждено совместное влияние уровня СКФ и индекса времени гипертензии САД на риск развития выраженных канальцевых расстройств (Const.B0=-27,6, OR=4*10-4, *105, χ²=106,9, df=2, р<0,001).
Обсуждение
В исследовании было показано, что клинические проявления ХСН в большей степени ассоциированы с нарушением фильтрационной способности почек и альбуминурией, что подтверждается многочисленными исследованиями [13]. Вместе с тем, литературе встречается не так много исследований, посвящённых канальцевым повреждениям почек при ХСН [14]. Данные работы касаются преимущественно дисфункции канальцевых котранспортеров или рецепторов к натрий-уретическому гормону [15]. Нами было показано, что канальцевые нарушения в виде роста уровня NAG в моче ассоциируются с изменениями левых отделов сердца, проявляющимися процессами дилатации гипертрофии. Важным является анализ связи различных проявлений почечного повреждения с проявлениями АГ. В частности, высокая вариабельность АД, худший контроль при применении антигипертензивной терапии и высокая скорость утреннего подъёма АД в большей степени связаны именно с канальцевыми повреждениями. Также с канальцевыми повреждениями в большей степени связано возникновение патологического профиля АГ. В литературе имеются работы, посвящённые исследованию канальцевой дисфункции при АГ, и в основном они демонстрируют её связь с АГ [16]. Вместе с тем исследований, посвящённых анализу кардио-ренальных взаимоотношений при АГ, отличающейся высокой вариабельностью, практически нет.
При исследовании результатов холтеровского мониторирования ЭКГ было показано, что и гломерулярные и канальцевые повреждения ассоциируются с более частым выявлением случаев ишемии миокарда (СИМ), однако гломерулярные повреждения ассоциируются с повышением продолжительности всех ишемических эпизодов, а канальцевые — только эпизодов безболевой ишемии миокарда. Известно, что без болевая ишемия миокарда в целом чаще наблюдается при ХБП, при этом ХБП является ещё и фактором риска смерти этих пациентов [17][18]. Однако дифференцированный подход с выяснением преимущественно поражающихся структур не проводилось.
Выводы
Канальцевые повреждения в виде повышения уровня NAG в моче, клубочковые повреждения в виде АУ и снижение фильтрационной способности почек (снижение СКФ) при ХБП ассоциируются с процессами ремоделирования миокарда у больных с ИБС, ПИКС и АГ в равной мере, однако высокая вариабельность АГ, патологические суточные профили АГ в большей степени ассоциируются с наличием канальцевых повреждений, вместе с тем возникновение эпизодов ишемии миокарда и продолжительность безболевой ишемии — с наличием клубочковых и канальцевых повреждений.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
1. Хроническая сердечная недостаточность. Клинические рекомендации РКО, НОИСНЗБ, ОССН. Информация снята 23.05.2024. https://cardioweb.ru/files/glavny-kardiolog/rekomendation/Клин_рекомендации_ХСН_2020.pdf
2. Хроническая болезнь почек. Клинические рекомендации АН. 2021. Информация снята 10.05.2024. https://rusnephrology.org/wp-content/uploads/2020/12/CKD_final.pdf
Список литературы
1. Khoshakhlagh AH, Mohammadzadeh M, Gruszecka-Kosowska A, Oikonomou E. Burden of cardiovascular disease attributed to air pollution: a systematic review. Global Health. 2024;20(1):37. DOI: 10.1186/s12992-024-01040-0
2. Qu C, Liao S, Zhang J, Cao H, Zhang H, Zhang N, et al. Burden of cardiovascular disease among elderly: based on the Global Burden of Disease Study 2019. Eur Heart J Qual Care Clin Outcomes. 2024;10(2):143-153. DOI: 10.1093/ehjqcco/qcad033
3. Бойцов С.А. Резервы снижения смертности от сердечно-сосудистых заболеваний. Терапевтический архив. 2023;95(12):1052-1055. DOI: 10.26442/00403660.2023.12.202500
4. Бойцов С.А., Драпкина О.М. Современное содержание и совершенствование стратегии высокого сердечно-сосудистого риска в снижении смертности от сердечно-сосудистых заболеваний. Терапевтический архив. 2021;93(1):4-6. DOI: 10.26442/00403660.2021.01.200543
5. Pedamallu H, Zmora R, Perak AM, Allen NB. Life Course Cardiovascular Health: Risk Factors, Outcomes, and Interventions. Circ Res. 2023;132(12):1570-1583. DOI: 10.1161/CIRCRESAHA.123.321998
6. Huiban N, Gehant M, Brocq FX, Collange F, Mayet A, Monteil M. Global Cardiovascular Risk and Associated Factors in 2792 French Military and Civilian Aircrew. Aerosp Med Hum Perform. 2024;95(5):233-244. DOI: 10.3357/AMHP.6415.2024
7. Вишнева Е.М., Сагадеева О.А., Вишнева К.А. Проблема коморбидности пациентов с хронической болезнью почек и сердечно-сосудистыми заболеваниями. Medicus. 2022;3(45):24-32. eLIBRARY ID: 48467118 EDN: TELOAW
8. GBD Chronic Kidney Disease Collaboration. Global, regional, and national burden of chronic kidney disease, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2020;395(10225):709-733. DOI: 10.1016/S0140-6736(20)30045-3
9. Chaitman BR, Cyr DD, Alexander KP, Pracoń R, Bainey KR, Mathew A, et al. Cardiovascular and Renal Implications of Myocardial Infarction in the ISCHEMIA-CKD Trial. Circ Cardiovasc Interv. 2022;15(8):e012103. DOI: 10.1161/CIRCINTERVENTIONS.122.012103
10. Kampmann JD, Heaf JG, Mogensen CB, Petersen SR, Wolff DL, Mickley H, et al. Rate and Risk Factors of Acute Myocardial Infarction after Debut of Chronic Kidney Disease-Results from the KidDiCo. J Cardiovasc Dev Dis. 2022;9(11):387. DOI: 10.3390/jcdd9110387
11. Шляхто Е.В., Беленков Ю.Н., Бойцов С.А., Виллевальде С.В., Галявич А.С., Глезер М.Г., и др. Результаты промежуточного анализа проспективного наблюдательного многоцентрового регистрового исследования пациентов с хронической сердечной недостаточностью в Российской Федерации “ПРИОРИТЕТ-ХСН”: исходные характеристики и лечение первых включенных пациентов. Российский кардиологический журнал. 2023;28(10):5593. DOI: 10.15829/1560-4071-2023-5593
12. Yandrapalli S, Christy J, Malik A, Wats K, Harikrishnan P, Aronow W, et al. Impact of Acute and Chronic Kidney Disease on Heart Failure Hospitalizations After Acute Myocardial Infarction. Am J Cardiol. 2022;165:1-11. DOI: 10.1016/j.amjcard.2021.10.041
13. Gilbert C, Cherney DZ, Parker AB, Mak S, Floras JS, Al-Hesayen A, et al. Hemodynamic and neurochemical determinates of renal function in chronic heart failure. Am J Physiol Regul Integr Comp Physiol. 2016;310(2):R167-75. DOI: 10.1152/ajpregu.00190.2015
14. Zheng H, Liu X, Sharma NM, Li Y, Pliquett RU, Patel KP. Urinary Proteolytic Activation of Renal Epithelial Na+ Channels in Chronic Heart Failure. Hypertension. 2016;67(1):197-205. DOI: 10.1161/HYPERTENSIONAHA.115.05838
15. Ouwerkerk W, Belo Pereira JP, Maasland T, Emmens JE, Figarska SM, et al. Multiomics Analysis Provides Novel Pathways Related to Progression of Heart Failure. J Am Coll Cardiol. 2023;82(20):1921-1931. DOI: 10.1016/j.jacc.2023.08.053
16. Shi K, Yuan S, Huang Y, Li Z, Wang C, Liu H, et al. Clinic-pathological characteristics of rare tubulointerstitial diseases. Zhong Nan Da Xue Xue Bao Yi Xue Ban. 2022;47(10):1365-1374. (In English, Chinese). DOI: 10.11817/j.issn.1672-7347.2022.220127
17. Wetmore JB, Broce M, Malas A, Almehmi A. Painless myocardial ischemia is associated with mortality in patients with chronic kidney disease. Nephron Clin Pract. 2012;122(1-2):9-16. DOI: 10.1159/000347143
18. Bangalore S, Maron DJ, O’Brien SM, Fleg JL, Kretov EI, Briguori C, et al. Management of Coronary Disease in Patients with Advanced Kidney Disease. N Engl J Med. 2020;382(17):1608-1618. DOI: 10.1056/NEJMoa1915925
Об авторах
З. В. БитароваРоссия
Зарина Вячеславовна Битарова, старший лаборант
Республика Северная Осетия — Алания; Владикавказ
О. В. Ремизов
Россия
Олег Валерьевич Ремизов, руководитель кафедры
кафедра ЮНЕСКО «Образование в области здоровья для устойчивости развития»
Республика Северная Осетия — Алания; Владикавказ
З. Т. Астахова
Россия
Замира Татарбековна Астахова, заведующая кафедры
кафедра Внутренних болезней № 4
Республика Северная Осетия — Алания; Владикавказ
Рецензия
Для цитирования:
Битарова З.В., Ремизов О.В., Астахова З.Т. Взаимосвязь клубочковых и канальцевых повреждений с клиническим течением, морфо-функциональными параметрами сердца и показателями гемодинамики у больных ишемической болезнью сердца, постинфарктным кардиосклерозом и артериальной гипертензией. Южно-Российский журнал терапевтической практики. 2025;6(1):27-37. https://doi.org/10.21886/2712-8156-2025-6-1-27-37
For citation:
Bitarova Z.V., Remizov O.V., Astakhova Z.T. Relationship between glomerular and tubularile kidney injuries and clinical course, morpho-functional parameters of the heart and hemodynamic indicators in patients with coronary heart disease, postinfarction cardiosclerosis and arterial hypertension. South Russian Journal of Therapeutic Practice. 2025;6(1):27-37. (In Russ.) https://doi.org/10.21886/2712-8156-2025-6-1-27-37
JATS XML

























