Перейти к:
Геморрагические синдромы в практике терапевта (лекция для практикующих врачей, ч. 1)
https://doi.org/10.21886/2712-8156-2025-6-2-106-117
Аннотация
Геморрагический синдром возникает вследствие поражения сосудистой стенки, нарушения структуры, функции и количества тромбоцитов, нарушения коагуляционного гемостаза. Для постановки диагноза важны не только ла- бораторные показатели, но и полные сведения о состоянии пациента, анамнезе, коморбидности, наследственности, проводимом лечении. Использование стандартизированных инструментов, таких как шкалы кровоточивости, шкалы риска возникновения геморрагического синдрома помогают в диагностике и определении тактики ведения пациентов. Причинами геморрагического синдрома наследственного генеза чаще являются тромбоцитопатии, гемофилии, болезнь Виллебранда, телеангиэктазия, причинами геморрагического синдрома приобретённого — вторичная тромбоцитопения и тромбоцитопатии, ДВС-синдром, дефицит факторов протромбинового комплекса, геморрагический васкулит, а также лекарственные средства (антитромботические, цитостатики, антибиотики и др.). Клиницисту отводится важная роль в диагностике и лечении, что требует знания современных руководств, клинических рекомендаций, инструкций, стандартов и других регламентирующих документов.
Ключевые слова
Для цитирования:
Бурнашева Е.В., Шатохин Ю.В., Снежко И.В., Мацуга А.А., Рябикина Е.В., Дегтерева Е.В. Геморрагические синдромы в практике терапевта (лекция для практикующих врачей, ч. 1). Южно-Российский журнал терапевтической практики. 2025;6(2):106-117. https://doi.org/10.21886/2712-8156-2025-6-2-106-117
For citation:
Burnasheva E.V., Shatokhin Yu.V., Snezhko I.V., Matsuga A.A., Ryabikina E.V., Degtereva E.V. Hemorrhagic syndromes in the practice of a general practitioner (lecture for practicing physicians, p. 1). South Russian Journal of Therapeutic Practice. 2025;6(2):106-117. (In Russ.) https://doi.org/10.21886/2712-8156-2025-6-2-106-117
Введение
Состояния, связанные с расстройствами системы гемостаза, в частности с геморрагическим синдромом (ГС), встречаются часто и требуют дифференциальной диагностики и грамотной коррекции. Система гемостаза обеспечивает целостность живого организма, тесно связана с сосудами и иммунной системой, участвует в реакциях воспаления, ангиогенезе и репарации тканей. Геморрагический синдром возникает как следствие изменений в одном или нескольких звеньях гемостаза. Это может быть поражение сосудистой стенки, нарушение функции или количества тромбоцитов, нарушение коагуляционного гемостаза. Учитывая сложности в интерпретации сиюминутных лабораторных показателей, необходимы полные сведения о состоянии пациента, анамнезе, коморбидности, наследственности, проводимом лечении. При определении причин кровоточивости необходимо учитывать, что одни виды патологии часты, другие редки, а третьи крайне редки. Из наследственных нарушений гемостаза наиболее часто в терапевтической практике встречаются тромбоцитопатии, гемофилия A, болезнь Виллебранда (БВ), гемофилия В, из сосудистых форм — телеангиэктазия. Причиной приобретённых форм ГС наиболее часто становятся вторичная тромбоцитопения и тромбоцитопатии, ДВС-синдром, дефицит факторов протромбинового комплекса и геморрагический васкулит. Следует учитывать, что в последние годы ГС всё чаще связан с приёмом лекарственных препаратов, нарушающих агрегацию тромбоцитов (антиагреганты) и свёртываемость крови (антикоагулянты) [1-3].
Правильная оценка пациента с ГС или подозрением на повышенную кровоточивость складывается из нескольких этапов, включающих опрос пациента, использование специальных шкал и калькуляторов для оценки степени тяжести ГС, определение типа кровоточивости и назначение анализов, подтверждающих диагноз. Значение данных анамнеза в отношении выявления наследственной или приобретённой патологии системы гемостаза сложно переоценить: повышенная кровоточивость в самых разнообразных проявлениях (явное кровотечение, гематомы, геморрагическая сыпь) у пациента и/или его родственников 1-й и 2-й линий родства, информация о наличии тяжёлого заболевания печени или костного мозга, факт приёма антитромботических препаратов (антиагрегантов и антикоагулянтов) могут значить больше, чем определение отдельных параметров системы гемостаза [4]. Представленный алгоритм помогает в короткий промежуток времени установить диагноз [5].
Основные вопросы, на которые необходимо получить ответы:
- Действительно ли геморрагический синдром присутствует у пациента?
- Какого типа данный геморрагический синдром: тромбоцитарного или коагуляционного?
- Геморрагическое нарушение приобретённое или врождённое?
- Какие анализы нужно выполнить и как их интерпретировать?
Действительно ли геморрагический синдром присутствует у пациента?
Несмотря на кажущуюся очевидность первого вопроса, восприятие выраженности и клинических проявлений ГС может различаться у разных людей. Так, например, пациентка с обильными менструациями может считать их нормальными, если они всегда сопровождались повышенной кровопотерей или такие же менструации были у её матери и бабушки. У части больных с наследственными нарушениями свёртываемости крови могут быть минимальные геморрагические проявления; и наоборот, многие пациенты с нормальным гемостазом сообщают о повышенной кровоточивости. Кроме того, клинические проявления могут быть весьма разнообразными даже у пациентов с одним и тем же нарушением свёртываемости крови.
Объективно оценить наличие и выраженность ГС, а также спрогнозировать риск развития кровотечения при любой процедуре помогает правильно собранный анамнез и использование специальных шкал. Важно, чтобы разговор с пациентом не ограничивался единственным вопросом — вопросом о том, есть ли у пациента повышенная кровоточивость? Предлагаем воспользоваться уточняющими вопросами для сбора гемостазиологического анамнеза из перечня, предложенного Федерацией анестезиологов и реаниматологов [4].
Рекомендуемые вопросы для сбора гемостазиологического анамнеза:
- Были ли у Вас когда-либо длительное кровотечение, припухлость языка или внутренней поверхности щек после прикусывания?
- Были ли у Вас синяки размером более рублевой монеты без очевидной причины или повреждения? Если да, то какой величины был этот синяк?
- Как часто Вам удаляли зубы, и как долго длилось кровотечение? Возникало ли кровотечение на следующий день?
- Какие хирургические операции Вы перенесли, в том числе малые, такие как биопсия кожи? Не замечали ли Вы образования кровоподтёков вокруг операционной раны или других повреждений кожи?
- Были ли у Вас заболевания в течение последних 5 лет, требовавшие врачебной помощи? Если да, то какие?
- Какие лекарства, включая аспирин, таблетки от головной боли, простуды, менструальных и прочих болей Вы принимали в течение последних 7–9 дней?
- Страдает ли кто-нибудь из Ваших кровных родственников от необычных кожных кровоизлияний или кровотечений после хирургических вмешательств?
- Наблюдались ли у вас постоянные меноррагии при отсутствии фиброзных опухолей или других аномалий матки?
При обследовании пациента с подозрением на нарушение свертываемости крови для количественной оценки ГС по локализации и степени тяжести применяют стандартизированные инструменты оценки кровотечения — шкалы. Наиболее часто в клинической практике используется опросник Международного общества по тромбозу и гемостазу ISTH-SSC Bleeding Assessment Tool (BAT). Шкала ISTH-SSC BAT включает 14 категорий для ретроспективной оценки симптомов кровотечения (носовое кровотечение, кожные кровоизлияния, кровотечения из небольших ран, кровотечения ротовой полости, желудочно-кишечное кровотечение, гематурия, кровотечение после удаления зубов, хирургические кровотечения, меноррагии, послеродовое кровотечение, внутримышечные гематомы, гемартрозы, кровоизлияния в структуры ЦНС, другие кровотечения). Каждая из 14 категорий оценивается по шкале от 0 до 4 (кроме кровотечения в ЦНС, где баллы составляют 0, 3 или 4) и на основе этого выводится итоговый балл. Нормальный диапазон составляет <4 у взрослых мужчин, <6 — у взрослых женщин и <3 — у детей). Оценка ≥4 указывает на возможное нарушение свёртываемости крови у взрослых; часто у таких людей составляет ≥10 [6]. Наиболее информативен этот показатель для оценки степени ГС у пациентов с БВ (общая чувствительность составляет 75%, а общая специфичность — 54% [7], наследственных нарушений тромбоцитарного звена гемостаза, дефицита XIII фактора свертывания крови, а также других нарушений системы гемостаза. Общий балл менее 4 позволяет с большей долей вероятности исключить заболевания свертывающей системы крови. В качестве примера приведены первые 2 категории оценки ГС (табл.1).
Таблица / Table 1
Шкала ISTH/SSC Bleeding Assessment Tool
Scale ISTH/SSC Bleeding Assessment Tool
Носовое кровотечение | Балл |
Нет/незначительное | 0 |
Более 5 в год, дольше 10 мин. | 1 |
Осмотр пациента и направление его к специалисту или проведение детального лабораторного исследования | 2 |
Тампонирование, прижигание, антифибринолитики | 3 |
Переливание компонентов крови, заместительная терапия, десмопрессин | 4 |
Кожные кровоизлияния |
|
Нет/незначительно | 0 |
5 и более экхимоз ( более 1 см) в различных частях тела | 1 |
Осмотр пациента и направление его к специалисту или проведение детального лабораторного исследования | 2 |
Обширные | 3 |
Спонтанная гематома, требующая переливания препаратов крови | 4 |
Полный текст шкалы (калькулятор) можно найти по ссылке https:// bleedingscore.certe.nl/.
Существует большое количество и других опросников, используемых при конкретных нозологиях. Так, при идиопатической тромбоцитопенической пурпуре (ИТП) оценка признаков кровотечения проводится с помощью шкалы ITP-BAT (ITP-specific Bleeding Assessment Tool). Инструмент для оценки ГС при ИТП предложен Международной рабочей группой по ИТП для стандартизации понятия «кровотечения» и разграничения видов кровотечений [8]. Признаки /симптомы кровотечения сгруппированы по трём основным локализациям: кожа (skin, S), видимые слизистые оболочки (mucosae, M) и органы (organ, O). Градация тяжести кровотечения (система S-M-O Gradation, SMOG): каждое проявление кровотечения должно быть оценено на момент обследования, осмотра. Степень его тяжести выражается в баллах от 0 до 4. Данный опросник используют также для оценки эффективности проводимой терапии.
В педиатрии используют Pediatric Bleeding Questionnaire (PBQ) — анкету, разработанную для детей, чтобы помочь выяснить, указывают ли симптомы повышенной кровоточивости на возможность наличия заболевания свертывающей системы крови [9].
Отдельного внимания заслуживают шкалы оценки обильных/аномальных менструальных кровотечений (ОМК/АМК). В соответствии с клиническими рекомендациями [10] к АМК относятся кровотечения, чрезмерные по длительности (более 8 дней), объёму кровопотери (более 80 мл), частоте (менее 24 дней или более 38 дней) и/или регулярности (вариабельность цикла >9 дней). Согласно определению NICE, ОМК — это чрезмерная менструальная кровопотеря, которая оказывает негативное влияние на физическое, социальное, эмоциональное и/или материальное благополучие женщины [11].
Довольно сложно бывает объективно оценить объём кровопотери во время менструации. Такие показатели, как количество использованных прокладок или тампонов, могут быть неточными, поскольку они зависят от индивидуальных особенностей и предпочтений женщины, а объём потерянной крови практически невозможно определить при применении гигиенических прокладок или тампонов. Некоторые опросники, например Menorrhagia Impact Questionnaire (MIQ), оценивают лишь степень ограничивающего влияния менструального кровотечения на работу, физические, социальные и досуговые занятия женщин. Наиболее полезными с практической точки зрения являются системы оценки, в которых используются изображения прокладок или тампонов с разной степенью наполненности; в некоторых исследованиях высокий балл хорошо коррелировал с наличием ОМК [12].
Pictorial Bleeding Assessment Chart (PBAC) — графическая таблица оценки кровопотери (PBAC) — это простой визуальный инструмент, который используется у женщин с ОМК (рис. 1).

Рисунок 1. Шкала Pictorial Blood Assessment Chart
Figure 1. Scale Pictorial Blood Assessment Chart
Он позволяет определить примерный объём кровопотери во время менструации с помощью набора картинок, представляющих разные уровни наполненности гигиенических прокладок или тампонов, а также размеров сгустков. Существующие калькуляторы подсчёта интенсивности маточных кровотечений помогают специалистам принять решение, является ли потеря крови чрезмерной. Врождённые коагулопатии имеет до 50% подростков и 10–20% женщин с ОМК. В 70% случаев выявляется БВ, реже — дефицит XI, VII, VIII факторов свёртывания, носительство гемофилии А или В [13][14].
История ГС имеет большое значение. Наличие в анамнезе выраженных кровотечений, требующих хирургических вмешательств, переливания крови или восполнения запасов железа, подтверждает подозрение на скрытое нарушение свёртываемости крови. И наоборот, если оперативное лечение, удаление зубов и/или серьёзные травмы ранее не сопровождались повышенной кровоточивостью, то это будет свидетельствовать об отсутствии наследственной патологии гемостаза (или, если у человека в настоящее время наблюдается аномальное кровотечение, подтверждать возможность приобретённого нарушения свёртывающей системы крови).
У женщин очень важно выяснить историю беременностей, в том числе кровотечение во время родов или послеродовое кровотечение, а также выкидыш на ранних сроках (наблюдается при некоторых редких нарушениях свертываемости крови). При БВ послеродовое кровотечение (через 24–28 часов после родов) встречается чаще, чем кровотечение во время беременности, поскольку более высокий уровень эстрогена во втором и третьем триместрах способствует увеличению выработки фактора Виллебранда. Прокоагулянтные изменения во время беременности могут нивелировать проявления ГС, вызванные нарушениями в системе гемостаза со склонностью к кровоточивости [3].
Помимо шкал, подтверждающих наличие и оценивающих выраженность ГС, о которых мы говорили выше, существуют шкалы прогнозирования вероятности его развития при различных ситуациях, а также классификации кровотечений, в том числе в клинических исследованиях [6, 15].
Шкалы риска развития кровотечений в кардиологии и неврологии:
- Шкала CRUSADE (Can Rapid risk stratification of Unstable angina patients Suppress ADverse outcomes with Early implementation of the ACC/ AHA guidelines) используется после острого инфаркта миокарда для определения 30-дневного риска кровотечения, не связанного с проведением операции аорто-коронарного шунтирования.
- Шкала REACH (REduction of Atherothrombosis for Continued Health) предназначена для расчёта риска серьёзных кровотечений у стабильных больных атеросклерозом, не имеющих фибрилляции предсердий (ФП), острого коронарного синдрома, не проходивших эндоваскулярного лечения (стентирования).
- ШкалаS2TOP-BLEED применяется для оценки риска кровотечений при назначении антитромбоцитарных препаратов при вторичной профилактике инсульта.
- Шкала SEDAN (blood Sugar (glucose) on admission, Early infarct signs and (hyper) Dense cerebral artery sign on admission computed tomography (CT) head scan, Age, and NIHSS) оценивает риск симптоматического внутричерепного кровоизлияния при проведении тромболитической терапии у больных с ишемическим инсультом.
- Шкала AIS-GIB (Acute Ischemic Stroke-GastroIntestinal Bleeding) применяется для оценки риска гастроинтестинального кровотечения в остром периоде ишемического инсульта.
Для оценки риска геморрагических осложнений на фоне антикоагулянтной терапии могут применяться шкалы HAS-BLED, VTE-BLEED, RIETE, шкала ACCP. Выбор шкалы основывается на предпочтениях врача, определяющего целесообразность проведения или продления антикоагулянтной терапии [16].
Шкала HAS-BLED используется для оценки индивидуального риска большого кровотечения в продолжение одного года у пациентов с ФП, получающих оральные антикоагулянты. HAS-BLED может являться оптимальным выбором для оценки риска не только у больных с ФП, но и при остром коронарном синдроме и кардиохирургических операциях (табл. 2).
Таблица / Table 2
Шкала HAS-BLED оценки риска развития кровотечений у пациентов с фибрилляцией предсердий, получающих антикоагулянтыScale HAS-BLED assessing the risk of bleeding in patients with atrial fibrillation receiving anticoagulants
Акроним | Клиническая характеристика | Баллы |
H | Артериальная гипертония | 1 |
A | Нарушение функции печени и почек ( по 1 баллу) | 1 или 2 |
S | Инсульт | 1 |
B | Кровотечение | 1 |
L | Нестабильное МНО | 1 |
E | Возраст старше 65 лет | 1 |
D | Прием некоторых лекарств, алкоголя ( по 1 баллу) | 1 или 2 |
Артериальная гипертония — систолическое АД>160мм рт. ст.
Нарушение функции почек — креатинин >200мкмоль\л, диализ, трансплантация почек.
Нарушение функции печени — повышение билирубина в 2 раза в сочетании с повышением активности АСТ /АЛТ / щелочной фосфатазы ≥3 раза.
Кровотечение в анамнезе или геморрагический диатез, анемия.
Нестабильное МНО — недостаточное (<60%) время пребывания в целевом диапазоне.
Лекарства — приём антитромбоцитарных средств, НПВС, злоупотребление алкоголем.
Согласно проведённым расчётам, риск геморрагических осложнений возрастает от 1,02% в год при 1 балле до 12,5% при сумме баллов 5 и более.
Шкала обладает высокой предсказательной ценностью, оценка на её основе коррелирует с частотой внутричерепных кровотечений и, что не менее важно, указывает на поддающиеся коррекции факторы (неконтролируемое артериальное давление, сопутствующее применение ацетилсалициловой кислоты/НПВС, нестабильное МНО и др.) для снижения риска кровотечений. Оценку риска кровотечения рекомендуется проводить у всех пациентов с ФП. Пациенты с количеством баллов по шкале HAS-BLED ≥3 требуют осторожного подхода, регулярного наблюдения, более частого контроля МНО и проведения мероприятий по коррекции потенциально обратимых факторов риска кровотечений, внимательного отношения к фармакотерапии сопутствующих патологий. Превышение уровня >3 баллов не является сигналом к отмене терапии пероральными антикоагулянтами.
Шкала VTE-BLED разработана для оценки риска кровотечений у пациентов с ТЭЛА. Оценка по школе VTE-BLED может быть полезна для принятия решения о возможном продлении антикоагулянтной терапии после первых 3–6 месяев при сопоставлении с индивидуальным риском ВТЭО.
Шкала оценки риска кровотечений RIETE разработана на основе данных регистра пациентов с ВТЭО (Registry of Patients with Venous Thromboembolism) и может также использоваться в клинической практике при необходимости применения антикоагулянтной терапии.
Шкала ACCP прогнозирует риск больших кровотечений у пациентов с ВТЭО, принимающих оральные антикоагулянты, однако оценка риска кровотечений по ACCP была разработана путём анализа исследований, основанных только на использовании антагонистов витамина К, поэтому применять шкалу АССР у пациентов с ВТЭО при длительном лечении пероральными антикоагулянтами следует с осторожностью [16].
Шкалы оценки тяжести кровотечений
Шкалы кровотечений клинических исследований TIMI и GUSTO были разработаны с целью контроля за безопасностью тромболитической терапии. Классификация тяжести кровотечений согласно критериям группы GUSTO выделяет тяжелые или угрожающие жизни кровотечения, умеренные кровотечения, лёгкие кровотечения. В классификация тяжести кровотечений, согласно критериям группы TIMI, присутствуют большие кровотечения, умеренные кровотечения, незначительные кровотечения. Классификация тяжести кровотечений BLEEDSCORE предлагает фиксировать эпизоды кровоточивости на основе балльной системы. Классификация тяжести кровотечений по BARC (Bleeding Academic Research Consortium) определяет разные типы кровотечений от несущественного до фатального с учётом клинических и лабораторных характеристик. Тяжесть кровотечений, определяемая по типам BARC, коррелирует с риском смерти [17].
Какого типа данный геморрагический синдром: тромбоцитарного или коагуляционного?
Для ответа на этот вопрос нам понадобятся данные объективного обследования пациента, информация об особенностях кровотечений после травм, данные анамнеза (табл. 3). Первичный гемостаз относится к начальным этапам образования тромба, которые в основном зависят от целостности и эластичности стенки сосуда, а также от взаимодействия между стенкой сосуда, тромбоцитами и фактором фон Виллебранда (ФВ). Вторичный гемостаз относится к последующему образованию тромба на основе фибрина, который в основном зависит от факторов свертывания крови. Нарушения первичного гемостаза часто проявляются в виде кровоточивости слизистых оболочек (например, кровоточивость дёсен и частые носовые кровотечения) или кожных экхимозов и петехий, тогда как нарушения вторичного гемостаза проявляются в виде гематом в глубоких тканях или кровотечений в суставах. Пациенты с БВ могут иметь признаки нарушения обоих звеньев гемостаза [18].
Основные элементы геморрагических проявлений и типы кровоточивости представлены ниже.
Петехии — это небольшие плоские красные пятна на коже, обычно менее 2 мм в диаметре (рис. 2). Они не бледнеют и не прощупываются. Обычно появляются в зависимых от гравитации частях тела (чаще на нижних конечностях, либо в области крестца у лежачих пациентов). Петехии могут появляться при тяжёлой тромбоцитопении, тромбоцитопатии, а также при «хрупкости» кожи или приёме глюкокортикоидов, особенно у пожилых.
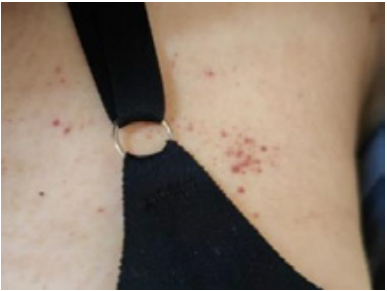
Рисунок 2. Петехии
Figure 2. Petechiae
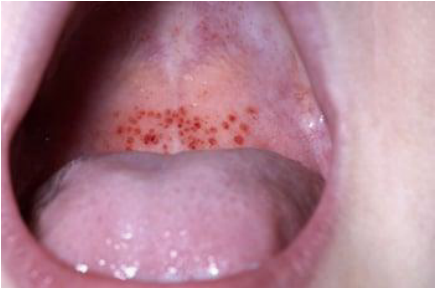
Рисунок 3. Пурпура на слизистых оболочках
Figure 3. Purpura on the mucous membranes
Пурпура может возникать в результате слияния петехий. Сухая пурпура — это пурпура на коже. Влажная пурпура — это геморрагические волдыри на слизистых оболочках (рис. 3). Пурпура, вызванная тромбоцитопенией, плоская и не бледнеет, обычно появляется на участках тела, подвергающихся сдавлению. Пурпура, вызванная васкулитом, обычно пальпируется и может сопровождаться зудом, а её распространение не ограничивается участками, подвергающихся сдавлению. Влажная пурпура чаще всего приводит к серьёзным кровотечениям у людей с тромбоцитопенией [7].
Синяк/экхимоз представляет собой подкожное скопление крови, не возвышающееся над поверхностью кожи. Со временем цвет меняется от пурпурно-синего до красновато-коричневого и зеленовато-желтого, что отражает расщепление гемоглобина до биливердина и билирубина. Синяки обычно считаются значимыми, когда их количество достигает пять или более, либо их размер более 1 см (рис. 4)1. Если экхимозы появляются только на кистях и предплечьях, особенно у пожилых людей, это может указывать на солнечную пурпуру (также называемую старческой пурпурой). Кроме того, склонность к образованию синяков не является чувствительным и специфичным признаком и может быть признаком травмы или патологии сосудистой стенки, а не истинного нарушения свёртываемости крови.
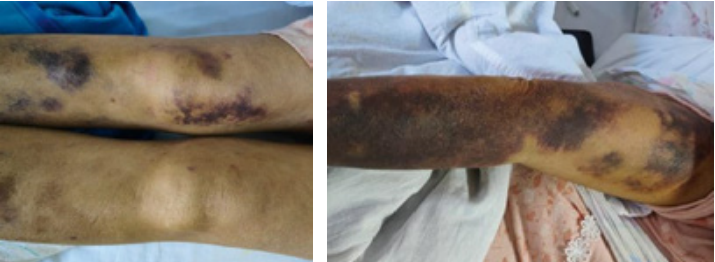
Рисунок 4. Экхимозы у пациентки с тромбоцитопенией
Figure 4. Ecchymosis in a patient with thrombocytopenia
Гематома — это скопление крови во внесосудистом пространстве. Подкожная гематома может приподнимать кожу; гематомы в глубоких тканях (мышцах, забрюшинной области) следует заподозрить по боли, снижению уровня гемоглобина или скоплению жидкости при визуализации. Гематомы и гемартрозы (кровоизлияния в суставы) характерны для дефицита факторов свертывания крови.
Классификация типов кровоточивости по З.С. Баркагану (1975) [1][2]
- Микроциркуляторный (петехиально-пятнистый).
- Гематомный.
- Смешанный.
- Васкулитно-пурпурный.
- Ангиоматозный.
Микроциркуляторный (петехиально-пятнистый, синячковый) возникает чаще при тромбоцитопении, тромбоцитопатии, иногда при редких нарушениях свёртывающей системы (гипо- и дисфибриногенемия, наследственном дефиците факторов свертывания X и II, иногда VII).
Гематомный типичен для гемофилии А и В, характеризуется возникновением болезненных напряжённых кровоизлияний в мягкие ткани и суставы, постепенным развитием нарушений функции опорно-двигательного аппарата.
Смешанный (микроциркуляторно-гематомный) развивается при тяжёлом дефиците факторов протромбинового комплекса и фактора XIII, дефиците VII фактора, БВ, ДВС-синдроме, передозировке антикоагулянтов и тромболитиков, появлении в крови иммунных ингибиторов факторов VIII и IX, характеризуется сочетанием петехиально-пятнистых кожных геморрагии с отдельными большими гематомами в забрюшинном пространстве, стенке кишечника. В отличие от гематомного типа кровоизлияние в полость суставов возникает крайне редко. Синяки могут быть обширными и болезненными.
Васкулитно-пурпурный тип наблюдается при инфекционных и иммунных васкулитах, легко трансформируется в ДВС-синдром и характеризуется геморрагией в виде симметричной мелкоточечной сыпи или эритемы на воспалительной основе, возможным присоединением нефрита и кишечного кровотечения.
Ангиоматозный тип развивается в зонах телеангиэктазий (рис. 5), ангиом, артериовенозных шунтов и характеризуется упорными локальными, строго локализованными, геморрагиями, связанными с зонами сосудистой патологии.
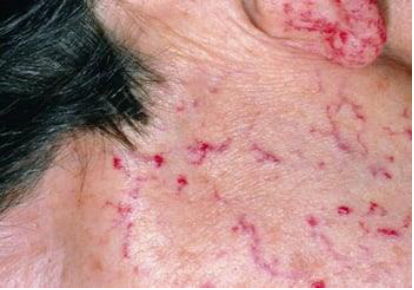
Рисунок 5. Наследственная телеангиоэктазия
Figure 5. Hereditary telangiectasia
Таблица / Table 3
Клинические особенности нарушений свертываемости крови
Clinical features of bleeding disorders
Характеристика геморрагического синдрома | Дефицит факторов свертывания или ингибиторы факторов свертывания |
Тромбоцитопении или нарушения функции тромбоцитов |
Локализация | Гематомы глубоких тканей (суставов, мышц или мягких тканей) | Поражение слизистых оболочек (рта, носа, желудочно-кишечного тракта, мочевыводящих путей, меноррагии) |
Петехии | Редки | Характерны |
Гематомы | Характерны | Редки |
Чаще большие одиночные | Обычно небольшие множественные, поверхностные; в зависимости от степени тромбоцитопении могут быть значительными | |
Характерны для гемофилии | Редки | |
Отсроченная кровоточивость | Обычна | Редка |
Кровотечение из порезов и царапин | Минимальное | Длительное, часто интенсивное |
Чрезмерное кровотечение при хирургическом вмешательстве или инвазивных процедурах | Часто во время процедуры; при дефиците фактора XIII возможно отсроченное кровотечение | Часто проявляется немедленно, степень тяжести варьируется в зависимости от выраженности тромбоцитопении |
Геморрагическое нарушение приобретенное или наследственное?
Для ответа на этот вопрос необходимо получить информацию о семейном анамнезе повышенной кровоточивости и о возрасте, в котором появились клинические признаки ГС у пациента.
Некоторые пациенты знают о конкретном диагнозе, поставленном родственнику первой или второй степени родства; другие могут сообщить о случаях сильного кровотечения в семье, потребовавших хирургического вмешательства или переливания крови [5]. Наличие семейного анамнеза увеличивает вероятность наследственного нарушения свёртываемости крови. Отсутствие семейного анамнеза не исключает вероятность наследственного заболевания. Так, например, 30–40% пациентов с гемофилией А имеют зародышевую мутацию de novo, а некоторые аутосомно-рецессивные состояния (тромбастения Гланцмана, болезнь Виллебранда 2N) не проявляются ни у одного из родителей.
Диагностировать наследственное нарушение свертываемости крови можно в любом возрасте. Тяжёлые заболевания, как правило, манифестируются в детстве, но могут быть впервые диагностированы и у взрослых пациентов при легком течении заболевания. Так, лёгкая форма гемофилии или БВ может никак клинически не проявляться до первой травмы или хирургического вмешательства. Некоторые наследственные заболевания имеют дополнительные синдромологические признаки, которые помогают поставить диагноз [1-3].
Характер наследования также может указывать на определённый набор заболеваний. Гемофилия А и В наследуется по Х-сцепленному типу (матери-носительницы передают больным сыновьям, больные отцы — дочерям-носительницам), болеют в основном лица мужского пола, в то время как болезнь Виллебранда и другие дефициты факторов свертывания наследуются по аутосомно-рецессивному типу и могут встречаться как у мужчин, так и у женщин [5].
Однако, помимо классической формы гемофилии, которой страдают преимущественно мужчины, с манифестаций заболевания, как правило, в детском возрасте, гемофилию можно диагностировать и у женщин. Женщин с патогенным вариантом гена FVIII или FIX называют облигатными носительницами гемофилии, они могут быть выявлены при анализе семейного анамнеза гемофилии. В категорию облигатных носительниц входят все биологические дочери отца с гемофилией, любая биологическая мать ребенка с гемофилией, у которой есть хотя бы один другой член семьи с гемофилией (то есть её брат, дед по материнской линии, дядя, племянник или двоюродный брат) или член семьи с уже известным статусом носительницы (то есть её мать, сестра, бабушка по материнской линии, тетя, племянница или двоюродная сестра), любая биологическая мать двух и более детей с гемофилией. Зачастую носительницы гемофилии не проявляют симптомов заболевания, поскольку, хотя у них и есть аномальный ген FVIII или FIX на одной из X-хромосом, в другой X-хромосоме содержится неизмененный ген FVIII или FIX, который, как правило, работает и производит уровни фактора на нижней границе нормального диапазона. Тем не менее у определённого процента женщин-носительниц гемофилии уровень активности фактора VIII (FVIII) или фактора IX (FIX) является низким из-за лайонизации (случайного подавления одной из двух Х-хромосом; также это называется «инактивацией Х-хромосомы»), что может вызвать лёгкую, средне-тяжёлую и даже (в редких случаях) тяжёлую гемофилию. При наличии симптомов женщинам может быть поставлен диагноз «Гемофилия» с определённой степенью тяжести, так же как и мужчинам с гемофилией [3].
Кроме того, существуют приобретённые формы гемофилии (ПГА). ПГА — редкое заболевание, поражающее мужчин и женщин всех возрастов. Обычно наблюдается два пика заболеваемости ПГА: один связан с беременностью, а другой — с пожилым возрастом (старше 60 лет). Примерно у половины пациентов с ПГА наблюдаются сопутствующие заболевания, чаще всего другие аутоиммунные заболевания или злокачественные опухоли. Примерно в 1−5% случаев ПГА диагностируется во время беременности или в течение 1 года после родов. Кровоточивость при ПГА может варьироваться от опасных для жизни кровотечений до незначительных кровотечений или их отсутствия. Подкожные гематомы характерны для ПГА, они могут быть первым признаком заболевания [19].
Описание клинического случая
Пациентка М., 31 год. Обратилась в связи с появлением синяков на ногах (без причины), на руках — от напряжения рук при уборке или приготовлении пищи в течение последних 10 дней. После мытья окон появилась гематома и отёчность в области левого плеча и предплечья (рис. 6), в связи с выраженным болевым синдром принимала парацетамол в течение двух дней.
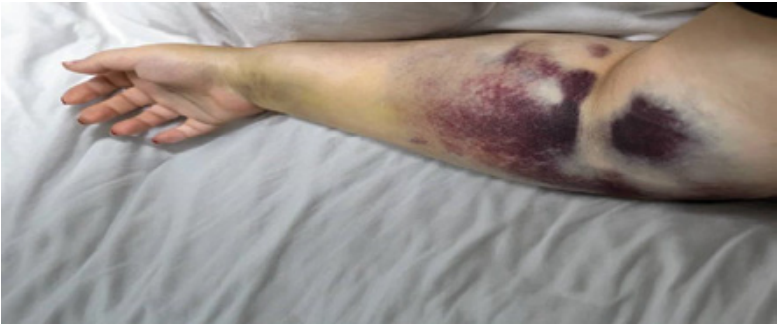
Рисунок 6. Гематомы при приобретенной гемофилии у пациентки М.
Figure 6. Hematomas in acquired hemophilia in patient M.
2,5 месяца назад естественные роды, первые, на сроке 38 недель, без осложнений. Из сопутствующих заболеваний — хронический гастрит. В анамнезе проявлений ГС у пациентки, а также ближайших родственников не было; лекарственных препаратов, кроме парацетамола, не принимает. При детальном расспросе по шкале ISTH/SSC BAT оценка 8 баллов (норма для женщин — менее 6). Таким образом, на основании изучения данных анамнеза и объективного осмотра, у пациентки заподозрено приобретённое заболевание свертывающей системы крови с гематомным типом кровоточивости, более характерным для дефектов коагуляционного (вторичного) гемостаза. Представлены результаты анализов. В ОАК признаки гипохромной микроцитарной анемии легкой степени: гемоглобин — 117 г/л, эритроциты — 4,2×10*12/л, MCV 78, МСН МСНС, лейкоциты — 4,9×10*9/л, тромбоциты — 189×10*9/л. В коагулограмме выраженное удлинение АПТВ: АПТВ — 117,2 сек. (норма — 25,4–36,9), результат проверен дважды, протромбиновое время — 10,7 сек (норма — 10–13,2 сек), протромбин по Квику — 93% (норма — 80–133%), фибриноген — 4,3 (норма 2–4 г/л), тромбиновое время — 13,8 сек. (норма — 10,3–16,6).
С учётом типа кровоточивости, удлинения АПТВ, характеризующего внутренний путь свёртывания крови, рекомендовано определение активности факторов VIII, IX, XI, проведение теста смешивания, определение ингибиторов фактора VIII, IX. Выявлено выраженное снижение активности VIII фактора — 1% (норма — 50–150%), уровень факторов IX, XI, в пределах нормальных значений. Ингибитор фактора VIII составил 12 ед. Бетесда/мл (норма — 0–0.6). Таким образом, по результатам проведённого обследования пациентке установлен диагноз «Послеродовая приобретённая гемофилия».
Какие тесты нужно выполнить и как их интерпретировать?
Основными скрининговыми тестами у пациентов с предполагаемым анамнезом повышенной кровоточивости являются активированное частичное тромбопластиновое время (АЧТВ), протромбиновое время (ПВ), количество тромбоцитов. Результаты этих тестов позволяют сузить пространство диагностического поиска и выбрать дальнейшие методы исследования [1-3][20].
Чаще всего встречаются следующие изменения:
- Удлинение АЧТВ у пациентов с повышенной кровоточивостью может быть при дефиците факторов внутреннего пути свертывания крови VIII, IX и XI. Наследственный дефицит факторов VIII или IX свидетельствует о наличии гемофилии А или В. Дефицит фактора XI сопровождается различными типами кровоточивости, часто связан с послеоперационным кровотечением. Приобретённые ингибиторы факторов будут проявляться внезапным началом кровотечения. Редко удлинение АЧТВ наблюдается при БВ при снижении уровня фактора VIII ниже 30%. У пациентов без геморрагических проявлений в анамнезе либо с историей тромбозов повышение АЧТВ может быть связано с присутствием волчаночного антикоагулянта и требует исключения антифосфолипидного синдрома. Дефицит фактора XII также может сопровождаться удлинением АЧТВ без клинических проявлений повышенной кровоточивости.
- Удлинение ПВ характерно для изолированного дефицита фактора VII. Для адекватного гемостаза требуется уровень фактора VII всего 5–10%, поэтому незначительное удлинение ПВ либо повышение международного нормализованного отношения (МНО) (менее 3) редко сопровождаются ГС.
- Удлинение ПВ и АЧТВ встречается при сочетанном дефиците факторов внешнего и внутреннего либо снижении активности факторов общего пути свёртывания крови. Характерно для редких дефицитов факторов X, V и II. Более частыми причинами удлинения как ПВ, так и АЧТВ являются заболевания печени, ДВС синдром.
- Снижение количества тромбоцитов необходимо проводить дифференциальную диагностику между ИТП и вторичными тромбоцитопениями. Геморрагические проявления микроциркуляторного типа при нормальном числе тромбоцитов в периферической крови требуют выполнения тестов, характеризующих функцию тромбоцитов.
В зависимости от результатов скрининговых тестов назначаются дополнительные исследования, например, активность факторов свертывания крови, антигены факторов, исследование функции тромбоцитов, интегральные тесты и т.д.
Нормальные результаты исследования на начальном этапе могут исключить множество нарушений свертываемости. Однако это не относится к болезни Виллебранда, которая является заболеванием, при котором дефицит фактора VIII часто оказывается недостаточным для продления АЧТВ. Пациентов с нормальными результатами первичных исследований и с наличием симптомов или признаков кровотечения и отягощённым семейным анамнезом нужно обследовать на БВ с помощью определения антигена фактора фон Виллебранда (ФВ) в плазме, ристоцетин-кофакторной активности (непрямой тест функции ФВ), типа мультимера ФВ и уровней фактора VIII [1-3][20].
Проводя дифференциальную диагностику врачу необходимо помнить о различных причинах ГС и исключать при наличии соответствующей симптоматики такие состояния, как геморрагическая лихорадка с почечным синдромом, геморрагические лихорадки другой этиологии, лептоспироз, сыпной тиф, гломерулонефрит, геморрагический васкулит, грипп, сепсис, уремический синдром и т.д. Наличие дополнительных симптомов при осмотре, например, лимфоаденопатии или спленомегалии, может помочь установить диагноз, сопровождающийся клиникой повышенной кровоточивости. Очень важным является уточнение лекарственного анамнеза, а именно приём антикоагулянтов, антиагрегантов либо других препаратов, влияющих на свертывающую систему крови, в том числе растительных препаратов и биологически активных добавок.
Необходимо помнить, что нарушения системы гемостаза (тромбозы, кровотечения и диссеминированное внутрисосудистое свертывание) играют важную роль в танатогенезе (являются причиной смерти) при самых разных хирургических и терапевтических заболеваниях. Клиницисту отводится важная роль в диагностике и лечении, что требует знания современных руководств, клинических рекомендаций, инструкций, стандартов и других регламентирующих документов [1-3].
1. International Society on Thrombosis and Haemostasis Bleeding Assessment Tool (ISTH-BAT) Bleeding Score in Normal Children https://cdn.ymaws.com/www.isth.org/resource/resmgr/ssc/isthssc_bleeding_assessment.pdf
Список литературы
1. Баркаган З.С. Геморрагические заболевания и синдромы. 2-е изд., перераб. и доп. Москва: Медицина; 1988.
2. Руководство по гематологии: в 3т. Т. 3. под ред. Воробьева А.И. Москва: Ньюдиамед; 2005.
3. Система гемостаза. Теоретические основы и клиническая практика: национальное руководство. Под ред. Рукавицына О.А., Игнатьева С.В. Москва: ГЭОТАР – Медиа; 2024.
4. Заболотских И.Б., Синьков С.В., Буланов А.Ю., Воробьева Н.А., Еременко А.А., Кузовлев А.Н., и др. Периопераци онное ведение пациентов с нарушениями системы гемостаза. Методические рекомендации Общероссийской общественной организации «Федерация анестезиологов и реаниматологов» и Национальной ассоциации специалистов по тромбозам, клинической гемостазиологии и гемореологии. Вестник интенсивной терапии имени А.И. Салтанова. 2024;(1):7–46.
5. DeLoughery TG. Hemostasis and Thrombosis. Fourth Edution. Springer; 2019.
6. Rodeghiero F, Tosetto A, Abshire T, Arnold DM, Coller B, James P, et al. ISTH/SSC bleeding assessment tool: a standardized questionnaire and a proposal for a new bleeding score for inherited bleeding disorders. J Thromb Haemost. 2010;8(9):2063-2065. https://doi.org/10.1111/j.1538-7836.2010.03975.x
7. Kalot MA, Husainat N, Tayiem S, El Alayli A, Dimassi AB, Diab O, Abughanimeh O, Madoukh B, Qureini A, Ameer B, Di Paola J, Eikenboom JCJ, Jacobs-Pratt V, McLintock C, Montgomery R, O’Donnell JS, Sidonio R, Brignardello-Petersen R, Flood V, Connell NT, James PD, Mustafa RA. Bleeding assessment tools in the diagnosis of VWD in adults and children: a systematic review and meta-analysis of test accuracy. Blood Adv. 2021;5(23):5023-5031. https://doi.org/10.1182/bloodadvances.2021004368
8. Rodeghiero F, Michel M, Gernsheimer T, Ruggeri M, Blanchette V, Bussel JB, et al. Standardization of bleeding assessment in immune thrombocytopenia: report from the International Working Group. Blood. 2013;121(14):2596-2606. https://doi.org/10.1182/blood-2012-07-442392
9. Яфошкина Т.Ю., Флоринский Д.Б., Пшонкин А.В., Федорова Д.В., Полетаев А.В., Серегина Е.А., и др. Оценка чувстви тельности и специфичности детского опросника кровото чивости при различных геморрагических заболеваниях. Педиатрия им. Г.Н. Сперанского. 2021;100(3):35–41.
10. Клинические рекомендации «Аномальные маточные кровотечения» (утв. Министерством здравоохранения Российской Федерации, 2024).
11. Heavy menstrual bleeding: assessment and management. London: National Institute for Health and Care Excellence (NICE); 2021. PMID: 29634173.
12. Rodeghiero F, Kadir RA, Tosetto A, James PD. Relevance of quantitative assessment of bleeding in haemorrhagic disorders. Haemophilia. 2008;14 Suppl 3:68-75. https://doi.org/10.1111/j.1365-2516.2008.01714.x
13. Munro MG. Practical aspects of the two FIGO systems for management of abnormal uterine bleeding in the reproductive years. Best Pract Res Clin Obstet Gynaecol. 2017;40:3-22. https://doi.org/10.1016/j.bpobgyn.2016.09.011
14. Singh S, Best C, Dunn S, Leyland N, Wolfman WL. No. 292-Abnormal Uterine Bleeding in Pre-Menopausal Women. J Obstet Gynaecol Can. 2018;40(5):e391-e415. https://doi.org/10.1016/j.jogc.2018.03.007
15. Tosetto A, Castaman G, Plug I, Rodeghiero F, Eikenboom J. Prospective evaluation of the clinical utility of quantitative bleeding severity assessment in patients referred for hemostatic evaluation. J Thromb Haemost. 2011;9(6):1143-1148. https://doi.org/10.1111/j.1538-7836.2011.04265.x
16. Селиверстов Е.И., Лобастов К.В., Илюхин Е.А., Апханова Т.В., Ахметзянов Р.В., Ахтямов И.Ф., и др. Профилак тика, диагностика и лечение тромбоза глубоких вен. Рекомендации российских экспертов. Флебология. 2023;17(3):152‑296.
17. Бурячковская Л.И., Ломакин Н. В., Сумароков А.Б., Широков Е.А. Алгоритмы и шкалы риска тромбоза и кровотечения в кардиологии и неврологии. Практическое пособие. 2018.
18. Neutze D, Roque J. Clinical Evaluation of Bleeding and Bruising in Primary Care. Am Fam Physician. 2016;93(4):279-286. PMID: 26926815.
19. Tiede A, Collins P, Knoebl P, Teitel J, Kessler C, Shima M, Di Minno G, d’Oiron R, Salaj P, Jiménez-Yuste V, Huth-Kühne A, Giangrande P. International recommendations on the diagnosis and treatment of acquired hemophilia A. Haematologica. 2020;105(7):1791-1801. https://doi.org/10.3324/haematol.2019.230771
20. Moenen FCJI, Nelemans PJ, Schols SEM, Schouten HC, Henskens YMC, Beckers EAM. The diagnostic accuracy of bleeding assessment tools for the identification of patients with mild bleeding disorders: A systematic review. Haemophilia. 2018;24(4):525-535. https://doi.org/10.1111/hae.13486
Об авторах
Е. В. БурнашеваРоссия
Бурнашева Ева Владимировна, к.м.н., доцент кафедры внутренних болезней №2
Ростов-на-Дону
Ю. В. Шатохин
Россия
Шатохин Юрий Васильевич, д.м.н., проф., зав. кафедрой гематологии и трансфузиологии (с курсами клинической лабораторной диагностики, генетики и лабораторной генетики),
Ростов-на-Дону
И. В. Снежко
Россия
Снежко Ирина Викторовна, к.м.н., доцент кафедры гематологии и трансфузиологии (с курсами клинической лабораторной диагностики, генетики и лабораторной генетики)
Ростов-на-Дону
А. А. Мацуга
Россия
Мацуга Андрей Александрович, ассистент кафедры гематологии и трансфузиологии (с курсами клинической лабораторной диагностики, генетики и лабораторной генетики)
Ростов-на-Дону
Е. В. Рябикина
Россия
Рябикина Елена Витальевна, к.м.н., доцент кафедры гематологии и трансфузиологии (с курсами клинической лабораторной диагностики, генетики и лабораторной генетики)
Ростов-на-Дону
Е. В. Дегтерева
Россия
Дегтерева Елена Валентиновна, к.м.н., доцент кафедры гематологии и трансфузиологии (с курсами клинической лабораторной диагностики, генетики и лабораторной генетики)
Ростов-на-Дону
Рецензия
Для цитирования:
Бурнашева Е.В., Шатохин Ю.В., Снежко И.В., Мацуга А.А., Рябикина Е.В., Дегтерева Е.В. Геморрагические синдромы в практике терапевта (лекция для практикующих врачей, ч. 1). Южно-Российский журнал терапевтической практики. 2025;6(2):106-117. https://doi.org/10.21886/2712-8156-2025-6-2-106-117
For citation:
Burnasheva E.V., Shatokhin Yu.V., Snezhko I.V., Matsuga A.A., Ryabikina E.V., Degtereva E.V. Hemorrhagic syndromes in the practice of a general practitioner (lecture for practicing physicians, p. 1). South Russian Journal of Therapeutic Practice. 2025;6(2):106-117. (In Russ.) https://doi.org/10.21886/2712-8156-2025-6-2-106-117
JATS XML


























