Перейти к:
Фармако-микробиологические особенности коморбидности воспалительных заболеваний верхних дыхательных путей
https://doi.org/10.21886/2712-8156-2025-6-2-39-46
Аннотация
Цель: проведение комплексной оценки клинических особенностей и характера микробиоценоза глотки и небных миндалин у пациентов с хроническим компенсированным тонзиллитом (ХКТ) в сочетании с хроническим фарингитом (ХФ). Материалы и методы: в исследование были включены 238 пациентов обоего пола с ХКТ и ХФ, которые были разделены на 3 группы: I группа (n=79) — пациенты с признаками воспаления в большей степени со стороны миндалин; II группа (n=97) — больные с проявлениями воспаления преимущественно слизистой оболочки глотки; III группа (n=62) — лица с клиникой обострения ХТ и ХФ в равной степени. Исследование включало клиническое обследование, бактериологический анализ с выделением, идентификацией и подсчётом количества микроорганизмов в микробном очаге. Статистическая обработка полученных данных проводилась на персональном компьютере в пакете программы Statistica 10.0. Различия признавались статистически значимыми при p<0,05. Результаты: встречаемость резидентных микроорганизмов была меньше в III группе (p<0,05); коагулазопозитивные Staphylococcus spp. чаще регистрировались во II и III группах больных, при этом в III достоверно чаще, чем во II (p<0,05); грибы рода Candida во II и III группах выявлялись чаще, чем в I группе (p<0,05). Во всех группах наблюдалось перемещение транзиторного вида β-гемолитических Streptococcus spp. в постоянные виды: их концентрация 106 и более наблюдалась у обследуемых пациентов во всех трёх группах, составив, соответственно, 77,7%, 80,4% и 91,7%. Во всех исследуемых группах от 20,9% до 46,7% исследованных микробиоценозов являлись ассоциациями из 3–4 компонентов, а монокультуры статистически значимо чаще встречались в I группе. В 57,14% и 52,3% случаев, соответственно, регистрировалась множественная устойчивость к антибактериальным и противогрибковым ЛС. Выводы: качественный и количественный составы микробиоценозов глотки и нёбных миндалин у пациентов с ХКТ и ХФ отличается в зависимости от клинического варианта проявления данной коморбидности. Микроорганизмы, вегетирующие в глотке и нёбных миндалинах у пациентов с ХКТ и ХФ, характеризуются высокой устойчивостью, зачастую множественной, к антимикробным ЛС. Результаты, полученные в ходе выполнения настоящего исследования, подтверждают необходимость поиска и внедрения в лечебную практику новых антибактериальных ЛС для эффективной фармакотерапии сочетания ХКТ и ХФ.
Ключевые слова
Для цитирования:
Мелоян Е.К., Сафроненко А.В., Ганцгорн Е.В. Фармако-микробиологические особенности коморбидности воспалительных заболеваний верхних дыхательных путей. Южно-Российский журнал терапевтической практики. 2025;6(2):39-46. https://doi.org/10.21886/2712-8156-2025-6-2-39-46
For citation:
Meloyan E.K., Safronenko A.V., Gantsgorn E.V. Pharmaco-microbiological features of comorbidity at inflammatory diseases of the upper respiratory tract. South Russian Journal of Therapeutic Practice. 2025;6(2):39-46. (In Russ.) https://doi.org/10.21886/2712-8156-2025-6-2-39-46
Введение
Среди инфекционно-воспалительных заболеваний верхних дыхательных путей ведущую позицию занимает сочетание патологий глотки и гортани. Ввиду близкого анатомического расположения и сходств в гистологическом строении воспалительный процесс зачастую захватывает и нёбные миндалины, и нижние отделы глотки. Результатом развития воспаления, иммунологической и нервно-рефлекторной дисрегуляции становится дисбаланс биоценоза ротоглотки с последующим повреждением слизистой оболочки глотки и нёбных миндалин. Такой воспалительный процесс отличается склонностью к хроническому, рецидивирующему течению, обусловливая частую коморбидность хронического тонзиллита (ХТ) и хронического тонзиллита (ХТ). В связи с этим в медицинской литературе часто встречается указание на «тонзиллофарингит» [1—5]. При этом относительно острого тонзиллофарингита разработаны и внедрены в практическую медицину клинические рекомендации1, в то время как в аспекте сочетания хронического воспаления глотки и нёбных миндалин единая, общепринятая терминология отсутствует, в связи с чем не предусмотрена официальная статистика регистрация данного вида коморбидности и подходы к лечению представлены отдельными клиническими стандартами2 [6]. В условиях клинической практики наличие смешанного воспалительного процесса в области структур лимфо-глоточного кольца называют «фарингит», «ангина», «тонзиллит», что в сущности отражается в окончательном ЛОР-диагнозе «Отдел с наиболее существенными проявлениями воспаления».
Учитывая анатомо-физиологическую общность и морфо-функциональную взаимосвязь структур, образующих кольцо Пирогова—Вальдейера, потенциально важное значение имеет комплексное изучение их микробиоценоза. Несмотря на это, таких данных в литературе крайне недостаточно. Основные сведения, имеющиеся в литературе, касаются микрофлоры либо задней стенки глотки, либо небных миндалин [7—12].
Принимая во внимание особое «стратегическое» положение лимфо-глоточного кольца вследствие контакта с большим количеством антигенов и первого реагирования на антигенное раздражение, определяющего дальнейшее включение иммунной системы, оправданной представляется принятая стратегия ограничения показаний к хирургическому лечению, органосохраняющий подход в коррекции тонзиллярной патологии [13]. При этом вопросы о соответствии клинических проявлений сочетания ХТ с ХФ микробному составу очага инфекции, факторах патогенности и персистенции симбионтных микроорганизмов задней стенки глотки и небных миндалин, а также их чувствительности к антимикробным лекарственным средствам (ЛС) и влияния на степень выраженности патологического процесса до сих пор остаются открытыми. Этим во многом объясняется тот факт, что до настоящего времени не отработаны рациональные схемы коррекции нарушений микрофлоры при данном виде ЛОР-коморбидности.
Цель исследования — проведение комплексной оценки клинических особенностей и микробиоценоза глотки и нёбных миндалин пациентов с ХКТ в сочетании с ХФ.
Материалы и методы
В исследование были включены 238 пациентов обоего пола ХКТ в сочетании с ХФ. Возраст больных колебался в широком диапазоне — 18–63 лет. Дизайн исследования соответствовал описанию в ранее опубликованной работе [14].
В зависимости от клинической картины они были разделены на 3 группы: в I группу (n=79) были включены пациенты с признаками воспаления в большей степени со стороны миндалин; II группу (n=97) составили больные с проявлениями воспаления преимущественно слизистой оболочки глотки; III группу (n=62) — лица с клиникой обострения ХТ и ХФ в равной степени.
Клиническое обследование пациентов включало сбор жалоб, анализ истории заболевания, термометрию, общий анализ крови, общий анализ мочи, выполнение ревмопроб, фарингоскопический осмотр. При фарингоскопии учитывали выраженность следующих симптомов: боли в глотке, степень гиперемии и инфильтрации слизистой оболочки нёбных миндалин, нёбных дужек, задней стенки глотки, степень гипертрофии нёбных миндалин, патологические изменения лимфатических фолликулов задней стенки глотки (их увеличение, воспалительно-гнойные изменения), наличие патологического отделяемого в лакунах нёбных миндалин.
Бактериологическое исследования проводилось на мазках со слизистой оболочки глотки, забор которых производился стерильным стандартным ватным тампоном, натощак, при строгом соблюдении «стандартной» последовательности: правая нёбная миндалина – правая задняя нёбная дужка – левая задняя нёбная дужка – левая нёбная миндалина – задняя стенка глотки. Микробиологический анализ материала выполняли в первые 2 часа после его забора. Выделение микроорганизмов выполняли путём посева на плотные питательные среды (5% кровяной агар, желточно-солевой агар, среда Эндо, среда Сабуро), используя методику «тампон-штрих». Идентификацию выделенных штаммов проводили методом масс-спектрометрии (MALDI-ToF MS).
Принимая во внимание, что этиологическая значимость представителей условно-патогенной флоры определяется их количеством в микробном очаге, этот показатель тоже оценивался. В соответствии с количеством видов микроорганизмов данные были разделены на три группы: низкая степень (101–103), средняя степень (104–105) и высокая степень (106 и более).
Статистическая обработка полученных данных проводилась на персональном компьютере в пакете программы Statistica 10.0 (Statsoft, USA). Проверка на нормальность распределения количественных данных проводилась с помощью критерия Колмогорова – Смирнова с поправкой Лиллиефорса. При сравнении непараметрических количественных показателей между группами использовали U-критерий Манна – Уитни. При сравнении показателей, подчинявшихся нормальному закону распределения, применяли t-критерий Стьюдента. Различия признавались статистически значимыми при p<0,05.
Результаты
В I группе (n=79) обследуемых на первый план выходили признаки воспалительного процесса в нёбных миндалинах. В частности, пациенты жаловались на чувство инородного тела в глотке, неприятный запах изо рта, желание откашливаться. Фарингоскопическая картина: верхний полюс небных миндалин выступал из-за небных дужек (до 0,5 см), лакуны нёбных миндалин были мешкообразно расширены, особенно в нижних и средних отделах, опорожнение которых даже в условиях двушпательной пробы было затруднительным.
У пациентов II группы (n=97) патологические изменения слизистой оболочки задней стенки глотки преобладали над таковыми в нёбных миндалинах. Больные предъявляли жалобы на чувство сухости и першения в глотке в утренние часы, а в течение дня — на чувство прочного «налипания» слизи, которую невозможно откашлять. Улучшение наступало только после питья тёплой воды. Провоцирующими факторами зачастую являлись холодное питьё, острая, горячая, раздражающая пища. Симптомы в основном развивались параллельно с возникновением дисфункции кишечника.
У больных III группы (n=62) патологические изменения в нёбных миндалинах и слизистой оболочке задней стенки глотки проявлялись в равной степени. Среди жалоб отмечались: отхождение мокроты утром (нередко с неприятным запахом), сухость в глотке, гнилостный привкус, чувство стекания по задней стенке глотки, зуд в глотке, а также частые проявления дисфункции кишечника. Вышеперечисленные жалобы в большей или меньшей степени отмечались пациентами постоянно, но их выраженность была невысокой, и больные «привыкали» к ним, не считая патологическими.
Результаты исследования качественного состава микробиоценоза глотки и нёбных миндалин и частота обнаружения (%) соответствующих микроорганизмов у больных с различными вариантами клинических проявлений сочетания ХКТ и ХФ отражены на рисунке 1.
Как видно из данных, представленных на рисунке 1, оценка качественного состава микробиоценозов глотки и нёбных миндалин у пациентов с обозначенной ЛОР-коморбидностью позволил выявить следующие особенности:
1) α-гемолитические Streptococcus spp. чаще регистрировались в I группе, однако эта разница была статистически не значима; β-гемолитические Streptococcus spp. выявлялись микробиоценозе глотки и нёбных миндалин у большинства пациентов всех групп;
2) негемолитические Streptococcus spp. реже встречались в III группе по сравнению с I и II группами, и эти различия носили статистически значимый характер (p<0,05);
3) коагулазопозитивные Staphylococcus spp. статистически достоверно (p<0,05) чаще регистрировались во II и III группах больных, при этом в III достоверно чаще, чем во II (p<0,05);
4) коагулазоотрицательные Staphylococcus spp. статистически достоверно реже наблюдались в III группе (при этом одинаково сравнимо часто во II и I группах);
5) Corinebacteria spp. и непатогенные Neisseria spp. во II группе встречались статистически значимо (p<0,05) чаще, чем в I, а в III группе — статистически достоверно (p<0,05) реже, чем и в I и во II группах;
6) грибы рода Candida регистрировались во II и III группах статистически значимо (p<0,05) чаще, чем в I группе.
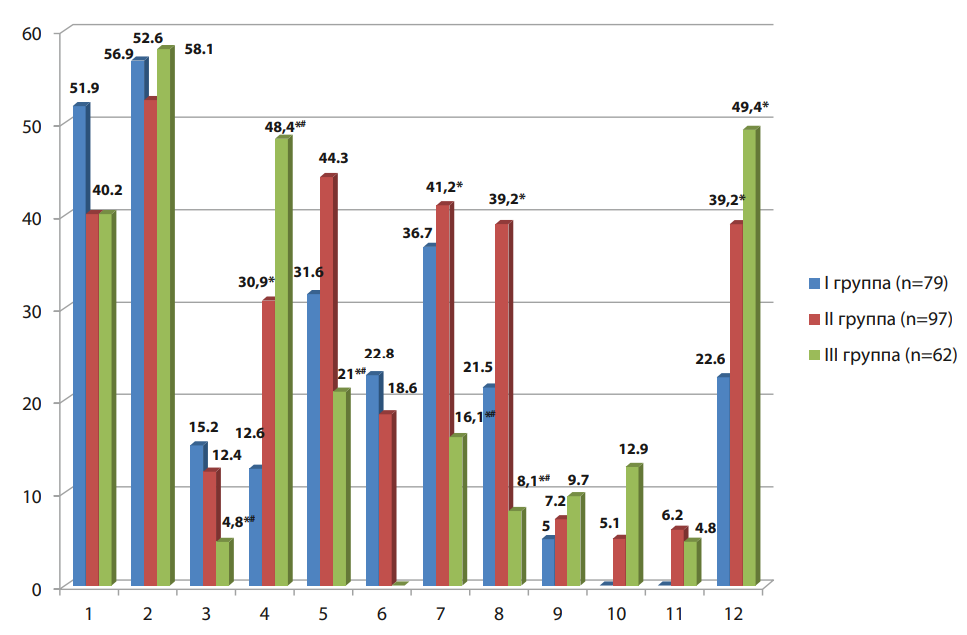
Рисунок 1. Качественный состав микробиоценозов глотки и нёбных миндалин и частота обнаружения (%) соответствующих микроорганизмов у пациентов с ХКТ в сочетании с ХФ
Примечание: Streptococcus spp.: 1 — α-гемолитические; 2 — β-гемолитические, 3 — негемолитические; Staphylococcus spp.: 4 — коагулазопозитивные; 5 — коагулазоотрицательные; 6 — Moraxella; 7 — Corinebacteria spp.; 8 — Neisseria spp.; 9 — E.coli; 10 — Klebsiella spp.; 11 — Pseudomonas spp.; 12 — грибы рода Candida. * — статистически значимые различия по сравнению с показателями I группы при p<0,05 (по U-критерию Манна – Уитни); # — статистически значимые различия между показателями II и III группы при p<0,05 (по U-критерию Манна – Уитни).
Что касается количественного содержания микроорганизмов в биоценозе глотки и небных миндалин, то были получены различные результаты по представителям резидентной и транзиторной флоры.
В частности, от 53% до 91% популяции α-гемолитических и негемолитических Streptococcus spp. во всех группах пациентов выявлялось в высокой степени обсеменённости, что соответствует норме. Коагулазоотрицательные Staphylococcus spp., также входящие в состав облигатной микрофлоры, аналогично в большинстве случаев определялись в нормальном количестве (103–104), однако в 20%, 20,9% и 33,3% случаев их наблюдение в I, II и III группах, соответственно, достигало или превышало 106. Ещё одни представители нормальной микрофлоры — Corinebacteria spp. — более, чем у половины пациентов в I, II и III групп, определялись с высокой степенью обсеменённости (61%, 67,5% и 66%, соответственно) (p<0,05). Наконец, непатогенные Neisseria spp. определялись с низкой степенью обсеменённости во II и III группах в 39,5% и 93% случаев соответственно, а в I группе в большинстве случаев (73%) — с высокой степенью обсеменённости (p<0,05).
Кроме того, анализ структуры выявил перемещение транзиторного вида β-гемолитических Streptococcus spp. в постоянные виды. Их высокая концентрация наблюдалась у большинства обследуемых пациентов во всех трёх группах, составив, соответственно, 77,7%, 80,4% и 91,7%. Коагулазопозитивные Staphylococcus spp. в концентрации до 103 сравнимо часто обнаруживались во всех трёх группах (30%, 26,7% и 33,3% соответственно). Однако их количество до 105 и 106 и более значительно и достоверно (p<0,05) увеличивалось во II и III группах наблюдаемых лиц (до 50% и 54,3% соответственно). Грибы рода Candida в 50% случаев выявлялись в низкой концентрации в I группе, а во I и II группах — в средней степени концентрации в 39,5% и 42,8% случаев соответственно (p<0,05).
Данные о частоте встречаемости монокультур и ассоциаций в составе микробиоценозов наблюдаемых клинических групп представлены в таблице 1.
Таблица / Table 1
Частота встречаемости монокультур и ассоциаций микроорганизмов, составляющих микробиоценоз глотки и небных миндалин у пациентов с ХКТ в сочетании с ХФ
Frequency of occurrence of monocultures and associations of microorganisms that make up the microbiocenosis of the pharynx and palatine tonsils in patients with CCT in combination with CP
Группа | Число монокультур и ассоциаций | ||||||
Монокульт. | 2 | 3 | 4 | 5 | 6 | 7 | |
I | 6 (7,6%) | 13 (16,5%) | 24 (30,4%) | 22 (27,8%) | 11 (13,9%) | 2 (2,5%) | 1 (1,3%) |
II | 2* (2%) | 17 (17,5%) | 25 (25,8%) | 34* (35,1%) | 12 (12,4%) | 7* (7,2%) | - |
III | 1* (1,6%) | 9 (14,5%) | 29 (46,7%) | 13* # (20,9%) | 9 (14,5%) | 1# (1,6%) | - |
Примечание: * — статистически значимые различия по сравнению с показателями I группы при p<0,05 (по U-критерию Манна – Уитни); # — статистически значимые различия между показателями II и III группы при p<0,05 (по U-критерию Манна – Уитни).
Таким образом, среди микробиоценозов 238 человек были обнаружены лишь в 3,8% случаев, при этом статически значимо (p<0,05) чаще среди пациентов I группы. Монокультуры были представлены β-гемолитическими Streptococcus spp. (5 случаев), коагулазопозитивными Staphylococcus spp. (3 случая), Pseudomonas spp. (1 случай).
Минимальная частота 4- и 6-тикомпонентных ассоциаций отмечалась в III группе (по сравнению с I и II группами), и это было статистически значимым (p<0,05). В остальных случаях статистически достоверной значимости между количеством разнокомпонентных ассоциаций в клинических группах выявлено не было.
В целом, в составе ассоциаций в микробиоценозах преобладали сочетания α- и β-гемолитических Streptococcus spp., они же в сопровождении с коагулазоотрицательными и коагулазопозитивными Staphylococcus spp., грибами рода Candida, а также Corinebacteria spp. и непатогенными Neisseria spp.
Особую ценность для проведения максимально эффективной и целенаправленной фармакотерапии данного заболевания представляет определение чувствительности идентифицированных возбудителей к основным представителям антимикробных ЛС.
В связи с этим нами была выполнена оценка чувствительности выявленных популяций, составляющих микробиоценоз глотки и нёбных миндалин у пациентов с ХКТ в сочетании с ХФ. По итогам проведённого анализа, максимальное число случаев чувствительности было установлено к имипенему (81%), цефотаксиму (77%), цефолатину (66,5%), цефоперазону (58%). К другим антибиотикам чувствительность составляла менее 55%. При этом максимальная частота устойчивости наблюдалась к эритромицину (78%), доксициклину (64%) и азитромицину (61%). При этом устойчивость одновременно к нескольким ЛС проявляли 57,14% ассоциаций микроорганизмов.
Отдельно было изучена чувствительность штаммов грибов рода Candida, вегетирующих в глотке у больных с ХКТ в сочетании с ХФ к антимикотическим ЛС. В результате максимальная чувствительность, составившая всего лишь 50% случаев, была выявлена к амфотерицину, в то время как к нистатину, интраконазолу и кетоконазолу отмечалась резистентность в 85%, 70% и 61,5% случаев соответственно. В 52,3% проб выявлялись штаммы, устойчивые к 3–4 антимикотикам.
Обсуждение
Как уже было нами отмечено, основные сведения, представленные в доступных источниках информации, касаются микрофлоры либо задней стенки глотки, либо нёбных миндалин [7—12]. Так, исходя из данных, представленных в отечественной и зарубежной медицинской литературе, наиболее частыми «находками» при проведении бактериологического исследования образцов из небных миндалин становятся Streptococcus pyogenes, Staphylococcus aureus, грибы рода Candida, хламидии и микоплазмы. Таким образом, «классическое» рассмотрение стрептококка в качестве основного возбудителя тонзиллита на сегодняшний день эволюционировало до теории смешанной флоры [15]. Кроме этого, в медицинской литературе появляется всё больше сведений о значимости в патогенезе тонзиллярной патологии возбудителей не только на слизистой оболочке, но и внутриклеточно, в частности в паренхиме небных миндалин, что значительно осложняет их элиминацию [16][17]. Что касается комплексного изучения микробиоценоза при сочетании ХТ и ХФ, то таких данных в литературе крайне недостаточно. Кроме того, в литературе не представлены сведения о микрофлоре задней стенки глотки и нёбных миндалин при смешанной патологии, учитывающие преимущественное поражение одного из данных образований лимфо-глоточного кольца.
Проведённые нами детальный клинический осмотр и опрос пациентов при сочетании ХТ и ХФ позволил выделить три варианта проявлений коморбидной ЛОР-патологии: с преобладанием признаков обострения ХТ, с проявлениями преимущественно ХФ и с клиникой обострения ХТ и ХФ в равной степени.
Следующим этапом стало проведение исследование микробиоценоза глотки и нёбных миндалин пациентов с данным видом ЛОР-коморбидности различных клинических вариантов. В результате в пробах выявлялись представители как резидентной (α-гемолитические и негемолитические стрептококки, эпидермальные стафилококки, коринеформные бактерии, нейссерии), так и транзиторной флоры (грибы рода Candida, золотистые стафилококки) верхних дыхательных путей, однако их соотношение было неравномерным и отличалось от нормального.
В частности, β-гемолитические Streptococcus spp. выявлялись микробиоценозе глотки и нёбных миндалин у большинства пациентов всех групп. Учитывая, что в микробиоценозах условно-здоровых людей их практически не бывает, их присутствие даже в количестве 103 можно расценивать в качестве этиологически значимого фактора развития тонзиллярно-фарингеального воспаления.
Интересным оказался факт обнаружения грибов рода Candida во II и III группах статистически значимо (p<0,05) чаще, чем в I группе, следовательно, их вклад в развитие воспалительного процесса в нёбных миндалинах не является значимым.
Аналогичная картина складывалась и с коагулазопозитивными Staphylococcus spp., которые статистически достоверно (p<0,05) чаще регистрировались во II и III группах больных, при этом в III достоверно чаще, чем во II (p<0,05).
Встречаемость резидентных микроорганизмов статистически значимо (p<0,05) была меньше в III группе, то есть при равной степени выраженности патологических изменений в нёбных миндалинах и слизистой оболочке задней стенки глотки.
Следует отметить, что большинство исследователей считают, что мазки с поверхности небных миндалин не обладают высокой степенью информативности, так как у 10% здоровых людей при бактериологическом исследовании носо- и ротоглотки выявляют Streptococcus spp., а у 40% — Staphylococcus spp. Более информативный метод — подсчёт количества микробных клеток в мазке. Однако ввиду трудоёмкости данный вид исследования применяется нечасто.
В настоящем исследовании количественное содержание микроорганизмов в биоценозе глотки и нёбных миндалин было оценено. В результате было выявлено некоторое уменьшение представительства резидентных микроорганизмов на фоне перемещения транзиторного вида β-гемолитических Streptococcus spp. в постоянные виды.
При всех клинических вариантах проявления сочетания ХТ и ХФ от 20,9% до 46,7% исследованных микробиоценозов представляли собой ассоциации из 3–4 компонентов, а монокультуры статистически значимо чаще встречались в I группе пациентов.
Что касается оценки чувствительности идентифицированных возбудителей к основным представителям антимикробных ЛС, то полученные нами результаты свидетельствовали о низком уровне чувствительности к «базовым» антибиотикам, являющихся стартовой терапией при неосложнённых инфекциях верхних дыхательных путей, при этом в 57,14% случаев устойчивость носила характер множественной, то есть к нескольким ЛС.
Аналогичные данные были получены и в отношении противогрибковых ЛС: к амфотерицину В, системному средству с достаточно выраженными побочными эффектами чувствительность проявили только 50% грибов рода Candida, вегетирующих в глотке пациентов с ХТФ, в то время как к таким «стандартным» антимикотикам, как нистатин и интраконазол, она составила всего 15% и 30%, соответственно. При этом более чем у половины пациентов штаммы грибов рода Candida проявляли устойчивость одновременно к 3–4 противогрибковым ЛС.
Полученные данные подтверждают необходимость поиска и внедрения в лечебную практику новых антибактериальных ЛС, способных преодолевать лекарственную резистентность при сочетании ХТ и ХФ.
Выводы
- Качественный и количественный составы микробиоценозов глотки и нёбных миндалин у пациентов с ХКТ в сочетании с ХФ различаются в зависимости от клинического варианта проявления обозначенной коморбидности: встречаемость резидентных микроорганизмов статистически значимо (p<0,05) была меньше в III группе; коагулазопозитивные Staphylococcus spp. статистически достоверно (p<0,05) чаще регистрировались во II и III группах больных, при этом в III достоверно чаще, чем во II (p<0,05); грибы рода Candida во II и III группах выявлялись статистически значимо (p<0,05) чаще, чем в I группе; во всех группах наблюдалось перемещение транзиторного вида β-гемолитических Streptococcus spp. в постоянные виды: их концентрация 106 и более наблюдалась у большинства обследуемых пациентов во всех трех группах, составив, соответственно, 77,7%, 80,4% и 91,7%.
- При всех клинических вариантах проявления сочетания ХКТ с ХФ от 20,9% до 46,7% исследованных микробиоценозов являлись ассоциациями из 3–4 компонентов, а монокультуры статистически значимо чаще встречались у пациентов с преобладанием признаков ХТ.
- В 57,14% и 52,3% случаев, соответственно, регистрировалась множественная устойчивость к антибактериальным и противогрибковым ЛС.
- Результаты, полученные в ходе выполнения настоящего исследования, подтверждают необходимость поиска и внедрения в лечебную практику новых антибактериальных ЛС для эффективной фармакотерапии, часто встречающейся в клинической практике ЛОР-коморбидности в виде сочетания ХКТ с ХФ.
1. https://www.garant.ru/products/ipo/prime/doc/402776263/
2. Клинические рекомендации – Хронический тонзиллит – 2024 (20.11.2024) – Утверждены Минздравом РФ
Список литературы
1. Кривопалов А.А., Рязанцев С.В., Еремин С.А., Шамкина П.А. Клиническая эффективность препаратов бензидамина в терапии обострений хронического тонзиллофарингита. РМЖ. Медицинское обозрение. 2019;3(2-2):36–41.
2. Мирзоева Е.З., Портенко Г.М., Портенко Е.Г., Шматов Г.П. Современная информационная технология помощник врача в диагностике хронического тонзиллита и хронического фарингита. Российская оториноларингология. 2015;4(77):74–78.
3. Портенко Г.М., Шматов Г.П. Хронический тонзиллофарингит и информационная технология его диагностики. Российская оториноларингология. 2017;6(91):100-106.
4. Ceylan ME, Çukurova I, De Corso E. Chronic Tonsillopharyngitis, In: Cingi C. et al. (eds.) Pediatric ENT Infections. 2022. https://doi.org/10.1007/978-3-030-80691-0_45
5. Celik E.K. Acute and Chronic Tonsillopharyngitis. In: Infections in Otolaryngology. 2022. https://doi.org/10.69860/nobel.9786053359401.8
6. Товмасян А.С., Филина Е.В., Голубева Л.И., и др. Хронический фарингит. Современные подходы к диагностике и лечению. Вестник оториноларингологии. 2023;88(3):56‑62.
7. Гуров А.В., Юшкина М.А. Возможности применения препарата Тонзилгон® Н в комплексной терапии хронического тонзиллита. Consilium Medicum. 2018;20(11):20-24.
8. Хуснутдинова Л.М. Микрофлора слизистой оболочки миндалин человека в норме и при патологии. Журнал микробиологии, эпидемиологии и иммунобиологии. 2006;1:60-63.
9. Цыркунов В.М., Рыбак Н.А., Васильев А.В., Рыбак Р.Ф. Микробиологические и морфологические аспекты хронического тонзиллита. Инфекционные болезни. 2016;14(1):42–47.
10. Choby BA. Diagnosis and treatment of streptococcal pharyngitis. Am Fam Physician. 2009;79(5):383-390. Erratum in: Am Fam Physician. 2013;88(4):222. PMID: 19275067.
11. Raju G., Selvam E.M. Evaluation of microbial flora in chronic tonsillitis and the role of tonsillectomy. Bangladesh Journal of Otorhinolaryngology. 2012;18(2):109-113. https://doi.org/10.3329/bjo.v18i2.11982
12. Shaik A., Krishna T.G., Sayyad A.P. A study on tonsil core culture in chronic and recurrent tonsillitis. Journal of Evolution of Medical and Dental Sciences. 2018;7(29):3308-3311. https://doi.org/10.14260/jemds/2018/745
13. Haidara A., Sidibé Y., Samaké D., Coulibaly A., Touré M., Coulibaly B. Tonsillitis and their complications: epidemiological, clinical and therapeutic profiles. Int. J. Otolaryngology and Head & Neck Surg. 2019;8(3):98–105. https://doi.org/10.4236/ijohns.2019.83011
14. Мелоян Е.К., Сафроненко А.В., Ганцгорн Е.В. Клинико-микробиологические особенности хронического тонзиллофарингита различных клинических вариантов. Медицина. Социология. Философия. Прикладные исследования. 2023;3:75-79.
15. Рязанцев С.В., Криволапов А.А., Еремин С.А. Особенности неспецифической профилактики и лечения пациентов с обострением хронического тонзиллита. Русский Медицинский Журнал. 2017;23:1688–1694.
16. Шишкунова Т. М. Современные методы диагностики и консервативного лечения хронического тонзиллита. Российская оториноларингология. 2022;21(3):96–111.
17. Салтанова Ж.Е. Хронический тонзиллит, этиологические и патогенетические аспекты развития метатонзиллярных осложнений. Вестник оториноларингологии. 2015;80(3):65‑70.
Об авторах
Е. К. МелоянРоссия
Мелоян Елена Константиновна, врач-оториноларинголог
Ростов-на-Дону
А. В. Сафроненко
Россия
Сафроненко Андрей Владимирович, д.м.н., профессор, заведующий кафедрой фармакологии и клинической фармакологии
Ростов-на-Дону
Е. В. Ганцгорн
Россия
Ганцгорн Елена Владимировна, к.м.н., доцент, доцент кафедры фармакологии и клинической фармакологии
Ростов-на-Дону
Рецензия
Для цитирования:
Мелоян Е.К., Сафроненко А.В., Ганцгорн Е.В. Фармако-микробиологические особенности коморбидности воспалительных заболеваний верхних дыхательных путей. Южно-Российский журнал терапевтической практики. 2025;6(2):39-46. https://doi.org/10.21886/2712-8156-2025-6-2-39-46
For citation:
Meloyan E.K., Safronenko A.V., Gantsgorn E.V. Pharmaco-microbiological features of comorbidity at inflammatory diseases of the upper respiratory tract. South Russian Journal of Therapeutic Practice. 2025;6(2):39-46. (In Russ.) https://doi.org/10.21886/2712-8156-2025-6-2-39-46


























