Перейти к:
Моноцитарный хемоаттректантный протеин-1 у больных с дислипидемией и хронической болезнью почек 5 стадии на гемодиафильтрации, взаимосвязь с факторами риска и сердечно-сосудистыми осложнениями
https://doi.org/10.21886/2712-8156-2025-6-2-47-57
Аннотация
Цель: изучение взаимосвязей уровня МСР-1 в крови у больных с дислипидемией и хронической болезнью почек 5 стадии на гемодиафильтрации (ГДФ) с метаболическими и гемодинамическими параметрами, а также риском сердечно-сосудистых осложнений. Материал и методы: исследование одномоментное, когортное, с ретроспективным анализом сердечно-сосудистых осложнений. В исследование было включено 103 пациента, средний возраст составил 61,9±12,9 лет. Фиксировались сердечно-сосудистые осложнения, которые на момент обследования уже развились в период получения пациентами диализного лечения. Всем пациентам проводилось определение параметров липидограммы, включая липопротеин (а) и окисленные липопротеины. Также определялись параметры обмена веществ, признаки сосудистой кальцификации, сосудистой жесткости, нутритивного статуса. Результаты: среднее значение МСР-1 в исследованной когорте пациентов составило 54,3±13,6 пг/мл и колебалось от 31 до 79 пг/мл. У больных на ГДФ рост концентрации МСР-1 происходил однонаправленно с ростом уровней ЛП(а) и окЛПНП, играющих большую роль в процессе атерогенеза. Также выявлено однонаправленное повышение уровня МСР-1 в крови по мере нарастания выраженности уремической кальцификации клапанов и стенки аорты, гиперурикемии и признаков сосудистого воспаления (СРБ). Повышение уровня МСР-1 сопровождалось высокой вероятностью выявления сосудистой кальцификации и кальцификации клапанов сердца, периферического атеросклероза, коронарных поражений, мозгового инсульта (МИ) и комбинированной точки ИМ+МИ+ХСН. Заключение: МСР-1 оказывает негативное влияние на риск сердечно-сосудистых событий как в виде самостоятельного воздействия, так и в виде комбинированного воздействия с параметрами липидного обмена и гемодинамическими факторами. Последнее явилось мотивацией для разработки оригинальной шкалы ХС-ЛПНП+ЛП(а)+МСР-1, которая позволяет оценивать риск развития сердечно-сосудистых осложнений.
Для цитирования:
Газзаева С.А., Ремизов О.В., Астахова З.Т., Авсарагова А.З. Моноцитарный хемоаттректантный протеин-1 у больных с дислипидемией и хронической болезнью почек 5 стадии на гемодиафильтрации, взаимосвязь с факторами риска и сердечно-сосудистыми осложнениями. Южно-Российский журнал терапевтической практики. 2025;6(2):47-57. https://doi.org/10.21886/2712-8156-2025-6-2-47-57
For citation:
Gazzayeva S.A., Remizov O.V., Astakhova Z.T., Avsaragova A.Z. Monocyte chemoattractant protein-1 in patients with dyslipidemia and chronic kidney disease stage 5 on hemodiafiltration, relationship with risk factors and cardiovascular complications. South Russian Journal of Therapeutic Practice. 2025;6(2):47-57. (In Russ.) https://doi.org/10.21886/2712-8156-2025-6-2-47-57
Введение
В развитии атеросклеротического процесса важную роль играют не только атерогенные дислипидемии, но и состояние сосудистой стенки в части её проницаемости, способности к аккумуляции липидных компонентов и их преобразования в липидные пятна [1—3]. Данный процесс обеспечивается целым рядом хемокинов, среди которых особое место занимают и факторы адгезии (ICAM, VCAM и др.), и хемотаксические факторы [4]. Важную роль в хемотаксисе играет моноцитарный хемоаттрактантный протеин-1 (MCP-1), главной функцией которого является экстравазация лейкоцитов из кровообращения в очаг воспаления [5]. К хемокинам, помимо МСР-1, относят MIP-1β (macrophage inflammatory protein-1β) и RANTES (Regulated on Activation, Normal T-cell Expressed and Secreted). В настоящее время изучено более 50 хемокинов и 20 G-белок-связанных хемокиновых рецепторов, играющих определённую биологическую роль [6]. Свою активность они реализуют через рецепторы, связанные с гетеротримерным G-белком. MCP-1, он же CCL2 (CC motifligand 2), который является цитокином, относящимся к группе CC-хемокинов (β-хемокинов).
В ряде работ было показано увеличение уровня МСР-1 в крови у пациентов с хронической болезнью почек (ХБП) в сравнении с когортой с нормальной функцией почек [7][8]. Уремические токсины, такие как р-крезил сульфат, индоксил сульфат, обладают провоспалительными свойствами и запускают каскад высвобождения ряда хемокинов, в том числе и МСР-1 [9][10]. У больных на гемодиализе выявлены взаимосвязи между уровнями уремических токсинов и концентрацией MCP-1, что свидетельствует о связи уровня MCP-1 с выраженностью почечной дисфункции с явлениями системного воспаления, окислительного стресса, эндотелиальной дисфункции и атеросклероза [11][12]. Более того, повышение уровня MCP-1 у больных с сердечно-сосудистыми заболеваниями при ХБП и без неё независимо ассоциируется со смертностью [7].
Известно, что МСР-1 существует в двух основных формах: циркулирующей, активирующей пул моноцитов в кровеносном русле, и тканевой, участвующей в процессах воспаления путём привлечения моноцитов в очаг повреждения. Индуцированная МСР-1 миграция моноцитов в стенку сосуда является ключевым событием, способствующим развитию атеросклероза. В одном из исследований были изучены атеросклеротические бляшки 1199 пациентов после операции эндартерэктомии вследствие стеноза сонной артерии. Было установлено, что экспрессия МСР-1 в атеросклеротических бляшках была связана с критериями уязвимости бляшек, то есть с характеристиками воспаления бляшек, гистологическими признаками уязвимости, клинической нестабильностью бляшек и периоперационными сосудистыми осложнениями в течение месяца после эндартерэктомии [13].
В мексиканском исследовании было показано, что на каждые десять пг/мл повышения уровня MCP-1 в крови риск развития преждевременной ИБС увеличивается на 2,7% у лиц с генотипом AA гена MCP-1 [5]. Также было показано влияние повышенной концентрации МСР-1 на риск развития каротидного атеросклероза и дальнейшего развития мозгового инсульта [14].
В настоящее время существуют модели стратификации риска инфаркта миокарда, в которые интегрирован повышенный уровень MCP-1 в крови как фактора риска [15]. Однако большие сложности возникают в оценке роли уровня MCP-1 в развитии сердечно-сосудистых осложнений у больных с дислипидемией и ХБП 5 стадии, в связи с этим исследования на диализных когортах пациентов представляют актуальными.
Цель исследования — изучение взаимосвязей уровня МСР-1 в крови у больных с дислипидемией и хронической болезнью почек 5 стадии на гемодиафильтрации (ГДФ) с метаболическими и гемодинамическими параметрами, а также риском сердечно-сосудистых осложнений.
Материал и методы
Исследование одномоментное, когортное, с ретроспективным анализом сердечно-сосудистых осложнений. Исследование было проведено в соответствии с принципами Хельсинкской декларации и надлежащей клинической практики. Протокол исследования одобрен локальным независимым этическим комитетом. Все пациенты подписали добровольное информированное согласие на участие в исследовании.
Критерии включения: пациенты с ХБП различного генеза 5Д стадии, получающие лечение хронической гемодиафильтрацией (ГДФ), имевшие до старта заместительной почечной терапии (ЗПТ) результаты исследования липидного профиля крови, получающие и сохранившие её на ГДФ или не получающие статины.
Формирование внутригрупповых страт и подходы к рандомизации групп — свободный сплошной набор пациентов, Набор в две группы (с уровнем МСР-1 выше и ниже медианы распределения в когорте). В исследование не включались пациенты младше 18 и старше 80 лет, имеющие иные вторичные причины развития дислипидемии, кроме ХБП (пациенты с патологией щитовидной железы, с нефротическим синдромом, болезнями печени, приёмом глюкокортикоидов и цитостатиков по каким-либо причинам), пациенты с наследственными дислипидемиями.
В исследование были включены 103 пациента, средний возраст которых составил 61,9±12,9 лет, из них лиц мужского пола было 65, женского пола — 38. Все пациенты имели ХБП 5Д стадии и получали терапию ГДФ на протяжении от 2 лет до 21 года (в среднем 7,9±3,3 лет). Продолжительность ХБП составила 17,4±3,3 года и колебалась от 6 до 3 лет. Артериальная гипертензия (АГ) регистрировалась у 77 пациентов, сахарный диабет (СД) — у 51 пациента (СД 1 типа — у 14 пациентов, СД 2 типа – у 37 пациентов).
Поскольку исследование являлось одномоментным, фиксировались сердечно-сосудистые осложнения, которые на момент обследования уже развились в период получения пациентами лечения ГДФ. Ряд осложнений в дальнейшем статистически анализировался самостоятельно либо в составе комбинированных точек. Учитывались следующие осложнения:
- хроническая сердечная недостаточность (ХСН) 2 или более функционального класса со сниженной или умеренно сниженной систолической функцией, отмечено 15 событий (7 пациентов имели 2ФК, 8 пациентов — 3ФК);
- инфаркт миокарда (ИМ) перенесли 14 пациентов;
- хроническая ишемическая болезнь сердца, стабильная стенокардия (ХИБС, стенокардия) у 3 пациентов;
- мозговой инсульт перенесли 5 пациентов;
- чрескожное коронарное вмешательство в виде ангиопластики со стентированием (ЧКВ/стентирование) у 9 пациентов;
- признаки периферического атеросклероза были зарегистрированы у 10 пациентов (у 4 — стеноз почечных артерий, у 6 — атеросклероз бедренных артерий или подвздошно-бедренного сегмента);
В качестве комбинированных точек анализировались следующие:
- периферический атеросклероз + МИ — у 13 пациентов;
- ХИБС/стенокардия + ЧКВ/стентирование + ИМ — у 17 пациентов;
- ИМ + МИ + ХСН — у 17 пациентов.
Причины развития ХБП были следующими: диабетическая нефропатия — у 51 пациента, гломерулонефриты и тубулоинтерстициальные нефриты — у 36 пациентов, гипертоническая нефропатия — у 13 пациентов, поликистозная болезнь почек — у 3 пациентов.
45 пациентов получали статины, 41 пациенту был назначен аторвастатин, 4 пациентам — розувастатин. У 9 пациентов доза аторвастатина составила 10 мг, у 26 — 20 мг и у 6 — 40 мг, у 2 пациентов доза розувастатина составила 10 мг, у 2 — 20 мг.
Наиболее распространённой формой дислипидемии был IIa тип по классификации Фридриксена (82%), IIb тип наблюдался у 14% пациентов, III тип — у 2% пациентов, IV тип — у 2% пациентов.
Всем пациентам проводилось объективное и общеклиническое обследование. Анализировались лабораторные показатели: общий анализ крови, биохимический анализ крови (креатинин, мочевина до и после ГДФ, а также % снижения уровня мочевины во время ГДФ, мочевая кислота, параметры электролитного обмена, фосфор, кальций общий, фибриноген, С-реактивный белок (СРБ)). Фиксировали данные липидограммы, выполненные до старта ЗПТ: общий холестерин крови (ОХС), ХС липопротеидов низкой плотности (ХС-ЛПНП), ХС липопротеидов высокой плотности (ХС-ЛПВП), ХС-неЛПВП, триацилглицериды. В ходе проведения исследования определяли все перечисленные параметры липидограммы с помощью иммуноферментного анализа. Окисленные ЛПНП (ок-ЛПНП) определялись с помощью твердофазного иммуноферментного анализа, ЛП(а) в крови — латексным турбидиметрическим методом. Оценивали индекс атерогенности путем отношения ХС-неЛПВП/ХС-ЛПВП и предложенный нами индекс (ХС-неЛПВП/ХС-ЛПВП)*ЛП(а). Также в ходе исследования однократно определяли концентрацию моноцитарного хемоаттрактантного протеина-1 (МСР-1) в крови методом количественного иммуноферментного анализа с применением системы для мультиплексного анализа и принципа проточной цитофлуориметрии.
Нами была предложена оригинальная шкала, включающая данные об уровнях ХС-ЛПНП, ЛП(а) и МСР-1. Для её расчёта нами принимались за 0 баллов значения ХС-ЛПНП<1,4 ммоль/л, и значения ЛП(а)<30 мг/дл, значения МСР-1 менее 55 пг/мл (55 пг/мл медиана значения данного признака в группе). Значения выше указанных пороговых уровней принимались за 1 балл. Далее баллы по всем трём показателям суммировались и представлялись как «шкала ХС-ЛПНП+ЛП(а)+МСР-1».
В ходе эхокардиографического исследования учитывались данные выраженности кальцификации клапанов сердца по полуколичественной шкале оценки степени кальциноза для структур сердца.
С целью оценки кальцификации брюшного отдела аорты пациентам проводилась обзорная рентгенография брюшной полости в боковой проекции. Степень кальцификации оценивали с использованием шкалы Kauppilla, которая позволяет осуществлять оценку степени тяжести кальцификации на уровне каждого отдельного сегмента.
Оценивались параметры нутритивного статуса. Определялся индекс массы тела (ИМТ) (по формуле: вес пациента (кг)/рост пациента (метр2)), уровень сывороточного альбумина и абсолютное содержание лимфоцитов в крови, уровень трансферрина крови. Также оценивалась окружность плеча (ОП, см), окружность талии (ОТ, см) с помощью мягкой измерительной ленты, толщина кожно-жировой складки над трицепсом (ТКЖСТ, см) с помощью калипера, объём мышц плеча по формуле (ОМП, см). Поскольку ОТ имеет гендерные различия, значение ОТ у лиц женского пола умножалось на 1,175 (поправочный коэффициент) для того, чтобы можно было сгладить гендерные различия для последующего статистического анализа. Выраженность нутритивных расстройств с оценкой степени белково-энергетической недостаточности (БЭН) рассчитывали по методике Bilbrey G.L., Cohen T.L. [16]. Скорость распространения каротидно-феморальной пульсовой волны (СРПВ, м/сек) определялась с помощью методики сфигмографии на аппарате для объемной сфигмографии.
Предварительно размер выборки определялся по методу Отдельновой К.А. [17]. Статистический анализ проводили с помощью компьютерной программы «STATISTICA 10.0» (StatSoftInc., США). Характер распределения количественных признаков в исследованной когорте больных на ГДФ определялся методом Колмогорова-Смирнова с поправкой Лиллифорса. Использовались методы описательной статистики, а также корреляционный и логит-регрессионный анализы. Для оценки информативности инструментов прогнозирования использовали ROC-анализ.
Результаты
Среднее значение МСР-1 в исследованной когорте пациентов составило 54,3±13,6 пг/мл и колебалось от 31 до 79 пг/мл (рис. 1).
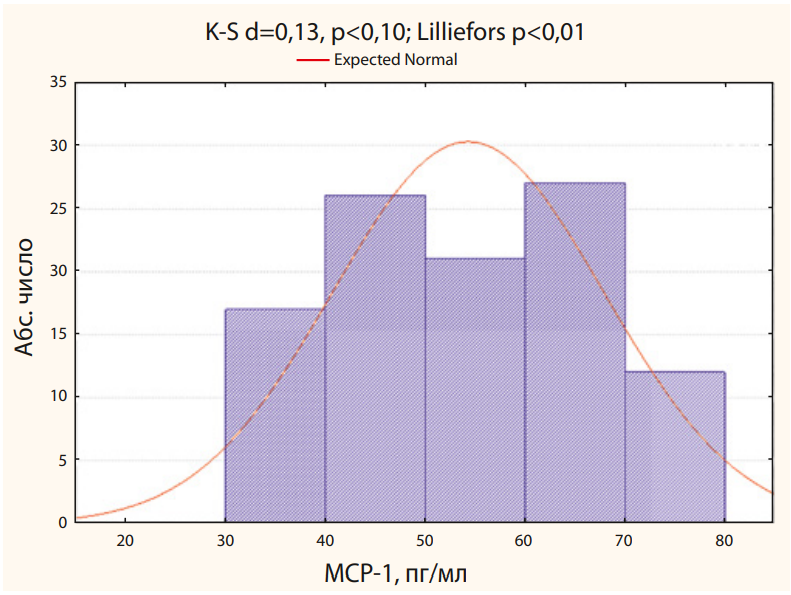
Рисунок 1. Ранговое распределение пациентов по значениям МСР-1
Figure 1. Rank distribution of patients by MCP-1 values
Нами был проведён корреляционный анализ с установлением взаимосвязей МСР-1 с различными изученными параметрами (табл. 1).
Таблица / Table 1
Корреляционные взаимосвязи МСР-1 с антропометрическими, метаболическими и гемодинамическими параметрами
Correlation relationships of MSR-1 with anthropometric, metabolic and hemodynamic parameters
Признак | r | Признак | r |
Возраст | 0,15 | Мочевая кислота | 0,22* |
Длит-ть ХБП | -0,08 | % ↓ мочевины | 0,09 |
Длит-ть ШДФ | 0,08 | О. белок | 0,21 |
ОХС | 0,41* | Ферритин | 0,02 |
ХС-ЛПНП | 0,46* | Гемоглобин | -0,05 |
ХС-ЛПВП | -0,09 | СОЭ | 0,18 |
ХС-неЛПВП | 0,42* | ПТГ | 0,13 |
ХС-ЛПОНП | -0,09 | Кальций | -0,01 |
ТАГ | -0,07 | Фосфор | -0,11 |
ЛП(а) | 0,76* | Глюкоза | -0,09 |
окЛПНП | 0,58* | Осм-ть плазмы | -0,08 |
Степень кальциноза клапанов | 0,30* | АЛТ | -0,13 |
Степень кальцификации аорты | 0,31* | АСТ | -0,14 |
ΔОХС | 0,30* | ГГТП | -0,19 |
ΔХС-ЛПНП | 0,33* | СРБ | 0,32* |
ΔХС-ЛПВП | 0,01 | HbA1c | 0,16 |
ΔХС-неЛПВП | 0,35* | ИМТ | 0,28* |
ΔХС-ЛПОНП | 0,01 | Альбумин крови | -0,11 |
ΔТАГ | -0,15 | Трансферрин | -0,17 |
ХС-неЛПВП/ХС-ЛПВП | 0,38* | ОТ*1,175(ПК) | 0,31* |
(ХС-неЛПВП/ХС-ЛПВП)*ЛП(а) | 0,66* | ТКЖСТ | 0,27* |
ОХС до старта ЗПТ | -0,11 | ОП | 0,20* |
ХС-ЛПНП до старта ЗПТ | -0,09 | ОМП | 0,20* |
ХС-ЛПВП до старта ЗПТ | -0,08 | БЭН | -0,01 |
ХС-неЛПВП до старта ЗПТ | -0,08 | САД | 0,24* |
ХС-ЛПОНП до старта ЗПТ | -0,08 | ДАД | 0,22* |
ТАГ до старта ЗПТ | -0,11 | ПД | 0,18 |
Креатинин | -0,10 | СРПВ | 0,19 |
Отмечено, что связь МСР-1 с атерогенными фракциями ЛП оказывает содружественное воздействие на сосудистую стенку в процессе развития атеросклероза. Важно также отметить, что у больных на ГДФ рост концентрации МСР-1 происходил однонаправленно с ростом уровней ЛП(а) и окЛПНП, также играющих большую роль в процессе атерогенеза. Не остановила рост концентрации МРС-1 и высокая вариабельность ХС в додиализный-диализный периоды ХБП, по мере роста уровня атерогенных ЛП за это время происходило и повышение концентрации МСР-1. Поскольку когорта пациентов получала лечение ГДФ, ей были свойственны все те изменения, которые наблюдаются при уремической интоксикации. То есть было выявлено однонаправленное повышение уровня МСР-1 в крови по мере нарастания выраженности уремической кальцификации клапанов и стенки аорты, гиперурикемии и признаков сосудистого воспаления (СРБ).
Также концентрация МСР-1 нарастала у пациентов по мере повышения массы тела и усугубления проявлений абдоминального ожирения (ОТ).
Это в свою очередь позволяет рассматривать роль хемотаксических факторов, участвующих в развитии атеросклероза (МСР-1), в формировании ряда метаболических расстройств у больных на ГДФ. Далее нами было показано, что повышение уровня МСР-1 наблюдается у пациентов по мере повышения САД и ДАД.
Поскольку уровень МРС-1 был связан с целым рядом факторов, которые влияют на прогноз течения заболевания, следовало предположить, что уровень МСР-1 также будет влиять и на прогноз. С этой целью нами проведён логит-регрессионный анализ и определены те точки, на вероятность развития которых уровень МСР-1 оказывает влияние (табл. 2).
Таблица / Table 2
Вероятность выявления события в зависимости от уровня МСР-1 в крови
Probability of event detection depending on the level of MCP-1 in the blood
Комбинированная точка | Const.B | Estimate (оценка) | OR (range) | χ2 | р |
Кальцификация аорты и/или клапанов сердца | -4,41 | 0,07 | 23,56 | 57,7 | 0,0001 |
Кальцификация клапанов сердца | -5,2 | 0,07 | 27,3 | 49,3 | 0,0003 |
Кальцификация аорты | -4,38 | 0,06 | 19,4 | 55,76 | 0,0004 |
Периферический атеросклероз | -5,91 | 0,06 | 20,4 | 30,1 | 0,02 |
Периферический атеросклероз+МИ | -6,2 | 0,07 | 32,6 | 34,6 | 0,003 |
ХИБС/стенокардия | -8,59 | 0,08 | 55,3 | 12,2 | 0,09 |
ЧКВ/стентирование | -7,71 | 0,09 | 71,3 | 26,2 | 0,003 |
ИМ | -10,9 | 0,15 | 1138 | 28,6 | <0,0001 |
МИ | -7,89 | 0,08 | 49,6 | 17,8 | 0,03 |
ХИБС+ЧКВ/стентирование+ ИМ | -10,6 | 0,15 | 1084 | 31,88 | <0,0001 |
ИМ+МИ+ХСН | -10,37 | 0,15 | 1607 | 36,8 | <0,0001 |
Повышение уровня МСР-1 сопровождалось высокой вероятностью выявления сосудистой кальцификации и кальцификации клапанов сердца, периферического атеросклероза, коронарных поражений, МИ и комбинированной точки ИМ+МИ+ХСН. Ниже представлены графические изображения логит-регрессионной связи (рис. 2, 3).
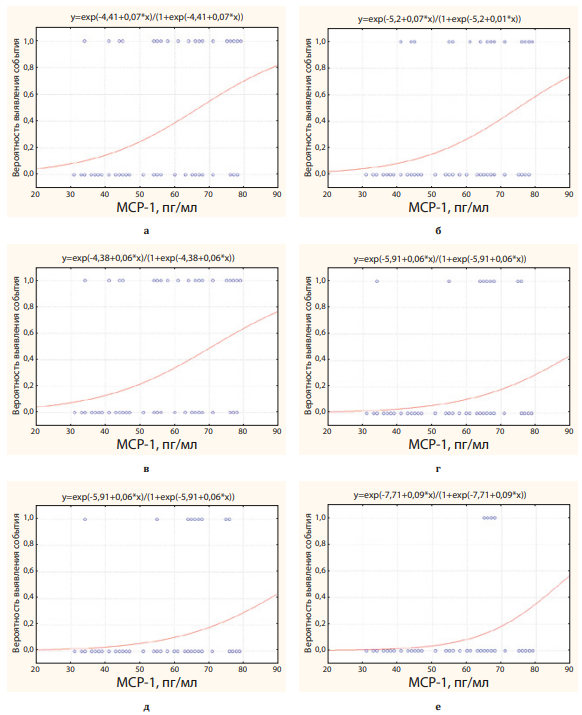
Рисунок 2. Вероятность выявления кальцификации в целом (а), кальцификации клапанов сердца (б), аорты (в), периферического атеросклероза (г), периферического атеросклероза+МИ (д), ЧКВ/стентирования (е) в зависимости от уровня МСР-1 в крови
Figure 2. Probability of detecting calcification in general (a), calcification of heart valves (b), aorta (c), peripheral atherosclerosis (d), peripheral atherosclerosis + MI (d), PCI/stenting (e) depending on the level of MCP-1 in the blood
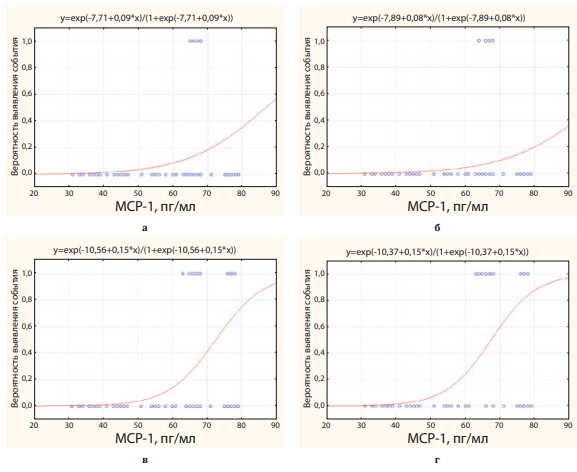
Рисунок 3. Вероятность выявления ИМ (а), МИ (б), ХИБС+ЧКВ/стентирование+ ИМ (в), ИМ+МИ+ХСН (г) в зависимости от уровня МСР-1 в крови
Figure 3. Probability of detecting MI (a), MI (b), CIHD+PCI/stenting+ MI (c), MI+MI+CHF (d) depending on the level of MCP-1 in the blood
На основании логит-регрессионного анализа нами были составлены номограммы прогнозирования вероятности выявления сердечно-сосудистых событий (табл. 3).
Таблица / Table 3
Номограммы прогнозирования вероятности выявления событий в зависимости от уровня МСР-1 в крови
Nomograms for predicting the probability of detecting events depending on the level of MCP-1 in the blood
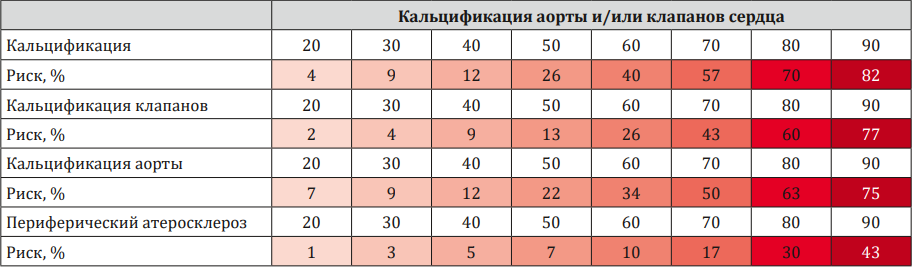
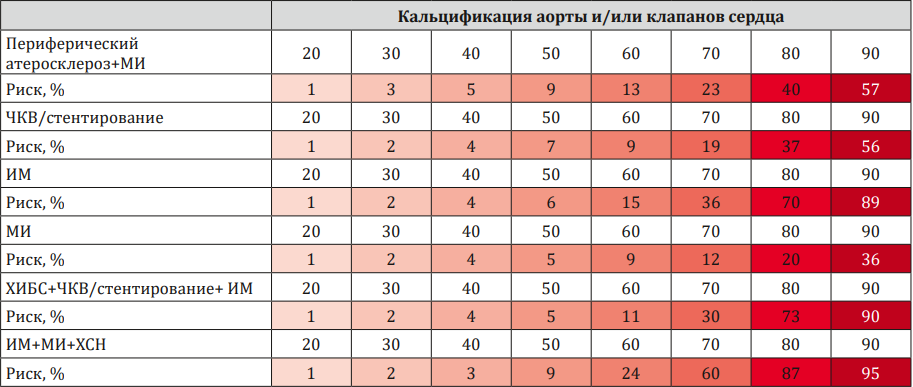
Далее нами был проведён двухфакторный логит-регрессионный анализ риска таких комбинированных точек, как ИМ+МИ+ХСН, ХИБС+ЧКВ/стентирование+ИМ и Периферический атеросклероз+МИ с участием в качестве одного из критериев МСР-1, а второй критерий выбирался на основании статистически значимого влияния на конечные точки в рамках однофакторного анализа (табл. 4).
Таблица / Table 4
Вероятность выявления комбинированной точки ИМ+МИ+ХСН, ХИБС+ЧКВ/стентирование+ИМ и Периферический атеросклероз+МИ в зависимости от уровня МСР-1 в комбинации с другими параметрами
Probability of detecting a combined point of MI+MI+CHF, CIHD+PCI/stenting+MI and Peripheral atherosclerosis+MI depending on the level of MCP-1 in combination with other parameters
Комбинированная точка | Const.B | Estimate (оценка), МСР-1/другой признак | OR (range), МСР-1/другой признак | χ2 | р |
ИМ+МИ+ХСН | |||||
ОХС | -11,4 | 0,15/0,24 | 1368/4,09 | 36,3 | <0,0001 |
ХС-ЛПНП | -10,8 | 0,15/0,20 | 1340/3,7 | 36,5 | <0,0001 |
ХС-неЛПВП | -11,2 | 0,15/0,26 | 1282/4,7 | 36,1 | <0,0001 |
ЛП(а) | -10,4 | 0,16/-0,01 | 2510/0,48 | 36,7 | <0,0001 |
СРБ | -12,5 | 0,18/0,05 | 5335/70,5 | 32,4 | <0,0001 |
СРПВ | -11,6 | 0,15/0,17 | 1329/6,4 | 35,3 | <0,0001 |
ХИБС+ЧКВ/стентирование+ИМ | |||||
Комбинированная точка | Const.B | Estimate (оценка), МСР-1/другой признак | OR (range), МСР-1/другой признак | χ2 | р |
ХС-неЛПВП | -10,7 | 0,14/0,08 | 993/1,56 | 31,8 | <0,0001 |
ХС-неЛПВП/ХС-ЛПВП | -10,8 | 0,14/0,08 | 938/2,1 | 31,8 | <0,0001 |
ЛП(а) | -10,7 | 0,14/0,01 | 765/1,98 | 31,8 | <0,0001 |
Периферический атеросклероз+МИ | |||||
Комбинированная точка | Const.B | Estimate (оценка), МСР-1/другой признак | OR (range), МСР-1/другой признак | χ2 | р |
ХС-ЛПНП | -6,57 | 0,07/0,24 | 24,1/4,52 | 34,2 | <0,0001 |
ХС-ЛПВП | -2,13 | 0,07/-4,44 | 26,1/0,01 | 33,0 | 0,002 |
ЛП(а) | -6,16 | 0,06/0,01 | 19,4/2,2 | 34,5 | 0,01 |
СРПВ | -9,1 | 0,07/0,36 | 23,8/49,9 | 28,9 | <0,0001 |
ПД | -12,3 | 0,07/0,11 | 22,7/125 | 30,4 | 0,0002 |
Было показано, что на фоне повышения уровня МСР-1 увеличение значений ОХС, ХС-ЛПНП, ХС-неЛПВП, ЛП(а), а также уровня СРБ или СРПВ приводит к статистически значимому повышению вероятности выявления комбинированной точки ИМ+МИ+ХСН. На вероятность выявления комбинированной точки ХИБС+ЧКВ/стентирование+ИМ оказывало влияние содружественное с ростом уровня МСР-1 повышение значений ХС-неЛПВП, ХС-неЛПВП/ХС-ЛПВП и ЛП(а). Периферический атеросклероз + МИ выявлялся чаще по мере роста уровня МСР-1 в сочетании с повышением уровней ХС-ЛПНП,ЛП(а), снижением уровня ХС-ЛПВП, а также ростом СРПВи ПД.
Поскольку МСР-1 обладает очевидным прогностическим воздействием в комбинации с рядом параметров липидного обмена, целесообразно было бы произвести анализ на основании комбинации данных факторов. Уровень ХС-ЛПНП менее 1,4 ммоль/л был у 12 из 103 пациентов (11,7%), ЛП(а) менее 30 мг/дл — у 25 из 103 пациентов (29,1%). По оригинальной шкале ХС-ЛПНП+ЛП(а)+МСР-1 0 баллов был отмечен у 8 пациентов, 1 балл — у 19 пациентов, 2 балла — у 27 пациентов, 3 балла — у 49 пациентов.
Нами был проведён логит-регрессионный анализ с оценкой влияния оригинальной шкалы ХС-ЛПНП+ЛП(а)+МСР-1 на вероятность возникновения сердечно-сосудистых осложнений (табл. 5).
Таблица / Table 5
Вероятность выявления комбинированных точек в зависимости от уровня шкалы ХС-ЛПНП+ЛП(а)+МСР-1
Probability of establishing combined points depending on the level of the LDL-C+LP(a)+MCP-1 scale
Комбинированная точка | Const.B | Estimate (оценка), МСР-1/другой признак | OR (range), МСР-1/другой признак | χ2 | р |
Периферический атеросклероз | -4,59 | 0,96 | 18,3 | 30,5 | 0,03 |
ЧВК/стентирование | -5,0 | 1,24 | 41,0 | 34,9 | 0,004 |
ИМ | -60,3 | 20 | 39*107 | 29,3 | <0,001 |
МИ | -61,7 | 20 | 6*108 | 31,6 | <0,001 |
ИМ+МИ+ХСН | -89,8 | 29,9 | 1*1013 | 33,9 | <0,001 |
ХИБС/стенокардия | -58,6 | 19 | 1*109 | 11,3 | 0,03 |
Нами был проведён ROC-анализ для оценки информативности полученной оригинальной шкалы ХС-ЛПНП+ЛП(а)+МСР-1в отношении прогнозирования риска сердечно-сосудистых событий. В результате оценки прогностической информативности оригинальной шкалы была продемонстрирована её высокая чувствительность и специфичность в отношении целого ряда сердечно-сосудистых событий как в виде отдельно взятых эпизодов, так и в отношении комбинированных точек (табл. 6).
Таблица / Table 6
Параметры информативности оригинальной шкалы ХС-ЛПНП+ЛП(а)+МСР-1
Parameters of the information content of the original scale of LDL-C+LP(a)+MCP-1
Прогнозируемое событие | AUC | Чувствительность | Специфичность |
Периферический атеросклероз | 0,85 | 80 | 78 |
ЧКВ/стентирования | 0,84 | 80 | 78 |
ИМ | 0,86 | 82 | 79 |
МИ | 0,86 | 83 | 79 |
ИМ+МИ+ХСН | 0,87 | 85 | 81 |
ХИБС/стенокардия | 0,85 | 82 | 79 |
Заключение
Таким образом, МСР-1 оказывает негативное влияние на риск сердечно-сосудистых событий как в виде самостоятельного воздействия, так и в виде комбинированного воздействия с параметрами липидного обмена и гемодинамическими факторами. Последнее явилось мотивацией для разработки оригинальной шкалы ХС-ЛПНП+ЛП(а)+МСР-1, которая позволяет оценивать риск развития сердечно-сосудистых осложнений.
Список литературы
1. Botts SR, Fish JE, Howe KL. Dysfunctional Vascular Endothelium as a Driver of Atherosclerosis: Emerging Insights Into Pathogenesis and Treatment. Front Pharmacol. 2021;12:787541. https://doi.org/10.3389/fphar.2021.787541
2. Hooglugt A, Klatt O, Huveneers S. Vascular stiffening and endothelial dysfunction in atherosclerosis. Curr Opin Lipidol. 2022;33(6):353-363. https://doi.org/10.1097/MOL.0000000000000852
3. Weinberg PD. Haemodynamic Wall Shear Stress, Endothelial Permeability and Atherosclerosis-A Triad of Controversy. Front Bioeng Biotechnol. 2022;10:836680. https://doi.org/10.3389/fbioe.2022.836680
4. Saud A, Ali NA, Gali F, Hadi N. The role of cytokines, adhesion molecules, and toll-like receptors in atherosclerosis progression: the effect of Atorvastatin. J Med Life. 2022;15(6):751-756. https://doi.org/10.25122/jml-2021-0187
5. Posadas-Sánchez R, Velázquez-Sánchez F, Reyes-Barrera J, Cardoso-Saldaña G, Velázquez-Argueta F, Antonio-Villa NE, et al. MCP-1 rs1024611 Polymorphism, MCP-1 Concentrations, and Premature Coronary Artery Disease: Results of the Genetics of Atherosclerotic Disease (GEA) Mexican Study. Biomedicines. 2024;12(6):1292. https://doi.org/10.3390/biomedicines12061292
6. Haller H, Bertram A, Nadrowitz F, Menne J. Monocyte chemoattractant protein-1 and the kidney. Curr Opin Nephrol Hypertens. 2016;25(1):42-49. https://doi.org/10.1097/MNH.0000000000000186
7. Gregg LP, Tio MC, Li X, Adams-Huet B, de Lemos JA, Hedayati SS. Association of Monocyte Chemoattractant Protein-1 with Death and Atherosclerotic Events in Chronic Kidney Disease. Am J Nephrol. 2018;47(6):395-405. https://doi.org/10.1159/000488806
8. Fukami A, Yamagishi S, Adachi H, Matsui T, Yoshikawa K, Ogata K, et al. High white blood cell count and low estimated glomerular filtration rate are independently associated with serum level of monocyte chemoattractant protein-1 in a general population. Clin Cardiol. 2011;34(3):189-194. https://doi.org/10.1002/clc.20834
9. Masai N, Tatebe J, Yoshino G, Morita T. Indoxyl sulfate stimulates monocyte chemoattractant protein-1 expression in human umbilical vein endothelial cells by inducing oxidative stress through activation of the NADPH oxidase-nuclear factor-κB pathway. Circ J. 2010;74(10):2216-2224. https://doi.org/10.1253/circj.cj-10-0117
10. Maciel RA, Rempel LC, Bosquetti B, Finco AB, Pecoits-Filho R, et al. p-cresol but not p-cresyl sulfate stimulate MCP-1 production via NF-κB p65 in human vascular smooth muscle cells. J Bras Nefrol. 2016;38(2):153-160. (In English, Portuguese) https://doi.org/10.5935/0101-2800.20160024
11. Koeda Y, Nakamura M, Tanaka F, Onoda T, Itai K, Tanno K, et al. Serum C-reactive protein levels and death and cardiovascular events in mild to moderate chronic kidney disease. Int Heart J. 2011;52(3):180-184. https://doi.org/10.1536/ihj.52.180
12. Recio-Mayoral A, Banerjee D, Streather C, Kaski JC. Endothelial dysfunction, inflammation and atherosclerosis in chronic kidney disease--a cross-sectional study of predialysis, dialysis and kidney-transplantation patients. Atherosclerosis. 2011;216(2):446-451. https://doi.org/10.1016/j.atherosclerosis.2011.02.017
13. Georgakis MK, van der Laan SW, Asare Y, Mekke JM, Haitjema S, Schoneveld AH, et al. Monocyte-Chemoattractant Protein-1 Levels in Human Atherosclerotic Lesions Associate With Plaque Vulnerability. Arterioscler Thromb Vasc Biol. 2021;41(6):2038-2048. https://doi.org/10.1161/ATVBAHA.121.316091
14. Nyárády BB, Dósa E, Kőhidai L, Pállinger É, Gubán R, Szőnyi Á, et al. Associations between Various Inflammatory Markers and Carotid Findings in a Voluntary Asymptomatic Population Sample. Int J Mol Sci. 2024;25(17):9656. https://doi.org/10.3390/ijms25179656
15. Singh S, Anshita D, Ravichandiran V. MCP-1: Function, regulation, and involvement in disease. Int Immunopharmacol. 2021;101(Pt B):107598. https://doi.org/10.1016/j.intimp.2021.107598
16. Bilbrey GL, Gordon L, Cohen T. Identification and treatment of protein calorie malnutrition in chronic hemodialysis patients. Dialysis & Transplantation. 1989;18:669-700.
17. Баврина А.П. Основные понятия статистики. Медицинский альманах. 2020;3(64):101-111.
Об авторах
С. А. ГаззаеваРоссия
Газзаева Светлана Ахсарбековна, ассистент кафедры внутренних болезней №4
Владикавказ
О. В. Ремизов
Россия
Ремизов Олег Валерьевич, д.м.н., ректор
Владикавказ
З. Т. Астахова
Россия
Астахова Замира Татарбековна, д.м.н., профессор, зав. кафедрой внутренних болезней №4
Владикавказ
А. З. Авсарагова
Россия
Авсарагова Анжела Заурбековна, к.м.н, доцент кафедры внутренних болезней №4
Владикавказ
Дополнительные файлы
Рецензия
Для цитирования:
Газзаева С.А., Ремизов О.В., Астахова З.Т., Авсарагова А.З. Моноцитарный хемоаттректантный протеин-1 у больных с дислипидемией и хронической болезнью почек 5 стадии на гемодиафильтрации, взаимосвязь с факторами риска и сердечно-сосудистыми осложнениями. Южно-Российский журнал терапевтической практики. 2025;6(2):47-57. https://doi.org/10.21886/2712-8156-2025-6-2-47-57
For citation:
Gazzayeva S.A., Remizov O.V., Astakhova Z.T., Avsaragova A.Z. Monocyte chemoattractant protein-1 in patients with dyslipidemia and chronic kidney disease stage 5 on hemodiafiltration, relationship with risk factors and cardiovascular complications. South Russian Journal of Therapeutic Practice. 2025;6(2):47-57. (In Russ.) https://doi.org/10.21886/2712-8156-2025-6-2-47-57
JATS XML


























