Перейти к:
Возможности коррекции повышенной тревожности методом песочной терапии у пациентов с ишемической болезнью сердца, проживающих в стационарных учреждениях социального обслуживания
https://doi.org/10.21886/2712-8156-2025-6-2-15-23
Аннотация
Цель: оценить эффективность применения метода песочной терапии для коррекции повышенной тревожности у пациентов, проживающих в стационарных учреждениях социального обслуживания. Материалы и методы: в исследовании приняли участие 116 пациентов с ИБС, стабильной стенокардией (напряжения), функциональный класс 1–3, проживающих в ГАУСОН РО «Ростовский №2 ДИПИ». Средний возраст пациентов составил 72,38 ± 9,15 года (56 мужчин и 60 женщин). Пациенты были рандомизированы на две группы: I группа — экспериментальная (получающую песочную терапию) — 58 пациентов, II группа — контрольная (получающую стандартную терапию, поддержку и уход) — 58 пациентов. Проведена оценка уровня тревожности с помощью «Шкала тревоги Гамильтона» и «Опросника тревоги в гериатрии», уровня приверженности к медикаментозной терапии ИБС с помощью с помощью шкалы комплаентности Мориски-Грин. Статистически значимыми считали различия данных и корреляций между ними при р<0,05. Результаты: проведённое исследование оценки эффективности применения метода песочной терапии для коррекции повышенной тревожности у пациентов, проживающих в стационарных учреждениях социального обслуживания, показало, что использование данного метода в течение 2 месяцев статистически значимо снижает уровень тревожности у пациентов с ИБС (p<0,05). Пациенты с ИБС, не приверженные к медикаментозной терапии ИБС, имеют статистически значимо большие показатели уровня тревожности (p<0,05). Установлена статистически значимая отрицательная корреляционная взаимосвязь между уровнем тревожности и приверженностью к медикаментозной терапии у пациентов с ИБС, проживающих в стационарных учреждениях социального обслуживания (p<0,05). Заключение: применение метода песочной терапии может способствовать улучшению психоэмоционального состояния и адаптации к новым условиям проживания, что свидетельствует о необходимости включения песочной терапии в комплекс психокоррекционных мероприятий для пациентов с ИБС.
Ключевые слова
Для цитирования:
Глова С.Е., Юдина О.А., Бучукури Л.В., Хаишева Л.А. Возможности коррекции повышенной тревожности методом песочной терапии у пациентов с ишемической болезнью сердца, проживающих в стационарных учреждениях социального обслуживания. Южно-Российский журнал терапевтической практики. 2025;6(2):15-23. https://doi.org/10.21886/2712-8156-2025-6-2-15-23
For citation:
Glova S.E., Yudina O.A., Buchukuri L.V., Khaisheva L.A. Possibilities of correcting increased anxiety by sandplay therapy in patients with ischemic heart disease living in inpatient social service institutions. South Russian Journal of Therapeutic Practice. 2025;6(2):15-23. (In Russ.) https://doi.org/10.21886/2712-8156-2025-6-2-15-23
Введение
Проживание в стационарных учреждениях социального обслуживания (СУСО) часто сопряжено с рядом психоэмоциональных проблем у пациентов, таких как одиночество, социальная изоляция, снижение самооценки, потеря привычного образа жизни и, как следствие, повышенная тревожность [1][2]. Хроническая тревожность негативно влияет на общее состояние здоровья, качество жизни и адаптацию к новым условиям. В связи с этим актуальным является поиск эффективных и доступных методов психокоррекции, направленных на снижение уровня тревожности у данной категории пациентов.
Песочная терапия — это психотерапевтический метод, использующий песок и миниатюрные предметы для создания трёхмерных композиций, отражающих внутренний мир человека [3]. Метод основан на юнгианской психологии и позволяет пациенту выразить свои чувства и переживания на символическом уровне, обойти вербальные защиты и получить доступ к бессознательным аспектам психики [4]. Песочная терапия имеет ряд преимуществ: невербальный характер, что делает её доступной для людей с ограниченными когнитивными и коммуникативными возможностями; безопасность и экологичность; возможность самовыражения и исследования собственных переживаний в поддерживающей среде [5][6].
Цель исследования — оценить эффективность применения метода песочной терапии для коррекции повышенной тревожности у пациентов, проживающих в СУСО.
Материалы и методы
В одномоментном проспективном исследовании приняли участие 116 пациентов с ИБС, стабильной стенокардией (напряжения), функциональный класс 1–3, проживающих в ГАУСОН РО «Ростовский №2 ДИПИ» более 12 месяцев. Период наблюдения — 2 месяца. Исследование было одобрено Локальным Независимым Этическим Комитетом, перед включением в исследование пациенты подписывали информированное согласие.
Средний возраст пациентов составил 72,38 ± 9,15 года (56 мужчин и 60 женщин).
Критерии включения: пациенты с ИБС, стабильной стенокардией (напряжения), функциональный класс 1–3, наличие повышенной тревожности, отсутствие выраженных когнитивных нарушений, согласие на участие в исследовании. Критерии исключения: наличие деменции на момент включения в исследование, а также противопоказания к использованию песочной терапии: эпилепсия, синдром навязчивых движений, аллергия на пыль и песок, бронхиальная астма в тяжёлой форме, туберкулёз, кожные заболевания и порезы на руках.
Диагноз ишемической болезни сердца устанавливался с учетом наличия критериев cтабильной стенокардии (напряжения) (РКО, 2020) [7].
Наличие тревожности оценивалось клинико-психопатологическим методом с использованием стандартизированных психометрических шкал: «Шкалы тревоги Гамильтона» (Hamilton Anxiety Rating Scale; HARS), по которой наличие повышенной тревожности определялось как значения в 18 баллов и более; краткой формы «Опросника тревоги в гериатрии» (Geriatric Anxiety Inventory; GAI-SF), при которой тревога присутствует, если результат ≥ 3 балла [8-10].
Когнитивные показатели оценивались с помощью «Мини-теста оценки когнитивных функций» (Mini-Mental State Examination; MMSE). Оценка по шкале MMSE ≤ 20 баллов, свидетельствовала о наличии деменции, являлась критерием исключения пациентов из исследования.
Пациенты были рандомизированы на две группы: I группа — экспериментальная (получающую песочную терапию, стандартную терапию, поддержку и уход) — 58 пациентов, II группа — контрольная (получающую стандартную терапию, поддержку и уход) — 58 пациентов. Стандартная терапия включала назначение блокаторов ренин-ангиотензин-альдостероновой системы, b-адреноблокаторов, антагонистов кальция, антиагрегантов, гиполипидемических препаратов. Группы были сопоставимы по качественному и количественному составу терапии, что позволяло исключить непосредственное медикаментозное воздействие на изучаемые показатели (p<0,05).
В соответствии с рекомендуемой частотой проведения песочной терапии, пациенты экспериментальной группы получали 5 сессий песочной терапии в неделю в течение 8 недель, стандартную терапию, поддержку и уход, включающие социальные мероприятия, беседы с персоналом и другие виды досуговой деятельности [11].
Сессии песочной терапии проводились индивидуально под руководством квалифицированного психолога, владеющего методом песочной терапии. В процессе сессии пациентам предлагалось создать композицию в песочнице, используя песок и миниатюрные предметы, отражающие их чувства и переживания. После создания композиции проводилось обсуждение символического значения элементов и общего содержания песочной картины.
Контрольная группа: пациенты получали стандартную терапию, поддержку и уход, включающие социальные мероприятия, беседы с персоналом и другие виды досуговой деятельности.
Обследование пациентов включало первичную оценку жалоб, сбор анамнеза основного заболевания и жизни, общий клинический осмотр. Всех пациентов консультировал врач-психиатр и психолог. Оценка уровня тревожности проводилась до начала и после окончания курса терапии с использованием шкал HARS и GAI-SF.
Всем обследованным была проведена оценка сопутствующей патологии: гипертоническая болезнь (ГБ), хроническая сердечная недостаточность (ХСН), хроническая обструктивная болезнь лёгких (ХОБЛ), бронхиальная астма (БА), сахарный диабет (СД), антропометрическое исследование с вычислением индекса массы тела (ИМТ) и объема талии.
Оценка приверженности к медикаментозной терапии ИБС проводилась с помощью шкалы комплаентности Мориски-Грин [12]. Пациенты, набравшие 2 и более баллов, считались не приверженными к терапии ИБС.
Статистическая обработка данных проводилась с использованием STATISTICA 10.0 и Microsoft Excel 2016 с применением оценки характера распределения данных (критерий Колмогорова – Смирнова), и представления их в виде M±SD или медианы интерквартильного интервала [Ме, 95% ДИ / Q₁ – Q₃] в зависимости от нормальности распределения. Качественные переменные представляли в виде относительной частоты объекта исследования (n, %). Для подтверждения статистической значимости применяли t-критерий Стьюдента или Краскела – Уоллиса, качественные данные сравнивали с помощью критерия χ2 Пирсона. Корреляционный анализ проводили с помощью метода Пирсона, количественную меру тестоны связи оценивали по шкале Чеддока. Статистически значимыми считали различия данных и корреляций между ними при р<0,05.
Результаты
Пациенты, включённые в исследование, были в возрасте от 46 до 98 лет, в среднем их возраст составил 72,38 ± 9,15 года (табл. 1), длительность ИБС — 14,0 лет [ 95% ДИ 6,00–22,00]. Средний индекс массы тела (ИМТ) соответствовал наличию избыточной массы тела 27,14 кг/м2 [ 95% ДИ 25,31 – 29,16], объём талии — 96,0 см, [ 95% ДИ 86,00–114,00].
Суммарный балл по школе MMSE составил 26,67±6,13, что соответствует наличию лёгких когнитивных расстройств и отсутствию деменции. В 81,9% случаев у обследуемых пациентов было выявлено наличие тревожности, которая соответствовала среднему уровню (37±5,28 балла).
Таблица / Table 1
Клинико-анамнестическая характеристика пациентов, включённых в исследование
Clinical and anamnestic characteristics of patients included in the study
Показатели | M ± SD / Me | 95% ДИ / Q₁ – Q₃ | n | min | max |
Возраст, M ± SD, лет | 72,38 ± 9,15 | 64,00 – 82,00 | 116 | 46,00 | 98,00 |
Длительность ИБС, Me, лет | 14,00 | 6,00 – 22,00 | 116 | 2,00 | 41,00 |
ИМТ, Me, кг/м2 | 27,14 | 25,31 – 29,16 | 116 | 19,00 | 41,16 |
Объем талии, Me, см | 96,00 | 86,00 – 114,00 | 116 | 59,00 | 143,00 |
САД, Me, мм рт. ст | 127,00 | 129,00 – 147,00 | 116 | 96,00 | 154,00 |
ДАД, Me, мм рт. ст. | 76,00 | 72,00 – 89,00 | 116 | 58,00 | 94,00 |
ЧСС, Me, ударов в мин. | 68,00 | 65,00 – 77,00 | 116 | 52,00 | 89,00 |
Когнитивный функции (суммарный балл MMSE) | 26,67±6,13 | 24,00 – 30,00 | 116 | 23,00 | 31,00 |
Уровень тревожности по шкале HARS | 24,37±5,28 | 18,00 – 35,00 | 116 | 9,00 | 44,00 |
Уровень тревожности по шкале GAI-SF | 3,35±0,12 | 2,00-4,00 | 116 | 1,00 | 5,00 |
При оценке сопутствующей патологии было установлено, что наиболее часто встречалась патология сердечно-сосудистой системы: ГБ у пациентов экспериментальной группы в 94,8% случаев, у пациентов контрольной группы — в 93,1%, ХСН — в 58,6% и 62,1% случаев соответственно. СД регистрировался у пациентов экспериментальной группы в 29,3% случаев, у пациентов контрольной группы — в 27,5% . Патология дыхательной системы была представлена ХОБЛ у пациентов экспериментальной группы в 15,5% случаев, у пациентов контрольной группы — в 13,8%, БА — в 8,6% и 6,9% соответственно. Изучаемые группы были сопоставимы по наличию коморбидной патологии (p<0,05).
При сравнении уровня тревожности по шкале HARS в зависимости от функционального класса ИБС нам не удалось выявить статистически значимых различий (p = 0,058, табл. 2), что позволило не разделять пациентов на группы в зависимости от функционального класса.
Таблица / Table 2
Анализ уровня тревожности по шкале HARS в зависимости от ФК ИБС
Analysis of anxiety levels according to the HARS scale depending on the FC of coronary heart disease
Показатель | Категории | Шкала тревожности HARS | p | ||
M ± SD | 95% ДИ | n | |||
ИБС, ФК | ФК I | 24,31 ± 7,52 | 21,45 – 27,17 | 29 | 0,058 |
ФК II | 25,31 ± 7,91 | 22,63 – 27,98 | 46 | ||
ФК III | 28,49 ± 7,63 | 26,08 – 30,89 | 41 | ||
При анализе эффективности применения метода песочной терапии для коррекции повышенной тревожности у пациентов, проживающих в СУСО, установлено статистически значимое снижение уровня тревожности по шкале HARS в экспериментальной группе с 24,57±7,12 баллов исходно до 21,54±8,56 после лечения (p<0,05, табл. 3). При сравнении уровня тревожности по шкале HARS в контрольной группе нами не было выявлено статистически значимых изменений до и после лечения (р≥0,05).
Таблица / Table 3
Динамика уровня тревожности по шкале HARS у пациентов с ИБС
Dynamics of anxiety level according to the HARS scale in patients with coronary heart disease
| Шкала HARS | Шкала GAI-SF | ||||
Исходно | После лечения | p | Исходно | После лечения | p | |
I группа | 24,57±7,12 | 21,54±8,56 | p=0,04* | 3,39±0,76 | 3,05±0,85 | р=0,02* |
II группа | 24,11± 9,24 | 21,32±7,36 | р=0,61 | 3,24±0,92 | 3,21±0,79 | р=0,85 |
Примечание: * — статистически значимый уровень различий при сравнении групп по критерию Стьюдента (p < 0,05).
Note: * — statistically significant level of differences when comparing groups using the Student’s t-test (p < 0.05).
Аналогичная динамика была получена и при оценке тревожности по шкале GAI-SF. В экспериментальной группе уровень тревожности статистически значимо снизился с 3,39±0,76 до 3,05±0,85 (p < 0,05), в контрольной группе исходно составил 3,24±0,92 балла, после лечения — 3,21±0,79 балла (р≥0,05).
Анализ изменения уровня тревожности показал, что в экспериментальной группе наблюдения статистически значимо снизилось количество пациентов с высоким и увеличилось количество пациентов с низким уровнем тревожности (p<0,05, рис. 1).
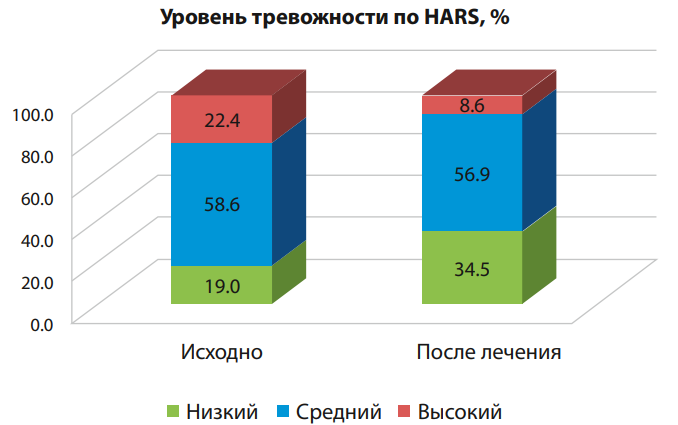
Рисунок 1. Динамика уровня тревожности по шкале HARS у пациентов с ИБС экспериментальной группы
Figure 1. Dynamics of anxiety level according to the HARS scale in patients with coronary heart disease of the experimental group
В контрольной группе статистически значимого изменения уровня тревожности установлено не было (р≥0,05, рис. 2).
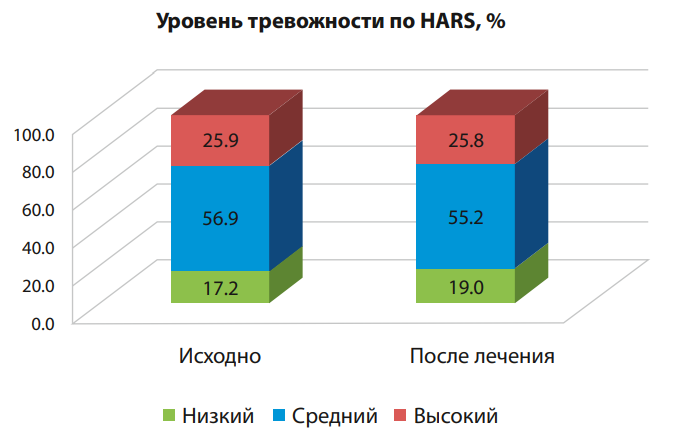
Рисунок 2. Динамика уровня тревожности по шкале HARS у пациентов с ИБС контрольной группы
Figure 2. Dynamics of anxiety level according to the HARS scale in patients with coronary heart disease in the control group
Для оценки влияния повышенной тревожности на уровень приверженности к медикаментозной терапии ИБС был проведён анализ уровня тревожности по шкале HARS в зависимости от приверженности пациентов с ИБС, включённых в исследование. По результатам шкалы комплаентности Мориски-Грин, все пациенты были разделены на приверженных к терапии (0 баллов), недостаточно приверженных к терапии (1 балл), не приверженных к терапии (2 и более баллов).
Установлено, что пациенты с ИБС, не приверженные к медикаментозной терапии, ИБС имели в 1,8 раза, а недостаточно приверженные — в 1,2 раза более высокие показатели уровня тревожности по шкале HARS по сравнению с пациентами, приверженными к терапии, (р<0,001, табл. 4).
Таблица / Table 4
Анализ уровня тревожности по шкале HARS в зависимости от уровня приверженности
Analysis of the level of anxiety according to the HARS scale depending on the level of commitment
Показатель | Категории | Шкала тревожности HARS | p | ||
M ± SD | 95% ДИ | n | |||
Уровень приверженности | Приверженный | 17,42 ± 6,26 | 13,44 – 21,39 | 17 | < 0,001* |
Недостаточно приверженный | 20,83 ± 3,61 | 19,61 – 22,06 | 36 | ||
Неприверженный | 31,47 ± 5,90 | 29,91 – 33,02 | 63 | ||
Примечание: * — различия показателей статистически значимы (p < 0,05).
Note: * — differences in indicators are statistically significant (p < 0.05).
При корреляционном анализе оценки взаимосвязи уровня тревожности по шкале HARS и приверженности к медикаментозной терапии ИБС по шкале комплаентности Мориски-Грин была установлена статистически значимая отрицательная корреляционная взаимосвязь заметной тесноты связи по шкале Чеддока, равная -0,665 (р< 0,001), заметная при оценке взаимосвязи (рис 3).
Наблюдаемая зависимость приверженности от уровня тревожности по шкале HARS описывается уравнением парной линейной регрессии:
YПриверженность = -0,064 × XШкала тревожности HARS + 4,088
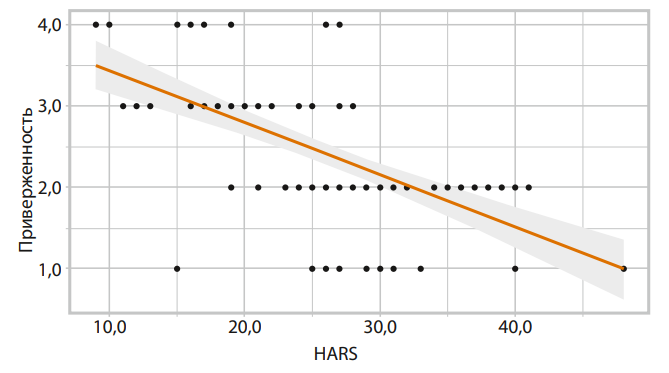
Рисунок 3. График регрессионной функции, характеризующий зависимость приверженности по шкале комплаентности Мориски-Грин от уровня тревожности по шкале HARS
Figure 3. Graph of the regression function characterizing the dependence of commitment according to the Morisky-Green compliance scale on the level of anxiety according to the HARS scale
При увеличении уровня тревожности по шкале HARS на 1 балл следует ожидать уменьшение приверженности к терапии ИБС по шкале комплаентности Мориски-Грин на 0,064 балла. Полученная модель объясняет 37,5% наблюдаемой дисперсии приверженности.
Обсуждение
Клинически значимая тревожность является распространённой проблемой для многих жителей учреждений длительного ухода, имеющих ИБС. Однако проблемы с тревожностью часто остаются невыявленными и не лечатся у этой группы населения [2]. Установлены механизмы, с помощью которых повышенная тревожность может оказывать влияние на развитие сердечно-сосудистых заболеваний и прогрессирование ИБС. К ним относятся активация тромбоцитов, гиперфункция гипоталамо-гипофизарно-надпочечниковой системы (ГГНС), дисфункция эндотелия сосудов [13]. В большинстве случаев ГГНС является нейроэндокринным посредником нейронных и поведенческих реакций на стресс [14]. С точки зрения механизма, кортикотропин-рилизинг-фактор, высвобождаемый гипоталамусом, связывается с рецепторами кортикотропин-рилизинг-фактора 1 и 2 типов в передней доле гипофиза. Это активирует секрецию адренокортикотропного гормона (АКТГ), что приводит к высвобождению глюкокортикоидов (ГК) из коры надпочечников и активирует петлю отрицательной обратной связи с участием кортизола. Нарушение работы этой системы связано с повышенным риском депрессии и тревожных расстройств [15]. Интерлейкин-1 (IL-1) запускает высвобождение кортикотропин-рилизинг-фактора из паравентрикулярного ядра, впоследствии приводя к секреции АКТГ из передней доли гипофиза, который в свою очередь стимулирует секрецию глюкокортикоидов (ГК) из коры надпочечников [16].
Нарушение нейроэндокринной функции приводит к активации гипоталамо-гипофизарно-надпочечниковой системы и симпатической нервной системы, что способствует высвобождению ангиотензина II и ГК. В конечном итоге активация глюкокортикоидных рецепторов (ГР) приводит к повышенному риску развития ИБС. При увеличении кортикотропин-рилизинг-фактора увеличивается частота сердечных сокращений и сердечный выброс, что способствует повышению артериального давления за счёт стимуляции высвобождения норадреналина и адреналина. Появляется всё больше данных, указывающих на то, что кортикотропин-рилизинг-фактор может напрямую регулировать зависимую от оксида азота вазодилатацию и проницаемость сосудов [17]. Симпатическая гиперфункция надпочечников приводит к повышению уровня катехоламинов в плазме крови, сужению сосудов, увеличению частоты сердечных сокращений и активации тромбоцитов [18].
Провоспалительные цитокины, такие как фактор некроза опухоли, IL-1 и IL-6, были признаны основными цитокинами, стимулирующими ГГНС, которые напрямую вызывают выработку кортикотропин-рилизинг-фактора в гипоталамусе [19]. Стимуляция симпатической надпочечниковой системы приводит к ускоренной вазоконстрикции, повышению артериального давления, учащению сердечного ритма и усилению активации тромбоцитов у пациентов с сердечно-сосудистой патологией. Установлена положительная корреляция между повышенным уровнем кортизола в утренней плазме крови и развитием ИБС [20].
Активация ГР оказывает влияние на функцию эндотелия посредством регуляции молекул адгезии, таких как молекула адгезии сосудистых клеток-1 (VCAM-1), молекула межклеточной адгезии-1 (ICAM-1), а также провоспалительных цитокинов и хемокинов, которые приводят к выработке IL-6, IL-8 и моноцитарного хемоаттрактантного белка-1. Кроме того, это влияет на сосудорасширяющий оксид азота и вазоконстрикторы (ангиотензин II или эндотелин 1) [21].
Таким образом, повышенная тревожность, изменяя работу гипоталамо-гипофизарно-надпочечниковой системы, может вызывать повреждение эндотелия и способствовать возникновению и развитию ишемической болезни сердца [21].
Песочная терапия была основана в 1989 г. Дорой М. Калфф [22]. Теоретические модели терапевтического процесса в песочной терапии указывают на то, что этот подход позволяет пациентам выражать эмоциональное содержание, как сознательное, так и бессознательное, чтобы сделать его видимым и доступным для размышления [23]. В процессе преобразования эмоционального содержания в картину на подносе с песком пациенты могут непосредственно изменять и модифицировать свои внутренние мысли и эмоции, перестраивая свой внутренний мир и устанавливая порядок. Процесс песочной терапии характеризуется рядом сеансов, в которых клиент работает над своими психологическими проблемами, создавая серию картинок. Часто в таких процессах определённые элементы и символы появляются повторно на картинках, но их структура меняется в ходе терапии. Поскольку терапия начинается неструктурированным образом, она предоставляет возможности для пациентов освободиться от негативных и подавленных эмоций и выразить их, а также почувствовать себя принятыми в присутствии терапевта [22]. Опыт прикосновения к песку и фигурам во время создания картинки является приятным сенсорным опытом и способствует регрессивным процессам. Игра как естественное явление и часть саморегулирующихся функций психики обладает способностью регулировать неразрешённые конфликты и эмоции и погружать в процесс реструктуризации и реорганизации внутреннего мира. Также для людей с ограниченными физическими возможностями, потерявшими способность пользоваться своим телом, возможно использование приспособлений для песочной терапии [24], что поддерживает способность человека игре и обеспечивает возможность восстановления. Таким образом, процесс песочной игры обеспечивает сознательную личность средствами для решения конфликтов, травм, потерь, а также психическим содержанием, необходимым для дальнейшего развития личности [25].
Эффективность песочной терапии подтверждена нейровизуализирующими исследованиями, показывающими её положительное влияние на функционирование коры и подкорки головного мозга [26—29]. С помощью спектроскопии ближнего инфракрасного диапазона установлено, что песочная терапия способствует динамическому взаимодействию префронтальной и височной областей (лобно-височной сети), что позволяет объяснить, как песочная терапия способствует поиску и переработке воспоминаний с оптимальным уровнем когнитивного контроля [26]. Также обнаружена межмозговая синхронизация между терапевтом и пациентом во время песочной терапии, что, возможно, отражает нейронную основу эмпатии во время сеанса [3]. С помощью магнитно-резонансной спектроскопии и оценки результатов у пациентов с генерализованным тревожным расстройством было обнаружено клиническое улучшение симптомов тревоги, связанное с улучшением функционирования лимбической системы и префронтальной коры головного мозга [27][28].
Полученные нами результаты эффективности применения метода песочной терапии для коррекции повышенной тревожности у пациентов c ИБС, проживающих в СУСО подтверждаются международными клиническими исследованиями. В недавно опубликованном мета-анализе по оценке эффективности песочной терапии [29], в котором изучались эмоциональные и поведенческие результаты лечения детей и взрослых, проанализированы 40 исследований из восьми стран (включая в общей сложности 1284 участника), которые соответствовали стандартам качества и критериям включения. Был установлен статистически значимый эффект песочной терапии (RR= 1,10, p<0,05), который сохранялся при интернализации, экстернализации. Как индивидуальные, так и групповые сеансы песочной терапии были признаны эффективными, причем при индивидуальном лечении эффект был больше, чем при групповом. Также было установлено, что песочная терапия также улучшает результаты, если её добавлять к обычному лечению.
Плохая приверженность к терапии может негативно сказаться на эффективности лечения ИБС и привести к прогрессированию заболевания [30]. Несмотря на существование работ по определению факторов риска снижения приверженности к терапии у пациентов с ИБС, данные о соответствующем влиянии психической патологии и когнитивных нарушений ограничены. В отдельных работах отмечается связь снижения приверженности к терапии с такими личностными чертами, как гнев, тревожность и враждебность, что соответствует данным литературы о негативном влиянии типа личности D на приверженность к терапии у пациентов с ИБС [31]. Полученные нами результаты также подтверждают наличие взаимосвязи между уровнем тревожности и приверженностью к медикаментозной терапии у пациентов с ИБС.
Заключение
Проведённое исследование оценки эффективности применения метода песочной терапии для коррекции повышенной тревожности и влияния на уровень приверженности у пациентов, проживающих в СУСО показало, что использование данного метода в течение 2 месяцев статистически значимо снижает уровень тревожности у пациентов с ИБС. Пациенты с ИБС, не приверженные к медикаментозной терапии, имеют статистически значимо большие показатели уровня тревожности. Установлена статистически значимая отрицательная корреляционная взаимосвязь между уровнем тревожности и приверженностью к медикаментозной терапии у пациентов с ИБС, проживающих в СУСО.
Список литературы
1. Garcia M, Moazzami K, Almuwaqqat Z, Young A, Okoh A, Shah AJ, et al. Psychological Distress and the Risk of Adverse Cardiovascular Outcomes in Patients With Coronary Heart Disease. JACC Adv. 2024;3(2):100794. https://doi.org/10.1016/j.jacadv.2023.100794
2. Pifer MA, Segal DL, Jester DJ, Molinari V. Assessment of Anxiety in Long-Term Care Residents: Issues and Strategies. Int J Aging Hum Dev. 2021;93(3):807-833. https://doi.org/10.1177/0091415020943321
3. Akimoto M, Tanaka T, Ito J, Kubota Y, Seiyama A. Inter-Brain Synchronization During Sandplay Therapy: Individual Analyses. Front Psychol. 2021;12:723211. https://doi.org/10.3389/fpsyg.2021.723211
4. Loscalzo Y. Sandplay Therapy and Active Imagination: What Are the Similarities and Differences? Reflections about Jung's Writings on Active Imagination. Behav Sci (Basel). 2024;14(7):553. https://doi.org/10.3390/bs14070553
5. Li S, Lu Y, Wu J. Sandplay Therapy as a Complementary Treatment for Children with ADHD: A Scoping Review. Issues Ment Health Nurs. 2023;44(9):911-917. https://doi.org/10.1080/01612840.2023.2249990
6. Punnett A, Canfield M. Changes in verbalizations during sandplay: an empirical study. J Anal Psychol. 2020;65(3):497-518. https://doi.org/10.1111/1468-5922.12597
7. Стабильная ишемическая болезнь сердца. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4076.
8. Клинические тесты в гериатрии: Методические рекомендации. Под ред. Ткачевой О.Н. М.: Прометей; 2019.
9. Johnco C, Knight A, Tadic D, Wuthrich VM. Psychometric properties of the Geriatric Anxiety Inventory (GAI) and its short-form (GAI-SF) in a clinical and non-clinical sample of older adults. Int Psychogeriatr. 2015;27(7):1089-1097. https://doi.org/10.1017/S1041610214001586
10. Byrne GJ, Pachana NA. Development and validation of a short form of the Geriatric Anxiety Inventory--the GAI-SF. Int Psychogeriatr. 2011;23(1):125-131. https://doi.org/10.1017/S1041610210001237
11. Dong J, Liu L, Liang Q. Analysis of mental health problems of hospitalized sick adolescents guided by psychology and intervention with sandplay therapy. Curr Psychol. 2024;43:18960–18970. https://doi.org/10.1007/s12144-024-05704-3
12. Morisky DE, Green LW, Levine DM. Concurrent and predictive validity of a self-reported measure of medication adherence. Med Care. 1986;24(1):67-74. https://doi.org/10.1097/00005650-198601000-00007
13. Xu L, Zhai X, Shi D, Zhang Y. Depression and coronary heart disease: mechanisms, interventions, and treatments. Front Psychiatry. 2024;15:1328048. https://doi.org/10.3389/fpsyt.2024.1328048
14. Bao AM, Swaab DF. Corticotropin-releasing hormone and arginine vasopressin in depression focus on the human postmortem hypothalamus. Vitam Horm. 2010;82:339-365. https://doi.org/10.1016/S0083-6729(10)82018-7
15. Kim JS, Kim JH, Eo H, Ju IG, Son SR, Kim JW, et al. Inulae Flos has Anti-Depressive Effects by Suppressing Neuroinflammation and Recovering Dysfunction of HPA-axis. Mol Neurobiol. 2024;61(10):8038-8050. https://doi.org/10.1007/s12035-024-04094-8
16. Suliman I, Almkainzi HA, Alsubaie AM, Alqahtani FN, Alkhudairy FA, Alrodiman O, et al. The Prevalence of Depression in Survivors of Acute Myocardial Infarction and Gender Differences in King Abdulaziz Medical City (KAMC), Riyadh. Cureus. 2024;16(4):e57456. https://doi.org/10.7759/cureus.57456
17. Iob E, Kirschbaum C, Steptoe A. Persistent depressive symptoms, HPA-axis hyperactivity, and inflammation: the role of cognitive-affective and somatic symptoms. Mol Psychiatry. 2020;25(5):1130-1140. https://doi.org/10.1038/s41380-019-0501-6
18. Cherian K, Schatzberg AF, Keller J. HPA axis in psychotic major depression and schizophrenia spectrum disorders: Cortisol, clinical symptomatology, and cognition. Schizophr Res. 2019;213:72-79. https://doi.org/10.1016/j.schres.2019.07.003
19. Varghese TP, Chand S, Varghese NM, Singh R, Yadav SK. Interplay of inflammatory biomarkers in heart disease patients with depressive symptoms: An update. Curr Probl Cardiol. 2024;49(3):102352. https://doi.org/10.1016/j.cpcardiol.2023.102352
20. Crawford AA, Soderberg S, Kirschbaum C, Murphy L, Eliasson M, Ebrahim S, et al. Morning plasma cortisol as a cardiovascular risk factor: findings from prospective cohort and Mendelian randomization studies. Eur J Endocrinol. 2019;181(4):429-438. https://doi.org/10.1530/EJE-19-0161
21. Feng LS, Wang YM, Liu H, Ning B, Yu HB, Li SL, et al. Hyperactivity in the Hypothalamic-Pituitary-Adrenal Axis: An Invisible Killer for Anxiety and/or Depression in Coronary Artherosclerotic Heart Disease. J Integr Neurosci. 2024;23(12):222. https://doi.org/10.31083/j.jin2312222
22. Kalff DM. The sandplay: A contribution from C. G. Jung's point of view on child therapy. Journal of Sandplay Therapy. 2007;16(2);49–53. https://doi.org/10.61711/jst.2007.16.2.592.
23. Roesler C. Sandplay therapy: An overview of theory, applications and evidence base. The Artin Psychotherapy. 2019;64;84-94. https://doi.org/10.1016/jaip2019.04.001
24. Dermott DM. Assisted sandplay therapy: Bridging the way for persons with physical disabilities. Journal of Sandplay Therapy. 2024;33(1);45–56. https://doi.org/10.61711/jst.2024.33.1.645.
25. Freedle LR. Sandplay therapy: An evidence-based treatment. Journal of Sandplay Therapy. 2022;31(1):129–136. https://doi.org/10.61711/jst.2022.31.1.898
26. Akimoto M, Furukawa K, Ito J. Exploring the sandplayer’s brain: A single case study. Archives of Sandplay Therapy. 2018;30(3):73-84.
27. Foo M, Freedle L, Sani R, Fonda G. The Effect of Sandplay Therapy on the Thalamus in the Treatment of Generalized Anxiety Disorder: A Case Report. International Journal of Play Therapy. 2020;29(4):191-200. https://doi.org/10.1037/pla0000137
28. Foo M, Pratiwi A. The effectiveness of sandplay therapy in treating patients with generalized anxiety disorder with childhood trauma using magnetic resonance spectroscopy to examine choline level in the dorsolateral prefrontal cortex and centrum semiovale. International Journal of Play Therapy. 2021;30(3):177-186. https://doi.org/10.1037/pla0000162
29. Wiersma JK, Freedle LR, McRoberts R, Solberg KB. A meta-analysis of sandplay therapy treatment outcomes. International Journal of Play Therapy. 2022;31(4):197–215. https://doi.org/10.1037/pla0000180
30. Лукина Ю.В., Кутишенко Н.П., Марцевич С.Ю., Драпкина О.М. Проблемные вопросы и разработка классификаций основных параметров качества и приверженности фармакотерапии. Часть I: приверженность пациентов к лечению. Кардиоваскулярная терапия и профилактика. 2023;22(6):3603.
31. Волель Б.А., Трошина Д.В., Фомичева А.В., Гогниева Д.Г., Богданова Р.С., Копылов Ф.Ю., и др. Влияние психических расстройств на приверженность терапии у пациентов с фибрилляцией предсердий. Кардиология и сердечно-сосудистая хирургия. 2020;13(6):530‑538.
Об авторах
С. Е. ГловаРоссия
Глова Светлана Евгеньевна, к.м.н., доцент кафедры терапии
Ростов-на-Дону
О. А. Юдина
Россия
Юдина Ольга Александровна, заместитель директора по медицинской части
Ростов-на-Дону
Л. В. Бучукури
Россия
Бучукури Лариса Васильевна, директор
Ростов-на-Дону
Л. А. Хаишева
Россия
Хаишева Лариса Анатольевна, д.м.н., заведующий кафедрой терапии
Ростов-на-Дону
Рецензия
Для цитирования:
Глова С.Е., Юдина О.А., Бучукури Л.В., Хаишева Л.А. Возможности коррекции повышенной тревожности методом песочной терапии у пациентов с ишемической болезнью сердца, проживающих в стационарных учреждениях социального обслуживания. Южно-Российский журнал терапевтической практики. 2025;6(2):15-23. https://doi.org/10.21886/2712-8156-2025-6-2-15-23
For citation:
Glova S.E., Yudina O.A., Buchukuri L.V., Khaisheva L.A. Possibilities of correcting increased anxiety by sandplay therapy in patients with ischemic heart disease living in inpatient social service institutions. South Russian Journal of Therapeutic Practice. 2025;6(2):15-23. (In Russ.) https://doi.org/10.21886/2712-8156-2025-6-2-15-23
JATS XML


























