Перейти к:
Роль нейроваскулярного конфликта в патогенезе классической невралгии тройничного нерва и динамика подходов к его визуализации
https://doi.org/10.21886/2712-8156-2021-2-1-24-31
Аннотация
В тематическом обзоре представлены и проанализированы различные точки зрения на служащие фундаментом в развитии классической невралгии тройничного нерва топографо-атомические особенности расположения корешка тройничного нерва и верхней мозжечковой артерии. Рассматриваются диагностические возможности магнитнорезонансной томографии в распознавании нейроваскулярного конфликта как основополагающего элемента заболевания. В хронологическом аспекте освещён поиск диагностических критериев, отличающих нейроваскулярный конфликт от нейроваскулярного контакта благодаря совершенствованию выполнения МРТ и новым техническим возможностям её трактовки. Описаны возможности мультиспиральной рентгенкомпьютерной ангиографии в режиме 3D как альтернативный метод диагностики нейроваскулярного конфликта.
Ключевые слова
Для цитирования:
Балязина Е.В., Евусяк О.М., Балязин В.А., Кадян Н.Г. Роль нейроваскулярного конфликта в патогенезе классической невралгии тройничного нерва и динамика подходов к его визуализации. Южно-Российский журнал терапевтической практики. 2021;2(1):24-31. https://doi.org/10.21886/2712-8156-2021-2-1-24-31
For citation:
Baliazina E.V., Evusyak O.M., Baliazin V.A., Kadyan N.G. The role of neurovascular conflict in the pathogenesis of classical trigeminal neuralgia and the dynamics of approaches to its visualization. South Russian Journal of Therapeutic Practice. 2021;2(1):24-31. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-1-24-31
Первым нейрохирургом, который еще в 1934 г. заметил необычный контакт корешка тройчниного нерва (КТН) и верхней мозжечковой артерии, был Вальтер Денди. При выполнении разработанной им операции пересечения КТН в области мосто-мозжечкового угла у больных тригеминальной невралгией (ТН) он заметил тесное прилежание верхней мозжечковой артерии к корешку, но не связал эту аномалию сосуда с заболеванием (W. Dandy, 1934) [1]. Четверть века спустя, в 1959 г., W. Gardner и V. Miclos [2] выполнили первую декомпрессию КТН. Тремя годами позже W. Gardner (1962) [3] сформулировал теорию о сосудистой компрессии КТН в области мосто-мозжечкового угла как причины пароксизмального болевого синдрома лица. Пришедшие в нейрохирургическую практику операционные микроскопы позволили американскому нейрохирургу Питеру Джаннетта (Jannetta P.J., 1967) [4] детально рассмотреть нейроваскулярный конфликт (НВК) и стать убежденным сторонником теории нейроваскулярного конфликта как основы ТН. Им создана методика декомпрессии КТН с использованием синтетического губчатого протеза [5, 6], которая в дальнейшем стала носить его имя.
В отличие от деструктивных операций, широко использовавшихся в то время во всех клиниках мира, микроваскулярная декомпрессия (МВД) имела ряд неоспоримых преимуществ: боли исчезали сразу после операции, при этом не возникали нарушения чувствительности на лице и не страдали жевательные мышцы. Все это способствовало широкому международному распространению этой операции [7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17].
С накоплением опыта применения МВД росло число публикаций, освещающих прогрессивное увеличение послеоперационных рецидивов заболевания [10, 14, 18, 19]. Цифры рецидивов заболевания колебались в широком диапазоне, достигая 30% за период 10-летнего наблюдения [19, 20]. Рассматривались различные причины возникновения рецидивов классической невралгии тройничного нерва (КНТН). Так, Sun T. (1994) [14] и Lee S.H. (2000) [18] обнаружили, что обострение возникало у пациентов, имевших НВК с венозным сосудом. В дальнейшем последовали работы других авторов, где было подтверждено мнение об «обречённости» больных с венозной компрессией. Нейрохирурги, имеющие большой опыт в применении МВД КТН, подтверждают главенствующую роль НВК в патогенезе тригеминальной невралгии и отмечают более благоприятные отдаленные результаты при проведении хирургического вмешательства у пациентов с артериальной компрессией, чем при венозной [13, 14, 20, 21, 22].
Внимание к изучению топографо-анатомических особенностей взаиморасположения верхней мозжечковой артерии (ВМА) и КТН усилилось в связи с широким распространением использования МВД в последние десятилетия [23, 24, 25, 26, 27, 28, 29, 30, 31]. Hardy F. et al. [25] изучили 50 анатомических препаратов, на половине из которых присутствовал контакт КТН с артериальным сосудом, при этом только часть из них находилась в воротной зоне. НВК при этом выявлен у 34 из 40 пациентов (85%), наблюдалась компрессия КТН, при которой артерия пересекает не менее 50% толщины КТН, чего не обнаружено ни на одном анатомическом препарате. Контакт КТН и ВМА обнаружены Haines S.J. et al. (1979, 1980) у здоровых лиц в 35% случаев [23, 24], а Hamlin P.J. (1997) [26] — в 16% случаев, у 26% отмечалось очень близкое их взаиморасположение. Балязиной Е.В. (2009) [29] при изучении 50 трупов лиц, не страдавших КНТН (100 препаратов КТН с ВМА), в 32% случаев обнаружен контакт передне-верхней поверхности КТН и ВМА, в 12% случаев — близкое расположение артерии у корешка (менее 2 мм). Ни в одном из 100 препаратов вершина петли ВМА не пересекала КТН в вертикальном направлении и в 56% наблюдений располагалась между наметом мозжечка и КТН. Guclu B. et al. (2011) [28], изучая морфологию корешка тройничного нерва на 6 трупах, подтвердили роль демиелинизации в переходной зоне от периферического миелина в центральный в патогенезе КНТН.
В первом десятилетии текущего века серьезная дискуссия на страницах зарубежной печати развернулась по вопросу о том, кому показана микроваскулярная декомпрессия. Так, Burchiel K.J. (2003) [31], а затем Eller J.L. et al. (2004) [32] клинически выделяют НТН 1 типа, для которой характерны приступы острой стреляющей боли, наличие триггерных точек и отсутствие эффекта от проводимой медикаментозной терапии, и НТН 2 типа, которая характеризуется постоянным болевым синдромом в зоне иннервации ТН. Уточняя клинические характеристики НТН, Miller J.P. et al. (2009) [33] в качестве облигатного признака для НТН 1 типа добавляют рефрактерный (безболевой) период, а также подчеркивают более частую встречаемость конфликта с артериальным сосудом (в 2 раза) и более редкую — с венозным (в 5 раз, чем при НТН 2 типа). Оценка отдаленных результатов выявила более плохой прогноз течения заболевания и частое количество рецидивов у пациентов с НТН 2 типа. Heros R.S. (2009) [34] считает, что выполнение МВД показано пациентам, имеющим клинику КНТН, а также подтвержденный при нейровизуализации нейроваскулярным конфликт. Одновременно с этим его интересует вопрос, помешает ли Burchiel K.J. выполнить МВД больному с НТН 2 типа, имеющему постоянный болевой синдром и при отсутствии НВК по методам нейровизуализации. Heros R.S. полагает, что «доктор Burchiel K.J., уважаемый лидер в своей области, не позволит открыть ящик Пандоры, который может подстрекать менее опытных нейрохирургов оперировать больных с лицевыми болями в зоне ТН, у которых нет типичных признаков КНТН».
Miller J. P. et. al. (2009) [33] в ответ на эти замечания предложили разделить НТН 2 типа на два подтипа — 2а (болевой синдром дебютирует с пароксизмальных стреляющим болей, а затем трансформируется в постоянную боль) и 2б (прозопалгия изначально носит постоянный характер). Точку в этом споре поставила принятая в 2018 г. международная классификация головной боли 3-го пересмотра [34], в которой дано чёткое определение классической тригеминальной невралгии. Основными критериями диагностики, позволяющими рекомендовать пациенту выполнение МВД являются типичная клиническая картина КНТН, отсутствие эффекта от адекватной консервативной терапии, а также подтверждение НВК при помощи методов нейровизуализации [35, 36].
В начале 90-х годов предыдущего столетия в мире работало около 6000 аппаратов магнитно-резонансной томографии (МРТ), большая их часть приходилась на Японию и США. Первые оптимистичные сообщения о диагностике нейроваскулярного конфликта с помощью МРТ приходятся на конец XX в. Так, Meaney J.F. et al. (1994) [37] обнаружили контакт ВМА и КТН у 70% больных до контрастного усиления, у 15% — после. При этом у 10% пациентов обнаружен контакт КТН с двумя сосудами. Кроме этого, у 30% пациентов выявлена деформация КТН. В контрольной группе, состоявшей из лиц без клиники КНТН, контакт обнаружен только в 8% случаев, не было обнаружено деформаций КТ или контакта с двумя сосудами. Масштабные поиски диагностических критериев нейроваскулярного конфликта у больных КНТН с помощью МРТ приходятся на первое десятилетие XXI в. С накоплением опыта использования МРТ для диагностики нейроваскулярного конфликта появилось много работ, ставящих под сомнение не только возможности МРТ в распознавании нейроваскулярного конфликта, но и тот факт, что нейроваскулярный конфликт находится в причинной связи с возникновением КНТН.
Изучая взаимоотношение КТН и смежных сосудов на 48 людях без клиники КНТН при помощи 1,5 Т МРТ, Kress B. et al. (2006) [38] обнаружили нейроваскулярный контакт у 73% обследованных, из них у 61% — с артерией, у 27% — с веной и пришли к выводу о том, что контакт сосудов с КТН является вариантом нормы и не свидетельствует о наличии НВК. Monstad P. (2007) [39] в своём исследовании выявил контакт сосуда и КНТ при помощи МРТ у большинства здоровых лиц, а Benes L. et al. (2005) [40] вовсе высказали недоверие высокопольной МРТ как методу, способному достоверно визуализировать компрессию КТН у пациентов с НТН. Miller J.P. et al. (2009) [33] и Peker S., et al. (2009) [41] использовали 3Т МРТ в качестве метода нейровизулизации и выявили НВК как у здоровых лиц, так и у большинства больных НТН, что было подтверждено далее при МВД. Это исследование позволило утверждать, что контакт КТН и сосуда не всегда приводит к болевому синдрому, хотя у пациентов с НТН конфликт более выражен. В это же время стали появляться работы, упоминающие долихоэктазию сосудов вертебро-базилярного бассейна как важный фактор, ведущий к формированию НВК [42, 43, 44].
Существование таких неоднозначных выводов связано, вероятно, с неодинаковым пониманием природы таких терминов, как нейроваскулярный конфликт, сосудистый контакт, сосудистая компрессия. Во втором десятилетии XXI века внимание исследователей сосредоточилось на проблеме разработки новых методик выполнения МРТ, а также на усовершенствовании интерпретации результатов исследования [45, 46, 47, 48, 49, 50, 51, 52, 53,54, 55, 56, 57]. Antoniani G. et al. (2014) [49], сравнивая МРТ 24 больных, страдавших НТН, и 24 здоровых лиц, обнаружили нейроваскулярный контакт у 76% больных и 17% здоровых, а анатомические изменения в корешке — у 52% больных и у 9% здоровых и отметили, что когда контакт сосуда с нервом сочетается с анатомическими изменениями, то вероятность конфликта высока. В то же время, Lin W. et al (2014) [51] не обнаружили при МРТ исследовании у здоровых лиц, имевших нейроваскулярный контакт, ни демиелинизации, ни повреждения волокон КТН. Maarbjerg S. et al. (2015) [51] провели изучение результатов МРТ у 135 пациентов КНТН, и обнаружили контакт артерии с КТН как на больной (89%), так и на бессимптомной (78%) сторонах. 70% пациентов имели двусторонний нейроваскулярный контакт. Частота нейроваскулярного контакта в зоне входа КТН в мост была одинаковой на симптоматической и бессимптомной сторонах (81% против 70%, р = 0,100), но нейроваскулярный контакт с участием артерии был более распространён на симптоматической стороне. Авторы вводят новое понятие нейроваскулярного конфликта, называя его «тяжелый нейроваскулярный контакт». К сожалению, чёткого определения отличия лёгкого нейроваскулярного контакта от тяжелого с достоверными отличительными признаками в статье не приводится. В заключении авторы делают вывод, что нейроваскулярный контакт является распространенным нейроанатомическим вариантом, при этом тяжёлый нейроваскулярный контакт встречался в их наблюдениях гораздо чаще на симптоматической стороне, чем на бессимптомной. Важным выводом, сделанным авторами, является тот факт, что под тяжёлым нейроваскулярным контактом они понимают контакт, вызванный именно артериями, расположенными в зоне входа КТН.
Masuda Y. et al. (2015) [49] с целью диагностики нейроваскулярного конфликта у больных НТН использовали МРТ цистернографию с субтракционной обработкой изображений. Указанные лучевыми специалистами повреждающие сосуды и места их конфликта с корешком были подтверждены интраоперационными находками. На рис. 1 проиллюстрированы возможности описанного авторами метода диагностики.

Рисунок 1. Стрелки указывают места нейроваскулярных конфликтов, а на рисунке В видно, что конфликтующим сосудом является каменистая вена (Masuda Y. et al., 2015).
Alper J. et al. (2016) [53] отмечали уменьшение объёма и площади поперечного сечения КТН, снижение фракционной анизотропии и увеличение кажущегося коэффициента диффузии на пораженной стороне у пациентов НТН по сравнению с незатронутой стороной, а также у пациентов по сравнению с контролем. Donahue J.H. et al. (2017) [54] подчёркивают важность визуализации нейроваскулярного конфликта при выборе метода лечения (медикаментозной терапии, стереотаксической радиохирургии, инъекции ботулотоксина или хирургической микроваскулярной декомпрессии). Очень ценная информация для понимания патогенеза классической невралгии получена Zhang Y. et al. (2018) [56] благодаря использованию диффузионно-тензорной визуализации. Ими показана возможность неинвазивно выявлять микроструктурные аномалии тройничного нерва, лежащие в основе КНТН in vivo, а полученные диффузно-тензорные изменения дают возможность рассматривать их как суррогатные маркеры аксонального и миелинового состояний для мониторинга пациентов. Yao S. et al. (2018) [58] сообщают о том, что использование 7,0 Теслового МРТ даёт гораздо более четкое представление о судах в области мосто-мозжечковой цистерны. Shapey J. et al. (2019) [59] рассматривают применение диффузионной МРТ и трактографии черепных нервов в задней ямке как перспективный метод диагностики нейроваскулярного конфликта и призывают изучать новые возможности использования ДМРТ. Все приведённое выше свидетельствует о том, что поиски надежных критериев отграничения нейроваскулярного контакта как варианта взаимоотношения КТН и ВМА от нейроваскулярного конфликта как причины КНТН продолжаются и в настоящее время. Проблема не теряет своей актуальности.
Актуальным остается и вопрос диагностики нейроваскулярного конфликта у больных, которым противопоказана МРТ. Так, Gospodarev V. et al. (2018) [60] предлагают применять в этих случаях рентген-компьютерную цистернографию. Надежным методом визуализации нейроваскулярного конфликта может служить мультиспиральная ренген-компьютерная ангиография (МСРКТ АГ) в режиме 3D (Балязина Е.В., (2010) [60, 61, 62. 63. 64, 65]. В отличие от МРТ МСРКТ АГ не обеспечивает нейровизуализацию корешка ТН, но позволяет проследить ход артерий не только в трёх плоскостях, но и в режиме 3D. Суждение о конфликте или контакте строится на основании взаимоотношения заднего края мекелевой ямки, являющейся ложем для КТН, с ВМА. НВК первого типа был обнаружен у 145 (65%) из 223 прооперированных пациентов и характеризовался расположением вершины петли ВМА ниже уровня КТН, то есть ниже заднего края мекелевой ямки.
Учитывая топографо-анатомические особенности, характерные для НВК 1 типа, можно уверенно говорить о его причастности к КНТН, что подтверждается отсутствием подобного взаимоотношения ВМА и КТН на 100 анатомических препаратах (100%) лиц, не страдавших КНТН, а также у пациентов с НТН на безболевой стороне. Такая аномальная долихоэктазия ВМА может быть врождённым вариантом анатомии артерии, но для выявления данного варианта топографии ВМА с КТН у лиц без КНТН при учёте частоты возникновения НТН (5 случаев на 100 тысяч населения) могут потребоваться десятки тысяч секционных исследований.
НВК 2 типа был обнаружен у 78 (35%) пациентов с КНТН и характеризовался расположением вершины петли ВМА у верхнего края КТН, контактируя с его передне-верхней поверхностью, что подтверждалось интраоперационно. На МСРКТ вершина петли ВМА находилась непосредственно над задним краем мекелевой ямки. Учитывая толщину КТН в данной локализации (от 3 до 4,5 мм, в среднем — 3,92 мм), НВК может быть заподозрен при положении вершины петли, при котором расстояние от неё до края мекелевой ямки равно менее половины диаметра КТН (2 мм). Однако подобное расположение вершины петли ВМА к краю мекелевой ямки наблюдается и на бессимптомной стороне, что не позволяет с уверенностью отличить контакт от конфликта.

Рисунок 2. Нейроваскулярный конфликт первого типа: а) схема конфликта; б) мультиспиральная рентген-компьютерная ангиография в режиме 3D, фронтальная проекция; в) поворот влево на 30°; г) итраоперационная регистрация нейроваскулярного конфликта.
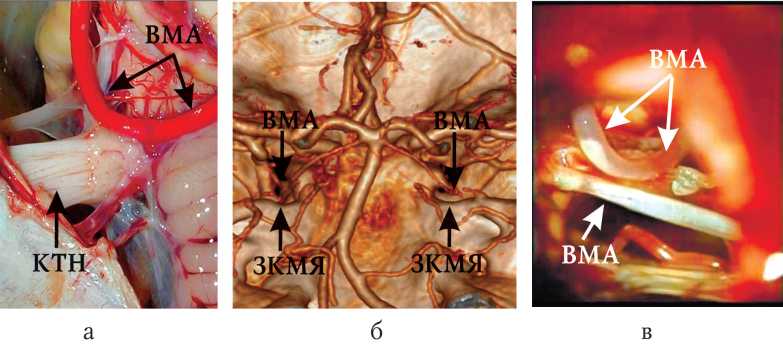
Рисунок 3. Нейроваскулярный конфликт второго типа: а) анатомический препарат нейроваскулярного контакта; б) мультиспиральная рентген-компьютерная ангиография в режиме 3D, фронтальная проекция; в) итраоперационная регистрация нейроваскулярного конфликта.
Заключение
Подводя итоги краткого обзора, посвящённого диагностике нейроваскулярного конфликта у больных КНТН, можно сделать вывод, что при МРТ-исследовании достоверных критериев отличия нейроваскулярного конфликта от нейроваскулярного контакта, кроме смещения или деформации корешка, наблюдаемых редко, пока не установлено. Использование МСРКТ АГ в режиме 3D позволяет с уверенностью диагностировать нейроваскулярный конфликт лишь у 65% больных благодаря выявлению долихоэктазии ВМА как аномалии развития сосуда, не встречающейся у здоровых лиц и на бессимптомной стороне у больных НТН. Необходимость поиска как новых методов диагностики, так и совершенствования современных диагностических методов исследования сохраняет свою актуальность и в настоящее время.
Список литературы
1. Dandy W.E. Concerning the cause of trigeminal neuralgia. Amer J Surg. 1934;24:447-455. doi: 10.1016/S0002-9610(34)90403-7
2. Gardner W.J., Miklos M.V. Response of trigeminal neuralgia to decompression of sensory root; discussion of cause of trigeminal neuralgia. J Am Med Assoc. 1959;170(15):1773-6. doi: 10.1001/jama.1959.03010150017004.
3. Gardner WJ. Concerning the mechanism of trigeminal neuralgia and hemifacial spasm. J Neurosurg. 1962;19(6):947-958. doi: 10.3171/jns.1962.19.11.0947
4. Jannetta PJ. Arterial compression of the trigeminal nerve at the pons in patients with trigeminal neuralgia. J Neurosurg. 1967;26:159-162. doi: 10.3171/jns.1967.26.1part2.0159
5. Jannetta PJ. Neurovascular compression in cranial nervi and systemic disease. Ann Surg. 1980;192(4):518-525. doi: 10.1097/00000658-198010000-00010
6. Jannetta PJ. Microvascular decompression of the trigeminal nerve root entry zone: theoretical considerations, operative anatomy, surgical techniques, and results. In: Trigeminal neuralgia. R.I. Rovit, R. Murali, PJ. Jannetta, eds. Baltimore, Md: Williams&Wilkins;1990:201-222. ISBN 0683073931
7. Оглезнев К.Я., Григорян Ю.А., Шестрериков С.А. Патофизиологические механизмы возникновения и методы лечения лицевых болей. Новосибирск; Наука, 1990:190. ISBN 5-02-029226-5.
8. Ashkan K., Marsh H. Microvascular decompression for trigeminal neuralgia in the elderly: a review of the safety and efficacy. Neurosurgery. 2004;55(4):840-884. doi: 10.1227/01.neu.0000137660.06337.c5
9. Broggi G., Ferroli P., Franzini A., Servello D., Dones I. Microvascular decompression for trigeminal neuralgia: comments on a series of 250 cases, including 10 patients with multiple sclerosis. J Neurol Neurosurg Psychiatry. 2000;68(1):59-64. doi: 10.1136/jnnp.68.1.59
10. Broggi G., Ferroli P., Franzini A., Nazzi V., Farina L., La Mantia L. et al. Operative findings and outcomes of microvascular decompression for trigeminal neuralgia in 35 patients affected by multiple sclerosis. Neurosurgery. 2004;55(4):830-8. PMID: 15458591.
11. Gandolfi A., Salvinelli F., Greco F., Casale M., D'Ascanio L. Microvascular decompression for trigeminal neuralgia: a simple and effective transposition method using synthetic adhesive. Clin Neurol Neurosurg. 2005;107(5):439-40. doi: 10.1016/j.clineuro.2004.09.023
12. Mendoza N., Illingworth R.D. Trigeminal neuralgia treated by microvascular decompression: a long-term follow-up study. Br J Neurosurg. 1995;9(1):13-9. PMID: 7786420.
13. Sun S.Y., Yin J.Z., Qiu L.L. Microvascular decompression for trigeminal neuralgia. Chin Med J (Engl). 1994;107(4):286-8. PMID: 8088197.
14. Sun T., Saito S., Nakai O., Ando T. Long-term results of microvascular decompression for trigeminal neuralgia with reference to probability of recurrence. Acta Neurochir (Wien). 1994;126(2-4):144-8. doi: 10.1007/BF01476425
15. Tashiro H., Kondo A., Aoyama I., Nin K., Shimotake K., Nishioka T. et al. Trigeminal neuralgia caused by compression from arteries transfixing the nerve. Report of three cases. J Neuro-surg. 1991;75(5):783-6. doi: 10.3171/jns.1991.75.5.0783
16. Weidmann M.J. Trigeminal neuralgia. Surgical treatment by microvascular decompression of the trigeminal nerve root. Med J Aust. 1979;2(12):628-30. PMID: 537548.
17. Zakrzewska J.M., Coakham H.B. Microvascular decompression for trigeminal neuralgia: update. Curr Opin Neurol. 2012;25(3):296-301. doi: 10.1097/WCO.0b013e328352c465.
18. Lee S.H., Levy E.I., Scarrow A.M., Kassam A., Jannetta PJ. Recurrent trigeminal neuralgia attributable to veins after microvascular decompression. Neurosurgery. 2000;46(2):356-61. doi: 10.1097/00006123-200002000-00019
19. Barker F.G. 2nd, Jannetta P.J., Babu R.P., Pomonis S., Bis-sonette D.J., Jho H.D. Long-term outcome after operation for trigeminal neuralgia in patients with posterior fossa tumors. J Neurosurg. 1996;84(5):818-25. doi: 10.3171/jns.1996.84.5.0818
20. Barker F.G. 2nd, Jannetta PJ., Bissonette D.J., Larkins M.V., Jho H.D. The long-term outcome of microvascular decompression for trigeminal neuralgia. N EnglJ Med. 1996;334(17):1077-83. doi: 10.1056/NEJM199604253341701
21. Kitt C.A., Gruber K., Davis M., Woolf C.J., Levine J.D. Trigeminal neuralgia: opportunities for research and treatment. Pain. 2000;85(1-2):3-7. doi: 10.1016/s0304-3959(99)00310-3
22. Kuncz A., Mencser Z., Voros E., Bodosi M. Management of trigeminal neuralgia by microvascular decompression. Orv Hetil. 1997;138(33):2051-5. PMID: 9304096.
23. Haines S.J., Martinez A.J., Jannetta PJ. Arterial cross compression of the trigeminal nerve at the pons in trigeminal neuralgia. Case report with autopsy findings. J Neurosurg. 1979;50(2):257-9. doi: 10.3171/jns.1979.50.2.0257
24. Haines S.J., Jannetta P.J., Zorub D.S. Microvascular relations of the trigeminal nerve. An anatomical study with clinical correlation. J Neurosurg. 1980;52(3):381-6. doi: 10.3171/jns.1980.52.3.0381
25. Hardy D.G., Peace D.A., Rhoton A.L. Jr. Microsurgical anatomy of the superior cerebellar artery. Neurosurgery. 1980;6(1):10-28. doi: 10.1227/00006123-198001000-00002
26. Hamlyn PJ. Neurovascular relationships in the posterior cranial fossa, with special reference to trigeminal neuralgia. 2. Neurovascular compression of the trigeminal nerve in cadaveric controls and patients with trigeminal neuralgia: quantification and influence of method. Clin Anat. 1997;10(6):380-8. doi: 10.1002/(SICI)1098-2353(1997)10:6<380::AID-CA2>3.0.C0;2-T.
27. Rhoton A.L. Jr. The cerebellar arteries. Neurosurgery. 2000;47(3 Suppl):S29-68. doi: 10.1097/00006123-200009001-00010
28. Guclu B., Sindou M., Meyronet D., Streichenberger N., Simon E., Mertens P. Cranial nerve vascular compression syndromes of the trigeminal, facial and vago-glossopharyngeal nerves: comparative anatomical study of the central myelin portion and transitional zone; correlations with incidences of corresponding hyperactive dysfunctional syndromes. Acta Neuro-chir(Wien). 2011;153(12):2365-75. doi: 10.1007/s00701-011-1168-1
29. Балязина Е.В. Топографоанатомические взаимоотношения ствола тойничного нерва с верхней мозжечковой артерией у больных с невралгией тройничного нерва. Морфология. 2009;136(5):27-31. eLIBRARY ID: 13001713
30. Sindou M. Trigeminal neuralgia: a plea for microvascular decompression as the first surgical option. Anatomy should prevail. Acta Neurochir (Wien). 2010;152(2):361-4. doi: 10.1007/s00701-009-0506-z
31. Burchiel K.J. A new classification for facial pain. Neurosurgery. 2003;53(5):1164-6. doi: 10.1227/01.neu.0000088806.11659.d8
32. Eller J.L., Raslan A.M., Burchiel K.J. Trigeminal neuralgia: definition and classification. Neurosurg Focus. 2005;18(5):E3. doi: 10.3171/foc.2005.18.5.4
33. Miller J.P., Acar F., Burchiel K.J. Classification of trigeminal neuralgia: clinical, therapeutic, and prognostic implications in a series of 144 patients undergoing microvascular decompression. J Neurosurg. 2009;111(6):1231-4. doi: 10.3171/2008.6.17604
34. Headache Classification Committee of the International Headache Society (IHS) The International Classification of Headache Disorders, 3rd edition. Cephalalgia. 2018;38(1):1-211. doi: 10.1177/0333102417738202.
35. Heros R.C. Results of microvascular decompression for trigeminal neuralgia. J Neurosurg. 2009;110(4):617-8. doi: 10.3171/2008.10.0800243
36. Sarsam Z., Garcia-Finana M., Nurmikko T.J., Varma T.R., Eldridge P. The long-term outcome of microvascular decompression for trigeminal neuralgia. Br J Neurosurg. 2010;24(1):18-25. doi: 10.3109/02688690903370289
37. Meaney J.F., Miles J.B., Nixon T.E., Whitehouse G.H., Ballantyne E.S., Eldridge P.R. Vascular contact with the fifth cranial nerve at the pons in patients with trigeminal neuralgia: detection with 3D FISP imaging. AJR Am J Roentgenol. 1994;163 (6):1447-52. doi: 10.2214/ajr.163.6.7992745
38. Kress B., Schindler M., Rasche D., Hahnel S., Tronnier V., Sartor K. Trigeminal neuralgia: how often are trigeminal nerve-vessel contacts found by MRI in normal volunteers. Rofo. 2006;178(3):313-5. doi: 10.1055/s-2005-858959.
39. Monstad P. Microvascular decompression as a treatment for cranial nerve hyperactive dysfunction--a critical view. Acta Neurol Scand Suppl. 2007;187:30-3. doi: 10.1111/j.1600-0404.2007.00857.x
40. Benes L, Shiratori K, Gurschi M, Sure U, Tirakotai W, Krischek B, et al. Is preoperative high-resolution magnetic resonance imaging accurate in predicting neurovascular compression in patients with trigeminal neuralgia? A single-blind study. Neurosurg Rev. 2005;28(2):131-6. doi: 10.1007/s10143-004-0372-3.
41. Peker S., Dinner A., Necmettin Pamir M. Vascular compression of the trigeminal nerve is a frequent finding in asymptomatic individuals: 3-T MR imaging of 200 trigeminal nerves using 3D CISS sequences. Acta Neurochir (Wien). 2009;151(9):1081-8. doi: 10.1007/s00701-009-0329
42. Kraemer J.L., Pereira Filho Ade A., David Gd., Faria Mde B. Vertebrobasilar dolichoectasia as a cause of trigeminal neuralgia: the role of microvascular decompression. Case report. Arq Neuropsiquiatr. 2006;64(1):128-31. doi: 10.1590/s0004-282x2006000100027.
43. Klun B., Prestor B. Microvascular relations of the trigeminal nerve: an anatomical study. Neurosurgery. 1986;19(4):535-9. doi: 10.1227/00006123-198610000-00007
44. Li S.T., Pan Q., Liu N., Shen F., Liu Z., Guan Y. Trigeminal neuralgia: what are the important factors for good operative outcomes with microvascular decompression. Surg Neurol. 2004; 62 (5):400-4. doi: 10.1016/j.surneu.2004.02.028
45. Lorenzoni J.G., Massager N., David P., Devriendt D., Desmedt F., Brotchi J. et al. Neurovascular compression anatomy and pain outcome in patients with classic trigeminal neuralgia treated by radiosurgery. Neurosurgery. 2008;62(2):368-75. doi: 10.1227/01.neu.0000316003.80893.81
46. Kuncz A., Voros E., Barzo P., Tajti J, .Milassin P., Bodosi M. Az The role of MR angiography in predicting operative results of microvascular decompression in patients with trigeminal neuralgia. Orv Hetil. 2005;146(51):2595-602. PMID: 16468614.
47. Lang E., Naraghi R., Tanrikulu L., Hastreiter P., Fahlbusch R., Neundorfer B. et al. Neurovascular relationship at the trigeminal root entry zone in persistent idiopathic facial pain: findings from MRI 3D visualisation. J Neurol Neurosurg Psychiatry. 2005;76(11):1506-9. doi: 10.1136/jnnp.2005.066084
48. Ueda F., Suzuki M., Fujinaga Y., Kadoya M., Takashima T. In vivo anatomical analysis of arterial contact with trigeminal nerve: detection with three-dimensional spoiled grass imaging. Br J Radiol. 1999 Sep;72(861):838-45. doi: 10.1259/bjr.72.861.10645189.
49. Masuda Y., Yamamoto T., Akutsu H., Shiigai M., Masumoto T., Ishikawa E. et al. Usefulness of Subtraction of 3D T2WI-DRIVE from Contrast- Enhanced 3D T1WI: Preoperative Evaluations of the Neurovascular Anatomy of Patients with Neurovascular Compression Syndrome. Am.J. Neuroradiol. 2015;36(2):317-322. doi: 10.3174/ajnr.A4130
50. Antonini G., Di Pasquale A., Cruccu G., Truini A., Morino S., Saltelli G. et al. Magnetic resonance imaging contribution for diagnosing symptomatic neurovascular contact in classical trigeminal neuralgia: a blinded case-control study and meta-analysis. Pain. 2014;155(8):1464-71. doi: 10.1016/j.pain.2014.04.020
51. Lin W., Chen Y.L., Zhang Q.W. Vascular compression of the trigeminal nerve in asymptomatic individuals: a voxel-wise analysis of axial and radial diffusivity. Acta Neurochir (Wien). 2014;156(3):577-80. doi: 10.1007/s00701-013-1970-z
52. Maarbjerg S., Wolfram F., Gozalov A., Olesen J., Bendtsen L. Significance of neurovascular contact in classical trigeminal neuralgia. Brain. 2015;138(Pt 2):311-9. doi: 10.1093/brain/awu349
53. Alper J., Shrivastava R.K., Balchandani P. Is There a Magnetic Resonance Imaging-Discernible Cause for Trigeminal Neuralgia? A Structured Review. World Neurosurg. 2017;98:89-97. doi: 10.1016/j.wneu.2016.10.104
54. Donahue JH, Ornan DA, Mukherjee S. Imaging of Vascular Compression Syndromes. Radiol Clin North Am. 2017;55(1):123-138. doi: 10.1016/j.rcl.2016.08.001.
55. Xiang C.Q., Liu W.F., Xu Q.H., Su T., Yong-Qiang S., Min Y.L. et al. Altered Spontaneous Brain Activity in Patients with Classical Trigeminal Neuralgia Using Regional Homogeneity: A Resting-State Functional MRI Study. Pain Pract. 2019;19(4):397-406. doi: 10.1111/papr.12753
56. Zhang Y., Mao Z., Cui Z., Ling Z., Pan L., Liu X. et al. Diffusion Tensor Imaging of Axonal and Myelin Changes in Classical Trigeminal Neuralgia. World Neurosurg. 2018;112:e597-e607. doi: 10.1016/j.wneu.2018.01.095
57. Yang D., Shen J., Xia X., Lin Y., Yang T., Lin H. et al. Preoperative evaluation of neurovascular relationship in trigeminal neuralgia by three-dimensional fast low angle shot (3D-FLASH) and three-dimensional constructive interference in steady-state (3D-CISS) MRI sequence. Br J Radiol. 2018;91(1085):20170557. doi: 10.1259/bjr.20170557
58. Yao S., Zhang J., Zhao Y., Hou Y., Xu X., Zhang Z. et al. Multimodal Image-Based Virtual Reality Presurgical Simulation and Evaluation for Trigeminal Neuralgia and Hemifacial Spasm. World Neurosurg. 2018;113:e499-e507. doi: 10.1016/j.wneu.2018.02.069
59. Shapey J., Vos S.B., Vercauteren T., Bradford R., Saeed S.R., Bisdas S. et al. Clinical Applications for Diffusion MRI and Tractography of Cranial Nerves Within the Posterior Fossa: A Systematic Review. Front Neurosci. 2019;13:23. doi: 10.3389/fnins.2019.00023
60. Gospodarev V., Chakravarthy V., Harms C., Myers H., Kaplan B., Kim E. et al. Computed Tomography Cisternography for Evaluation of Trigeminal Neuralgia When Magnetic Resonance Imaging Is Contraindicated: Case Report and Review of the Literature. World Neurosurg. 2018;113:180-183. doi: 10.1016/j.wneu.2018.02.066
61. Балязина Е.В. Компьютерная ангиография в диагностике нейроваскулярного конфликта у больных классической невралгией тройничного нерва. Нейрохирургия. 2010;(4):46- 49. eLIBRARY ID: 16445554.
62. Балязина Е.В. Классическая невралгия тройничного нерва. Новочеркасск, Лик; 2015:278. eLIBRARY ID: 32713331
63. Baliazin V.A., Baliazina E.V., Aksenov D.P. Computed Tomography in the Diagnosis of Classical Trigeminal Neuralgia. J Comput Assist Tomogr. 2017;41(4):521-527. doi: 10.1097/RCT.0000000000000567
64. Балязина Е.В., Балязин В.А., Исаханова Т.А., Бондарева О.И., Балязин-Парфенов И.В., Кадян Н.Г. Физический механизм формирования двух типов нейроваскулярного конфликта у больных классической невралгией тройничного нерва. Неврологический журнал. 2017;(4):190-197. doi: 10.18821/1560-9545-2017-22-4-190-197
65. Baliazina E. Etio Pathogenesis of Trigeminal Neuralgia. In: Ovallath S., editors. Textbook of Trigeminal Neuralgia. Hauppauge: Nova Science Publisher, New York;2020:Chapter 3:48-85. ISBN: 978-1-53618-130-2
Об авторах
Е. В. БалязинаРоссия
Балязина Елена Викторовна - доктор медицинских наук, доцент, профессор кафедры неврологии и нейрохирургии.
Ростов-на-Дону
О. М. Евусяк
Россия
Евусяк Оксана Михайловна - аспирант кафедры неврологии и нейрохирургии.
Ростов-на-Дону
В. А. Балязин
Россия
Балязин Виктор Александрович, доктор медицинских наук, проф., заведующий кафедрой нервных болезней и нейрохирургии.
Ростов-на-Дону
Н. Г. Кадян
Россия
Кадян Норайр Грачяевич - аспирант кафедры неврологии и нейрохирургии.
Ростов-на-Дону
Рецензия
Для цитирования:
Балязина Е.В., Евусяк О.М., Балязин В.А., Кадян Н.Г. Роль нейроваскулярного конфликта в патогенезе классической невралгии тройничного нерва и динамика подходов к его визуализации. Южно-Российский журнал терапевтической практики. 2021;2(1):24-31. https://doi.org/10.21886/2712-8156-2021-2-1-24-31
For citation:
Baliazina E.V., Evusyak O.M., Baliazin V.A., Kadyan N.G. The role of neurovascular conflict in the pathogenesis of classical trigeminal neuralgia and the dynamics of approaches to its visualization. South Russian Journal of Therapeutic Practice. 2021;2(1):24-31. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-1-24-31


























