Перейти к:
Синдром раннего сосудистого старения у пациентов с метаболическим синдромом: особенности течения и диагностики
https://doi.org/10.21886/2712-8156-2021-2-1-50-62.
Аннотация
Цель: выявление причин раннего сосудистого старения у пациентов с метаболическим синдромом, оценка взаимосвязи между сосудистым возрастом и различными метаболическими нарушениями, степенью выраженности метаболического синдрома, тканевыми и циркулирующими маркерами риска, выраженностью неинфекционного воспаления и разработка модели прогнозирования степени изменения сосудистого возраста у больных с метаболическим синдромом.
Материалы и методы: обследованы 750 пациентов в возрасте от 35 до 80 лет с метаболическим синдромом. Синдром раннего сосудистого старения выявлен у 484 пациентов с метаболическим синдромом и скоростью пульсовой волны на каротидно-феморальном участке (СПВкф), превышающими ожидаемые для среднего возраста значения на 2 или более стандартных отклонения.
Результаты: риск наличия синдрома раннего сосудистого старения у пациентов с метаболическим синдромом увеличивался более чем в 2,5 раза при наличии СД 2 типа, более чем в 1,5 раза — у лиц с наличием клинических признаков инсулинорезистентности, на 76% — при увеличении HOMA-IR на 1 единицу, на 17% — при увеличении высокочувствительного С-реактивного белка на 1 мг/л и на 9% — с каждым годом увеличения паспортного возраста, на 4% — при увеличении диастолического артериального давления на 1 мм рт.ст., на 1% — с каждым 1 мкмоль/л повышения уровня мочевой кислоты. Взаимосвязь синдрома раннего сосудистого старения и индекса массы тела (ИМТ) была отрицательной: каждый 1 кг/м2 увеличения индекса массы тела приводил к снижению риска синдрома раннего сосудистого старения на 6%. Наличие сахарного диабета 2 типа и клинических маркеров инсулинорезистентности, индекс HOMA-IR и мочевая кислота были использованы для разработки новой методики выявления синдрома раннего сосудистого старения у пациентов с метаболическим синдромом, обеспечивающей общую точность 0,830 (95% ДИ 0,799-0,860).
Заключение: предложены параллельные методики для эффективной интеграции простой клинической оценки сосудистого возраста в рутинную практику. Разработанная методика позволяет точно идентифицировать пациентов с метаболическим синдромом и синдромом раннего сосудистого старения на основе широко доступных клинических переменных и классических факторов риска, что позволит расширить использование возраста сосудов в реальной клинической практике.
Ключевые слова
Для цитирования:
Недогода С.В., Саласюк А.С., Барыкина И.Н., Лутова В.О., Попова Е.А. Синдром раннего сосудистого старения у пациентов с метаболическим синдромом: особенности течения и диагностики. Южно-Российский журнал терапевтической практики. 2021;2(1):50-62. https://doi.org/10.21886/2712-8156-2021-2-1-50-62.
For citation:
Nedogoda S.V., Salasyuk A.S., Barykina I.N., Lutova V.O., Popova E.A. Early vascular aging in patients with metabolic syndrome: features of the course and diagnosis. South Russian Journal of Therapeutic Practice. 2021;2(1):50-62. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-1-50-62.
Введение
Сердечно-сосудистые заболевания (ССЗ) попрежнему остаются основной причиной заболеваемости и смертности во всем мире [1]. К одним из наиболее распространенных факторов риска (ФР) ССЗ среди пациентов любого возраста относятся метаболический синдром (МС) и абдоминальное ожирение, являющееся его ключевым звеном. Именно ассоциация абдоминального ожирения, МС и ССЗ является одной из основных причин повышения сердечно-сосудистого риска и развития ранних изменений сердечно-сосудистой системы [2].
Еще в 2008 г. P.M. Nilsson предложил понятие «раннего сосудистого старения» (РСС) (Early vascular aging, EVA) [3]. Оно предложено в качестве определения изменений сосудистой стенки, не свойственных человеку данного возраста и пола, и является новой концепцией для изучения больных с высоким сердечно-сосудистым (СС) риском, к которым относятся пациенты с МС. Понятие «сосудистый возраст» (СВ) в концепции РСС представляет собой маркер кумулятивного воздействия ФР и общего интегрального показателя развития многих хронических болезней (ССЗ, сахарного диабета 2 типа (СД 2 типа), онкологических заболеваний). В дальнейшем теми же авторами было обнаружено, что существует и защитный фенотип, при котором регистрируются очень низкие значения артериальной жесткости независимо от уровня воздействия факторов риска [4]. В 2019 г. было предложено выражать очень высокую и очень низкую жесткость артерий в терминах EVA и SUPERNOVA (супернормальное сосудистое старение) [5].
Новым аспектом изучения синдрома раннего сосудистого старения (СРСС) является поиск факторов, которые защищают от развития данного синдрома и являются связанными со здоровым старением сосудов или даже супернормальным старением сосудов (SUPERNOVA) [6]. Если такую защиту от сосудистого старения можно будет лучше понять на основе расширенного обследования, появится потенциал для поиска новых способов медикаментозной и немедикаментозной защиты сосудов. Тот факт, что мы до сих пор не до конца понимаем возможности ангиопротекции, неоднократно доказан практикой: например, поразительное отсутствие серьезных кардиоваскулярных осложнений у нескольких пациентов с диабетом 1 типа длительностью более 40–50 лет [7, 8] или широко обсуждаемый «парадокс ожирения» и существование «метаболически здорового ожирения» [9, 10]. Изучение особенностей «ухода» от гемодинамического старения у этих пациентов представляется крайне интересной задачей [11].
Существуют веские причины для оценки сосудистых биомаркеров СРСС у людей с ожирением и МС: во-первых, сам ИМТ является плохим маркером для индивидуального прогнозирования риска ССЗ [12]. Во-вторых, используемые на настоящий момент шкалы оценки риска ССЗ могут недооценивать СС риск у лиц с ожирением и МС [13]. В-третьих, между возникновением ожирения и МС и явными сердечно-сосудистыми осложнениями существует задержка в десятилетия. При этом с увеличением тяжести или количества компонентов МС нарастает степень повреждения сосудов [14, 15]. Это обусловлено тем, что связь между МС и СРСС многогранна и обусловлена взаимовлиянием большого количества патофизиологических состояний, свойственных данной патологии.
При этом совершенствование возможностей клинической и лабораторной диагностики позволяет сегодня без особых трудозатрат неинвазивными методами выявлять субклинические маркеры повышенного СС риска, являющиеся индикаторами сосудистой коморбидности и предикторами СРСС у пациентов с МС. Это позволяет аккуратнее определять СС риск и точнее стратифицировать пациентов по группам риска, что в свою очередь приводит к более обоснованному выбору мер профилактики и лечения и этим превосходит значимость использования классических ФР. Существуют многочисленные методы оценки сосудистого возраста, которые можно разделить на “value-based” и “risk-based” подходы [16]. У каждого из подходов существуют недостатки, поиск идеального метода продолжается.
Цель исследования — выявление причин раннего сосудистого старения у пациентов с МС, оценка взаимосвязи между сосудистым возрастом и различными метаболическими нарушениями, степенью выраженности МС, тканевыми и циркулирующими маркерами риска, выраженностью неинфекционного воспаления и разработка модели прогнозирования степени изменения сосудистого возраста у больных с МС.
Материал и методы
В основу экспериментальной работы положены клинические наблюдения и исследования, выполненные на базе кафедры внутренних болезней ИНМФО ФГБОУ ВО «Волгоградский государственный медицинский университет» Минздрава РФ. Общее число обследованных пациентов — 850. Из них — 750 пациентов с МС (по критериям IDF, 2005 г.) и 100 практически здоровых пациентов без выявленных метаболических нарушений, которые рассматривались в качестве группы сравнения.
Исследование было основано на принципах биоэтики и Надлежащей Клинической Практики, этические риски были минимальными.
Всем пациентам было проведено физикальное обследование с оценкой антропометрических показателей (роста, веса, индекса массы тела (ИМТ), окружности талии (ОТ)), измерение артериального давления (АД) (аппарат OMRON 750 IТ), клинический и биохимический анализ крови с оценкой состояния липидного обмена (общий холестерин (ОХ), триглицериды (ТГ), липопротеиды низкой плотности (ЛПНП), липопротеиды высокой плотности ЛПВП), углеводного обмена (глюкоза плазмы натощак (ГПН), индекс инсулинорезистентности HOMA-IR), уровня мочевой кислоты (МК), высокочувствительного с-реактивного белка (вчСРБ), исследование параметров сосудистой жесткости и центральной гемодинамики (измерение скорости пульсовой волны на каротидно-феморальном участке (СПВкф) с помощью компьютеризированного устройства SphygmoCor, измерение индекса аугментации (ИА) в аорте методом аппланационной тонометрии, измерение толщины интима-медия (ТИМ) (Aloka ProSound a7), центрального систолического АД (цСАД), центрального пульсового давления (цПД)), сбор анамнеза.
МС традиционно классифицируется на основе дихотомических критериев, что делает невозможным оценку спектра изменений данного состояния и отслеживание рисков, связанных с МС, с течением времени. Вследствие недостатков такого подхода в работе использовали также оценку индекса степени тяжести МС (Metabolic Syndrome Severity Score, MSSS), который позволяет определить степень выраженности МС на настоящий момент [17]. MSSS показал высокую прогностическую ценность у пациентов с МС (показана корреляция с долгосрочным риском развития СД 2 типа и ССЗ [18, 19]). Расчет MSSS осуществлялся с помощью онлайн-инструмента по адресу https://metscalc.org [20].
Факт отсутствия или наличия СРСС определялся как значения СПВкф, превышающие ожидаемые для средних по возрасту значений на 2 и более стандартных отклонения (СО) [21], согласно европейским популяционным данным [22] (табл. 1).
Таблица 1
Значения СПВкф по возрастным группам для постановки СРСС
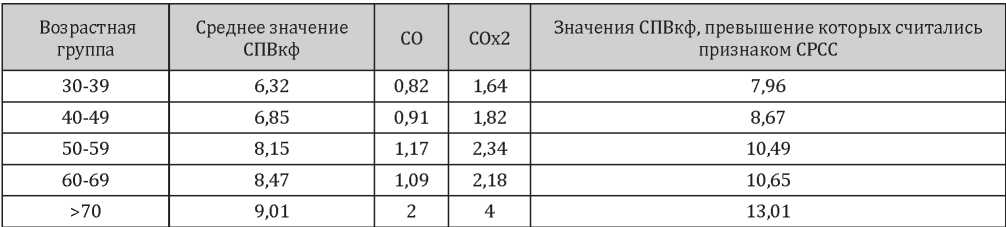
Расчётная скорость пульсовой волны (рСПВ) в этом исследовании была рассчитана с использованием уравнений, основанных на Reference Values for Arterial Stiffness Collaboration [22] иллюстрирующих зависимость СПВкф от возраста и среднего АД (срАД) по методике Greve S. и коллег [23].
Расчет сосудистого возраста у пациентов с МС проводился с использованием различных подходов [24, 25].
Первый подход заключался в использовании инструментальных маркеров изменения СС стенки, например, ТИМ, СПВкф и ИА для сравнения данных пациента с референтными в популяции для соответствующего возраста и пола. Так, в данной работе с применением методики, предложенной Betge S. и колл. [26], рассчитывались значения СВспв (по данным измерения СПВкф) и СВAlx (по данным измерения индекса аугментации). Аналогично рассчитывались значения СВрспв для рСПВ, методика расчёта которого описана выше. Расчет основывался на измерении параметров жёсткости сосудистой стенки и сравнении их с возрастно-гендерными референсными данными по материалам AngloCardiff Collaborative Trial (ACCT) [27]. На основании данных измерения ТИМ с использованием преобразованной формулы Homa S. et al. [28] рассчитывали также сосудистый возраст по формуле СВтим = (ТИМ – 0,116) ÷ 0,009 [29].
Расчёт сосудистого возраста с использованием легкодоступных в практике данных, входящих в системы оценки риска Framingham risk score, предложил D. Agostino R. et al. в 2008 г. [30]. На основании данных популяционнного исследования Framingham Heart Study D’Agostino и коллеги разработали алгоритм расчета СВ для стран североамериканского континента с учётом следующих параметров: пола и возраста пациента, статуса курения, уровеня ОХ и ЛПВП, уровеня САД и информации о приеме гипотензивных средств, статуса СД. На основании предложенного алгоритма D’Agostino и M.J. Pencina были разработаны два калькулятора расчёта СВ, использовавшиеся в данной работе, — классический, основанный на использовании всех вышеупомянутых параметров (СВфрамлипид), а также упрощённый, в котором уровень липидов заменили на показатель ИМТ (СВфрамимт). Оба калькулятора находятся в открытом доступе на сайте исследования Framingham Heart Study (https://www.framinghamheartstudy.org/fhs-risk-functions/cardiovascular-disease-10-year-risk/).
Для шкалы SCORE адаптацию расчёта произвели в 2010 г. Cuende J.I. и колл. [31]. Алгоритм расчёта СВ для шкалы SCORE (для стран высокого и низкого риска) был разработан с учетом пола, возраста, статуса курения, уровней артериального давления, ОХ сыворотки крови. На территории РФ рекомендовано использование алгоритма расчета сосудистого возраста для стран с высоким ССР.
В данной работе использовалась собственная адаптация шкалы оценки СВ по SCORE на базе Excel с помощью макроса VBA: параметры пациента автоматически обрабатывались в соответствии с имеющимися диапазонами СС риска. Следует отметить, что значения СВscore соответствуют таковым по результатам использования калькулятора ADVANT’AGE для смартфонов (версия 2, 2015), поскольку алгоритм расчета СВ в нём соответствует алгоритму SCORE, а расчёт СС риска производится на основании шкалы ASCORE [32, 33].
Также всем пациентам рассчитывали биологический возраст сердца по шкале QRISK-3 в модификации 2018 г. [34], в которой учитываются следующие параметры: возраст, пол, этническая принадлежность, ИМТ, уровень ОХ и ЛПВП, САД, вариабельность АД, статус курения, наличие сопутствующей патологии (СД, хроническая болезнь почек, фибрилляция предсердий, ревматоидный артрит, мигрень, системная красная волчанка, эректильная дисфункция у мужчин, психические заболевания), стенокардия у родственников в возрасте <60 лет, приём гипотензивных препаратов и атипичных антипсихотиков). Калькулятор доступен онлайн по ссылке www.qrisk.org.
Далее была проведена оценка особенностей клинического течения МС, распространённости и степени выраженности СРСС, расчёт показателей СВ по перечисленным 8 методикам и оценка взаимосвязи СВ с параметрами сосудистой жесткости и центральной гемодинамики, степенью тяжести МС, выраженностью неинфекционного воспаления у обследуемых пациентов.
Статистические методы анализа данных
Статистическая обработка результатов исследования проводилась с использованием NCSS 2019 Statistical Software, STATISTICA 10.0, «Stat Soft, Inc» и Microsoft Excel 2010 с пакетом XLSTAT и Visual Basic. Проверка гипотезы нормальности распределения количественных признаков проводилась с помощью критериев Шапиро-Уилка, Колмогорова-Смирнова, Крамера фон Мизеса и Андерсона-Дарлинга.
Непрерывные количественные данные выражались в виде среднего значения и его стандартного отклонения (M(SD)) или в виде среднего значения и стандартной ошибки среднего (M±SEM), если не указано другого. При отличном от нормального распределения количественного признака данные представлены в виде медианы значения и его интерквартильного размаха: Me (25–75 перцентили), если не указано другого. Дихотомические и порядковые качественные данные выражались в виде частот (n — число объектов с одинаковым значением признака и долей (%)).
Проверка гипотез о равенстве групповых средних, медиан, мод и дисперсий для количественных признаков проводилась с помощью однофакторного дисперсионного анализа (ANOVA) и непараметрических критериев Ван дер Вардена, медианного критерия, Краскела-Валлиса, Сиджела-Тьюки и Ансари-Брэдли. Различие между качественными признаками оценивалось с помощью двустороннего критерия Фишера. Корреляционный анализ проводился по методу ранговой корреляции Спирмана.
С целью анализа диагностической значимости показателей СВ, рассчитанных по различным методикам, по отношению к эталонному тесту были построены характеристические кривые (ROCкривые). Для оценки связи между показателями ригидности магистральных артерий и других факторов СС риска с СРСС была построена логистическая регрессионная модель. Для выявления клинических показателей, ассоциированных с СРСС, на основании корреляционного анализа были выявлены клинические характеристики, коррелирующие с величиной СПВкф. Затем для отобранных предикторов построены линейные регрессионные модели и с учётом полученных данных были построены множественные регрессионные модели с введением фиксированных переменных (пол, СД 2 типа, курение, получение АГТ) и серийной корреляцией ошибок регрессии с последовательным включением в каждую новую модель в качестве независимой переменной одного из клинических предикторов увеличения СПВкф в зависимости от значения его регрессионного коэффициента.
Во всех процедурах статистического анализа критический уровень значимости р принимался равным 0,05.
Результаты
Клинико-демографическая характеристика сравниваемых групп представлена в табл. 2.
Таблица 2
Клинико-демографическая характеристика сравниваемых групп
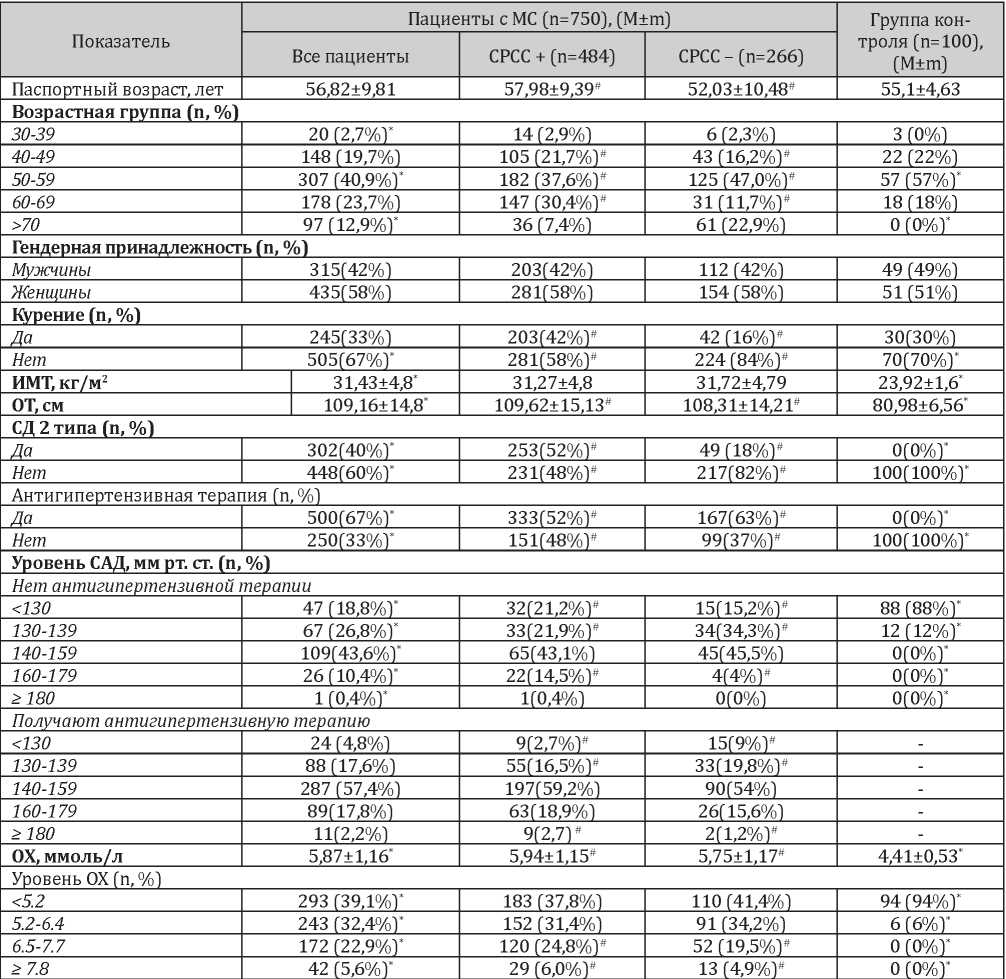
Примечание: * — p <0,05, статистически значимые различия между группой МС и контролем #- p <0,05, статистически значимые различия между СРСС+ и СРСС-.
Пациенты с СРСС были старше пациентов без СРСС: средний возраст составил 57,98±9,39 и 52,03±10,48, соответственно (p<0,05). При этом в группе с СРСС было больше пациентов возрастной группы 50-69 лет, чем в группе без СРСС. Однако пациенты старшей возрастной группы — >70лет, — наоборот, чаще встречались в группе пациентов без СРСС (22,9% против 7,7%, соответственно (p<0,05)). Пациенты были сопоставимы по гендерной принадлежности во всех группах сравнения. В целом, встречаемость и выраженность ФР достоверно превышала таковую в группе пациентов с СРСС в отличие от пациентов без СРСС (рис. 1).
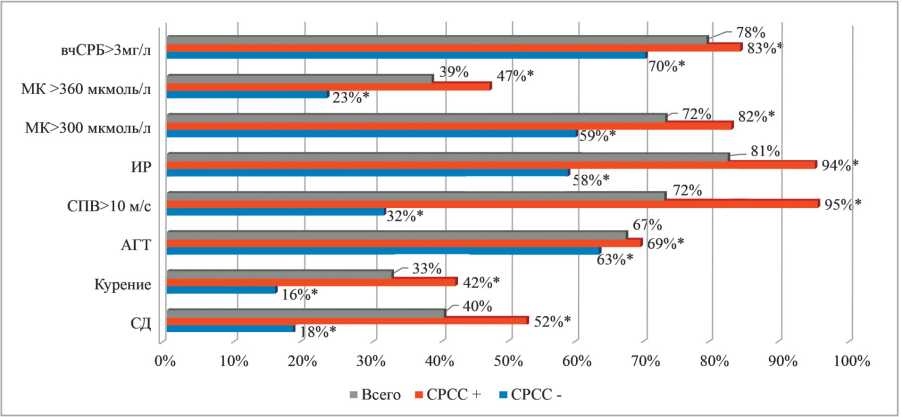
Рисунок 1. Сравнение распространённости ФР в группе пациентов с МС и СРСС+, СРСС- и всего.
Примечание: * — р˂0,05 при сравнении СРСС+ и СРСС-, χ2-критерий, СД — сахарный диабет, АГТ — антигипертензивная терапия, СПВ — скорость пульсовой волны, ИР — инсулинорезистентность, вчСРБ — высокочувствительный с-реактивный белок.
ИМТ у пациентов с МС был значительно выше значений у лиц контрольной группы, однако достоверно не различался между группами пациентов с/без СРСС. При этом отклонялись от нормальных значений средние показатели ОТ с небольшими, но достоверными различиями между пациентами с СРСС и без него.
АГТ пациенты с СРСС принимали реже, чем пациенты без такового — 52% и 63% соответственно (p<0,05). У пациентов, не принимавших АГТ, в группе пациентов с СРСС в сравнении с пациентами без СРСС достоверно чаще выявлялся уровень САД >130 мм рт.ст. (21,2% против 15,2%, p<0,05) и >160 мм рт.ст. (14,9% против 4%, p <0,05). У пациентов, получавших АГТ, частота достижения уровня САД ниже 130 мм рт.ст. была достоверно выше в группе пациентов без СРСС — 9% в сравнении с 2,7% в группе пациентов с СРСС (p<0,05 для межгруппового различия). Значения САД ниже 140 мм рт.ст. на АГТ также чаще наблюдались в группе пациентов без СРСС — 19,8% в сравнении с 16,5% в группе пациентов с СРСС (p<0,05). Напротив, превышение уровня САД выше целевых значений чаще присутствовало в группе пациентов с СРСС — 80,8% в сравнении с 70,8% в группе пациентов без СРСС ( <0,05).
При анализе АД, ЧСС и показателей сосудистой жесткости в исследуемых группах выявлено различие между пациентами по уровню САД, но не ДАД и ЧСС. СПВкф в группе пациентов с СРСС был достоверно выше аналогичного показателя в группе без СРСС. При анализе количества пациентов, у которых СПВкф превышал 10 м/с выявлено, что среди пациентов с СРСС таких пациентов было 95%, тогда как в группе без СРСС — только 32%. Для рСПВкф и ИА различия между пациентами с/без СРСС не были статистически значимыми. цСАД, цПД и ТИМ были ненамного, но достоверно выше в группе пациентов с СРСС в сравнении с пациентами без такового (табл. 3).
Таблица 3
Значения АД, ЧСС и показателей сосудистой жесткости в исследуемых группах
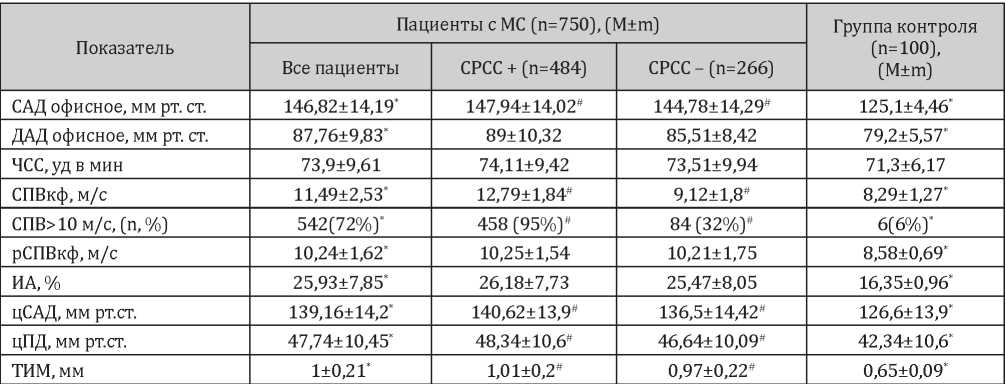
Примечание: * — p<0,05, статистически значимые различия между группой МС и контролем; # — p<0,05, статистически значимые различия между СРСС+ и СРСС-.
Таблица 4
Выраженность МС, неинфекционного воспаления и ИР у пациентов с МС с/без СРСС
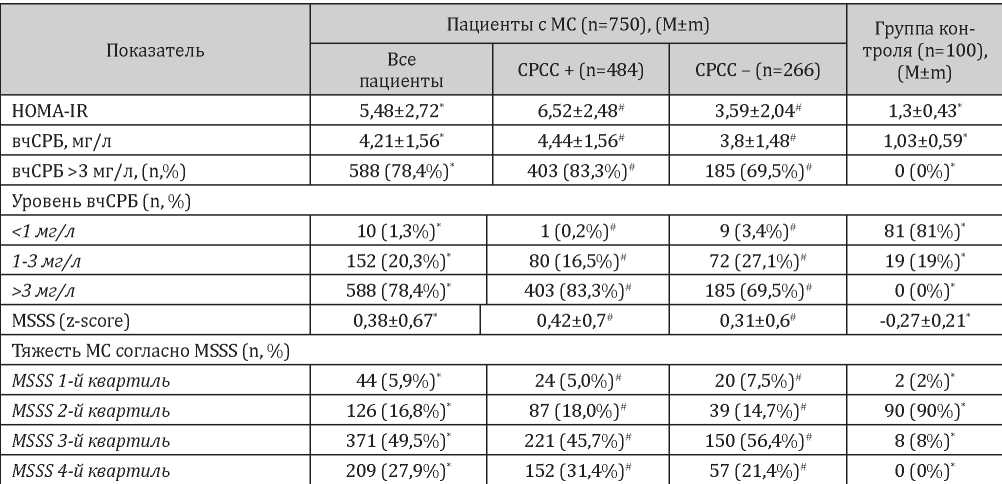
Примечание: * — p<0,05, статистически значимые различия между группой МС и контролем; # — p <0,05, статистически значимые различия между СРСС+ и СРСС-.
Результаты изучения показателей липидного обмена и уровня МК показали, что у большинства пациентов с МС выявлены дислипидемии различной степени выраженности, а также значимое повышение уровня МК по сравнению с группой контроля, однако группы с/без СРСС достоверно различались только по уровню ТГ и МК. Повышение уровня МК выше 300 мкмоль/л выявлено у 72% пациентов с МС (82% в группе пациентов с СРСС и 59,4% в группе пациентов без СРСС), уровень МК выше 360 мкмоль/л выявлен у 38,5% пациентов с МС (46,9% в группе с СРСС и 23,3% в группе без СРСС) (p<0,05 для межгрупповых различий).
Результаты оценки выраженности МС, неинфекционного воспаления и ИР у пациентов с МС с/без СРСС представлены в табл. 4.
По результатам оценки выявлена достоверно большая степень тяжести МС у пациентов с СРСС. Так, в группе пациентов с МС и СРСС 31,4% пациентов относились к 4-му квартилю MSSS, тогда как в группе пациентов без СРСС данный показатель составил 21,4%. При этом средний z-score MSSS составил 0,42±0,7 в группе пациентов с СРСС и 0,31±0,6 в группе пациентов без СРСС (p<0,05 при сравнении групп). При оценке ИР по индексу HOMA-IR показано 45%-ное увеличение данного показателя в группе пациентов с СРСС в сравнении с пациентами без СРСС (p<0,05 при сравнении групп).
Оценка вчСРБ показала, что пациенты с СРСС и без него значимо различались как по средним значениям вчСРБ (4,44±1,56 и 3,8±1,48 мг/л, соответственно (p<0,05)), так и по проценту пациентов, у которых вчСРБ превышал 3 мг/л (83,3% против 69,5% (p <0,05)) при общем проценте 78,4% в группе пациентов с МС. Показано, что среди пациентов с МС практически отсутствовали пациенты с уровнем вчСРБ <1 мг/л (1,3%, в среднем, по группе, 0,2% — среди пациентов с СРСС и 3,4% — в группе пациентов без СРСС). При этом распределение пациентов между диапазонами вчСРБ <3 мг/л и >3 мг/л показало, что у пациентов с СРСС выраженность неинфекционного воспаления значимо превосходит таковую у пациентов без СРСС.
В ходе анализа популяции пациентов с МС был рассчитан СВ по 8 вышеперечисленным методикам. В целом, значения СВ, рассчитанные с помощью алгоритма с использованием значений ТИМ, оказались максимальными (рис. 2).
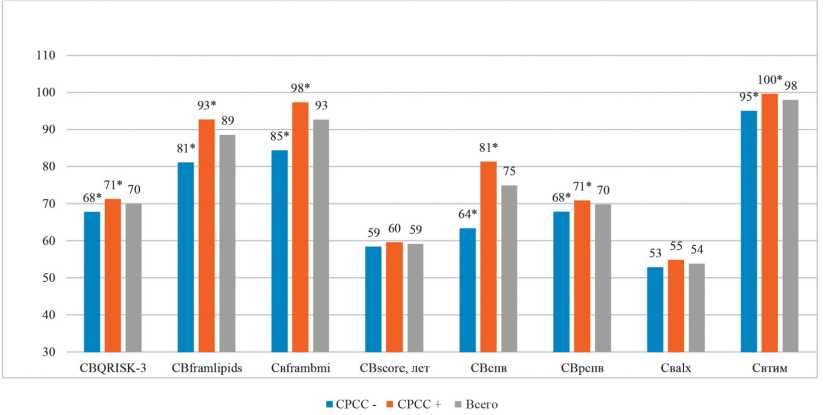
Рисунок 2. Значения СВ, рассчитанного по разным методикам, у пациентов с и без СРСС.
Примечание: * — p <0,05, статистически значимые различия между СРСС+ и СРСС-.
При этом для всех методик, кроме СВscore и СВalx, средние значения СВ достоверно различались в группах с и без СРСС. Обращает на себя внимание тот факт, что, хотя значения СВscore в группах пациентов с СРСС и без него не достигли статистически значимого различия, разница между паспортным возрастом и СВscore различалась между группами достоверно. В среднем, СВ по алгоритму SCORE у лиц с МС был на 2,5 года выше паспортного. Для остальных методик также отмечалась достоверная разница между паспортным и СВ у пациентов с/без СРСС (рис. 3).
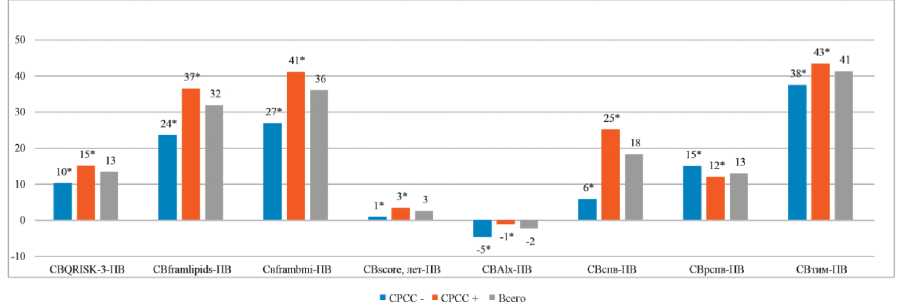
Рисунок 3. Разница СВ, рассчитанного по разным методикам, и паспортного возраста у пациентов с и без СРСС.
Примечание: * — p <0,05, статистически значимые различия между СРСС+ и СРСС-.
Далее с целью анализа диагностической значимости показателей СВ по отношению к эталонному тесту были построены ROC-кривые. На рис. 4 представлены ROC–кривые и значения AUC для различных методик определения СВ.

Рисунок 4. ROC-кривые диагностических тестов на наличие СРСС.
По результатам построения ROC-кривых, наибольшие значения AUC были получены для показателей СВ, рассчитанных по методикам СВспв (AUC >0,81 — может быть допущено к клинической валидации), СВscore, СВframlipids, СВframbmi и QRISK-3 (AUC >0,6 <0,8 — требуется доработка), что указывает на диагностическую значимость этих методов. Диагностическая значимость СВframbmi, по данным ROC-анализа, в группе пациентов с МС выше, чем СВframlipids. Методики CВтим, СВalx и СВрспв характеризовались низкой диагностической ценностью при МС.
Анализ зависимости показателей СВ от степени тяжести МС показал, что только результаты значений СВспв не зависели от степени тяжести МС. Точность методик CВscore, СВQRISK-3 и СВframbmi снижалась с увеличением степени
тяжести МС. Наличие СД 2 типа также влияло на точность определения СРСС, определенного по методике SCORE (но не СВспв, СВframbmi и QRISK-3). Показано, что наличие СД 2 типа резко снижает чувствительность и специфичность СВSCORE для выявления СРСС, что является несомненным препятствием для использования данной методики у пациентов с МС.
Для оценки связи между показателями ригидности магистральных артерий и других факторов СС риска с СРСС была построена логистическая регрессионная модель. В качестве независимых предикторов СРСС в модель вошли возраст, наличие СД 2 типа, ДАД, наличие клинических маркеров ИР, уровень МК, вчСРБ, ИМТ. Показано, что шансы наличия СРСС увеличивались более чем в 2,5 раза при наличии СД 2 типа, более чем в 1,5 раза у лиц с наличием ИР. Кроме того, риск наличия СРСС возрастал на 76% при увеличении HOMA-IR на 1 единицу, на 17% — при увеличении вчСРБ на 1 мг/л и на 9% с каждым годом увеличения паспортного возраста, на 4% — при увеличении ДАД на 1 мм рт.ст., на 1% с каждым 1 мкмоль/л повышения уровня МК. Обращает на себя внимание тот факт, что взаимосвязь СРСС и ИМТ была отрицательной: каждый 1 кг/м2 увеличения ИМТ приводил к снижению риска СРСС на 6% (рис. 5).
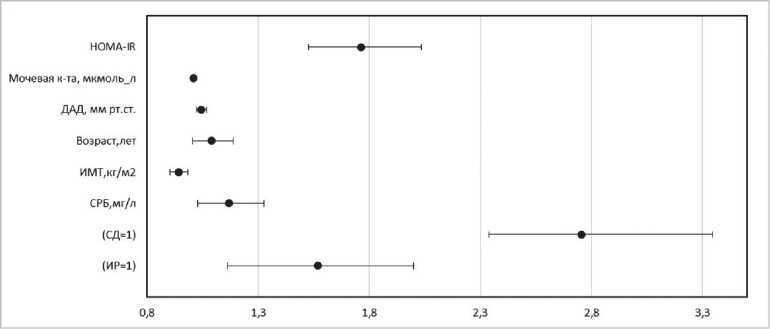
Рисунок 5. Результаты многомерной логистической регрессии ФР СРСС.
Далее на основании корреляционного анализа выявлены клинические характеристики, коррелирующие с основной детерминантой СРСС — величиной СВспв. По результатам множественной линейной регрессии достоверными независимыми предикторами повышения СПФкф являлись наличие СД2 типа и клинических маркеров ИР, уровня МК, вчСРБ, HOMA-IR, ОХ, ТГ, ДАД. Сохранялась отрицательная достоверная корреляция с ИМТ. Множественные ФР, отобранные в регрессионных моделях, использовали для разработки модели расчета СВ у пациентов с МС для прогнозирования СРСС с помощью алгоритма Random Forest, включая уровень МК, индекс HOMA-IR, наличие СД2 типа и клинических маркеров ИР. Другими ФР, которые также были изучены, но не использовались в модели, поскольку они обладали повышенной интерколлинеарностью с другими ФР, ухудшали прогностическую точность модели или не были статистически значимыми, были рСПВ, вчСРБ, ИМТ и ОТ, уровень АД, ЧСС, ОХ, ТГ, ЛПВП, ЛПНП, АГТ, статус курения. Степень влияния независимых факторов на величину СВ рассчитывался исходя из величины стандартизированных коэффициентов регрессии β (logОР для каждого из факторов) с помощью формулы:
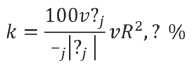
Итоговая формула расчета СВмс представлена ниже:

где ПВ – паспортный возраст, лет;
МК – уровень мочевой кислоты, мкмоль/л;
НОМАir — индекс НОМА-IR;
СД1– наличие СД 2 типа;
ИР1 – наличие клинических маркеров инсулинорезистентности.
На рис. 6 представлены ROC-кривые и значения площади под кривой для СВспф, СВscore и разработанного алгоритма определения СВмс.
Значение площади под кривой для СВмс составило 0,83, что выше значений для СВscore, СВframlipids, СВframbmi и QRISK-3 и говорит о высокой чувствительности и специфичности данного метода, основанного на общеклинических обследованиях, в диагностике СРСС. Наиболее точным, по данным исследования, является метод диагностики СРСС, основанный на анализе инструментальных показателей жесткости сосудистой стенки — СВспв. Показано, что чувствительность и специфичность определения СВмс для диагностики СРСС не зависят от степени тяжести МС и возраста пациентов.
По результатам исследования был разработан калькулятор для расчета СВ и диагностики СРСС у пациентов с МС (рис. 7).

Рисунок 6. ROC-кривые диагностических тестов на наличие синдрома РСС.
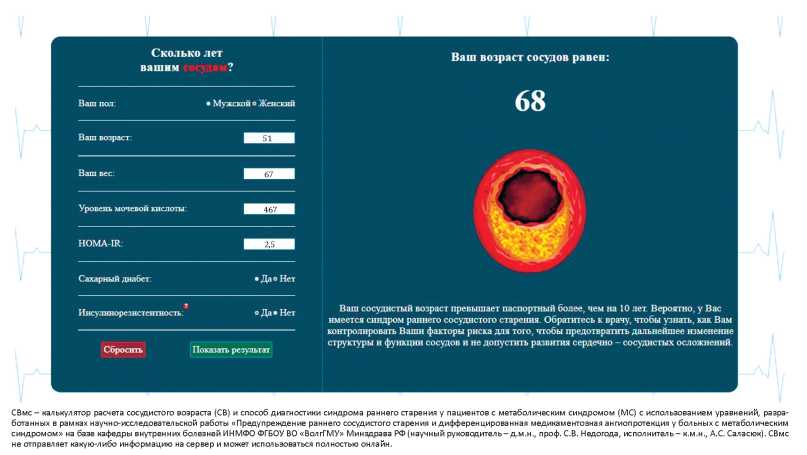
Рисунок 7. Онлайн-калькулятор для расчёта СВ и диагностики СРСС у пациентов с МС.
Обсуждение
Поскольку важной особенностью МС является его обратимость в целом и его отдельных факторов, ранний старт терапии имеет важное значение в отношении возможностей профилактики связанных с ним осложнений. Мета-анализы свидетельствуют, что влияние даже на один из компонентов МС позволяет добиться заметного улучшения общего состояния за счет компенсации изменений в других звеньях его патогенеза [35].
Поэтому очень важно своевременное выявлять больных МС с ранним сосудистым старением, мотивировать пациентов на изменение образа жизни и назначать правильно подобранное и патогенетически обоснованное лечение. РСС и СВ — концепция, предлагающая высокоточный и легко воспринимаемый пациентами прогноз риска [16].
К сожалению, у пациентов с МС использование стандартных методов расчета СВ (на основании шкалы SCORE) не показало высокой чувствительности и специфичности в выявлении СРСС в связи с многогранностью патогенеза РСС у пациентов с МС и не главенствующей ролью АД в данном процессе. У пациентов с МС накопление классических ФР приводит к ускорению РСС [21, 36]. В частности, для АГ при МС важным является не только опосредованное повышением АД повреждение сосудов, но и предикторы его повышения. Таким образом, оценки СВ, основанные только на факторах воздействия АД на сосуды, приводят к недооценке степени повреждения сосудистой стенки у пациентов с многокомпонентным генезом поражения сосудов, к которым относятся и пациенты с МС.
СПВкф (в настоящее время — наиболее широко используемый показатель жесткости артерий) соответствует большинству строгих критериев для биомаркера, подходящего для использования в клинической практике с целью выявления СРСС у пациентов с МС [37]. Однако, несмотря на многочисленные рекомендации экспертов [37, 38, 39], частота его использования в клинической практике является низкой, главным образом по практическим и логистическим причинам.
Выводы
Таким образом, хотя измерение СПВкф и расчёт СВ на основании этих данных является наиболее чувствительным и специфичным маркером СРСС у пациентов с МС, методики оценки СВ на основании общеупотребимых клинических маркеров необходимо также интегрировать в клиническую практику. Нами разработана методика оценки СВ у пациентов с МС, использующая данные стандартной клинической оценки (уровень МК, индекс HOMA-IR, наличие СД2 типа и клинических маркеров ИР), которая предсказывает наличие СРСС на основе широко доступных клинических переменных и улучшает прогнозирование риска по сравнению с традиционными показателями, такими, как оценка СВ по шкале SCORE, у пациентов с МС. Расчёт СВ по разработанной методике применим в случае отсутствия данных о СПВкф, и обе эти методики могут привести к улучшению стратификации риска и планирования терапии у пациентов с МС.
Список литературы
1. Шляхто E.В., Звартау Н.Э., Виллевальде C.В., Яковлев A.Н., Соловьева А.Е., Алиева А.С., и др. Cистема управления сердечно-сосудистыми рисками: предпосылки к созданию, принципы организации, таргетные группы. Российский кардиологический журнал. 2019;(11):69-82. DOi: 10.15829/1560-4071-2019-11-69-82
2. Pucci G, Alcidi R, Tap L, Battista F, Mattace-Raso F, Schillaci G. Sex- and gender-related prevalence, cardiovascular risk and therapeutic approach in metabolic syndrome: A review of the literature. Pharmacol Res. 2017;120:34-42. DOI: 10.1016/j.phrs.2017.03.008
3. Nilsson PM. Early vascular aging (EVA): consequences and prevention. Vasc Health Risk Manag. 2008;4(3):547-52. DOI: 10.2147/vhrm.s1094
4. Laurent S, Boutouyrie P, Cunha PG, Lacolley P, Nilsson PM. Concept of Extremes in Vascular Aging. Hypertension. 2019;74(2):218-228. DOI: 10.1161/HYPERTENSIO-NAHA.119.12655
5. Ротарь О.П., Толкунова К.М. Сосудистое старение в концепциях EVA и SUPERNOVA: непрерывный поиск повреждающих и протективных факторов. Артериальная гипертензия. 2020;26(2):133-145. DOI: 10.18705/1607-419X-2020-26-2-133-145
6. Nilsson PM. Early Vascular Aging in Hypertension. Front Cardiovasc Med. 2020;7:6. DOI: 10.3389/fcvm.2020.00006
7. Bain SC, Gill GV, Dyer PH, Jones AF, Murphy M, Jones KE, et al. Characteristics of Type 1 diabetes of over 50 years duration (the Golden Years Cohort). DiabetMed. 2003;20(10):808-11. DOI: 10.1046/j.1464-5491.2003.01029.x
8. Adamsson Eryd S, Svensson AM, Franzen S, Eliasson B, Nilsson PM, Gudbjornsdoffir S. Risk of future microvascular and macrovascular disease in people with Type 1 diabetes of very long duration: a national study with 10-year follow-up. Diabet Med. 2017;34(3):411-418. DOI: 10.1111/dme.13266
9. Tremmel M, Lyssenko V, Zoller B, Engstrom G, Magnusson M, Melander O, et al. Characteristics and prognosis of metabolically healthy obesity (MHO) - the Malmo Preventive Project. Obes Med. 2018;11:6-12. doi: 10.1016/j.obmed.2018.06.005.
10. Elagizi A, Kachur S, Lavie CJ, Carbone S, Pandey A, Ortega FB, et al. An Overview and Update on Obesity and the Obesity Paradox in Cardiovascular Diseases. Prog Cardiovasc Dis. 2018;61(2):142-150. DOI: 10.1016/j.pcad.2018.07.003
11. Nilsson PM. Hemodynamic Aging as the Consequence of Structural Changes Associated with Early Vascular Aging (EVA). Aging Dis. 2014;5(2):109-13. DOI: 10.14336/AD.2014.0500109
12. Mongraw-Chaffin M, Foster MC, Anderson CAM, Burke GL, Haq N, Kalyani RR, et al. Metabolically Healthy Obesity, Transition to Metabolic Syndrome, and Cardiovascular Risk. J Am Coll Cardiol. 2018;71(17):1857-1865. DOI: 10.1016/j.jacc.2018.02.055.
13. Шляхто Е.В., Недогода С.В., Конради А.О., Баранова Е.И., Фомин В.В., Верткин А.Л., и др. Концепция новых национальных клинических рекомендаций по ожирению. Российский кардиологический журнал. 2016;(4):7-13. DOI: 10.15829/1560-4071-2016-4-7-13
14. Stehouwer CD, Henry RM, Ferreira I. Arterial stiffness in diabetes and the metabolic syndrome: a pathway to cardiovascular disease. Diabetologia. 2008;51(4):527-39. DOI: 10.1007/s00125-007-0918-3
15. Topouchian J, Labat C, Gautier S, Back M, Achimastos A, Blacher J, et al. Effects of metabolic syndrome on arterial function in different age groups: the Advanced Approach to Arterial Stiffness study. J Hypertens. 2018;36(4):824-833. DOI: 10.1097/HJH.0000000000001631
16. Groenewegen KA, den Ruijter HM, Pasterkamp G, Polak JF, Bots ML, Peters SA. Vascular age to determine cardiovascular disease risk: A systematic review of its concepts, definitions, and clinical applications. Eur J Prev Cardiol. 2016;23(3):264-74. DOI: 10.1177/2047487314566999
17. Gurka MJ, Lilly CL, Oliver MN, DeBoer MD. An examination of sex and racial/ethnic differences in the metabolic syndrome among adults: a confirmatory factor analysis and a resulting continuous severity score. Metabolism. 2014;63(2):218-25. DOI: 10.1016/j.metabol.2013.10.006
18. Wiley JF, Carrington MJ. A metabolic syndrome severity score: A tool to quantify cardio-metabolic risk factors. Prev Med. 2016;88:189-95. DOI: 10.1016/j.ypmed.2016.04.006.
19. Gurka MJ, Golden SH, Musani SK, Sims M, Vishnu A, Guo Y, et al. Independent associations between a metabolic syndrome severity score and future diabetes by sex and race: the Atherosclerosis Risk In Communities Study and Jackson Heart Study. Diabetologia. 2017;60(7):1261-1270. DOI: 10.1007/s00125-017-4267-6
20. Taeber Rapczak. MetSCalc/metscalc: v0.1.0-alpha (Version 0.1.0-alpha). Zenodo. 2019, January 16. DOI: 10.5281/zeno-do.2542214
21. Nilsson PM, Laurent S, Cunha PG, Olsen MH, Rietzschel E, Franco OH, et al. Characteristics of healthy vascular ageing in pooled population-based cohort studies: the global Metabolic syndrome and Artery REsearch Consortium. J Hypertens. 2018;36(12):2340-2349. DOI: 10.1097/HJH.0000000000001824
22. Reference Values for Arterial Stiffness' Collaboration. Determinants of pulse wave velocity in healthy people and in the presence of cardiovascular risk factors: 'establishing normal and reference values'. Eur Heart J. 2010;31(19):2338-50. DOI: 10.1093/eurheartj/ehq165
23. Greve SV, Blicher MK, Kruger R, Sehestedt T, Gram-Kampmann E, Rasmussen S, et al. Estimated carotid-femoral pulse wave velocity has similar predictive value as measured carotid-femoral pulse wave velocity. J Hypertens. 2016;34(7):1279-89. DOI: 10.1097/HJH.0000000000000935
24. Ротарь О.П., Алиева А.С., Бояринова М.А., Толкунова К.М., Конради А.О. Концепция сосудистого возраста: какой инструмент для оценки выбрать в клинической практике? Кардиология. 2019;59(2):45-53. DOI: 10.18087/cardio.2019.2.10229
25. Троицкая Е.А., Вельмакин С.В., Кобалава Ж.Д. Концепция сосудистого возраста: новый инструмент оценки сердечно-сосудистого риска. Артериальная гипертензия. 2017;23(2):160-171. DOI: 10.18705/1607-419X-2017-23-2-160-171
26. Betge S, Kretzschmar D, Figulla HR, Lichtenauer M, Jung C. Predictive value of the augmentation index derived vascular age in patients with newly diagnosed atherosclerosis. Heart Vessels. 2017;32(3):252-259. DOI: 10.1007/s00380-016-0868-0
27. McEniery CM, Yasmin, Hall IR, Qasem A, Wilkinson IB, Cockcroft JR; ACCT Investigators. Normal vascular aging: differential effects on wave reflection and aortic pulse wave velocity: the Anglo-Cardiff Collaborative Trial (ACCT). J Am Coll Cardiol. 2005;46(9):1753-60. DOI: 10.1016/j.jacc.2005.07.037
28. Homma S, Hirose N, Ishida H, Ishii T, Araki G. Carotid plaque and intima-media thickness assessed by b-mode ultrasonography in subjects ranging from young adults to centenarians. Stroke. 2001;32(4):830-5. DOI: 10.1161/01.str.32.4.830
29. Аносова Е.В. Прощаев К.И. Применение в клинической практике показателя сосудистого возраста у больных аретриальной гипертензией на фоне гиперхолистеринемии в оценке эффективности липидснижающей терапии. Современные проблемы науки и образования. 2013;(1):44-44. eLIBRARY ID: 18828977
30. D'Agostino RB Sr, Vasan RS, Pencina MJ, Wolf PA, Cobain M, Massaro JM, et al. General cardiovascular risk profile for use in primary care: the Framingham Heart Study. Circulation. 2008;117(6):743-53. DOI: 10.1161/CIRCULA-TIONAHA.107.699579
31. Cuende JI, Cuende N, Calaveras-Lagartos J. How to calculate vascular age with the SCORE project scales: a new method of cardiovascular risk evaluation. Eur Heart J. 2010;31(19):2351-8. DOI: 10.1093/eurheartj/ehq205
32. Карпов Ю.А., Сорокин Е.В. Оценка риска осложнений при артериальной гипертонии и сосудистый возраст: новые инструменты для повышения качества лечения и улучшения взаимопонимания врача и больного. Атмосфера. Новости кардиологии. 2015;(2):18-25. eLIBRARY ID: 24930758
33. Карпов Ю.А., Сорокин Е.В. Влияние комбинированной гипотензивной терапии на риск сердечно-сосудистых осложнений и сосудистый возраст: результаты многоцентрового открытого исследования ADVANTAGE. Атмосфера. Новости кардиологии. 2015;(3):2-10. eLIBRARY ID: 25029045
34. Hippisley-Cox J, Coupland C, Brindle P. Development and validation of QRISK3 risk prediction algorithms to estimate future risk of cardiovascular disease: prospective cohort study. BMJ. 2017;357:j2099. DOI: 10.1136/bmj.j2099
35. Grundy SM. Pre-diabetes, metabolic syndrome, and cardiovascular risk. J Am Coll Cardiol. 2012;59(7):635-43. DOI: 10.1016/j.jacc.2011.08.080
36. Terentes-Printzios D, Vlachopoulos C, Xaplanteris P, Ioakeimidis N, Aznaouridis K, Baou K, et al. Cardiovascular Risk Factors Accelerate Progression of Vascular Aging in the General Population: Results From the CRAVE Study (Cardiovascular Risk Factors Affecting Vascular Age). Hypertension. 2017;70(5):1057-1064. DOI: 10.1161/HYPERTENSIO-NAHA.117.09633
37. Vlachopoulos C, Xaplanteris P, Aboyans V, Brodmann M, Cfkova R, Cosentino F, et al. The role of vascular biomarkers for primary and secondary prevention. A position paper from the European Society of Cardiology Working Group on peripheral circulation: Endorsed by the Association for Research into Arterial Structure and Physiology (ARTERY) Society. Atherosclerosis. 2015;241(2):507-32. DOI: 10.1016/j.atherosclerosis.2015.05.007
38. Васюк Ю.А., Иванова С.В., Школьник Е.Л., Котовская Ю.В., Милягин В.А., Олейников В.Э., и др. Согласованное мнение российских экспертов по оценке артериальной жесткости в клинической практике. Кардиоваскулярная терапия и профилактика. 2016;15(2):4-19. DOI: 10.15829/1728-8800-2016-2-4-19
39. Townsend RR, Wilkinson IB, Schiffrin EL, Avolio AP, Chirinos JA, Cockcroft JR, et al. Recommendations for Improving and Standardizing Vascular Research on Arterial Stiffness: A Scientific Statement From the American Heart Association. Hypertension. 2015;66(3):698-722. DOI: 10.1161/HYP.0000000000000033
Об авторах
С. В. НедогодаРоссия
Недогода Сергей Владимирович - доктор медицинских наук, профессор, зав. кафедрой внутренних болезней ИНМФО.
Волгоград
А. С. Саласюк
Россия
Саласюк Алла Сергеевна - кандидат медицинских наук, доцент кафедры внутренних болезней ИНМФО.
Волгоград
И. Н. Барыкина
Россия
Барыкина Ирина Николаевна - кандидат медицинских наук, доцент кафедры внутренних болезней ИНМФО.
Волгоград
В. О. Лутова
Россия
Лутова Виктория Олеговна - ассистент кафедры внутренних болезней ИНМФО.
Волгоград
Е. А. Попова
Россия
Попова Екатерина Андреевна - ассистент кафедры внутренних болезней ИНМФО.
Волгоград
Рецензия
Для цитирования:
Недогода С.В., Саласюк А.С., Барыкина И.Н., Лутова В.О., Попова Е.А. Синдром раннего сосудистого старения у пациентов с метаболическим синдромом: особенности течения и диагностики. Южно-Российский журнал терапевтической практики. 2021;2(1):50-62. https://doi.org/10.21886/2712-8156-2021-2-1-50-62.
For citation:
Nedogoda S.V., Salasyuk A.S., Barykina I.N., Lutova V.O., Popova E.A. Early vascular aging in patients with metabolic syndrome: features of the course and diagnosis. South Russian Journal of Therapeutic Practice. 2021;2(1):50-62. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-1-50-62.
JATS XML


























