Перейти к:
Прогнозирование ремоделирования артерий почек малого диаметра у пациентов с хроническим гломерулонефритом
https://doi.org/10.21886/2712-8156-2021-2-2-44-55
Аннотация
Цель: определение значимости клинико-лабораторных и морфометрических показателей структурной пере- стройки ткани почек в прогнозе ремоделирования артерий почек малого диаметра у пациентов с первичными хроническими гломерулонефритами.
Материалы и методы: в исследование включено 97 пациентов с наличием первичного хронического гломерулонефрита и показаниями к выполнению пункционной нефробиопсии. У всех па- циентов проводился учёт анамнестических и клинико-лабораторных факторов риска, выполнялась нефробиопсия. При выполнении морфометрического анализа нефробиоптата изучалось состояние ткани и сосудов почек малого диаметра. Для достижения поставленной цели все пациенты были разделены на две группы, ранжирование которых осуществлялось по медиане толщины стенки междольковой артерии.
Результаты: среди всех исследуемых факторов риска установлено статистически значимое влияние увеличения стадий АГ (χ2-критерий = 4,24, р = 0,03) и снижения скорости клубочковой фильтрации (χ2-критерий = 5,92, р = 0,015) на риск увеличения толщины междольковой артерии. Показатели структурной перестройки почечной ткани не имели статистически значимого влияния на вероятность ремоделирования артериальной стенки. Однако выявлена прямая корреляционная зависимость слабой силы между выраженностью тубулоинтерстициального воспаления и толщиной стенки междольковой артерии (r = 0,23, р = 0,02).
Заключение: показана первостепенная значимость артериальной гипертензии, сопровождающейся поражением органов-мишеней, как маркера ремоделирования сосудистой стенки междольковой артерии у пациентов с хрони- ческим гломерулонефритом.
Ключевые слова
Для цитирования:
Левицкая Е.С., Батюшин М.М., Синельник Е.А., Багмет А.Д., Мокрушин А.А., Черкашина М.Д., Чумакова И.Е., Гапоненко Н.И., Нажева М.И. Прогнозирование ремоделирования артерий почек малого диаметра у пациентов с хроническим гломерулонефритом. Южно-Российский журнал терапевтической практики. 2021;2(2):44-55. https://doi.org/10.21886/2712-8156-2021-2-2-44-55
For citation:
Levickaja E.S., Batiushin M.M., Sinel’nik E.A., Bagmet A.D., Mokrushin A.A., Cherkashina M.D., Chumakova I.E., Gaponenko N.I., Nazheva M.I. Prediction of remodeling of arteries of kidneys of small diameter in patients with chronic glomerulonephritis. South Russian Journal of Therapeutic Practice. 2021;2(2):44-55. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-2-44-55
Введение
Гломерулонефрит (ХГН) является социально-значимым заболеванием, характеризующимся высокой распространённостью, инвалидизацией преимущественно пациентов молодого возраста, а также развитием терминальной почечной недостаточности [1][2]. Множество научно-исследовательских работ посвящено изучению патогенетических механизмов развития и прогрессирования почечной дисфункции у пациентов с хроническим гломерулонефритом (ХГН), целью которых является создание эффективных мер по первичной и вторичной профилактике почечной дисфункции, а также формирование систем стратификации риска её прогрессирования. Важное место в структурной и функциональной полноценности почечной ткани занимает нормальное состояние почечного кровотока. Причём одно из приоритетных значений имеет состояние микроциркуляторного кровотока, напрямую обеспечивающее перфузию зависимого органа [3]. Наличие структурной перестройки артерий почек малого диаметра формирует и замыкает «порочный» круг в повреждении почечной ткани. С одной стороны, действие этиологического фактора приводит к ремоделированию почечной ткани, с другой стороны, нарушение адекватного кровоснабжения приводит к потенцированию структурных нарушений. В связи с этим определение факторов, принимающих участие в патогенезе повреждения сосудов малого калибра при ХГН, а также создание терапевтических целей в коррекции изменений микроциркуляторного русла имеют высокую значимость в дополнении стратификационных систем прогнозирования почечной дисфункции.
Потенциальными факторами, принимающими участие в ремоделировании артериальной стенки сосудов почек малого диаметра, являются компоненты иммунной агрессии, системные гемодинамические факторы, трансформация почечной паренхимы с реализацией феномена «сосудистого разрежения». Возможно, каждый из указанных факторов имеет значение в структурной перестройке артерий почек малого диаметра, но важным является определение первостепенного компонента в реализации патологического механизма повреждения сосудистой стенки. Литературный обзор имеющихся научно-исследовательских работ показал, что данных по изучению патогенетического механизма повреждения микроциркуляторного русла при ХГН крайне мало. Так, в одной из работ, проведённых с участием 165 пациентов, производилась оценка соответствия изменениям сосудистого русла по данным морфометрического и допплеровского исследований [4]. В качестве признака структурной перестройки артерий почек малого калибра было выбрано наличие артериолосклероза. В результате исследования было установлено, что с увеличением тяжести артериолосклероза повышаются и индексы сосудистого допплерографического сопротивления. Важно отметить, что выборка пациентов включала первичные и вторичные гломерулопатии, а также малое количество других патологий почек. Более того, целью исследовательской группы являлось не установление патогенетического фактора повреждения сосудов малого диаметра при ХГН, а соответствие изменений с показателями сосудистой резистивности. Необходимо подчеркнуть, что в большинстве исследований, проведённых с целью изучения состояния микроциркуляторного сосудистого русла при ХГН, использовались сонографические методы, являющиеся косвенными в интерпретации повреждения мелких артерий почек [5][6], не несущие аргументации в инициировании и прогрессировании сосудистой перестройки. Тем более ультразвуковое исследование является менее достоверным по сравнению с прямым морфометрическим методом.
Цель исследования — определение значимости клинико-лабораторных и морфометрических показателей структурной перестройки ткани почек в прогнозе ремоделирования артерий почек малого диаметра у пациентов с первичными ХГН.
Материалы и методы
В исследовании приняло участие 97 пациентов с наличием первичного хронического гломерулонефрита и показаниями к выполнению пункционной нефробиопсии. Средний возраст пациентов — 37,27 ± 1,2 лет, средняя продолжительность заболевания — 4,16 ± 0,47 лет, 36 женщин, 61 мужчина.
Одним из основных критериев невключения в исследование являлось наличие вторичных ХГН и тяжелой сопутствующей патологии, отсутствие которых устанавливалось при анализе первичной медицинской документации и результатов морфологического заключения, полученного после биопсии почки.
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинской Декларации. Протокол исследования был одобрен Этическими комитетами ФГБОУ ВО РостГМУ Минздрава России. До включения в исследование у всех участников было получено письменное информированное согласие.
Наиболее распространенными вариантами гломерулонефрита являлись IgA-нефропатия (44 пациента) и фокально-сегментарный гломерулосклероз (ФСГС) (30 пациентов). У 14 пациентов была выявлена мембранозная нефропатия, у 11 больных — болезнь минимальных изменений, у 5 пациентов — болезнь тонких мембран, IgM-нефропатия, мезангиопролиферативный гломерулонефрит 1 и 3 типов — по 2 пациента в каждом случае гломерулонефрита. Все пациенты, включённые в исследование, получали лечение первичных ХГН согласно стандартам их терапии.
У всех пациентов, включённых в исследование, проводился учёт клиниколабораторных факторов риска, таких как наличие гипергидратации мягких тканей, артериальной гипертензии (АГ), стадии АГ, уровень артериального давления (АД), концентрация сывороточного креатинина, мочевины, альбумина, фибриногена, расчёт скорости клубочковой фильтрации (СКФ), стадии хронической болезни почек (ХБП), определение суточной протеинурии и содержания белка в разовой порции мочи. Гемодинамические параметры определяли при первичном контакте с пациентами. Учет лабораторных показателей выполняли из анализов крови, взятой натощак. Расчет СКФ производился по формуле CKD-EPI, с последующим ранжированием пациентов по стадиям ХБП согласно общепринятой классификации (K/DOQI, 2002) [7].
Всем пациентам была проведена пункционная нефробиопсия для выполнения морфометрического анализа — изучение состояния ткани почек и вазометрии. Вазометрией было принято считать определение структурных особенностей сосудов почек малого диаметра у пациентов с ХГН. Ввиду того, что наиболее доступной для визуализации артерией почек малого диаметра являлась междольковая артерия (МА), параметры ремоделирования сосудистой стенки оценивались по данной артерии. При наличии в биоптате чётко визуализируемой структуры МА пациенты включались в исследование, при отсутствии данных критериев в статистический анализ не входили. В случае косого среза МА в нефробиоптате оценивались параметры наименьшего диаметра, соответствующие значениям диаметров прямого среза (рис. 1).
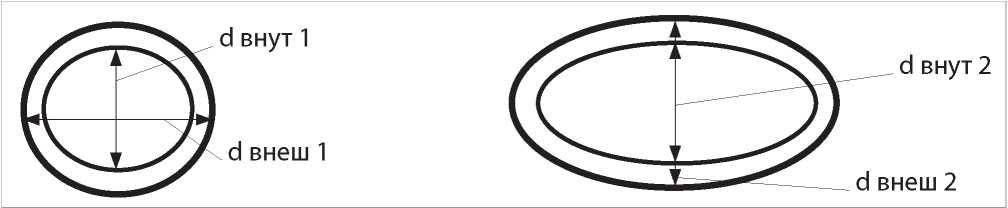
Рисунок 1. Пример измерения диаметров МА в нефробиоптате при различных срезах.
Примечание: d внут 1 = d внут 2, d внеш 1 = d внеш 2, где d внут — внутренний диаметр МА, d внеш — внешний диаметр МА.
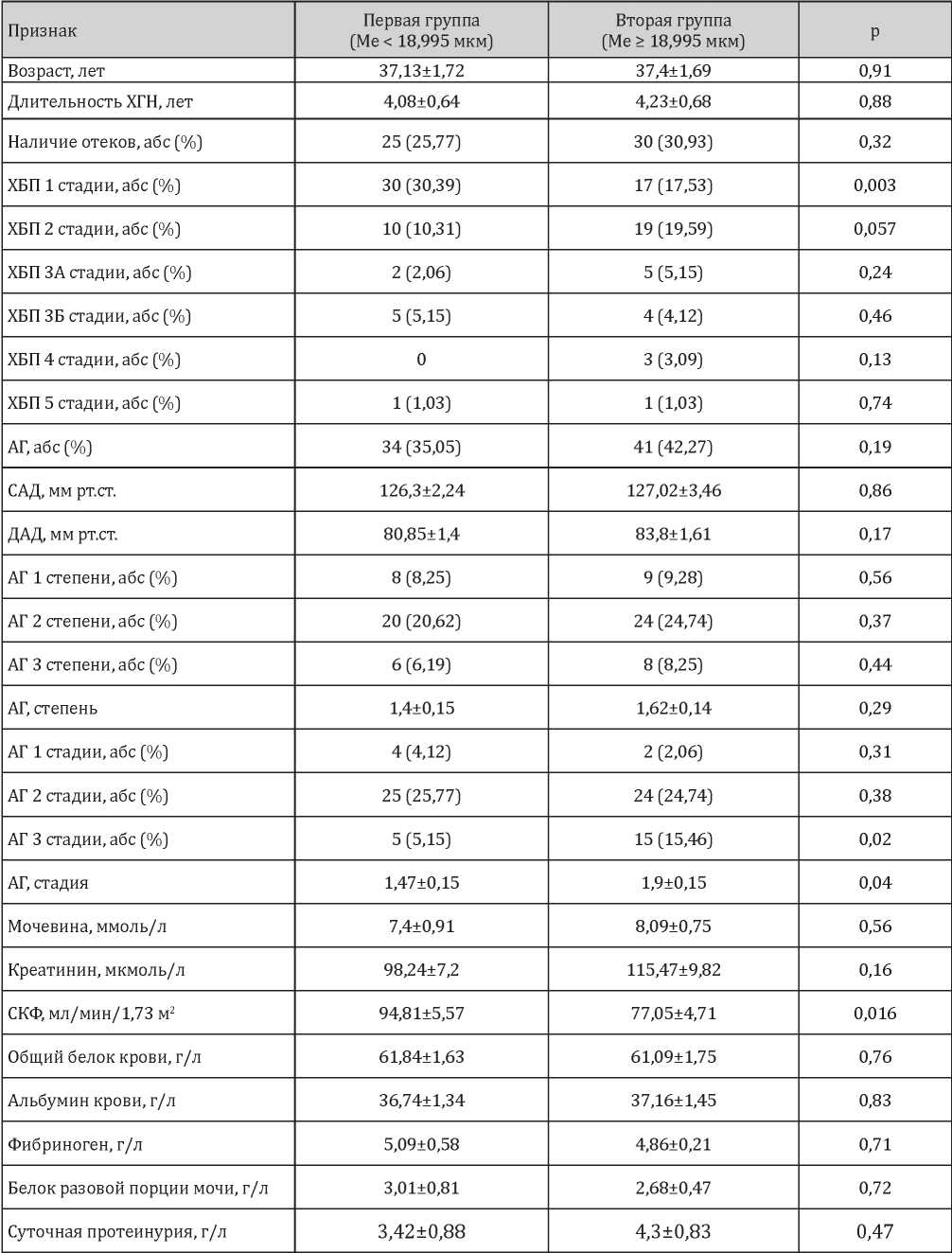
К параметрам структурной перестройки МА относили толщину артериальной стенки. Толщина стенки МА определялась расчётным способом как разница между внешним и внутренним диаметрами. Выбор толщины стенки как показателя ремоделирования артерий обусловлен данными литературы, свидетельствующими о гипертрофном типе ремоделирования сосудов малого диаметра. Поскольку существует недостаточно сведений, касающихся перестройки междольковой артерии и её нормальных параметров, тем более с учётом наличия разной возрастной категории пациентов исследования, для возможности проведения статистического анализа было принято определить медиану толщины стенки МА, которая составила 18,995 мкм. На основании полученных данных проведено ранжирование пациентов в две основные группы с учётом медианных значений. Число пациентов, имеющих толщину сосудистой стенки МА меньше значения медианы, составило 47 больных, больше либо равно медиане — 50 пациентов. Клиническая характеристика двух групп исследования, сформированных на основании медианы толщины стенки МА представлена в табл. 1.
Таблица 1
Сравнительная клиническая характеристика двух групп исследования по медиане толщины стенки междольковой артерии
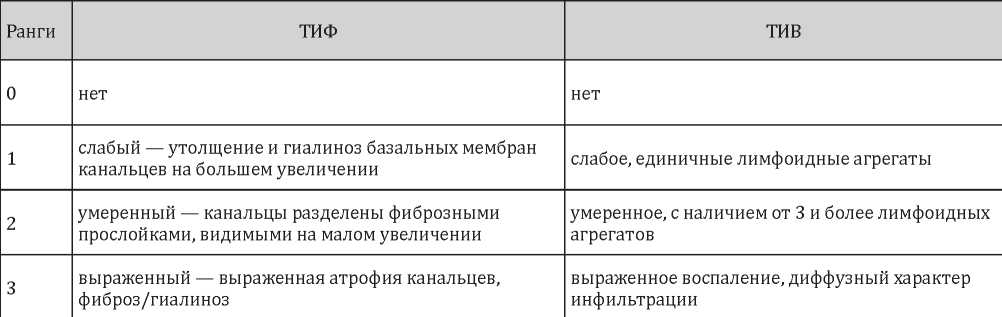
При морфометрическом анализе состояния тубулоинтерстициальной ткани почек учитывались следующие параметры: наличие тубулоинтерстициального фиброза (ТИФ), тубулоинтерстициального воспаления (ТИВ), тубулоинтерстициального компонента (ТИК). За ТИК принимали наличие ТИФ и / или ТИВ. Кроме того, оценивалась выраженность ТИФ и ТИВ, определяемая в рангах (табл. 2).
Таблица 2
Ранги ТИФ и ТИВ с учетом выраженности ремоделирования почечной ткани
Как видно из представленной таблицы, средний уровень АД на момент включения пациентов в исследование находился в диапазоне целевых значений. Все пациенты, имеющие АГ, принимали антигипертензивную терапию.
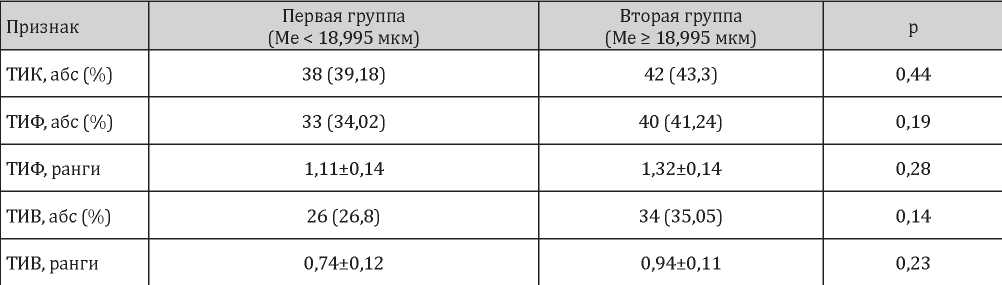
С учётом полученных данных был произведен статистический анализ частоты встречаемости параметров структурной перестройки тубулоинтерстициальной ткани в выделенных группах пациентов (табл. 3).
Таблица 3
Сравнительная морфометрическая характеристика тубулоинтерстициальной ткани в двух группах исследования по медиане толщины стенки междольковой артерии
Морфометрическое исследование проводилось с использованием цифрового микроскопа «Leica DMD108». Пример анализа параметров, оценивающих структурную перестройку междольковой артерии, приведен на рис. 2.
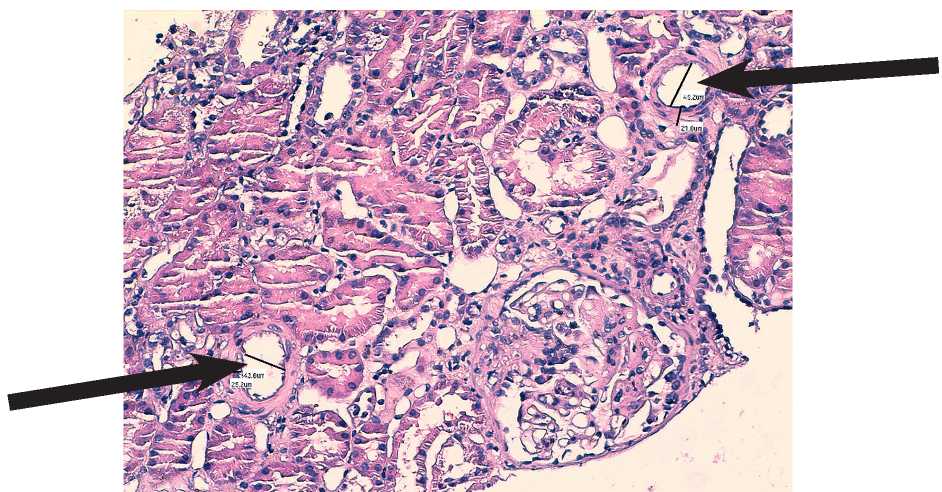
Рисунок 2. Анализ структуры междольковой артерии в нефробиоптате (толстыми стрелками указана локализация МА и техника вазометрии).
Статистический анализ данных проводился с помощью пакета прикладных статистических программ «Statistica 10,0» («Stat Soft», США). Данные представлены в виде средней арифметической ± ошибка средней. Для попарного сравнения независимых групп использовали t-критерий Стьюдента. Для оценки силы связи между изучаемыми переменными вычисляли коэффициент корреляции Пирсона. Нулевую статистическую гипотезу, свидетельствующую об отсутствии различий и связей, отвергали при p > 0,05.
Результаты
Был проведён анализ полученных данных при сравнении двух групп исследования по медиане толщины стенки МА. Как представлено в табл. 1, статистически достоверные отличия были получены в показателях стадий АГ и величины СКФ. У пациентов, имеющих бόльшую толщину стенки МА, стадия АГ больше, а СКФ — меньше по сравнению с больными с меньшей толщиной стенки МА в нефробиоптате. Более того, установлено, что при меньших размерах толщины стенки МА частота встречаемости более легкой стадии ХБП, соответствующей 1 стадии, больше по сравнению с наличием гипертрофированной стенки МА (табл. 1).
При однофакторном нелинейном логистическом регрессионном анализе определено статистически достоверное влияние стадий АГ и величины СКФ на изменение толщины стенки МА. Установлено, что при АГ I стадии риск увеличения толщины стенки составляет 44,4%, АГ II стадии — 54,7%, АГ III стадии — 64,6% (χ2-критерий = 4,24, р = 0,03). Прогнозирование риска ремоделирования стенки МА в зависимости от величины СКФ (χ2-критерий = 5,92, р = 0,015) представлено на рис. 3.
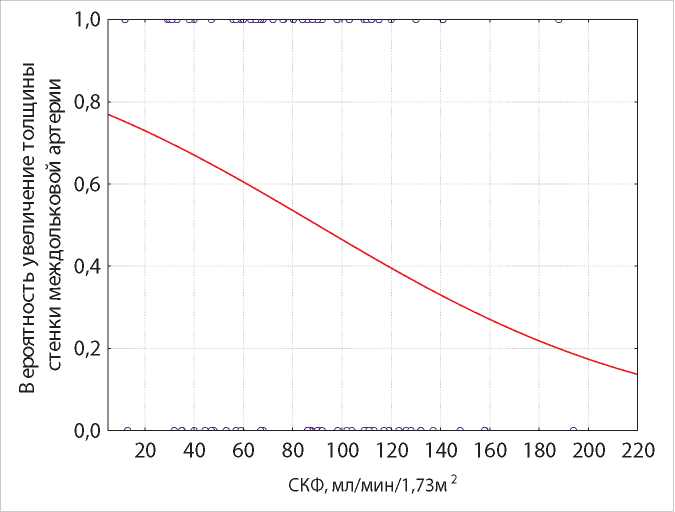
Рисунок 3. Логистическая модель регрессии вероятности увеличения толщины стенки МА у пациентов с первичными ХГН с учетом величины СКФ и уравнение регрессии.
Примечание. Риск увеличения толщины стенки МА = exp * (1,28 – [0,01 * СКФ (мл/мин/1,73м2)]) / (1 + exp * (1,28 – [0,01 * СКФ (мл/мин/1,73 м2)]).
С помощью корреляционного анализа Пирсона выявлена прямая корреляционная зависимость слабой силы между величиной стадий АГ и толщиной стенки МА (r = 0,21, р = 0,038), а также обратная корреляционная зависимость слабой силы между величиной СКФ и толщиной стенки МА (r = - 0,21, р = 0,038) (рис. 4,5).
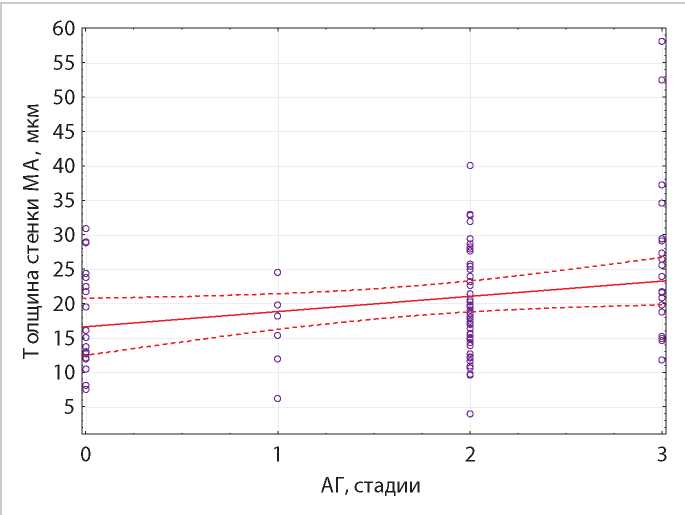
Рисунок 4. Линейная зависимость толщины стенки МА и стадий АГ, уравнение регрессии.
Примечание. Толщина стенки МА = 16,6 + 2,22 * АГ (стадия).
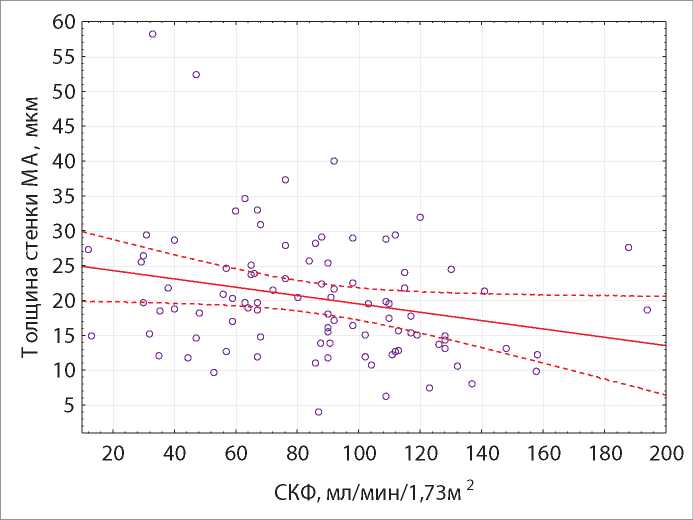
Рисунок 5. Линейная зависимость толщины стенки МА и величины СКФ, уравнение регрессии.
Примечание. Толщина стенки МА = 25,48 - 0,06 * СКФ (мл/мин/1,73м2).
Остальные рассматриваемые факторы риска статистически значимого влияния на риск увеличения толщины стенки МА не показали (р >0,05).
Исследование влияния тубулоинтерстициальных изменений на вероятность ремоделирования артерий почек малого диаметра статистически достоверных значений для ТИК (р = 0,28), ТИФ (р = 0,26), ТИВ (р = 0,2), рангов выраженности ТИФ (р = 0,27), ТИВ (р = 0,22) не показало. Однако установлена прямая корреляционная зависимость слабой силы между выраженностью ТИВ и толщиной стенки МА (r = 0,23, р = 0,02) (рис. 6).
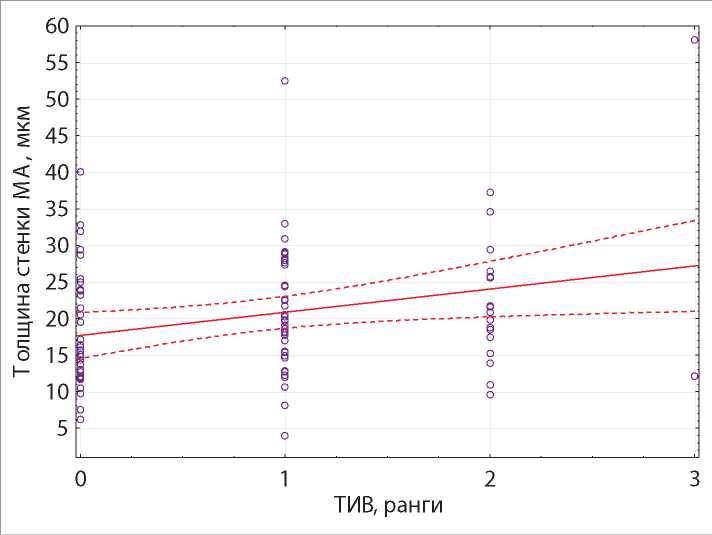
Рисунок 6. Линейная зависимость толщины стенки МА и выраженности ТИВ, уравнение регрессии.
Примечание. Толщина стенки МА = 17,67 + 3,17 * ТИВ (ранги).
Обсуждение
Определение факторов, влияющих на изменение структуры артерий почек малого диаметра, имеет высокое научное и прикладное клиническое значение. Особенно важным данный научно-исследовательский поиск проявляется в когорте пациентов с первичными ХГН, заболеванием с наибольшей распространённостью и социальной значимостью.
Роль АГ в ремоделировании артерий различного калибра, тем более почек, не вызывает сомнений [8]. В проведённом исследовании главной целью являлось определение ведущего механизма в инициировании и прогрессировании структурной перестройки артерий почек малого диаметра при хроническом аутоиммунном заболевании — первичном ХГН. Существует множество исследований, демонстрирующих высокую значимость развития гипертонической нефропатии, то есть формирование ангиосклероза, фокально-сегментарного гломерулосклероза [9], в определении прогноза основного заболевания почек. В основном данные исследования касаются первичного характера артериальной гипертензии, а наличие проявлений дисфункции почек и сосудистого русла, включая микроциркуляторное звено, представляют как поражение органов-мишеней, то есть стадийность персистирующего влияния гемодинамического фактора [10]. Однако данных, представляющих влияние АГ как компонента проявлений первичного почечного поражения, недостаточно. Поскольку формирование структурной перестройки микроциркуляторного русла является важным этапом в прогрессировании ремоделирования почечной ткани, определение механизма повреждения артерий почек малого диаметра у пациентов с ХГН является приоритетным для понимания
в первую очередь методов коррекции данного механизма, тем самым снижая вероятность развития терминальной почечной недостаточности. В нашей работе статистически значимых признаков относительно уровня САД и ДАД, демонстрирующих их влияние на изменение структуры почечных артерий малого диаметра, показано не было. Однако доказана роль АГ, вызвавшей развитие поражения органов-мишеней, в патогенезе утолщения стенки МА. В проведённых нами ранее научно-исследовательских работах были установлены корреляционная и логистическая зависимость, демонстрирующие влияние максимального уровня САД и после приёма антигипертензивной терапии на увеличение толщины интимы междольковой артерии и толщины её стенки [11]. Причём морфологические параметры нефробиопсии, имеющие статистически значимое влияние на ремоделирование МА, также, вероятнее всего, отражали в первую очередь влияние системного гемодинамического фактора (утолщение стенок капилляров, сращение капиллярных петель, облитерация капиллярных петель).
В исследовании продемонстрированы данные о том, что прогрессирующее снижение фильтрационной функции почек является маркером увеличение толщины стенки артерий почек малого диаметра. В результате научно-исследовательского поиска данных, сопоставимых с проведенной нами работой, нет. Выполнение вазометрии отражает наиболее достоверные данные о наличии и выраженности ремоделирования сосудов почек малого диаметра. Однако представлены сведения, являющиеся косвенными признаками изменения структуры почек малого калибра, и их зависимость от окружающего факторного влияния. Так, в работе Chen Q. и соавт. методом регистрации ремоделирования междолевых артерий являлось ультрасонографическое исследование у пациентов с хроническими заболеваниями почек [12]. Выполнялись регистрация скорости пульсовой волны (СПВ) и резистентность кровотока (РК). Кроме того, учитывались тубулоинтерстициальные и гломерулярные изменения, которые регистрировались при морфологическом анализе нефробиоптата, а также СКФ. Авторами установлено, что величина СКФ имела корреляционную зависимость с СПВ и РК междолевой артерии. Выявлена зависимость величин СПВ и РК с морфологическими параметрами состояния ткани почек, в первую очередь с наличием гломерулосклероза. Представленные данные подтверждаются и другими работами, исследование междолевого кровотока в которых проводилось также методом ультразвукового контроля [13]. Однако необходимо отметить известные данные о том, что сонографические признаки ремоделирования артериальной стенки появляются намного позже по сравнению с показателями фильтрационных нарушений.
Таким образом, вероятнее всего, полученные результаты зависимости нарушения фильтрационной функции почек от ремоделирования артериальной стенки МА, являются отражением гемодинамического фактора с поражением органов-мишеней.
Влияние этиологического фактора ХГН на изменение структуры МА маловероятно, поскольку все параметры, отражающие активность аутоиммунного процесса, не имели статистической значимости. В то же время получены сведения, отражающие значимость воспаления тубулоинтерстиция в прогнозировании увеличения толщины сосудистой стенки МА. По нашему мнению, ТИВ носит вторичный характер как проявление поражения почечной ткани, не имеющее связь с аутоиммунной агрессией ХГН. Данное предположение может быть подтверждено многими факторами. Например, в одной из работ представлены данные, демонстрирующие роль активации лейкоцитов в ответ на гипоксическое состояние ткани почек, вызванное любым хроническим почечным заболеванием [14].
Таким образом, среди возможных патогенетических механизмов изменения структуры артерий почек малого диаметра при первичном ХГН показана значимость влияния гемодинамического фактора артериальной гипертензии, а статистически достоверные данные в отношении других показателей являются, на наш взгляд, в большинстве случаев следствием гемодинамической перегрузки. Полученные нами результаты могут служить основой для дальнейшего поиска патогенетических механизмов ремоделирования микроциркуляторного русла и уточнения представленных данных.
Заключение
В проведённой работе показана значимость АГ, сопровождающейся поражением органов-мишеней, как маркера ремоделирования сосудистой стенки МА. Полученные результаты имеют высокое прикладное значение в качестве эффективного клинического инструмента профилактики прогрессирования почечной дисфункции. На основании представленных данных возможна дополнительная стратификация риска осложнений у пациентов с первичным ХГН, а также определение тактики ведения пациентов, направленной на замедление поражения органовмишеней.
Продемонстрированные данные статистически высоко значимы, поскольку методом их определения являлся наиболее точный анализ состояния микроциркуляторного сосудистого русла и тубулоинтерстиция — морфометрический анализ нефробиоптата с выполнением вазометрии. Представленные сведения могут являться основой для дальнейшего научно-исследовательского поиска, направленного в первую очередь на определение роли иммуновоспалительного характера в ремоделировании почечных артерий малого диаметра.
Список литературы
1. D, Sahota A, McCrory C, Hladunewich MA, Gill J, et al. Socioeconomic Position and Incidence of Glomerular Diseases. Clin J Am Soc Nephrol. 2020;15(3):367-374. DOI: 10.2215/CJN.08060719
2. Батюшин М.М., Дмитриева О.В., Терентьев В.П., Давиденко К.С. Расчетные методы прогнозирования риска развития анальгетического интерстициального поражения почек. Терапевтический архив. 2008;80(6):62-65. eLIBRARY ID: 23775755
3. Левицкая Е.С., Батюшин М.М., Пасечник Д.Г., Асрумян Э.Г. Ремоделирование почечных артерий — инициатор и мишень кардиоренального континуума. Кардиоваскулярная терапия и профилактика. 2015;14(1):90-96. DOI: 10.15829/1728-8800-2015-1-90-96
4. Gigante A, Barbano B, Di Mario F, Rosato E, Simonelli M, Rocca AR, et al. Renal parenchymal resistance in patients with biopsy proven glomerulonephritis: Correlation with histological findings. Int J Immunopathol Pharmacol. 2016;29(3):469-74. DOI: 10.1177/0394632016645590
5. Al-Katib S, Shetty M, Jafri SM, Jafri SZ. Radiologic Assessment of Native Renal Vasculature: A Multimodality Review. Radiographics. 2017;37(1):136-156. DOI: 10.1148/rg.2017160060
6. Agarwal R. Why does renal resistive index predict mortality in chronic kidney disease? Hypertension. 2015;66(2):267-9. DOI: 10.1161/HYPERTENSIONAHA.115.05690
7. Моисеев В.С., Мухин Н.А., Смирнов А.В., Кобалава Ж.Д., Бобкова И.Н., Виллевальде С.В., и др. Сердечно-сосудистый риск и хроническая болезнь почек: стратегии кардио-нефропротекции. Российский кардиологический журнал. 2014;(8):7-37. DOI: 10.15829/1560-4071-2014-8-7-37
8. Литвинова М.С., Хаишева Л.А., Шлык С.В. Резистентная гипертония: фокус на поражение сосудистого русла. Южно-Российский журнал терапевтической практики. 2020;1(3):16-26. DOI: 10.21886/2712-8156-2020-1-3-16-26.
9. Ovrehus MA., Oldereid TS, Dadfar A, Bjørneklett R, Aasarod KI., Fogo AB., et al. Clinical Phenotypes and Long-term Prognosis in White Patients With Biopsy-Verified Hypertensive Nephrosclerosis. Kidney Int Rep. 2020;5:339–347. DOI: 10.1016/j.ekir.2019.12.010.
10. Gulek В, Soker G, Erken E, Adam FU, Varan HI, Ada S, et al. The Usefulness of Renal Doppler Parameters in Chronic Kidney Disease: Is There a Cut-Off Value to Estimate End Stage Kidney Disease? Open Journal of Radiology. 2016;6(1):64450. DOI: 10.4236/ojrad.2016.61003.
11. Левицкая Е.С., Батюшин М.М., Пасечник Д.Г., Антипова Н.В. Прогнозирование ремоделирования ткани почек с учетом структурных изменений почечных артерий малого диаметра. Нефрология. 2016;20(5):55-61. eLIBRARY ID: 26727707 Chen Q, He F, Feng X, Luo Z, Zhang J, Zhang L, et al. Correlation of Doppler parameters with renal pathology: A study of 992 patients. Exp Ther Med. 2014;7(2):439-442. DOI: 10.3892/etm.2013.1442
12. Hanamura K, Tojo A, Kinugasa S, Asaba K, Fujita T. The resistive index is a marker of renal function, pathology, prognosis, and responsiveness to steroid therapy in chronic kidney disease patients. Int J Nephrol. 2012;2012:139565. DOI: 10.1155/2012/139565
13. Fu Q, Colgan SP, Shelley CS. Hypoxia: The Force that Drives Chronic Kidney Disease. Clin Med Res. 2016;14(1):15-39. DOI: 10.3121/cmr.2015.1282
Об авторах
Е. С. ЛевицкаяРоссия
Левицкая Екатерина Сергеевна, д.м.н., доцент кафедры внутренних болезней №2
Ростов-на-Дону
М. М. Батюшин
Батюшин Михаил Михайлович, д.м.н., проф., профессор кафедры внутренних болезней №2
Ростов-на-Дону
Е. А. Синельник
Синельник Елена Александровна, заведующая патологоанатомическим отделением
Ростов-на-Дону
А. Д. Багмет
Багмет Александр Данилович, д.м.н., проф., заведующий кафедрой поликлинической терапии
Ростов-на-Дону
А. А. Мокрушин
Мокрушин Александр Аркадьевич, фармаколог-биолог, магистр биологии
Ростов-на-Дону
М. Д. Черкашина
Черкашина Марина Дмитриевна, старший фармаколог, специалист биологии
Ростов-на-Дону
И. Е. Чумакова
Чумакова Ирина Евгеньевна, заместитель директора
Ростов-на-Дону
Н. И. Гапоненко
Гапоненко Наталья Игорьевн, к.хим.н., руководитель аналитической лаборатории
Ростов-на-Дону
М. И. Нажева
Нажева Марина Ибрагимовна, к.м.н., доцент кафедры внутренних болезней №2
Ростов-на-Дону
Дополнительные файлы
Рецензия
Для цитирования:
Левицкая Е.С., Батюшин М.М., Синельник Е.А., Багмет А.Д., Мокрушин А.А., Черкашина М.Д., Чумакова И.Е., Гапоненко Н.И., Нажева М.И. Прогнозирование ремоделирования артерий почек малого диаметра у пациентов с хроническим гломерулонефритом. Южно-Российский журнал терапевтической практики. 2021;2(2):44-55. https://doi.org/10.21886/2712-8156-2021-2-2-44-55
For citation:
Levickaja E.S., Batiushin M.M., Sinel’nik E.A., Bagmet A.D., Mokrushin A.A., Cherkashina M.D., Chumakova I.E., Gaponenko N.I., Nazheva M.I. Prediction of remodeling of arteries of kidneys of small diameter in patients with chronic glomerulonephritis. South Russian Journal of Therapeutic Practice. 2021;2(2):44-55. (In Russ.) https://doi.org/10.21886/2712-8156-2021-2-2-44-55
JATS XML


























