Перейти к:
Критическая коагулопатия у пациента с тяжелым течением COVID-19
https://doi.org/10.21886/2712-8156-2022-3-3-91-96
Аннотация
Важной особенностью патогенеза тяжелого течения новой коронавирусной инфекции (COVID-19) является разнообразие нарушений в свертывающей системе крови, что характеризуется усилением тромботических и микрососудистых осложнений. Аномальная коагулопатия напрямую взаимосвязана с риском летального исхода у больных COVID-19. Пациенты с COVID-19 имеют разнообразные изменения системы гемостаза, подобно синдрому диссеминированного внутрисосудистого свертывания (ДВС), тромботической микроангиопатии или антифосфолипидному синдрому, что является результатом сочетания воспаления с эндотелиальной дисфункцией, тромбоцитопенией потребления, тромбозом сосудов микроциркуляторного русла. Точный механизм коагулопатии, связанной с COVID, все еще выясняется, но, учитывая вероятную многофакторность этиопатогенеза, потенциирующие взаимодействия между иммунной системой и системой гемостаза в настоящее время возможно использование термина ковид - ассоциированная коагулопатия. Мы сообщаем о летальном случае 51-летнего мужчины с тяжелой тромбоцитопенией, значительным повышением фибринолитической активности системы гемостаза, развитием кожно-геморрагического синдрома и тромботических осложнений (инфаркт миокарда), вероятно связанных с развитием ДВС-синдрома на фоне тяжелого течения COVID-19, осложненного тяжелым острым респираторным синдромом (ТОРС). Этот случай подчеркивает необходимость дополнительных исследований механизмов развития коагулопатии при COVID-19 для предотвращения тяжелого течения заболевания и летальных исходов.
Ключевые слова
Для цитирования:
Рощина А.А., Юпатова М.И., Никитина Н.М. Критическая коагулопатия у пациента с тяжелым течением COVID-19. Южно-Российский журнал терапевтической практики. 2022;3(3):97-107. https://doi.org/10.21886/2712-8156-2022-3-3-91-96
For citation:
Roshchina A.A., Yupatova M.I., Nikitina N.M. Markable coagulopathy in the patient with severe COVID-19. South Russian Journal of Therapeutic Practice. 2022;3(3):97-107. (In Russ.) https://doi.org/10.21886/2712-8156-2022-3-3-91-96
Введение
Начиная с декабря 2019 г. мир «накрыла волна» заболеваемости COVID-19. Менее чем через 18 месяцев после начала пандемии во всем мире зарегистрировано около двухсот миллионов подтверждённых случаев заболевания и четыре миллиона смертей [1]. Важной особенностью патогенеза тяжёлого острого респираторного синдрома является коагулопатия, ассоциированная с COVID-19, характеризующаяся усилением тромботических и микрососудистых осложнений. Уже в ранних отчётах из Китая описывалось, что риск смертельного исхода от тяжелой инфекции SARS-CoV-2 связан с аномальными нарушениями в свертывающей системе крови, подобными ДВС-синдрому [2]. В этом исследовании 71% умерших пациентов с COVID-19 соответствовали критериям ДВС-синдрома Международного общества тромбоза и гемостаза ISTH [3].
В целом частота развития ДВС-синдрома при COVID-19 невысока, составляя, по данным разных исследователей, от 1 до 8,7% даже при тяжёлом течении, что гораздо реже, чем при сепсисе, где ДВС-синдром встречается примерно в 30% случаев [2]. Наряду с прогрессированием COVID-19 присоединение вторичной инфекции и развитие бактериального сепсиса несомненно вносят свой вклад в частоту развития тяжёлой коагулопатии у данной категории пациентов.
Существуют некоторые различия между традиционным ДВС-синдромом, наблюдаемым при сепсисе, и коагулопатией, развивающейся у пациентов с тяжёлой формой COVID-19. Так, ДВС-синдром при сепсисе обычно приводит к более выраженной коагулопатии потребления и тромбоцитопении по сравнению с коагулопатией, наблюдаемой у пациентов с COVID-19 [4], у которых чаще возникают тромбозы, нежели кровотечения из-за гиперфибринолиза [5]. При инфекции SARS-CoV-2 нередко наблюдается склонность к развитию вторичной тромботической микроангиопатии (ТМА), поражающей сосудистую сеть лёгких, периодически сочетающейся с микроангиопатией в руслах других органов [6–7]. Критерием диагноза ТМА является комбинация таких признаков, как тромбоцитопения, микроангиопатическая гемолитическая анемия, микроваскулярный тромбоз концевых артериол и капилляров с множественной дисфункцией органов. Высказывалось предположение, что локальные лёгочные тромбы (в отличие от тромбоэмболии легочной артерии (ТЭЛА)) при новой коронавирусной инфекции могут развиваться вследствие повреждения лёгочных сосудов и тяжёлого локального воспаления, вызванного вирусом SARS-CoV-2 [7]. Изменения некоторых показателей гемостаза наряду с маркерами воспаления коррелируют с тяжестью заболевания у пациентов с COVID-19. В частности, повышение уровня фибриногена, продуктов деградации фибриногена, С-реактивного белка (СРБ), интерлейкина-6 (ИЛ-6), скорости оседания эритроцитов (СОЭ) и D-димера напрямую взаимосвязано с тяжестью заболевания [8–10]. Развитие «цитокинового шторма» на фоне COVID-19, вызванное неконтролируемой активацией цитотоксических Т-лимфоцитов и естественных киллеров, приводит к повышенной секреции интерферона-γ, фактора некроза опухоли-α и интерлейкина-1β,2,6,12, 16, что в конечном итоге приводит к гиперактивации макрофагов, подобный процесс запускает неконтролируемый системный воспалительный ответ и каскад микро- и макроваскулярных осложнений [10].
Известно, что COVID-19 способствует нарушению системы гемостаза по определённым механизмам. Во-первых, сам вирус непосредственно взаимодействует с рецептором ангиотензинпревращающего фермента 2 на эндотелиальных клетках, что вызывает тяжёлое эндотелиальное воспаление с последующим сдвигом в сторону прокоагулянтного состояния и микрососудистой коагулопатии [11]. Во-вторых, микроорганизмы накапливают полифосфаты, которые активируют контактный путь свертывания крови [12]. В-третьих, активируется комплемент, тромбоциты и цитокины, такие как ИЛ-6, вызывая эндотелиальное повреждение. Также имеются данные об обнаружении антифосфолипидных антител у пациентов с COVID-19 в критическом состоянии [13]. Инфекции, в том числе COVID-19, считаются триггерными факторами антифосфолипидного синдрома (АФС), в том числе катастрофического, однако никаких доказательств этого найдено не было, так как не выяснено, являются ли эти антитела реактивными или они сами являются одной из причин развития тромбоза [14]. Критерием диагноза АФС является сочетание признаков сосудистого тромбоза с наличием лабораторных маркеров — волчаночного антикоагуляната, антител к кардиолипину, бета-2-гликопротеину.
С учётом сложности этиопатогенеза нарушений системы гемостаза при COVID-19 появился общий термин для описания этих изменений — «ковид-ассоциированная коагулопатия» (КаКП). Условно выделяют три стадии: первая (характеризующаяся повышением уровня D-димера), вторая (характеризующаяся повышением уровня D-димера параллельно с умеренным удлинением протромбинового времени (ПТВ), международного нормализованного отношения (МНО) и активизированного частичного тромбопластинового времени (АЧТВ) и легкой тромбоцитопенией), третья (соответствующая критическому состоянию пациента, в то время как результаты лабораторных исследований приближаются к классическому ДВС-синдрому [15]). КаКП сочетает в себе отдельные особенности различных нарушений гемостаза, однако отличается от каждого из них в целом [16]. Клинические проявления КаКП также весьма противоречивы. Так, среди пациентов, госпитализированных с COVID-19 в отделение интенсивной терапии, осложнения со стороны гемостаза были выявлены у 40%. Интересно, что возникали как венозные (79 %), так и артериальные (21 %) тромбозы [17]. Геморрагические осложнения были обнаружены у 21 % пациентов с критически тяжёлым течением COVID-19 [18]. H. Al-Samkari и соавт. (2020) к предикторам кровотечения относят тромбоцитопению менее 150×109 /л и уровень D-димера более 2500 нг/мл [19]. К дополнительным факторам риска развития гематом у больных новой коронавирусной инфекцией относят пожилой и старческий возраст, наличие сахарного диабета [20].
Обобщая результаты проведённых исследований, можно сделать заключение о том, что коагулопатия при COVID-19, наиболее вероятно, является результатом сочетания воспаления с эндотелиальной дисфункцией, ДВС-синдрома, тромбоза сосудов микроциркуляторного русла, что напрямую взаимосвязано с тяжестью заболевания. Точный механизм нарушений в системе гемостаза при COVID-19 всё ещё выясняется, но уже очевидна его многофакторность.
Клиническое наблюдение
Приводим клиническое наблюдение развития тяжёлой ковид-ассоциированной коагулопатии на фоне инфекции SARS-CoV-2.
Мужчина, 51 год, заболел остро 8 июня 2020 г. с повышением температуры тела до 37,5–38,6°C, спустя три дня появился сухой кашель, потеря обоняния, чувство заложенности в грудной клетке. Лечился самостоятельно жаропонижающими средствами (парацетамол 3 грамма в сутки) с кратковременным эффектом. Спустя 3–4 дня появилась одышка в покое, смешанного характера, температура тела повысилась до гектических цифр: 39–39,5°C, в связи с чем был госпитализирован в районную больницу города Маркс (Саратовская область), где на 5-ый день от начала болезни (13 июня 2020) по результатам рентгенографии органов грудной клетки выявлены двусторонние полиморфные очаговые тени, склонные к слиянию, ориентировочно 50% поражения, диагностирована двусторонняя полисегментарная пневмония. При анализе мазка носоглотки методом полимеразной цепной реакции (ПЦР) к РНК Sars-Cov-2 получен положительный результат. В районной больнице проводилось лечение раствором Цефтриаксона 4 грамма в сутки внутривенно капельно, Дексаметазоном 20 мг в сутки внутривенно струйно, инфузионная терапия с эуфиллином в объёме 400 мл/сутки, однако одышка прогрессивно усиливалась (ЧДД 24–26 в минуту), сохранялась гипертермия до 38,5оС, нарастала слабость.
18 июня 2020 г. (10-ые сутки от начала заболевания) пациент был доставлен бригадой скорой медицинской помощи в приёмное отделение инфекционной больницы по борьбе с новой коронавирусной инфекцией (Перинатальный центр) г. Саратова по экстренным показаниям в связи с нарастающей дыхательной недостаточностью (ДН).
Из анамнеза известно, что пациент страдает сахарным диабетом 2 типа в течение 5-ти лет, регулярно принимает пероральные сахароснижающие средства (Глимепирид — 4 мг дважды в день, Метформин — 1000 мг один раз в день), не курит. В течение последних 7–8 лет отмечается артериальная гипертензия с повышением артериального давления (АД) до 160/100 мм рт. ст. максимально, регулярной антигипертензивной терапии не получает.
При поступлении (10-ый день заболевания) пациент предъявляет жалобы на выраженную слабость, одышку смешанного характера, кашель с трудноотделяемой желтоватой мокротой и повышение температуры тела до 39°C. При объективном осмотре сознание ясное, кожа обычной окраски, влажная, положение активное, частота дыхательных движений — 23–24 в минуту, сатурация гемоглобина кислородом (SpO2) 89–90% при дыхании атмосферным воздухом, АД — 125 и 80 мм рт.ст., тоны сердца приглушены, аритмичны, частота сердечных сокращений (ЧСС) — 92–100 в минуту. Индекс массы тела (ИМТ) — 32,5 кг/м2 (ожирение 1 степени). С учётом выраженной интоксикации, гектической лихорадки, кашля с мокротой, изменений на рентгенограмме, снижения SpO2 ниже 90%, тахикардии, нормального уровня АД состояние расценено, как тяжёлое, суммарный балл, согласно протоколу оценки тяжести состояния пациента (NEWS), — 9 (≥7, высокий). В приёмном отделении выставлен диагноз — «U07.1 Коронавирусная инфекция, вызванная вирусом COVID-19, вирус идентифицирован, тяжёлое течение. J18.8 Двусторонняя полисегментарная пневмония, Ro 2, тяжёлое течение, осложнённая ДН 1–2 степени).
В общем анализе крови (ОАК) при поступлении отмечался лейкоцитоз до 19,6×109/л, уровень лимфоцитов — 4,2×109/л, эритроцитов — 4,14×109/л, гемоглобин — 148 г/л, обращала на себя внимание умеренная тромбоцитопения 80х109/л. По данным биохимического анализа крови при поступлении, выявлено значительное повышение уровня острофазовых показателей: высокочувствительного С-реактивного белка (вч СРБ) — до 36 мг/л (норма до 5 мг/л), ферритина — до 662 мкг/л (норма 20–250 мкг/л), а также повышение креатинин фосфокиназы (КФК) до 1351 ЕД/л (норма 26–174 ЕД/л), экспресс-тест на тропонин I положительный (качественным методом, при наличии в пробе cTn I в концентрации выше чувствительности и cut-off, равной 0,5 нг/мл), повышение уровня трансаминаз (АЛТ — 166 Ед/л (до 40 Ед/л), АСТ — 385 Ед/л (до 40 Ед/л)), выявлены нарушения азотистого и углеводного обмена (креатинин — 160 мкмоль/л (норма 62–115 мкмоль/л), мочевина — 22,8 ммоль/л (норма — 3,2–7,3 ммоль/л), глюкоза — 12,6 ммоль/л (норма 3,7-6,1 ммоль/л), электролиты (калий, натрий, магний, хлориды) — в пределах нормы. По результатам коагулограммы отмечалось повышение Д-димера до 1200 нг/мл (норма до — 500 нг/мл), ПТВ 19,3 секунд (11–16 секунд), остальные параметры оставались в пределах нормы: АЧТВ — 25,6 секунд (норма 21,1–36,5 секунд), фибриноген — 3,6 г/л (норма 2–4 г/л).
При выполнении ЭКГ диагностирована фибрилляция предсердий с ЧСС 90–105 ударов в минуту (рис. 1).
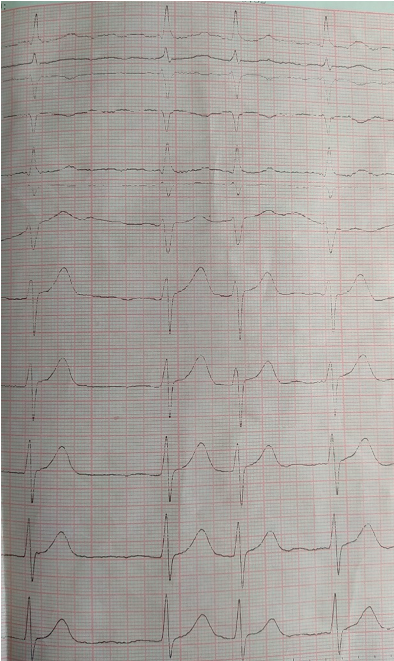
Рисунок 1. На ЭКГ нерегулярные интервалы RR, отсутствие зубцов P, волна фибрилляции f с различной амплитудой и формой. Электрическая ось сердца резко отклонена влево, QRS — 0,08 сек, QTс — 0,32 сек.
В стационаре проводилась постоянная оксигенотерапия увлажнённым кислородом со скоростью потолка 5–6 л в минуту через лицевую нереверсивную маску с резервным мешком, на фоне которой SpO2 составляла 95%. С учётом длительности заболевания, сохранения гектической лихорадки, наличия лейкоцитоза, гнойного характера мокроты нельзя было исключить присоединение бактериальной инфекции. Произведена смена антибактериальной терапии, проводимой амбулаторно в течение 5 дней. Назначены защищенные цефалоспорины 3-го поколения (раствор Цефоперазона с сульбактамом 1+1 грамма два раза в сутки внутривенно капельно), а также антикоагулянтная терапия в профилактической дозе (раствор Эноксапарин натрия 0,4 мл подкожно 1 раз в сутки) в соответствии с временными методическими рекомендациями «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19), 7 версия от 03.06.2020» [21], продолжена пероральная гипогликемическая терапия, назначены β-блокаторы (бисопролол 5 мг в сутки) с целью реализации стратегии ЧСС-контроль при фибрилляции предсердий неустановленной давности.
При наблюдении в течение суток обращало на себя внимание повышение лабораторных маркеров повреждения миокарда при отсутствии клинических признаков острого коронарного синдрома и соответствующих изменений на ЭКГ, что могло соответствовать острому повреждению миокарда, согласно четвертому универсальному определению инфаркта миокарда (Европейское Общество Кардиологов, 2018) [22] на фоне COVID-19. Отмечено появление точечных, сливных геморрагий и экхимозов на коже верхних и нижних конечностей, живота. Сохранялась выраженная тромбоцитопения (80-90 х109/л), по данным коагулограммы — коагулопатия потребления с активацией местного фибринолиза, удлинение протромбинового времени (ПТВ) более чем в два раза от исходного, резкое снижение уровня фибриногена, повышение Д-димеров до 1600 нг/мл, нарастание уровня трансаминаз до 10 норм. Обсуждалось развитие второй-третьей стадии ДВС-синдрома, вторичной ТМА, антифосфолипидного синдрома. Необходимо отметить, что для диагностики ДВС-синдрома основополагающими являются тесты определения содержания в крови растворимых фибрин-мономерных комплексов (РФМК) или продуктов деградации фибриногена (ПДФ), что свидетельствует об активизации фибринолиза, характерного для ДВС, однако определение Д-димеров является широкодоступной альтернативой в условиях стационарного обследования с использованием шкалы ДВС Международного общества тромбоза и гемостаза (ISTH) (3).
На 12-ый день от начала заболевания, учитывая сохраняющуюся гипертермию до 38,5оС и появление кашля с отделением гнойной мокроты на фоне продолжающейся антибактериальной терапии, нарастание лейкоцитоза до 18×109/л, уровня вч СРБ — до 85 мг/л, роста уровня прокальцитонина крови (ПТК) — до 1,2 нг/мл (норма — менее 0,05 нг/мл), к лечению добавлен второй антибактериальный препарат — респираторный фторхинолон (Левофлоксацин 500 мг внутривенно капельно 1 раз в сутки). Вновь обсуждалась высокая вероятность развития бактериального сепсиса.
Несмотря на постоянную кислородотерапию потоком 5–6 л/мин., одышка нарастала, SpO2 не превышала 93%, при дыхании атмосферным воздухом быстро снижалась до 86–85%. Была увеличена скорость потока кислорода до 10 л в минуту, к лечению добавлены системные пероральные глюкокортикоиды (ГК) (метилпреднизолон, 24 мг в сутки). С учётом декомпенсации углеводного обмена больной был переведён на инсулинотерапию (24 ЕД в сутки), доза антикоагулянтов в связи с развитием геморрагического синдрома и выраженной тромбоцитопенией не повышалась.
На 15-ый день заболевания в связи с прогрессированием тяжёлого острого респираторного синдрома (одышка в покое, ЧДД — 25 в минуту, снижение SpO2 до 84 % на фоне постоянной оксигенотерапии 10 л в минуту) и кожного геморрагического синдрома больной по тяжести состояния был переведён в отделение реанимации и интенсивной терапии (ОРИТ).
При осмотре в ОРИТ визуализировались множественные сливающиеся экхимозы, подкожные кровоизлияния по всему телу, особенно в области живота, коленных суставов, предплечий, голеней, местах подкожных инъекций с образованием булл, заполненных серозно-геморрагическим содержимым, развитием эпидермолиза кожи верхних и нижних конечностей (рис. 2–6). В ОАК нарастал лейкоцитоз (23,0×109/л) с нейтрофильным сдвигом, появилась анемия лёгкой степени, отмечено резкое падение уровня тромбоцитов до 31×109/л. Уровень вч СРБ составил 135 мг/л, ПКТ крови — 2 нг/мл. Риск госпитальной летальности вследствие полиорганной недостаточности у больного с вероятным сепсисом был расценен как высокий (SOFA — 9 баллов). Начата неинвазивная искусственная вентиляция лёгких (ИВЛ) с постоянным положительным давлением (режим CPAP) 10 см водного столба. На этом фоне SрO2 увеличилась до 94%. При исследовании кислотно-основного состояния (КОС) артериальной крови диагностировано компенсированное состояние: pH крови — 7,35, pСО2 — 45 мм рт ст, рО2 — 110 мм рт ст. В связи с неуклонным нарастанием лейкоцитоза высокий уровень ПКТ произведена смена антибактериальной терапии (добавлен антибиотик из группы карбапенемов Меропенем 3 г в сутки внутривенно капельно в сочетании с респираторным фторхинолоном Моксифлоксацин 400 мл в сутки внутривенно капельно), инфузионная терапия до 500 мл внутривенно капельно в сутки, парентеральное введение системных ГКС с увеличением дозы (Дексаметазон, 36 мг, в сутки внутривенно струйно), петлевых диуретиков (Фуросемид, 40 мг, внутривенно струйно), продолжена инсулинотерапия с увеличением дозы по уровню гликемии (54 ЕД инсулина короткого действия подкожно в сутки).

Рисунок 2. Подкожные экхимозы ладоней, пальцев, геморрагии околоногтевой, подногтевой зон. Фотография с разрешения пациента.

Рисунок 3. Подкожные геморрагии предплечий, туловища, везикулы, буллы, заполненные серозным содержимым, десквамация эпидермиса с раневой поверхностью. Фотография с разрешения пациента.
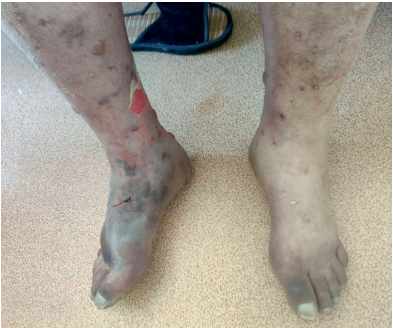
Рисунок 4. Кожно-геморрагический синдром нижних конечностей, крупные буллы с серозным содержимым, трофические нарушения, подкожные гематомы. Фотография с разрешения пациента.
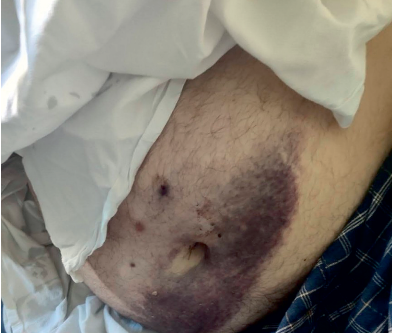
Рисунок 5. Подкожные гематомы, экхимозы живота в зоне инъекций гепарина. Фотография с разрешения пациента.

Рисунок 6. Подкожные гематомы, экхимозы плеча и предплечья. Фотография с разрешения пациента.
На 17-ый день от начала заболевания (25.06.2020) на фоне продолжающейся CPAP-терапии (PEEP — 11 см водного столба, FiO2 — 100%) у пациента произошло резкое снижение АД до 70/40 мм рт. ст, при этом болей в области сердца не отмечалось. На ЭКГ (рис. 7) появилась бифасцикулярная блокада — блокада передней ветви левой ножки пучка Гиса (ЛНПГ) и полная блокада правой ножки пучка Гиса (ПНПГ) на фоне сохраняющейся фибрилляции предсердий с ЧСС 120–130 в минуту. Тропониновый тест — положительный (качественным методом). По результатам коагулограммы отмечалось критическое снижение фибриногена (0,8 г/л), увеличение ПТВ в 2,5 раза, АЧТВ — в 3 раза, МНО — 6,5 с высоким риском кровотечения, уровень тромбоцитов в периферической крови снижен до 35×109/л, что свидетельствовало о преобладающей фибринолитической фазе коагулопатии.
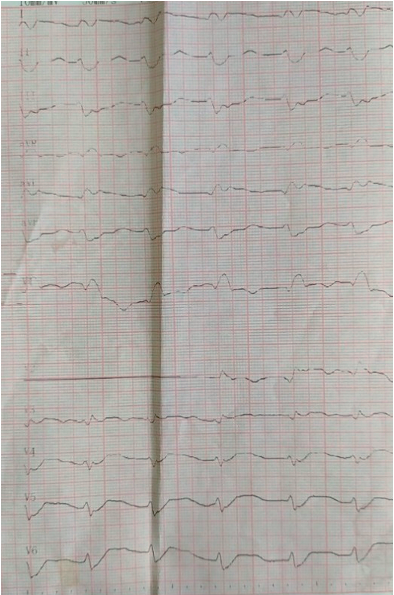
Рисунок 7. На ЭКГ фибрилляция предсердий тахисистолической формы с ЧСС 120–130 в минуту, электрическая ось сердца резко отклонена влево. Блокада передней ветви левой ножки пучка Гиса, полная блокада правой ножки пучка Гиса (QRS 0,12 секунд), QTс 0,30 секунд.
Внезапная гипотония, появление маркеров повреждения миокарда, изменения на ЭКГ (новая блокада ЛНПГ), коагулопатия потребления позволили заподозрить острый тромбоз в системе коронарных артерий, диагностировать острый инфаркт миокарда передней стенки левого желудочка с подъёмом сегмента ST, осложнённый острой левожелудочковой недостаточностью Killip 4 (кардиогенный шок). Отсутствие болевого синдрома объяснялось наличием сахарного диабета с нейропатией, тяжёлым состоянием больного. Однако похожая симптоматика могла быть результатом тромбоэмболии ветвей лёгочной артерии или локальным тромбообразованием in situ в системе легочных артерий — резкая гипотония, тахисистолическая форма фибрилляции предсердий, полная блокада ПНПГ.
Начата инфузия вазопрессоров (допамин 3 мкг/кг/час внутривенно капельно в виде непрерывной инфузии при помощи инфузомата), антикоагулянтная терапия (гепарин 1000 ЕД/час внутривенно струйно), двойная дезагрегантная терапия (нагрузочные дозы ацетилсалициловой кислоты (250 мг) и тикагрелора (180 мг), затем в поддерживающей). С учётом ограничений маршрутизации больных, связанных с COVID-19 в первую волну инфекции, перевод пациента в высокоспециализированный сосудистый центр, отделение рентгенохирургических методов диагностики и лечения был невозможен, выполнение ангиографии лёгочных артерий также было затруднено, продолжено лечение в условиях ОРИТ ковид-госпиталя. Основная проблема у больных с острым коронарным синдромом (ОКС) на фоне тромбоцитопении заключается в принятии решения о возможности проведения чрескожного коронарного вмещательства (ЧКВ) и назначении антитромбоцитарных препаратов. В настоящее время нет основанных на убедительной доказательной базе рекомендаций, предлагающих оптимальный подход к ведению таких больных. Литературные данные этому по вопросу противоречивы, часть проведённых исследований свидетельствует о неблагоприятном клиническом и прогностическом значении тромбоцитопении при ОКС, другие же не показали неблагоприятного влияния тромбоцитопении на клинические проявления и долгосрочный прогноз [23].
К концу 17-го дня болезни показатели коагулограммы достигли пика по уровню АЧТВ, ПТВ, уровень фибриногена снизился до минимальных значений, прогрессировала тромбоцитопения (рис. 8), при этом Д-димеры были повышены до 2000 нг/мл.
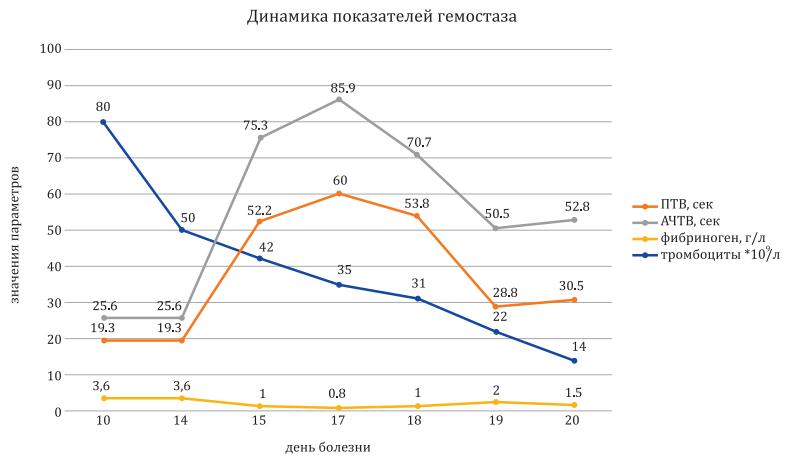
Рисунок 8. Показатели коагулограммы больного в течение 20 дней заболевания COVID-19
Помимо кожно-геморрагического синдрома, впервые была выявлена гематурия (40 эритроцитов в поле зрения в общем анализе мочи), что характерно для терминальной стадии ДВС-синдрома, которая характеризуется генерализованным фибринолизом, возможными паренхиматозными кровотечениями, петехиальными высыпаниями на коже и внутренних органах, гематурией, полиорганной недостаточностью. Однако для истинной гипокоагуляционной стадии нетипично повышение уровня Д-димера, наблюдающееся у пациента, что может быть связано с особенностями течения именно «ковид-ассоциированной» коагулопатии. Генез ДВС-синдрома связан не только с наличием тяжёлого COVID-19, но и присоединением нозокомиальной инфекции (выраженный лейкоцитоз до 28,2×109/л с нейтрофильным сдвигом, повышение уровня ПКТ в 40 раз от верхней границы нормы — 2,0 нг/мл), развитием бактериального сепсиса. По данным рентгенографии органов грудной клетки, существенной динамики по объёму поражения лёгких от исходного не наблюдалось (45–50%), однако появились признаки сердечно-сосудистой недостаточности, а именно выраженное сгущение бронхо-сосудистого рисунка в прикорневых отделах.
С учётом доминирующих признаков коагулопатии потребления в стадии гипокоагуляции и с целью восполнения дефицита плазменных факторов свертывания крови перелиты две дозы плазмы объёмом 600 мл, после чего отмечалось снижение АЧТВ и ПТВ, рост уровня фибриногена. Однако состояние пациента оставалось крайне тяжёлым, клинического улучшения не отмечалось, кожно-геморрагический синдром прогрессировал. По данным лабораторного исследования, АЛТ — 225 Ед/л, АСТ — 362 Ед/л, мочевина — 21,9 ммоль/л, креатинин — 127 мкмоль/л, вч СРБ — 49,4 мг/л, ферритин — 685 мкг/л.
На 20-й день болезни (28 июня 2020) в 00.00 состояние пациента резко ухудшилось: сознание нарушилость (12 баллов по шкале комы Глазго (ШКГ), отмечено нарастание дыхательной недостаточности, развитие острого респираторного дистресс-синдрома (PaO2/FiO2 < 150 мм рт.ст.), выраженного отёка верхних и нижних конечностей с критическим нарушением микроциркуляции, АД — 100/60 мм рт. ст. на фоне вазопрессорной терапии. Начата ИВЛ аппаратом «Newport e360» в режиме VCV с параметрами: f —16 в минуту, Vt — 500 мл, PEP — 8,0 см вод. ст., P max — 20 см вод. ст., FiO2 — 100%, SatO2 — 94%. Через два часа сознание пациента — 4–5 баллов по ШКГ, периферический и центральный (на сонных артериях) пульс не определялись, по ЭКГ-монитору — крупноволновая фибрилляция желудочков. Несмотря на проводимые реанимационные мероприятия, включая дефибрилляцию, трёхкратно с интервалом 2 минуты, непрямой массаж сердца с частотой компрессий грудной клетки 100–120 в минуту, по кардиомонитору зарегистрирована асистолия. Продолжен непрямой массаж сердца, введение адреналина гидрохлорида 1 мг внутривенно струйно каждые 3 минуты (суммарно 1 мг/мл — 10 мл). Через 30 минут безуспешной реанимации в полном объёме зафиксирована биологическая смерть больного.
Был сформулирован посмертный диагноз. Основной — «1. Ишемическая болезнь сердца. Острый трансмуральный инфаркт миокарда передней стенки левого желудочка. Гипертоническая болезнь III стадия, неконтролируемая, риск очень высокий IV. 2. Коронавирусная инфекция, вызванная вирусом COVID-19, вирус идентифицирован. Двусторонняя полисегментарная пневмония, тяжёлое течение».
Фоновый — «Сахарный диабет 2 типа, декомпенсированный. Ожирение 1 степени».
Осложнение — «Сепсис. Синдром полиорганной недостаточности. ДВС-синдром, IV фаза. Геморрагический синдром. Тромбоцитопения. Печёночно-почечная недостаточность. Острая сердечная недостаточность. Тяжёлый острый респираторный синдром. Состояние после реанимации и ИВЛ».
Протокол патологоанатомического вскрытия: паренхиматозная дистрофия, острое общее венозное полнокровие внутренних органов, головной мозг отёчен, вклинивание стволовых структур в большое затылочное отверстие, в миокарде на разрезе передней стенки левого желудочка обнаружен очаг пестрого вида 3×4 см, стенозирующий атеросклероз коронарных артерий сердца до 60% нисходящей ветви правой коронарной артерии, концентрическая гипертрофия миокарда (масса миокарда — 360 г, толщина стенки левого желудочка — 1,7 см, правого — 0,4 см), лёгкие уплотнены, мелкоочаговые альвеолярные кровоизлияния, отёк лёгких, с поверхности разрезов стекает жидкая пенистая кровь, в просвете бронхов обильная грязно-серая пенистая жидкость — серозно-гнойная пневмония. Множественные кровоизлияния в слизистую желудка. Крупнокапельная дистрофия гепатоцитов. Некроз извитых канальцев почек. Вторично-сморщенные почки. Гиперплазия селезенки с обильным соскобом.
Таким образом, имеется совпадение диагнозов.
Сепсис, синдром полиорганной недостаточности, ДВС — синдром явились осложнением COVID-19. Коагулопатия на фоне тяжёлого течения COVID-19 способствовала декомпенсации коронарного кровообращения, развитию инфаркта миокарда с летальным исходом.
Обсуждение
Коронавирусная инфекция 2019 г. (COVID-19) вызывает целый спектр патологических состояний, в патогенезе которых лежит тяжёлое провоспалительное состояние, что может быть связано с уникальной коагулопатией и прокоагулянтной эндотелиальной дисфункцией. Эндотелиальный тропизм SARS-CoV2 может также изменить клиническую картину COVID-19 у восприимчивых пациентов и вызвать обострение основных сосудистых заболеваний. Первоначально инфекция COVID-19 вызывает заметное повышение уровня продуктов деградации фибриногена и D-димера/фибриногена. Это связано с системной гиперкоагуляцией и частыми венозными тромбоэмболическими осложнениями, а также микрососудистыми тромботическими нарушениями, которые встречаются гораздо чаще, чем развернутый ДВС-синдром и кровотечения. Мы рассмотрели пример критической коагулопатии, генез которой очевидно связан с тяжёлым течением COVID-19. У представленного в клиническом наблюдении пациента выявлены следующие нарушения гемостаза: значительное снижение тромбоцитов при явлениях фибринолиза (повышение ПТВ, АЧТВ, падение уровня фибриногена, выраженный кожно-геморрагический синдром, в последующем развитие острого тромбоза коронарной артерии и инфаркта миокарда). Указанные нарушения системы гемостаза наблюдались на фоне тяжёлого течения COVID-19 острого респираторного синдрома у больного с предсуществующей патологией сердечно-сосудистой системы, ожирением, сахарным диабетом 2 типа. Учитывая сочетание доминирующих гипокоагуляционных механизмов с развитием тромбоза в системе коронарных артерий наиболее вероятно развитие ДВС-синдрома у представленного пациента.
С учётом его длительного пребывания в стационаре, постоянно высокого уровня лейкоцитоза, повышения ПКТ, спленомегалии и обильного соскоба селезёнки (по результатам вскрытия) наиболее вероятно присоединение нозокомиальной инфекции и развитие сепсиса, что усугубило течение коагулопатии. Рассматривался вариант ТМА как причина тромбоцитопении, анемии и полиорганной дисфункции. Однако истинно микроангиопатический гемолитический характер анемии не установлен, поражение почек за время наблюдения носило транзиторный кратковременный характер, поражения ЦНС не наблюдалось, а эффект от плазмотрансфузии был сомнительным. Ещё одной версией причины тромбоза коронарных сосудов было развитие катастрофического антифосфолипидного синдрома, так как подобные нарушения возможны при критическом течении COVID-19, учитывая, что SARS-CoV2 может потенцировать патогенные эффекты, включая активацию эндотелиальных клеток, моноцитов, тромбоцитов и комплемента, что приводит к провоспалительному состоянию и протромботическим явлениям [24]. Однако при АФЛ синдроме исходно преобладает гиперкоагуляционное состояние, а у нашего пациента — гипокоагуляция. Патогенез и механизмы коагулопатии при COVID-19 сложны и разнообразны, каждый причинный фактор можно рассматривать по отдельности и в совокупности. Сложность диагностики нарушений гемостаза заключалась в проблеме полноценного исследования всех маркеров нарушения гемостаза, в том числе исследования антитромбина III при малоэффективной гепаринотерапии, проблеме выполнения специализированного обследования (КТ-ангиопульмонографии, коронарографии) и лечения в первую волну коронавирусной инфекции 2020 г. Объём трансфузии свежезамороженной плазмы, необходимой в фазу гипокоагуляции, был ограничен в первую очередь развитием острого инфаркта миокарда, риском гиперволемии, по этой же причине возникли сложности с переливанием тромбоконцентрата и криопреципитата. Наличие исходной тромбоцитопении у пациента при госпитализации и её прогрессирование на фоне инфекции наводили на мысль о первичной иммунной тромбоцитопении, однако введение препаратов иммуноглобулина G не рассматривалось с учётом возможного увеличения риска тромбозов у данной категории больных [25] и ввиду низкой доказательной базы эффективности их применения у пациентов с COVID-19 и сепсисом.
Непосредственной причиной смерти явилось развитие тромботических осложнений коагулопатии — инфаркта миокарда. С учётом того, что инфаркт миокарда диагностирован на фоне тяжёлой гипоксии (ТОРС) пациента, потребовавшей кислородной поддержки вплоть до инвазивной ИВЛ, и с учётом тахиаритмии можно было бы обсуждать 2 тип инфаркта миокарда (несоответствие потребностей миокарда в кислороде и его доставке, не связанном с атеротромбозом коронарной артерии), согласно классификации типов инфаркта миокарда 2018 г. [22]. В то же время выявленное на аутопсии атеросклеротическое поражение коронарных артерий у пациента с факторами кардиоваскулярного риска (ожирение, декомпенсированный сахарный диабет 2 типа, артериальная гипертензия) делает ИБС основной причиной развития атеротромбоза у данного пациента. Эти факторы (ТОРС, сепсис, ДВС-синдром, атеротромбоз) создали «порочный круг», приведший к неблагоприятному исходу заболевания у данного пациента.
Заключение
В заключении следует отметить, что острый интерес клиницистов к проблеме COVID-19 связан с разнообразием и малоизученностью патологических процессов, происходящих под влиянием вируса SARS-CoV-2 в организме, однако известно, что одним из неизменных спутников тяжёлого течения COVID-19 является нарушение в системе гемостаза с наличием тромботических и микрососудистых осложнений, а аномальная коагулопатия напрямую взаимосвязана с риском летального исхода у данной категории больных.
Необходимость дифференциальной диагностики разнообразных нарушений системы гемостаза трактует потребность в проведении доступных разнообразных диагностических тестов. Расширение представлений о разнообразии факторов и механизмов коагулопатии у больных COVID-19 определяют необходимость повышения информированности практикующих врачей о данной патологии.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Ndwandwe D, Wiysonge CS. COVID-19 vaccines. Curr Opin Immunol. 2021;71:111–116. DOI: 10.1016/j.coi.2021.07.003
2. Tang N, Li D, Wang X, Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020;18(4):844– 847. DOI: 10.1111/jth.14768
3. Levi M, Toh CH, Thachil J, Watson HG. Guidelines for the diagnosis and management of disseminated intravascular coagulation. British Committee for Standards in Haematology. Br J Haematol. 2009;145(1):24–33. DOI: 10.1111/j.1365-2141.2009.07600.x
4. Hoechter DJ, Becker-Pennrich A, Langrehr J, Bruegel M, Zwissler B, Schaefer S, et al. Higher procoagulatory potential but lower DIC score in COVID-19 ARDS patients compared to non-COVID-19 ARDS patients. Thromb Res. 2020;196:186– 192. DOI: 10.1016/j.thromres.2020.08.030
5. Fox SE, Akmatbekov A, Harbert JL, Li G, Quincy Brown J, Vander Heide RS. Pulmonary and cardiac pathology in African American patients with COVID-19: an autopsy series from New Orleans. Lancet Respir Med. 2020;8(7):681–686. DOI: 10.1016/S2213-2600(20)30243-5
6. Ackermann M, Verleden SE, Kuehnel M, Haverich A, Welte T, Laenger F, et al. Pulmonary Vascular Endothelialitis, Thrombosis, and Angiogenesis in Covid-19. N Engl J Med. 2020;383(2):120–128. DOI: 10.1056/NEJMoa2015432
7. Cattaneo M, Bertinato EM, Birocchi S, Brizio C, Malavolta D, Manzoni M, et al. Pulmonary Embolism or Pulmonary Thrombosis in COVID-19? Is the Recommendation to Use High-Dose Heparin for Thromboprophylaxis Justified? Thromb Haemost. 2020;120(8):1230–1232. DOI: 10.1055/s-0040-1712097
8. Berger JS, Kunichoff D, Adhikari S, Ahuja T, Amoroso N, Aphinyanaphongs Y, et al. Prevalence and Outcomes of D-Dimer Elevation in Hospitalized Patients With COVID-19. Arterioscler Thromb Vasc Biol. 2020;40(10):2539–2547. DOI: 10.1161/ATVBAHA.120.314872
9. Nugroho J, Wardhana A, Mulia EP, Maghfirah I, Rachmi DA, A’yun MQ, et al. Elevated fibrinogen and fibrin degradation product are associated with poor outcome in COVID-19 patients: A meta-analysis. Clin Hemorheol Microcirc. 2021;77(2):221–231. DOI: 10.3233/CH-200978
10. Zeng F, Huang Y, Guo Y, Yin M, Chen X, Xiao L, et al. Association of inflammatory markers with the severity of COVID-19: A meta-analysis. Int J Infect Dis. 2020;96:467–474. DOI: 10.1016/j.ijid.2020.05.055
11. Varga Z, Flammer AJ, Steiger P, Haberecker M, Andermatt R, Zinkernagel AS, et al. Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020;395(10234):1417– 1418. DOI: 10.1016/S0140-6736(20)30937-5
12. Baker CJ, Smith SA, Morrissey JH. Polyphosphate in thrombosis, hemostasis, and inflammation. Res Pract Thromb Haemost. 2018;3(1):18–25. DOI: 10.1002/rth2.12162
13. Zhang Y, Xiao M, Zhang S, Xia P, Cao W, Jiang W, et al. Coagulopathy and Antiphospholipid Antibodies in Patients with Covid-19. N Engl J Med. 2020;382(17):e38. DOI: 10.1056/NEJMc2007575
14. El Hasbani G, Taher AT, Jawad A, Uthman I. COVID-19, Antiphospholipid Antibodies, and Catastrophic Antiphospholipid Syndrome: A Possible Association? Clin Med Insights Arthritis Musculoskelet Disord. 2020;13:1179544120978667. DOI:10.1177/1179544120978667
15. Wool GD, Miller JL. The Impact of COVID-19 Disease on Platelets and Coagulation. Pathobiology. 2021;88(1):15–27. DOI: 10.1159/000512007
16. Юпатов В.Д., Пономарева Е.Ю. COVID-19 ассоциированная коагулопатия: патогенетические особенности и практические аспекты диагностики и лечения (обзор). Саратовский научно-медицинский журнал. 2021;17(4):741–746. eLIBRARY ID: 48155719
17. Галстян Г.М. Коагулопатия при COVID-19. Пульмонология. 2020;30(5):645–657. DOI: 10.18093/0869-0189-2020-30-5-645-657
18. Fraissé M, Logre E, Pajot O, Mentec H, Plantefève G, Contou D. Thrombotic and hemorrhagic events in critically ill COVID-19 patients: a French monocenter retrospective study. Crit Care. 2020;24(1):275. DOI: 10.1186/s13054-020-03025-y
19. Al-Samkari H, Karp Leaf RS, Dzik WH, Carlson JCT, Fogerty AE, Waheed A, et al. COVID-19 and coagulation: bleeding and thrombotic manifestations of SARS-CoV-2 infection. Blood. 2020;136(4):489–500. DOI: 10.1182/blood.2020006520
20. Mechineni A, Nanavati S, Solis RA, Ismail M. Dilemma of systemic anticoagulation: a COVID-19 patient with spontaneous chest wall hematoma. Chest. 2020;158(4):A409. DOI: 10.1016/j.chest.2020.08.400
21. Камкин Е.Г., Костенко Н.А., Каракулина Е.В., Авдеев С.Н., Адамян Л.В., Байбарина Е.Н. и др. Временные методические рекомендации. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Версия 7 (03.06.2020). Министерство здравоохранения Российской Федерации. 2020. С. 165
22. Thygesen K, Alpert JS, Jaffe AS, Chaitman BR, Bax JJ, Morrow DA, et al. Fourth Universal Definition of Myocardial Infarction (2018). J Am Coll Cardiol. 2018;72(18):2231-2264. DOI: 10.1016/j.jacc.2018.08.1038
23. Liu S, Song C, Zhao Y, Guan C, Zhu C, et al. Impact of baseline thrombocytopenia on the long-term outcome of patients undergoing elective percutaneous coronary intervention: An analysis of 9,897 consecutive patients. Catheter Cardiovasc. Interv. 2019;93(1):764-771. DOI: 10.1002/ccd.28030
24. Merrill JT, Erkan D, Winakur J, James JA. Emerging evidence of a COVID-19 thrombotic syndrome has treatment implications. Nat Rev Rheumatol. 2020;16(10):581–589. DOI: 10.1038/s41584-020-0474-5
25. Rungjirajittranon T, Owattanapanich W. A serious thrombotic event in a patient with immune thrombocytopenia requiring intravenous immunoglobulin: a case report. J Med Case Rep. 2019;13(1):25. DOI: 10.1186/s13256-018-1955-x.
Об авторах
А. А. РощинаРоссия
Рощина Анна Алексеевна, кандидат медицинских наук, доцент кафедры госпитальной терапии лечебного факультета
Саратов
SPIN-код: 2975-8592
М. И. Юпатова
Россия
Юпатова Мария Игоревна, ординатор кафедры госпитальной терапии лечебного факультета
Саратов
Н. М. Никитина
Россия
Никитина Наталья Михайловна, доктор медицинских наук, профессор кафедры госпитальной терапии лечебного факультета
Саратов
Дополнительные файлы
Рецензия
Для цитирования:
Рощина А.А., Юпатова М.И., Никитина Н.М. Критическая коагулопатия у пациента с тяжелым течением COVID-19. Южно-Российский журнал терапевтической практики. 2022;3(3):97-107. https://doi.org/10.21886/2712-8156-2022-3-3-91-96
For citation:
Roshchina A.A., Yupatova M.I., Nikitina N.M. Markable coagulopathy in the patient with severe COVID-19. South Russian Journal of Therapeutic Practice. 2022;3(3):97-107. (In Russ.) https://doi.org/10.21886/2712-8156-2022-3-3-91-96


























