Перейти к:
Напряжение сдвига на эндотелии стенки сонной артерии и кальциноз коронарных артерий у пациентов с гипертонической болезнью
https://doi.org/10.21886/2712-8156-2022-3-3-60-67
Аннотация
Цель: изучить взаимообусловленность изменений скорости сдвига на эндотелии (ССЭ) стенки интактного от атеросклероза участка общей сонной артерии (ОСА) с величиной индекса коронарной кальцификации (КИ) среди пациентов с гипертонической болезнью (ГБ).
Материалы и методы: в исследование включили 99 пациентов с ГБ, у 52 из которых выявлено атеросклеротическое поражение брахиоцефальных артерий (БЦА). Всем пациентам проведено ультразвуковое исследование сонных артерий с определением ССЭ на интактном участке ОСА, мультиспиральная компьютерная томография коронарных артерий с определением КИ.
Результаты: распространённость атеросклеротического поражения БЦА в исследуемой выборке составила 53 %. Средние значения ССЭ для пациентов с ГБ и атеросклерозом БЦА (первая группа) составили 660,7 (185,6) с-1, для пациентов с ГБ без него (вторая группа) — 735,8 (149,8) с-1, р = 0,009. Параметры липидного спектра у пациентов обеих групп оказались сопоставимы. Медианные значения КИ у пациентов с атеросклеротическим поражением БЦА статистически значимо выше (15,00 (0,00;178, 00)) по сравнению с пациентами второй группы (0,00 (0,00;171,00), при р = 0,001. Шансы выявления кальциноза коронарных артерий среди пациентов первой группы в 2 раза выше (ОШ = 2,25, 95 % ДИ: 1,58–8,33), чем среди пациентов второй группы. Низкие значения ССЭ коррелировали с мужским полом (rs = 0,40 (95 % ДИ: 0,22;0,55) р<0,001) и увеличением КИ (rs = -0,23 (95 % ДИ: -0,41–0,04), р = 0,022).
Заключение: среди пациентов с ГБ без симптомных заболеваний, обусловленных атеросклерозом в анамнезе, распространённость атеросклеротического поражения БЦА составила 53 %. В группе пациентов с ГБ и атеросклеротическим поражением БЦА медианные значения КИ были значимо выше, а поражение коронарных артерий выявлялось достоверно чаще (ОШ = 2,25, 95 % ДИ: 1,58–8,33), чем среди пациентов с ГБ и интактными БЦА. Средние значения ССЭ для пациентов с ГБ и атеросклерозом БЦА статистически значимо ниже, чем для пациентов с ГБ без него и составили 660,7 (185,6) с-1 и 735,8 (149,8) с-1 соответственно, р = 0,009. Низкие значения ССЭ коррелировали с мужским полом и увеличением КИ.
Для цитирования:
Лобанова Н.Ю., Чичерина Е.Н., Мальчикова С.В., Максимчук-Колобова Н.С. Напряжение сдвига на эндотелии стенки сонной артерии и кальциноз коронарных артерий у пациентов с гипертонической болезнью. Южно-Российский журнал терапевтической практики. 2022;3(3):60-67. https://doi.org/10.21886/2712-8156-2022-3-3-60-67
For citation:
Lobanova N.I., Chicherina E.N., Malchikova S.V., Maksimchuk-Kolobova N.S. Fluid shear stress on the endothelium of the carotid artery wall and coronary artery calcinosis in patients with arterial hypertension. South Russian Journal of Therapeutic Practice. 2022;3(3):60-67. (In Russ.) https://doi.org/10.21886/2712-8156-2022-3-3-60-67
Введение
Гипертоническая болезнь (ГБ) — независимый фактор риска сердечно-сосудистых заболеваний (ССЗ) [1]. По данным ВОЗ, около 30 % взрослого населения планеты имеет ГБ1. Распространённость ГБ в Российской Федерации составляет 43,5 % [2]. При ГБ доказан высокий риск развития ишемической болезни сердца (ИБС), цереброваскулярных заболеваний и, как следствие, смертности от ССЗ [3]. Влияя на эндотелий сосудистой стенки, повышая её жесткость, ГБ является фактором формирования атеросклероза, ключом к развитию которого является ремоделирование артериальной стенки [4][5]. С точки зрения гемостаза и тромбоза, интактная, нормально функционирующая эндотелиальная оболочка обеспечивает идеальные условия для движения крови. Она не активирует собственный каскад коагуляции, не способствует адгезии тромбоцитов, а фактически обладает антикоагулянтными и фибринолитическими свойствами [6].
Из-за пульсирующего характера кровотока эндотелиальные клетки артерий постоянно подвергаются механическому воздействию, а именно продольному растяжению, растяжению по окружности и напряжению сдвига (сила трения, оказываемая текущей кровью на поверхность стенки) [7][8].
Напряжение сдвига является одной из наиболее важных гемодинамических сил воздействия циркулирующей крови на слой эндотелиальных клеток сосуда, его воздействие на стенки сосудов изменяет физиологию клеток эндотелия [9]. Напряжение сдвига стенки, также называемое напряжением сдвига эндотелия, возникает из-за трения между двумя слоями жидкости, будучи вызвано разницей в скорости движения и вязкости между этими слоями. ССЭ представляет собой тангенциальную силу на единицу площади и играет важную роль в развитии ремоделирования сосудов и атерогенезе [10]. Большое количество экспериментов показало, что снижение ССЭ имеет тесную связь с заболеваемостью атеросклерозом [10]. Изменение ССЭ может непосредственно влиять не только на функцию, но и на морфологию эндотелия сосудов, стимулировать миграцию и пролиферацию гладкомышечных и мононуклеарных клеток. Низкая ССЭ тесно связана с атеросклерозом [11][12].
Считается, что ССЭ по-разному влияет на стенку сосудов [13]. Хотя факторы риска образования атеросклеротических бляшек, включая высокий уровень холестерина, диабет и высокое артериальное давление, носят системный характер, бляшки локализуются в определённых участках артериальной системы. Участки артериального дерева с однородной геометрией подвергаются однонаправленному и постоянному воздействию тока крови, что определяет физиологическое напряжение сдвига, а области физиологических изгибов и бифуркаций подвергаются воздействию турбулентного потока, что определяет низкую ССЭ. Как правило, низкая ССЭ считается надёжным индикатором сосудистой эндотелиальной дисфункции [14][15]. Напротив, участки артерий, подвергающиеся умеренному/физиологическому воздействию ССЭ, защищены от атеросклероза [16][17].
Неинвазивная оценка атеросклероза доступна с использованием различных методов визуализации. Наиболее распространённым клиническим методом выявления атеросклероза является дуплексное сканирование БЦА с использованием ультразвуковой визуализации. Хотя прямое и точное измерение показателей ССЭ (таких как среднее, максимальное и периферическое изменения ССЭ) в клинике было бы весьма желательным, эта цель ещё не достигнута в первую очередь из-за ограничений разрешения текущих методов визуализации [18]. Измерение ССЭ может помочь в выявлении атеросклеротических бляшек повышенного риска, а также в оценке эффективности различных фармакологических вмешательств [19].
Эндотелий становится органом-мишенью при многих заболеваниях, поэтому максимально раннее выявление изменений его структуры и\или функции крайне актуально в диагностике атеросклероза. В качестве хорошо зарекомендовавшего себя «окна наблюдения» за структурой и функцией эндотелия всего сосудистого русла выступает эндотелий ОСА. Оценка ССЭ ОСА может отражать общее гемодинамическое состояние сосудов всего артериального русла [18-21].
Одним из основных механизмов повреждения органов-мишеней при ГБ является хроническое повреждение эндотелия [22]. Это взаимное влияние ГБ и эндотелиальной дисфункции приводит к распространённому поражению сосудов [23].
Цель исследования — изучить взаимообусловленность изменений ССЭ стенки интактного от атеросклероза участка ОСА с величиной индекса КИ среди пациентов ГБ.
Материал и методы
На базе клиники ФГБОУ ВО «Кировский ГМУ» Минздрава России проведено открытое нерандомизированное, клиническое исследование 99 пациентов с установленным диагнозом ГБ (62 женщины, медиана возраста — 58 (51; 62) лет). Все пациенты на момент включения не имели симптомных заболеваний, обусловленных атеросклерозом, 39 из них имели ожирение, 8 — сахарный диабет (СД) (у всех лиц СД имел неосложнённое течение, без потребности в инсулинотерапии).
Выделены две группы пациентов. 1-я группа — 52 пациента с атеросклеротическим поражением БЦА (n=52), 2-я групп — 47 (n=47) пациентов без атеросклеротического поражения БЦА. Наличие атеросклеротической бляшки в БЦА устанавливалось на основании консенсуса Mannheim [24]. Клиническая характеристика пациентов представлена в таблице 1.
Таблица 1
Клиническая характеристика пациентов обеих групп
|
Показатель |
1-я группа (n=52) |
2-я группа (n=47) |
p |
|
Возраст, лет, М (SD) |
59,64 (7,80) |
53,96 (8,54) |
<0,001♦ |
|
Пол, муж./жен., n (%) |
25 (48)/27(52) |
12 (26)/35 (74) |
0,021* |
|
СД, n (%) |
2 (4) |
6 (13) |
0,091* |
|
Курение, n (%) |
12 (23) |
7 (15) |
0,349* |
|
Ожирение, n (%) |
22 (42) |
17 (36) |
0,644* |
|
Индекс массы тела (ИМТ), кг/м2, Me (Q1;Q3) |
28,0 (26,0;32,0) |
27,5(25,0;32,0) |
0,585l |
Все медицинские исследования проведены в соответствии с Хельсинкской декларацией Всемирной Медицинской Ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. с соблюдением международных стандартов и биоэтических норм. Обследование включённых в работу пациентов проводили после подписания ими установленной формы информированного согласия. Протокол исследования, форма добровольного информированного согласия одобрены локальным этическим комитетом ФГБОУ ВО Кировский ГМУ Минздрава России.
Проведено общеклиническое, лабораторное и инструментальное обследования. Первый этап включал сбор жалоб, данных анамнеза, анализ медицинской документации, физикальное обследование. Лабораторное обследование, помимо общеклинического, включало определение уровня глюкозы плазмы натощак, показателей липидного профиля (общего холестерина (ОХС), холестерин липопротеинов низкой плотности (ЛПНП), холестерин липопротеинов высокой плотности (ЛПВП), триглицеридов (ТГ)). Все методы лабораторного обследования выполнены на сертифицированном оборудовании с использованием одинаковых наборов реактивов и строго стандартизированы.
Всем пациентам проведено цветное дуплексное сканирование БЦА на аппарате Vivid E9 (General Electric Co, США, 2012 г.), линейным датчиком с частотой 2,4–10 МГц в трёх плоскостях (двух продольных (передняя и заднебоковая) и поперечной) с оценкой наличия, структуры и степени стенозирования сосуда [24]. При выявлении атеросклеротических бляшек степень стенозирования оценивали в В-режиме и допплерографически. В В-режиме процент стенозирования сосуда (SD, %) определяли по диаметру и рассчитывали по формуле
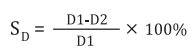 (1)
(1)
где D1 — истинный диаметр сосуда, измеренный по внутренней границе адвентиции, D2 — диаметр просвета сосуда, свободного от бляшки.
Сведения о взаимосвязи толщины комплекса интима-медиа с последующим развитием сердечно-сосудистых заболеваний противоречивы, с учётом этого её оценка в текущее исследование не включена [25][26].
Измерение напряжения сдвига проводится на интактном участке сонной артерии и рассчитывается по формуле [18]
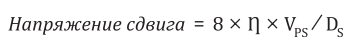 (2)
(2)
где — вязкость крови, — пиковая систолическая скорость кровотока, — систолический диаметр ОСА.
С учётом того, что измерение вязкости крови является достаточно трудоёмким, инвазивным исследованием, обладает высокой суточной вариабельностью, в качестве адекватного косвенного показателя напряжения сдвига использована скорость сдвига [8][18][14].
Скорость сдвига определяли по формуле
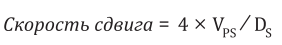 (3)
(3)
Определение ССЭ ОСА проводили на интактной от атеросклероза стороне, вне области её бифуркации (преимущественно в средней трети), где в М-режиме измеряли, оценку проводили в режиме импульсно-волновой допплерографии [21].
Также всем пациентам, включённым в исследование, проводили неинвазивное МСКТ-сканирование с ЭКГ-синхронизацией на 64-срезовом компьютерном томографе (с возможностью получения 128 срезов) Optima CT 660 (General Electric Co, США, 2012 г.). Сканирование осуществляли в пошаговом режиме от уровня бифуркации трахеи до уровня диафрагмы в кранио-каудальном направлении. Для последующей обработки использовали срезы толщиной 0,625 мм. Количественное определение наличия и степени выраженности коронарного кальциноза основано на расчёте индекса коронарной кальцификации (КИ). Для этого вычисляли фактор плотности по пиковой плотности зоны кальциноза, выражаемой в единицах Hounsfield (Hounsfield units — HU). Кальциноз коронарных артерий определяется как участок плотностью более 130 HU. Далее КИ рассчитывался по методу Agatston [28] с помощью программы CaScore, входящей в пакет программного обеспечения рабочей станции. КИ вычисляли путем умножения площади кальцинированного участка коронарной артерии на фактор плотности. Общий КИ вычислялся, как сумма индексов во всех срезах [27].
Статистическая обработка данных проведена при помощи программы «Statistica for Windows ver 10.0» (StatSoft, Inc. (США)), включала методы описательной и аналитической статистики. Оценка нормальности распределения количественных данных выполнена с помощью метода Шапиро-Уилка. Количественные признаки, имеющие распределение, близкое к нормальному, представлены средней арифметической (М) и стандартным отклонением (SD). Для описания количественных данных, не подчиняющихся закону нормального распределения, применялась медиана (Ме) и процентили (Q1; Q3). Для описания качественных данных использованы частоты и доли (в %). Для сравнения количественных параметров использованы U-критерий Манна-Уитни, непарный t-критерий Стьюдента. Качественные параметры сравнивались с использованием критерия χ2. Для статистического описания связи между различными параметрами использован коэффициент ранговой корреляции Спирмена. Коэффициент корреляции считался статистически значимым при значении р <0,05, с указанием силы и направления связи, а также 95 % ДИ.
Результаты
Из представленных в таблице 1 данных следует, что пациенты с ГБ и атеросклеротическим поражением БЦА были значимо старше, среди них преобладали мужчины, в то же время по таким факторам риска, как наличие СД, избыточная масса тела или ожирение, курение, межгрупповые различия не установлены (табл. 1). Результаты сравнительного анализа лабораторных данных представлены в таблице 2.
Таблица 2
Результаты анализа лабораторных данных у пациентов обеих групп
|
Показатель |
1-я группа (n=52) |
2-я группа (n=47) |
p |
|
ОХ, ммоль/л, М (SD) |
5,90 (1,13) |
5,70 (1,14) |
0,382* |
|
ХЛПНП, ммоль/л, М (SD) |
3,76 (0,92) |
3,51(0,96) |
0,196* |
|
ХСЛПВП, ммоль/л, Me (Q1;Q3) |
1,17 (1,05;1,46) |
1,18 (1,06;1,46) |
0,997l |
|
ТГ, ммоль/л, Me (Q1;Q3) |
2,01 (1,73;2,76) |
1,95 (1,70;2,46) |
0,674l |
|
Глюкоза плазмы натощак, ммоль/л, Me (Q1;Q3) |
5,54 (5,21;6,00) |
5,59 (4,99;6,23) |
0,902l |
Установлено, что параметры липидного спектра, уровень глюкозы плазмы натощак у пациентов обеих групп не имели статистически значимых различий.
Атеросклеротические бляшки, суживающие просвет БЦА более чем на 50%, среди всех исследуемых лиц не выявлены. Максимальная степень стенозирования составила 40%.
По результатам мультиспиральной компьютерной томографии коронарных артерий, медианные значения КИ у пациентов 1-й группы статистически значимо выше (15,00 (0,00;178,00)) по сравнению с пациентами второй группы (0,00 (0,00;171,00), при р=0,001.
Средние значения ССЭ для пациентов первой группы составили 660,7 (185,6) с-1 и 735,8 (149,8) с-1 — для второй. Таким образом, средние значения ССЭ у пациентов с атеросклеротическим поражением ОСА статистически значимо ниже по сравнению с пациентами 2-й группы при р=0,009.
Среди пациентов с атеросклеротическим поражением ОСА величина КИ >0 определена у 36 человек, во второй группе — у 18 человек, установленные различия статистически значимы (χ2=9,53, р=0,003), а шансы выявления кальциноза коронарных артерий у пациентов с атеросклеротическим поражением БЦА в 2 раза выше (ОШ=2,25, 95% ДИ: 1,58–8,33), чем у лиц с интактными каротидными артериями.
При проведении корреляционного анализа низкие скорости сдвига ассоциировались с мужским полом (rs=0,40 (95% ДИ: 0,22;0,55)) р<0,001. Кроме того, снижение ССЭ коррелирует с увеличением КИ (rs=-0,23 (95% ДИ: -0,41;-0,04)), р=0,022.
Обсуждение
Частота выявления субклинического атеросклеротического поражения БЦА в изученной когорте пациентов достаточно высока, составляя 53 %. При этом среди пациентов с ГБ в сочетании с атеросклеротическим поражением БЦА преобладали мужчины, кроме того, они были старше, что сопоставимо с данными, представленными в исследовании АТЕРОГЕН-Иваново, установившем, что распространённость каротидного атеросклероза в российской популяции составляет 67,1% (76,7% для мужчин, 59,1% для женщин) [28]. Хотя основные процессы прогрессирования атеросклероза сходны у мужчин и женщин, формирование и прогрессирование бляшек зависит от возраста и пола [14].
Известно, что атеросклеротическое поражение сосудистой стенки связано с изменением свойств эндотелия, проатерогенным влиянием различных факторов. Связь снижения ССЭ на локальном уровне, её тесная ассоциация с развитием атеросклеротических бляшек подтверждена разными авторами [8][14][15][29][30]. Так, Carallo C. et al. показали прогрессирование развития бляшек в каротидных артериях при низких значениях ССЭ [9]. Однако эндотелий сосудистой стенки становится мишенью не только на локальном, но и на системном уровне. По мнению Wu S.P. et al., ССЭ ОСА может отражать общее гемодинамическое состояние сосудов и может быть использована в качестве хорошо зарекомендовавшего себя «окна наблюдения» за функцией эндотелия [17], а Guo Y. et al. показали влияние снижения каротидной ССЭ с изменением функции почек, что может быть опосредовано нарушением регуляции функции эндотелия [18].
Roman M. J. et al. описали наличие тесной ассоциации атеросклеротического поражения коронарных артерий, гипертрофии миокарда левого желудочка (ЛЖ) с высокой частотой выявления атеросклеротических бляшек в сонной артерии. По мнению исследователей, это связано с повышением жёсткости, расширением сонных артерий, снижением растяжимости, а также скорости кровотока [31]. Точные механизмы, участвующие в развитии ремоделирования миокарда ЛЖ в сочетании с атеросклеротическим поражением каротидных и коронарных артерий, до конца ещё не ясны. Castro-Diehl C. et al. показали, что увеличение толщины стенки, характерное для большей массы ЛЖ, может привести к нарушению релаксации миокарда, повышению жёсткости желудочков и давления наполнения ЛЖ, а также к изменению жёсткости аорты, которое может приводить к развитию ремоделирования миокарда ЛЖ [32].
Поскольку артериальная дилатация и скорость кровотока напрямую связаны с напряжением сдвига, морфологические, а также функциональные изменения сонной артерии, связанные с гипертрофией миокарда ЛЖ, могут привести к его изменению, что может действовать, как локальный фактор прогрессирования атеросклероза. Более высокое местное пульсовое давление может влиять на структурные и функциональные изменения внутричерепных сосудов и толщину стенки сонной артерии, способствовать развитию бляшек и стенозов, а также разрыву нестабильных бляшек, что может объяснить учащение цереброваскулярных событий у этих пациентов [33]. Jaroch et al. показали, что концентрическая гипертрофия миокарда ЛЖ при артериальной гипертензии тесно связана с жёсткостью сонных артерий и снижением параметров ССЭ в ОСА [19]. Низкое локальное напряжение сдвига и большое количество бляшек в сонных артериях у пациентов с болью в груди — значимые предикторы ИБС. Представленные ими результаты показали, что ССЭ сонной артерии может выступить в роли индикатора атеросклеротического поражения коронарных артерий и служить предиктором развития их значительного атеросклеротического поражения [20].
Необходимо отметить, что в исследовании российских авторов снижение ССЭ <300с–1 ассоциировалось с увеличением в 11,2 раза (95 % ДИ: 1,26;99,3, p=0,03) относительного риска наличия атеросклеротических ССЗ (с поправкой на такие факторы, как пол, возраст, курение, ожирение, ГБ, СКФ, ХЛПНП, высокочувствительный С-реактивный белок, толщина интимы–медии ОСА). ССЭ сонной артерии <300с–1 позволяет прогнозировать наличие атеросклеротических сердечно-сосудистых заболеваний с чувствительностью 97,1 % и специфичностью 84,6 % [21].
Текущее исследование имеет ограничения, связанные с изучением когорты пациентов с установленным диагнозом ГБ, а кроме того, не позволяет выявить и оценить наличие причинно-следственных связей между изученными параметрами. Поэтому для уточнения диагностической и прогностической роли ССЭ в различных группах пациентов необходимо проведение дальнейших исследований.
Выводы
Среди пациентов с ГБ без симптомных заболеваний, обусловленных атеросклерозом в анамнезе, распространённость атеросклеротического поражения БЦА составила 53 %.
В группе пациентов с ГБ и атеросклеротическим поражением БЦА медианные значения КИ были значимо выше, а поражение коронарных артерий выявлялось достоверно чаще (ОШ=2,25, 95% ДИ: 1,58–8,33), чем среди пациентов с ГБ и интактными БЦА.
Средние значения ССЭ для пациентов с ГБ и атеросклерозом БЦА статистически значимо ниже, чем для пациентов с ГБ без него и составили 660,7 (185,6) с-1 и 735,8 (149,8) с-1 соответственно, р=0,009.
Низкие значения скорости сдвига эндотелия коррелировали с мужским полом и увеличением КИ.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
1. ВОЗ. Гипертония 2021. [электронный ресурс] – Режим доступа: https://www.who.int/ru/news-room/fact-sheets/detail/hypertension.
Список литературы
1. Reboussin DM, Allen NB, Griswold ME, Guallar E, Hong Y, Lackland DT, et al. Systematic Review for the 2017 ACC/AHA/ AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the Prevention, Detection, Evaluation, and Management of High Blood Pressure in Adults: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol. 2018;71(19):2176-2198. DOI: 10.1016/j.jacc.2017.11.004. Erratum in: J Am Coll Cardiol. 2018;71(19):2272-2273.
2. Бойцов С.А., Драпкина О.М., Шляхто Е.В., Конради А.О., Баланова Ю.А., Жернакова Ю.В., и др. Исследование ЭССЕ-РФ (Эпидемиология сердечно-сосудистых заболеваний и их факторов риска в регионах Российской Федерации). Десять лет спустя. Кардиоваскулярная терапия и профилактика. 2021;20(5):3007. DOI: 10.15829/1728-8800-2021-3007
3. Zaid M, Fujiyoshi A, Kadota A, Abbott RD, Miura K. Coronary Artery Calcium and Carotid Artery Intima Media Thickness and Plaque: Clinical Use in Need of Clarification. J Atheroscler Thromb. 2017;24(3):227-239. DOI: 10.5551/jat.RV1600
4. Harvey A, Montezano AC, Touyz RM. Vascular biology of ageing-Implications in hypertension. J Mol Cell Cardiol. 2015;83:112-21. DOI: 10.1016/j.yjmcc.2015.04.011
5. Kalra SS, Shanahan CM. Vascular calcification and hypertension: cause and effect. Ann Med. 2012 Jun;44 Suppl 1:S85-92. doi: 10.3109/07853890.2012.660498
6. Gimbrone MA Jr, García-Cardeña G. Endothelial Cell Dysfunction and the Pathobiology of Atherosclerosis. Circ Res. 2016;118(4):620-36. DOI: 10.1161/CIRCRESAHA.115.306301
7. Anssari-Benam A, Korakianitis T. Atherosclerotic plaques: is endothelial shear stress the only factor? Med Hypotheses. 2013;81(2):235-9. DOI: 10.1016/j.mehy.2013.04.041
8. Генкель В.В., Салашенко А.О., Алексеева О.А., Шапошник И.И. Эндотелиальная скорость сдвига и сосудистая жесткость на локальном и регионарном уровнях у пациентов на разных стадиях атерогенеза. Регионарное кровообращение и микроциркуляция. 2016;15(3):50-56. DOI: 10.24884/1682-6655-2016-15-3-50-56
9. Carallo C, Tripolino C, De Franceschi MS, Irace C, Xu XY, Gnasso A. Carotid endothelial shear stress reduction with aging is associated with plaque development in twelve years. Atherosclerosis. 2016;251:63-69. DOI: 10.1016/j.atherosclerosis.2016.05.04
10. Roger VL, Weston SA, Killian JM, Pfeifer EA, Belau PG, Kottke TE, et al. Time trends in the prevalence of atherosclerosis: a population-based autopsy study. Am J Med. 2001;110(4):267- 73. DOI: 10.1016/s0002-9343(00)00709-9
11. Hays AG, Kelle S, Hirsch GA, Soleimanifard S, Yu J, Agarwal HK, et al. Regional coronary endothelial function is closely related to local early coronary atherosclerosis in patients with mild coronary artery disease: pilot study. Circ Cardiovasc Imaging. 2012;5(3):341-8. DOI: 10.1161/CIRCIMAGING.111.969691.
12. Zhang B, Gu J, Qian M, Niu L, Zhou H, Ghista D. Correlation between quantitative analysis of wall shear stress and intima-media thickness in atherosclerosis development in carotid arteries. Biomed Eng Online. 2017;16(1):137. DOI: 10.1186/s12938-017-0425-9
13. Liu Z, Zhao Y, Wang X, Zhang H, Cui Y, Diao Y, et al. Low carotid artery wall shear stress is independently associated with brain white-matter hyperintensities and cognitive impairment in older patients. Atherosclerosis. 2016;247:78-86. DOI: 10.1016/j.atherosclerosis.2016.02.003
14. Wentzel JJ, Chatzizisis YS, Gijsen FJ, Giannoglou GD, Feldman CL, Stone PH. Endothelial shear stress in the evolution of coronary atherosclerotic plaque and vascular remodelling: current understanding and remaining questions. Cardiovasc Res. 2012;96(2):234-43. DOI: 10.1093/cvr/cvs
15. Peiffer V, Sherwin SJ, Weinberg PD. Does low and oscillatory wall shear stress correlate spatially with early atherosclerosis? A systematic review. Cardiovasc Res. 2013;99(2):242-50. DOI: 10.1093/cvr/cvt044.
16. Cecchi E, Giglioli C, Valente S, Lazzeri C, Gensini GF, Abbate R, et al. Role of hemodynamic shear stress in cardiovascular disease. Atherosclerosis. 2011;214(2):249-56. DOI: 10.1016/j.atherosclerosis.2010.09.008.
17. Wu SP, Ringgaard S, Oyre S, Hansen MS, Rasmus S, Pedersen EM. Wall shear rates differ between the normal carotid, femoral, and brachial arteries: an in vivo MRI study. J Magn Reson Imaging. 2004;19(2):188-93. DOI: 10.1002/jmri.10441. PMID: 14745752.
18. Guo Y, Wei F, Wang J, Zhao Y, Sun S, Zhang H, et al. Carotid artery wall shear stress is independently correlated with renal function in the elderly. Oncotarget. 2018;9(4):5251- 5262. DOI: 10.18632/oncotarget.23825.
19. Jaroch J, Łoboz-Grudzień K, Magda S, Florescu M, Bociąga Z, Ciobanu AO, et al. The Relationship of Carotid Arterial Stiffness and Left Ventricular Concentric Hypertrophy in Hypertension. Adv Clin Exp Med. 2016;25(2):263-72. DOI: 10.17219/acem/34654.
20. Cho KI, Kim BH, Kim HS, Heo JH. Low Carotid Artery Wall Shear Stress is Associated with Significant Coronary Artery Disease in Patients with Chest Pain. J Atheroscler Thromb. 2016;23(3):297-308. DOI: 10.5551/jat.31377.
21. Генкель В.В., Шапошник И.И. Показатели эндотелиальной скорости сдвига в сонной артерии как маркер системного атеросклероза и сердечнососудистых заболеваний, обусловленных атеросклерозом. Кардиология. 2019;59(5):45-52. DOI: 10.18087/cardio.2019.5.258
22. Dharmashankar K, Widlansky ME. Vascular endothelial function and hypertension: insights and directions. Curr Hypertens Rep. 2010;12(6):448-55. DOI: 10.1007/s11906-010-0150-2.
23. Sung JK, Kim JY, Youn YJ, Lee JW, Ahn SG, Yoo BS, et al. Urine Albumin Creatinine Ratio is Associated with Carotid Atherosclerosis in a Community Based Cohort: Atherosclerosis Risk of Rural Area in Korean General Population Study. J Cardiovasc Ultrasound. 2010;18(4):134-8. DOI: 10.4250/jcu.2010.18.4.134.
24. Touboul PJ, Hennerici MG, Meairs S, Adams H, Amarenco P, Bornstein N, et al. Mannheim carotid intima-media thickness consensus (2004-2006). An update on behalf of the Advisory Board of the 3rd and 4th Watching the Risk Symposium, 13th and 15th European Stroke Conferences, Mannheim, Germany, 2004, and Brussels, Belgium, 2006. Cerebrovasc Dis. 2007;23(1):75-80. DOI: 10.1159/000097034.
25. Lorenz MW, Polak JF, Kavousi M, Mathiesen EB, Völzke H, Tuomainen TP, et al. Carotid intima-media thickness progression to predict cardiovascular events in the general population (the PROG-IMT collaborative project): a meta-analysis of individual participant data. Lancet. 2012;379(9831):2053-62. DOI: 10.1016/S0140-6736(12)60441-3. Erratum in: Lancet. 2012;380(9840):474. PMID: 22541275; PMCID: PMC3918517.
26. Sillesen H, Sartori S, Sandholt B, Baber U, Mehran R, Fuster V. Carotid plaque thickness and carotid plaque burden predict future cardiovascular events in asymptomatic adult Americans. Eur Heart J Cardiovasc Imaging. 2018;19(9):1042- 1050. DOI: 10.1093/ehjci/jex239.
27. Agatston AS, Janowitz WR, Hildner FJ, Zusmer NR, Viamonte M Jr, Detrano R. Quantification of coronary artery calcium using ultrafast computed tomography. J Am Coll Cardiol. 1990;15(4):827-32. DOI: 10.1016/0735-1097(90)90282-t
28. Ершова А.И., Балахонова Т.В., Мешков А.Н., Куценко В.А., Яровая Е.Б., Шальнова С.А., и др. Распространенность атеросклероза сонных и бедренных артерий среди населения Ивановской области: исследование АТЕРОГЕН-Иваново. Кардиоваскулярная терапия и профилактика. 2021;20(5):2994. DOI: 10.15829/1728-8800-2021-2994
29. Mynard JP, Wasserman BA, Steinman DA. Errors in the estimation of wall shear stress by maximum Doppler velocity. Atherosclerosis. 2013;227(2):259-66. DOI: 10.1016/j.atherosclerosis.2013.01.026
30. Roustaei M, Nikmaneshi MR, Firoozabadi B. Simulation of Low Density Lipoprotein (LDL) permeation into multilayer coronary arterial wall: Interactive effects of wall shear stress and fluid-structure interaction in hypertension. J Biomech. 2018;67:114-122. DOI: 10.1016/j.jbiomech.201
31. Roman MJ, Pickering TG, Schwartz JE, Pini R, Devereux RB. Relation of arterial structure and function to left ventricular geometric patterns in hypertensive adults. J Am Coll Cardiol. 1996;28(3):751-6. DOI: 10.1016/0735-1097(96)00225-2. Erratum in: J Am Coll Cardiol. 1996;28(6):1642. PMID: 8772767.
32. Castro-Diehl C, Song RJ, Mitchell GF, McManus D, Cheng S, Vasan RS, et al. Association of subclinical atherosclerosis with echocardiographic indices of cardiac remodeling: The Framingham Study. PLoS One. 2020;15(5):e0233321. DOI: 10.1371/journal.pone.0233321.
33. Park SK, Kang JG, Seok HS, Jung JY. Echocardiographic parameters of left ventricular structure and diastolic function and their relation to coronary artery calcification. Int J Cardiovasc Imaging. 2021;37(10):2861-2869. DOI: 10.1007/s10554-021-02256-6.
Об авторах
Н. Ю. ЛобановаРоссия
Лобанова Надежда Юрьевна, врач-терапевт, УЗД
Киров
Е. Н. Чичерина
Чичерина Елена Николаевна, доктор медицинских наук, проф., заведующая кафедрой внутренних болезней
Киров
С. В. Мальчикова
Мальчикова Светлана Владимировна, доктор медицинских наук, профессор кафедры госпитальной терапии
Киров
Н. С. Максимчук-Колобова
Максимчук-Колобова Надежда Сергеевна, кандидат медицинских наук, доцент кафедры семейной медицины и поликлинической терапии
Киров
Рецензия
Для цитирования:
Лобанова Н.Ю., Чичерина Е.Н., Мальчикова С.В., Максимчук-Колобова Н.С. Напряжение сдвига на эндотелии стенки сонной артерии и кальциноз коронарных артерий у пациентов с гипертонической болезнью. Южно-Российский журнал терапевтической практики. 2022;3(3):60-67. https://doi.org/10.21886/2712-8156-2022-3-3-60-67
For citation:
Lobanova N.I., Chicherina E.N., Malchikova S.V., Maksimchuk-Kolobova N.S. Fluid shear stress on the endothelium of the carotid artery wall and coronary artery calcinosis in patients with arterial hypertension. South Russian Journal of Therapeutic Practice. 2022;3(3):60-67. (In Russ.) https://doi.org/10.21886/2712-8156-2022-3-3-60-67
JATS XML


























