Перейти к:
Железодефицитные состояния при сердечно-сосудистых заболеваниях: влияние на прогноз и особенности коррекции
https://doi.org/10.21886/2712-8156-2023-4-1-7-18
Аннотация
В статье обсуждается проблема коморбидности железодефицитных состояний и сердечно-сосудистых заболеваний (ССЗ). Железодефицитные состояния (латентный дефицит железа и железодефицитная анемия) значительно повышают риск развития и прогрессирования ССЗ. В ряде исследований установлено, что независимо от наличия или отсутствия анемии, дефицит железа приводит к развитию сердечно-сосудистых осложнений, снижению качества жизни и повышению смертности у пациентов с ССЗ. В настоящее время наиболее изученным является влияние железодефицитных состояния на прогноз больных с хронической сердечной недостаточностью (ХСН). В статье обсуждаются этиология и патогенез развития дефицита железа при ХСН, механизмы неблагоприятного влияния этого состояния на качество жизни, функциональный статус и прогноз жизни больных. В статье представлены разбор клинических исследований по лечению железодефицитных состояний при ХСН и выдержки из актуальных клинических рекомендаций. Также представлены данные, свидетельствующие о возможном вкладе базисной терапии ХСН в коррекцию анемии и дефицита железа. В статье обсуждается влияние железодефицитных состояний на течение и прогноз жизни при фибрилляции предсердий (ФП) и ишемической болезни сердца (ИБС). Подчеркивается негативный вклад железодефицитных состояний в развитие обострений ССЗ, увеличение числа госпитализаций и повышение риска смерти у данных категорий больных. Несмотря на известное негативное влияние железодефицитных состояний на функциональный статус и прогноз больных с ССЗ, всё ещё недостаточно данных об эффективности и безопасности коррекции дефицита железа у пациентов с ССЗ.
Ключевые слова
Для цитирования:
Виноградова Н.Г., Чесникова А.И. Железодефицитные состояния при сердечно-сосудистых заболеваниях: влияние на прогноз и особенности коррекции. Южно-Российский журнал терапевтической практики. 2023;4(1):7-18. https://doi.org/10.21886/2712-8156-2023-4-1-7-18
For citation:
Vinogradova N.G., Chesnikova A.I. Iron deficiency states in cardiovascular diseases: impact on prognosis and features of correction. South Russian Journal of Therapeutic Practice. 2023;4(1):7-18. (In Russ.) https://doi.org/10.21886/2712-8156-2023-4-1-7-18
Введение
Сердечно-сосудистые заболевания (ССЗ) во всём мире занимают лидирующие позиции как по распространённости, так и в структуре смертности. Распространённость ССЗ в популяции возрастает с увеличением возраста и в Российской Федерации (РФ) и составляет более 50% среди населения старше 70 лет [1][2]. К факторам, усугубляющим течение ССЗ, относятся железодефицитные состояния (латентный дефицит железа и железодефицитная анемия), встречаемость которых также увеличивается с возрастом. Железодефицитная анемия (ЖДА) является независимым предиктором кардиоваскулярных заболеваний и неблагоприятных исходов [1]. В популяционном исследовании ARIC-study (Atherosclerosis Risk in Communities), в котором проводилось наблюдение в течение более 6 лет за 13883 пациентами без ССЗ, было показано, что пациенты со сниженным уровнем гемоглобина имели риск развития ССЗ почти в 1,5 раза выше вне зависимости от всех остальных факторов риска ССЗ [2]. В ряде исследований установлено, что независимо от наличия или отсутствия анемии, дефицит железа приводит к развитию сердечно-сосудистых осложнений, снижению качества жизни и повышению смертности у пациентов с ССЗ [3][4]. При этом коррекция дефицита железа и ЖДА при ССЗ имеет особенности, которые необходимо учитывать в клинической практике. Так же необходимо отметить, что коррекция дефицита железа в последние годы изучена подробно при хронической сердечной недостаточности (ХСН), но остаётся недостаточно освещенной при таких заболеваниях, как ишемическая болезнь сердца (ИБС), фибрилляция предсердий (ФП) [5].
Проведены поиск и анализ источников литературы в база данных “Scopus”, “Web of Science”, “PubMed/MedLine”, “eLIBRARY”. Поиск литературы проводился с использованием следующих ключевых слов на русском и английском языках: «дефицит железа», «хроническая сердечная недостаточность», «ишемическая болезнь сердца», «фибрилляция предсердий». Нами проанализированы публикации с 2002 по 2022 гг. В статье представлены этиология, патогенез, эпидемиология, прогноз и лечение железодефицитных состояний у пациентов с распространенными ССЗ.
Дефицит железа и сердечная недостаточность
Железодефицитные состояния часто встречаются при сердечной недостаточности (СН), ассоциируются с плохим прогнозом как при хронической сердечной недостаточности (ХСН), так и при острой СН [6].
Независимое негативное влияние анемии на риск госпитализации и смерти среди пациентов с СН было показано во многих исследованиях [6][7]. Установлено, что анемия значительно ухудшает прогноз пациентов с СН и низкой фракцией выброса левого желудочка (ФВ ЛЖ): смертность от всех причин была выше на 47%, смерть или госпитализация — на 28%, госпитализация по причине СН — на 43% выше у пациентов с анемией по сравнению с пациентами без анемии [7]. Выраженное негативное влияние на прогноз жизни анемия оказывает у пациентов с острой декомпенсированной СН. В одном из исследований, в котором проводили анализ влияния анемии на прогноз жизни пациентов с острой СН при наблюдении в течение года, после поправки на возраст, тяжесть СН, уровни систолического и диастолического артериального давления и креатинина показано, что риск смерти пациентов с анемией был выше на 50% по сравнению с риском у пациентов, не имевших анемии [8].
Дефицит железа является важнейшей причиной анемии у пациентов с СН, хотя должен быть выполнен поиск и других причин, к которым могут быть отнесены хронические воспалительные заболевания и хроническая болезнь почек (ХБП) [6]. Железодефицитные состояния при СН могут быть ассоциированы со злокачественными новообразованиями желудочно-кишечного тракта, о которых сообщалось примерно у 10% пациентов с СН, проходивших эндоскопическое обследование в крупном исследовании [9]. Дефицит железа также может формироваться в течение жизни больного в связи с физиологическими (беременность, период лактации, особенности менструального цикла и старость) и патологическими причинами (нарушения пищеварения, вегетарианство, недоедание, глистные инвазии), что в последующем при присоединении ХСН также негативно отражается на прогнозе жизни больного [6]. Необходимо принимать во внимание повышение риска дефицита железа у пациентов с СН на фоне приёма антитромбоцитарных препаратов, нестероидных противовоспалительных средств, антикоагулянтов, ингибиторов протонной помпы и антацидов [10]. Этиология и патогенез железодефицитных состояний при ХСН и ССЗ представлены на рисунке 1.

Рисунок 1. Причины и патогенез дефицита железа у пациентов с ССЗ
Примечания: ЖКТ — желудочно-кишечный тракт, ИПП — ингибиторы протонной помпы, ИТП — идиопатическая тромбоцитопеническая пурпура, НПВП — нестероидные противовоспалительные препараты, СН — сердечная недостаточность, ХОБЛ — хроническая обструктивная болезнь лёгких, РА — ревматоидный артрит, ССЗ — сердечно-сосудистые заболевания, иНГЛТ2 — ингибитор натрий-глюкозного котранспортера 2 типа.
Дефицит железа следует рассматривать как самостоятельное клинически значимое сопутствующее состояние, которое встречается независимо от наличия или отсутствия анемии примерно у половины пациентов со стабильной ХСН [11] и до 83% случаев при острой декомпенсированной СН, причём часто без наличия анемии [12]. Дефицит железа оказывает более выраженное негативное влияние на прогноз больных, чем анемия без дефицита железа [10]. Наличие дефицита железа у пациентов с СН связано с низкой толерантностью к физической нагрузке, снижением качества жизни и повышением риска госпитализаций и смерти [10].
Дефицит железа при острой СН, вероятно, имеет ещё большее негативное влияние на прогноз. В исследовании было показано, что риск смерти пациентов с острой СН в течение года после выписки из стационара коррелировал с наличием дефицита железа (определён как низкий уровень гепсидина и высокий уровень растворимого рецептора трансферрина (рРТф)) и составил 41% для пациентов с дефицитом железа против 0% для пациентов без дефицита железа, что было показано независимо от наличия анемии [4]. Известно, что дефицит железа является частой находкой при острой декомпенсированной СН и коррелирует с выраженным влиянием на частоту повторных госпитализаций. Согласно результатам исследования, пациенты с абсолютным дефицитом железа госпитализировались на 72% чаще по сравнению с пациентами без дефицита железа [13]. Пациенты с эпизодом острой декомпенсированной СН и сопутствующим дефицитом железа представляют собой целевую группу населения высокого риска, у которой коррекция дефицита железа является необходимой мерой [14].
Изученные особенности патофизиологии дефицита железа при сердечной недостаточности свидетельствуют о том, что истощение запасов клеточного железа при СН негативно влияет на поддержание энергетического гомеостаза миокарда, скелетной мускулатуры, других органов и тканей, а также на функцию органов кроветворения [4][15]. Железо, в дополнение к его ключевой роли в поглощении и транспортировке кислорода в составе гемоглобина, играет важную роль в хранении и метаболизме кислорода в клетках, окислительно-восстановительном цикле и является необходимым как кофактор ряда ферментов, защищающих от активных форм кислорода [15]. Следовательно, поддержание нормального гомеостаза железа имеет решающее значение для клеток, которые требуют высокого поглощения энергии, таких как кардиомиоциты. Известно негативное влияние дефицита железо на функцию митохондрий и сократительную способность миокарда. В исследованиях было показано, что дефицит железа напрямую влияет на функцию кардиомиоцитов человека, нарушая митохондриальное дыхание и снижая сократимость и расслабление кардиомиоцитов, а восстановление уровня внутриклеточного железа приводило к обратному эффекту [16].
Клеточные нарушения в результате дефицита железа имеют чёткое клиническое выражение в виде ухудшения функционального статуса и повышения риска смерти у пациентов с СН даже при нормальном уровне гемоглобина [17]. Дефицит железа приводит к развитию симпатической активации, гипертрофии левого желудочка, дилатации камер сердца, нарушению центральной гемодинамики, что ухудшает прогноз пациентов с СН [18]. Таким образом, неблагоприятные изменения в сердечно-сосудистой системе при дефиците железа являются основными механизмами ухудшения прогноза жизни пациентов с СН.
Распространённость анемии у пациентов с ХСН от 30% до 50% в зависимости от критериев отбора в исследования. Результаты исследований позволяют установить, что пожилой возраст, тяжёлая СН, плохое питание и повышение маркеров воспаления связаны с более высокой частотой анемии. Однако наиболее частым фактором, способствующим развитию анемии при СН, является дефицит железа [6]. Анемия у пациентов с острой декомпенсированной СН по оценкам экспертов встречается чаще чем в 50% случаев, независимо от ФВ ЛЖ, что значительно выше по сравнению с распространённостью в общей популяции (менее 10%), хотя распространённость увеличивается с возрастом, превышая порог в 20% у респондентов в возрасте ≥85 лет [19]. Результаты исследований позволяют судить о том, что пациенты с ХСН, имевшие анемию, по сравнению с пациентами без анемии были старше и чаще женского пола, чаще имели сахарный диабет (СД), ХБП, тяжёлую СН с худшим функциональным статусом, более низкую толерантность к физической нагрузке, более низкое качество жизни, чаще имели отёки, гипотонию и нуждались в более высоких дозах петлевых диуретиков [19].
Особенности диагностики дефицита железа при СН
Диагностика дефицита железа при СН представляет некоторые сложности. Концентрация ферритина в сыворотке крови является маркером количества железа в депо. Известно, что при отсутствии воспаления или хронического заболевания сывороточный ферритин коррелирует с запасами железа в организме и ферритин сыворотки 100 мкг/л соответствует ≈1 г тканевого железа. У здоровых людей уровень ферритина ниже 30 мкг/л и индекс насыщения трансферрина железом (НТЖ) ниже 16% определяют дефицит железа [19].
При развитии воспалительных состояний, включая СН, уровень ферритина неспецифически повышен как реагент острой фазы, что делает идентификацию абсолютного или функционального дефицита железа затруднительной [5]. По этой причине в различных клинических исследованиях по коррекции дефицита железа у пациентов с СН уровни ферритина <100 мкг/л или <300 мкг/л, если НТЖ <20%, использовались для идентификации пациентов с абсолютным и функциональным дефицитом железа [13][14]. Данные критерии диагностики дефицита железа у пациентов с СН представлены в европейских рекомендациях 2021 г. [20], что согласуется с мнением Российских экспертов [21].
Необходимо помнить, что концентрации железа в сыворотке крови может иметь большие суточные колебания у пациентов с СН, поэтому данный лабораторный показатель не может самостоятельно применяться для диагностики дефицита железа у данной категории больных. Однако существуют и другие методы диагностики дефицита железа, которые применимы при СН. Например, уровень рРТф, который повышается при дефиците железа и не подвержен влиянию воспаления. Именно рРТф или насыщение трансферрина железом (НТЖ) среди всех диагностических параметров имеют наиболее сильную корреляцию с истощением запасов железа в костном мозге независимо от других состояний [22].
Другим важным маркером дефицита железа при СН может стать гепсидин, который является главным регулятором абсорбции железа [4]. Уровень гепсидина повышается при хронических заболеваниях, в том числе ХСН, так как, помимо регуляции абсорбции железа, он является белком острой фазы. В норме уровень гепсидина повышается при повышении уровня железа, но при ХСН и любом воспалительном заболевании гепсидин повышается независимо от уровня железа, что приводит к функциональному дефициту железа вследствие замедления его абсорбции в ЖКТ и высвобождения из макрофагов [19]. Гепсидин может стать потенциальной мишенью терапии при функциональном дефиците железа при СН, что требует дальнейшего изучения.
Таким образом, у всех пациентов с ХСН, независимо от уровня гемоглобина в крови, необходимо проводить обследование для оценки наличия и выраженности дефицита железа [11][21].
Особенности коррекции железодефицитных состояний у пациентов с сердечной недостаточностью
Учитывая выраженное влияние железодефицитных состояний на течение СН и прогноз, устранение дефицита железа должно рассматриваться как важное направление в лечении таких больных. Лечение дефицита железа и ЖДА при СН является сложной задачей в силу многофакторного патогенеза её развития. При лечении пациентов с СН основное внимание должно быть уделено поиску и устранению конкретных причин дефицита железа и ЖДА, если это возможно [11].
Необходимо учитывать, что лечение СН и уменьшение гипоксии органов и тканей способствует уменьшению выраженности анемии и дефицита железа. Пациенты с ХСН должны получать оптимальную базисную терапию СН, принципы которой подробно изложены в клинических рекомендациях [20][21]. Представляет особый интерес влияние базисной терапии СН на анемию и дефицит железа у пациентов с ХСН. В мировой литературе есть данные, указывающие на положительный эффект сакубитрила/валсартана в плане коррекции анемии у пациентов с ХСН и сопутствующей ХБП. В ретроспективном анализе базы данных было показано, что исходная распространённость анемии составила 64,7%, а через три месяца лечения сакубитрилом/валсартаном — 38,4% (p=0,016), что коррелировало со снижением уровня цистатина С в сыворотке. Авторы указывают, что эти результаты получены у пациентов с ХСН и сопутствующей ХБП и должны быть подтверждены в более широких клинических испытаниях [23]. Заслуживают внимания данные о том, что препараты из класса ингибиторов натрий-глюкозного котранспортера 2 типа (иНГЛТ2) повышают гематокрит и могут корректировать анемию у пациентов с ХСН [24]. Данный эффект опосредован через увеличение уровня эндогенного эритропоэтина на фоне иНГЛТ2 [25]. Обсуждается опосредованное влияние на гепсидин и процессы утилизации железа, связанные с системным воспалением, которое снижается при применении иНГЛТ2, что помогает улучшить использование запасов железа [26]. Известно, что в субанализах РКИ DAPA‐HF и EMPEROR-Reduced был получен стабильный эффект профилактики и лечения анемии у пациентов с СН на фоне дапаглифлозина или эмпаглифлозина по сравнению с плацебо. При применении эмпаглифлозина снижение риска развития анемии в процессе исследования составило 51% (ОР 0,49 (95% ДИ 0,41–0,59) p<0,001), при применении дапаглифлозина анемия была корригирована в 62,2% случаев по сравнению с 41,1% пациентов в группе плацебо (ОР 2,37 (95% ДИ 1,84–3,04; P <0,001) [27, 28].
Дефицит железа при СН является не только основной причиной анемии у данной категории пациентов, но и широко распространён в популяции пациентов с СН без анемии, оказывая негативное влияние на прогноз [11]. Коррекция дефицита железа у пациентов с СН имеет особенности. В исследовании IRON-OUT было установлено, что эффективность терапии пероральным железом у пациентов с СН недостаточна в связи с нарушением всасывания препарата и низкой приверженностью к лечению из-за побочных эффектов со стороны желудочно-кишечного тракта [29]. Поэтому пероральные формы препаратов железа не рекомендуются для коррекции дефицита железа у пациентов с СН [20][21].
Приоритетным направлением коррекции дефицита железа у пациентов с СН является применение внутривенной формы железа, в частности железа карбоксимальтозата. В РКИ FAIR-HF и EFFECT-HF было показано, что добавление к лечению карбоксимальтозата железа внутривенно безопасно, улучшает симптомы, повышает толерантность к физическим нагрузкам и качество жизни у пациентов с СН, низкой ФВ ЛЖ (СНнФВ) и дефицитом железа [30–32]. В исследовании CONFIRM-HF применение железа карбоксимальтазата внутривенно у пациентов с СН и ФВ ЛЖ≤45% и дефицитом железа по сравнению с плацебо имело стойкий эффект в виде сохранения преимуществ лечения в течение года. На протяжении всего исследования у пациентов, получивших железа карбоксимальтозат, наблюдалось улучшение функционального класса (ФК) NYHA, оценка по шкале общего состояния, качества жизни и показателя утомляемости со статистической значимостью, наблюдаемой начиная с 24-й недели. Лечение карбоксимальтозатом железа было связано со значительным снижением риска госпитализаций по поводу ухудшения СН (ОР (95%ДИ): 0,39 (0,19–0,82, р = 0,009)) [33]. Более того, мета-анализ РКИ, в которых использовался карбоксимальтозат железа для коррекции дефицита железа при СН, показал снижение риска комбинированной конечной точки: смерти от всех причин или госпитализации по сердечно-сосудистым причинам, смерти от ССЗ или госпитализации по причине СН, смерти от ССЗ или повторных госпитализаций по причине ССЗ или СН [34].
В РКИ AFFIRM-AHF изучалось применение железа карбокисмальтозата для внутривенного введения у пациентов с острой СН, госпитализированных в стационар. Пациенты с СН и ФВ ЛЖ менее 50%, имевшие сопутствующий дефицит железа, были рандомизированы для внутривенного введения железа карбоксимальтозата или плацебо сразу после стабилизации клинического состояния. Введение железа карбоксимальтозата не приводило к значительному снижению первичной конечной точки (ПКТ) в виде общего числа госпитализаций по поводу СН и смерти от ССЗ через 52 недели от начала лечения (ОР 0,79, 95% ДИ 0,62 1,01, р=0,059). Вместе с тем это лечение уменьшило составную конечную точку в виде первой госпитализации по поводу СН или смерти от сердечно-сосудистых заболеваний (ОР 0,80, 95% ДИ 0,66 0,98, p=0,030) и общее количество госпитализаций по поводу СН (ОР 0,74, 95% ДИ 0,58 0,94, p=0,013). В связи с тем, что пандемия COVID-19 значительно повлияла на обращение пациентов в медицинские учреждения и частоту госпитализаций во время проведения данного исследования, был дополнительно проведён анализ результатов AFFIRM-AHF до начала пандемии COVID-19. В этом анализе было показано, что ПКТ снижалась на 25% статистически значимо на фоне лечения железа карбоксимальтозатом (ОР 0,75, 95% ДИ 0,59–0,96, p=0,024) [14].
Таким образом, результаты РКИ и мета-анализов свидетельствуют об эффективности применения железа карбоксимальтозата у пациентов с СНнФВ и дефицитом железа, а также у пациентов с СН и ФВ ЛЖ <50%, недавно госпитализированных по поводу ухудшения течения СН, что нашло отражение в клинических рекомендациях.
Согласно клиническим рекомендациям по СН 2020 г., утверждённым МЗ РФ, внутривенное введение железа карбоксимальтозата рекомендуется симптоматическим пациентам с СНнФВ и дефицитом железа (сывороточный ферритин <100 мкг/л или уровень ферритина в диапазоне 100–299 мкг/л при уровне сатурации трансферрина (НТЖ) <20%) с целью улучшения симптомов СН, функциональных возможностей и качества жизни пациентов с ХСН (ЕОК IIaA (УУР А, УДД 2)) [21].
В рекомендациях Европейского общества кардиологов (ЕОК) 2021 г. на основании результатов исследования AFFIRM-AHF дополнительно обозначено следующее: пациентам с симптомами СН, недавно госпитализированным по поводу СН, с ФВ <50% и дефицитом железа (сывороточный ферритин <100 мкг/л, или уровень ферритина 100–299 мкг/л с сатурацией трансферрина (НТЖ) <20%) следует рассмотреть внутривенное введение железа карбоксимальтозата для снижения риска госпитализаций по поводу СН (ЕОК IIaB) [20].
В открытом рандомизированном проспективном исследовании IRONMAN, проведённом в Великобритании, проанализирована эффективность внутривенного применения железа деризомальтозата у пациентов с ХСН и ФВ ЛЖ < 45% и дефицитом железа, который определялся при НТЖ<20% или концентрации ферритина <100 мкг/л. Данные критерии отличались от критериев включения в исследование AFFIRM-AHF и критериев, указанных в национальных и европейских рекомендациях. Пациенты были рандомизированы в группу лечения железа деризомальтозатом или в группу стандартного ведения. Первичной конечной точкой были повторные госпитализации по поводу сердечной недостаточности и смерти от сердечно-сосудистых заболеваний, которые оценивались у всех правильно рандомизированных пациентов. У пациентов, получивших железа деризомальтозат, было зарегистрировано меньше событий ПКТ, но это не было статистически значимо (ОР 0,82 [ 95% ДИ от 0,66 до 1,02]; р=0,070), а при анализе, проведённом с учётом влияния пандемии COVID-19, различия в ПКТ достигли статистической значимости (ОР 0,76. 95% ДИ от 0,58 до 1,00]; р=0,047). [35]. Данный лекарственный препарат не включён в клинические рекомендации по ХСН [20][21].
Таким образом, пероральные препараты железа не рекомендованы при ХСН. В РФ для коррекции дефицита железа у пациентов с СН рекомендован препарат для внутривенного введения железа карбоксимальтозат, который представляет собой стабильный высокомолекулярной комплекс, обеспечивающий физиологичное высвобождение железа. Он обладает меньшим иммуногенным действием и может вводиться в высокой дозе (до 1000 мг в неделю). Дозу препарата подбирают с определением индивидуальной потребности в железе в зависимости от массы тела и исходного уровня гемоглобина, следуя инструкции по применению препарата. После введения железа карбоксимальтазата проводится оценка насыщенности организма пациента железом после введения (ферритин, НТЖ). Повторное поддерживающее введение препарата проводится в сроки, определяемые индивидуально для каждого пациента. Железа карбоксимальтозат применяется как при хронической, так и при острой СН после стабилизации состояния пациента [14]. Коррекция железодефицитных состояний при СН представлена в виде алгоритма на рисунке 2.
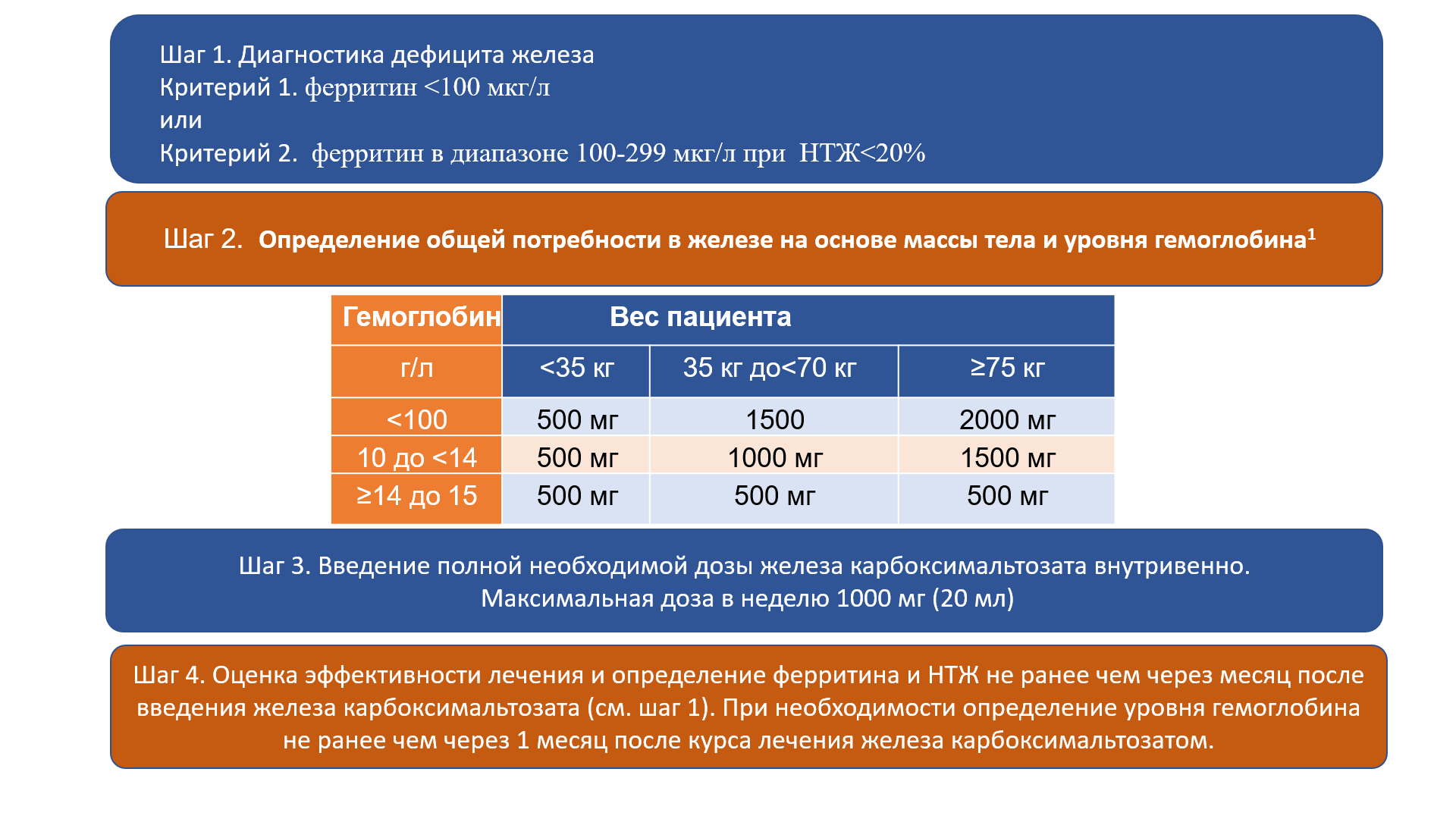
Рисунок 2. Алгоритм коррекции железодефицитных состояний при СН.
Примечание: НТЖ — насыщение трансферрина железом; 1 — Инструкция по медицинскому применению лекарственного препарата ЖКМ, раствор для внутривенного введения 50 мг/мл. ЛСР-008848/10_12.10.2020
Железодефицитные состояния и фибрилляция предсердий
Анемия и фибрилляция предсердий (ФП) часто встречаются у пожилых людей, и их распространённость зависит от возраста, увеличиваясь в большей степени среди лиц старше 80 лет. Известно, что пациенты с ФП имеют вдвое больший риск смерти по сравнению с пациентами с синусовым ритмом, вероятно, из-за сопутствующих заболеваний, включая анемию [36]. Анемия у пациентов с ФП часто сочетается с сахарным диабетом (СД), ХСН и хронической болезнью почек (ХБП) и встречается примерно у 16% пациентов [36]. По данным японского регистра ФП, пациенты с анемией и ФП имели более высокую распространённость сопутствующих заболеваний по сравнению с пациентами с одной только ФП. Они были старше, чаще имели ХСН, ишемическую болезнь сердца (ИБС), заболевания периферических артерий, ХБП и перенесённый инсульт в анамнезе. Также эти пациенты чаще имели большие и значимые кровотечения в анамнезе (4,2% у пациентов с анемией против 1,5% у пациентов без анемии, p<0,001). Известно, что пациенты с ФП и анемией реже получали пероральную антикоагулянтную терапию (44,4% у пациентов с анемией против 52,4% без анемии, р <0,001) [37]. Следовательно, наличие анемии при ФП снижает возможности эффективной профилактики инсульта и тромбоэмболических осложнений (ТЭО), увеличивая риск смерти, инсульта, системной тромбоэмболии и кровотечений [38].
Анемия известна как предиктор госпитализаций среди пожилых пациентов с ФП независимо от демографических факторов, сопутствующих заболеваний или приёма сердечно-сосудистых препаратов [39]. Важно отметить, что анемия может увеличивать риск госпитализаций по причине СН среди пациентов с ФП. Риск госпитализации по причине СН при наличии легкой анемии по сравнению с пациентами без анемии был выше на 87%, а при средней и тяжёлой анемии — более чем в два раза. Выявленная закономерность не зависела от приёма пероральных антикоагулянтов. Кроме того, в этом исследовании анемия была связана с более высоким риском большого кровотечения у пациентов с ФП [40].
Сосуществование дефицита железа, ЖДА и ФП значительно увеличивает бремя коморбидности [41]. Пациенты с ФП имеют высокий риск развития дефицита железа. Во-первых, потому что чаще это пожилые пациенты, у которых могут быть все факторы развития дефицита железа. Во-вторых, существуют и другие специфические факторы риска в когорте больных с ФП, такие как приём антикоагулянтов (повышается риск скрытых кровотечений при наличии патологии желудочно-кишечного тракта), приём ингибиторов протонной помпы (ИПП) параллельно приёму антикоагулянтов, что нарушает всасывание железа [38][41]. В исследовании было показано, что риск развития дефицита железа был в два раза выше у пациентов с постоянной формой ФП по сравнению с пациентами, имевшими пароксизмальную форму ФП [42]. Это, вероятно, может быть связано с большей длительностью применения антикоагулянтной терапии. Другим фактором, который мог повлиять на более высокий риск развития железодефицитной анемии, является более частый и длительный приём дигоксина при постоянной форме ФП. В исследовании было показано, что приём дигоксина повышает риск развития анемии на 38% у пациентов с ФП и на 50% у пациентов с ХСН [43].
По данным американских баз данных, среди 5 975 241 госпитализированных больных с ФП у 2,5% больных был выставлен диагноз ЖДА. При этом пациенты с ФП и ЖДА характеризовались более высокой частотой развития острого инфаркта миокарда, острого повреждения почек и других осложнений [36].
Таким образом, дефицит железа и ЖДА увеличивают бремя сопутствующих заболеваний у пациентов с ФП и независимо увеличивает риски неблагоприятных исходов, таких как увеличение количества госпитализаций, смертности, кровотечений и тромбоэмболических осложнений. Раннее выявление и коррекция дефицита железа и анемии у пациентов с ФП может оказать положительное влияние на уменьшение этих нежелательных явлений [40][42].
Коррекция дефицита железа у пациентов с ФП может быть действенным способом улучшения качества жизни и переносимости физических нагрузок, тем более что при ФП есть тесная связь с ХСН, при которой коррекция дефицита железа изучена хорошо [41]. Исследования по эффективности и безопасности коррекции дефицита железа у пациентов с ФП запланированы [44]. В настоящее время диагностика и коррекция дефицита железа у пациентов с ФП должна проводиться на общих основаниях.
Железодефицитные состояния и ишемическая болезнь сердца
Дефицит железа и анемия часто встречаются у пациентов с ИБС, в том числе и с острым коронарным синдромом (ОКС). Они связаны с неблагоприятным прогнозом, снижением функциональной способности и качества жизни [1][45].
По данным разных исследователей, у пациентов с ИБС анемия выявляется в 10–20% случаев [1]. Среди всех анемий ЖДА занимает первое место по распространённости (75%). Дефицит железа встречается в 10% случаев у пациентов с ИБС [46]. Недостаток железа может приводить к серьёзным нарушениям окислительного метаболизма и клеточных энергетических механизмов, что отражается на уровне потребления кислорода и переносимости физических нагрузок — факторах, особенно важных для пациентов с ССЗ [47].
Одно из недавних исследований было посвящено изучению взаимосвязи между уровнем железа и риском развития ССЗ [48]. В результате анализа данных 12164 пациентов, средний возраст которых составил 59 лет, было показано, что функциональный дефицит железа связан с повышением риска развития ИБС на 24% (p <0,01), повышением смертности от ССЗ на 26% (p = 0,03) и повышением общей смертности на 12% (p = 0,03). Абсолютный дефицит железа вызывал повышение риска ИБС на 20% (р = 0,01) [48].
В многочисленных исследованиях показано, что анемия способствует развитию и прогрессированию ишемии миокарда, вплоть до развития острого инфаркта миокарда [49]. Риск развития ИБС повышается ещё в большей степени при сочетании анемии с другими хроническими заболеваниями, например, при почечной дисфункции значимо повышается риск развития ИБС, даже с учётом поправки на такие известные факторы риска, как сахарный диабет, уровень липидов крови, артериальное давление и проведение антигипертензивной терапии [2]. Риск развития ИБС также увеличивался при снижении ферритина, НТЖ и повышении рРТф [5].
По данным исследований, распространённость анемического синдрома при ОКС колеблется от 18 до 30% и ассоциируется с повышением риска смерти [50]. Ассоциация неблагоприятных исходов при ОКС с анемией особенно отчётливо проявляется у молодых мужчин с избыточным весом, более низкой скоростью клубочковой фильтрации (СКФ), получающих диуретики и бета-адреноблокаторы и не получающих ингибиторы АПФ или блокаторы рецепторов к ангиотензину II [50]. У пациентов с анемией в анамнезе чаще отмечаются окклюзирующие поражения коронарных сосудов, поражение ствола левой коронарной артерии, наличие предшествующих инфарктов [51]. Пациенты с анемией и ОКС реже подвергаются реваскуляризации миокарда [51]. Анализ более чем 45 000 случаев ЧКВ при ОКС и стабильной ИБС показал, что анемия является независимым фактором риска госпитальной летальности у мужчин и серьёзных сердечно-сосудистых осложнений и у мужчин, и у женщин [52].
Дефицит железа является отдельным фактором риска неблагоприятного исхода ОКС. В исследованиях показано, что дефицит железа — это независимый предиктор смерти или развития тяжёлой СН в популяции пациентов с ОКС [53]. Одна из причин высокой распространённости дефицита железа у пациентов с ОКС (до 61%) связана с кровопотерей во время инвазивных процедур и применением антитромботической терапии [54].
Важно помнить, что гипоксия при дефиците железа и анемии компенсируется каскадом гемодинамических и гемодинамически неассоциированных механизмов. Реализация основных гемодинамических факторов достигается путём повышения сократительной способности миокарда, уменьшения постнагрузки, увеличения преднагрузки, реализацией положительного ино- и хронотропных эффектов. У пациентов с ССЗ эти дополнительные эффекты способствуют увеличению частоты сердечно-сосудистых осложнений [55].
Анализ данных свидетельствует о том, что дефицит железа часто встречается у пациентов с ИБС и увеличивает риск смерти. Таким образом, пациенты с ИБС являются таргетной группой для коррекции железодефицитных состояний. Однако в будущем предстоит доказать является ли восполнение дефицита железа у пациентов этой категории полезным и безопасным.
Заключение
Таким образом, результаты многочисленных исследований свидетельствуют о том, что железодефицитные состояния оказывают существенное влияние на течение ССЗ, являются независимым предиктором риска неблагоприятных клинических исходов, в связи с чем необходима ранняя диагностика анемии и дефицита железа для оценки риска и проведения оптимальной медикаментозной коррекции. В течение последних двух десятилетий были тщательно исследованы прогноз и подходы к лечению пациентов с дефицитом железа и симптомной ХСН и ФВ ЛЖ <50%, острой декомпенсированной СН и ФВ ЛЖ <50%. Данные исследования легли в основу формирования алгоритма диагностики и лечения железодефицитных состояний при ХСН, которые представлены в клинических рекомендациях различных стран мира. К сожалению, данные исследования были сосредоточены на пациентах с СН и сниженной фракцией выброса, исследования для пациентов с ХСН и сохранённой ФВ ЛЖ продолжаются. Современная клиническая практика остро нуждается в исследованиях, которые могли бы дать чёткий ответ на вопрос об эффективности и безопасности коррекции дефицита железа у пациентов с другими ССЗ (ФП, ИБС).
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Гороховская Г.Н., Мартынов A.И., Юн B.Л., Петина М.М. Современный взгляд терапевта на проблему железодефицитной анемии у пациентов с сердечно-сосудистой патологией. Медицинский Совет. 2020;(14):70-78. https://doi.org/10.21518/2079-701X-2020-14-70-78.
2. Astor B.C., Coresh J, Heiss G., Pettitt D., Sarnak M.J. Kidney function and anemia as risk factors for coronary heart disease and mortality: the AtheroscLerosis Risk in Communities (ARIC) Study. Am Heart J. 2006;151(2):492-500. https://doi.org/10.1016/j.ahj.2005.03.055.
3. Comin-Colet J, Enjuanes C, Gonzalez G et al. Iron deficiency is a key determinant of health-related quality of life in patients with chronic heart failure regardless of anaemia status. Eur. J. Heart Failure. 2013;15:1164–1172.
4. Jankowska E.A., Kasztura M., Sokolski M. et al. Iron deficiency defined as depleted iron stores accompanied by unmet cellular iron requirements identifies patients at the highest risk of death after an episode of acute heart failure. Eur. Heart J. 2014;35:2468–2476. doi: 10.1093/eurheartj/ehu235.
5. Iron deficiency and cardiovascular disease.von Haehling S, Jankowska EA, van Veldhuisen DJ, Ponikowski P, Anker SD. Nat Rev Cardiol. 2015 Nov;12(11):659-69. doi: 10.1038/nrcardio.2015.109.
6. Chopra VK, Anker SD. Anaemia, iron deficiency and heart failure in 2020: facts and numbers. ESC Heart Fail. 2020 Oct;7(5):2007-2011. doi: 10.1002/ehf2.12797.
7. Komajda M, Anker SD, Charlesworth A., et al. The impact of new onset anaemia on morbidity and mortality in chronic heart failure: results from COMET. Eur Heart J. 2006 Jun;27(12):1440-6. doi: 10.1093/eurheartj/ehl012.
8. Von Haehling S, Schefold JC, Hodoscek LM et al. Anaemia is an independent predictor of death in patients hospitalized for acute heart failure. Clin Res Cardiol. 2010;99:107–113. doi: 10.1007/s00392-009-0092-3.
9. Martens P, Minten L. Prevalence of underlying gastrointestinal malignancies in iron-deficient heart failure. ESC Heart Fail. 2019 Feb;6:37–44. doi: 10.1002/ehf2.12379.
10. Jankowska EA, von Haehling S, Anker SD, Macdougall IC, Ponikowski P. Iron deficiency and heart failure: diagnostic dilemmas and therapeutic perspectives. Eur Heart J. 2013;34:816–29. doi: 10.1093/eurheartj/ehs224.
11. Мареев В.Ю., Гиляревский С.Р., Мареев Ю.В. и др. Согласованное мнение экспертов по поводу роли дефицита железа у больных с хронической сердечной недостаточностью, а также о современных подходах к его коррекции. Кардиология. 2020;60(1):99–106. doi: 10.18087/cardio.2020.1.n961.
12. Mistry R. H., Kohut A., Ford P. Correction of iron deficiency in hospitalized heart failure patients does not improve patient outcomes. Annals of Hematology. 2020;100(3),661–666. doi:10.1007/s00277-020-04338-2.
13. Núñez J, Comín-Colet J, Miñana G et al. Iron deficiency and risk of early readmission following a hospitalization for acute heart failure. Eur J Heart Fail. 2016;18:798–802. doi: 10.1002/ejhf.513.
14. Ponikowski P, Kirwan BA, Anker SD et al. Ferric carboxymaltose for iron deficiency at discharge after acute heart failure: a multicentre, double-blind, randomised, controlled trial. AFFIRM-AHF investigators. Lancet. 2020 Dec 12;396(10266):1895-1904. doi: 10.1016/S0140-6736(20)32339-4.
15. Melenovsky V, Petrak J, Mracek T et al. Myocardial iron content and mitochondrial function in human heart failure: a direct tissue analysis. Eur J Heart Fail 2017;19:522–30. doi: 10.1002/ejhf.640.
16. Hoes MF, Grote Beverborg N, Kijlstra JD et al. Iron deficiency impairs contractility of human cardiomyocytes through decreased mitochondrial function. Eur J Heart Fail. 2018;20:910–19. doi: 10.1002/ejhf.1154.
17. Okonko D.O., Mandal A.K., Missouris C.G., Poole-Wilson P.A. Disordered iron homeostasis in chronic heart failure: Prevalence, predictors, and relation to anemia, exercise capacity, and survival. J. Am. Coll. Cardiol. 2011;58:1241–1251. doi: 10.1016/j.jacc.2011.04.040.
18. Naito Y, Tsujino T, Matsumoto M et al. Adaptive response of the heart to long-term anemia induced by iron deficiency. Am J Physiol Heart Circ Physiol. 2009;296:H585–H593. doi: 10.1152/ajpheart.00463.2008.
19. Anand IS, Gupta P. Anemia and Iron Deficiency in Heart Failure. Circulation. 2018;138(1):80-98. https://doi.org/10.1161/CIRCULATIONAHA.118.030099.
20. McDonagh TA, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021. doi: 10.1093/eurheartj/ehab368.
21. Терещенко С.Н., Галявич А.С., Ускач Т.М. и др. Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):311-374. doi: 10.15829/1560-4071-2020-4083.
22. Grote Beverborg N, Klip IT, Meijers WC, et al. Definition of iron deficiency based on the gold standard of bone marrow iron staining in heart failure patients. Circ Heart Fail. 2018;11:e004519. doi:10.1161/CIRCHEARTFAILURE.117.004519.
23. Robles NR, Campillejo RD, Valladares J, et al. Sacubitril-Valsartan Improves Anemia of Cardiorenal Syndrome (CRS). Cardiovasc Hematol Agents Med Chem. 2021;19(1):93-97. doi: 10.2174/1871525718666200506095537.
24. Docherty KF, Petrie MC. Sodium-glucose cotransporter 2 inhibitors as a treatment for heart failure. Heart 2021;0:1–9. doi:10.1136/heartjnl-2020-318658.
25. Mazer CD, Hare GM, Connelly PW, Gilbert RE, Shehata N, et al. Effect of empagliflozin on erythropoietin levels, iron stores, and red blood cell morphology in patients with type 2 diabetes mellitus and coronary artery disease. Circulation. 2020;141:704–7. doi: 10.1161/CIRCULATIONAHA.119.044235.
26. Ghanim H, Abuaysheh S, Hejna J, Green K, Batra M, et al. Dapagliflozin Suppresses Hepcidin And Increases Erythropoiesis. J Clin Endocrinol Metab. 2020 Apr 1;105(4):dgaa057. doi: 10.1210/clinem/dgaa057.
27. Docherty, K. F., Curtain, J. P., Anand, I. S., Bengtsson, O., Inzucchi, S. E., et al. Effect of dapagliflozin on anaemia in DAPA‐HF. European Journal of Heart Failure. 2021;23(4), 617–628. doi:10.1002/ejhf.2132.
28. Ferreira JP, Anker SD., Butler J, Filippatos G, Iwata T et al. Impact of anaemia and the effect of empagliflozin in heart failure with reduced ejection fraction: findings from EMPEROR-Reduced. European Journal of Heart Failure. 2022. doi:10.1002/ejhf.2409.
29. Effect of Oral Iron Repletion on Exercise Capacity in Patients with Heart Failure with Reduced Ejection Fraction and Iron Deficiency: the IRONOUT HF Randomized Clinical Trial. Gregory D. Lewis, Rajeev Malhotra, Adrian F. Hernandez, Steven E. McNulty, Andrew Smith, G. Michael Felker, W.H. Wilson Tang, Shane J. LaRue, Margaret M. Redfield, Marc J. Semigran, Michael M. Givertz, Peter Van Buren, David Whellan, Kevin J. Anstrom, Monica R. Shah, Patrice Desvigne-Nickens, Javed Butler, Eugene Braunwald, for the NHLBI Heart Failure Clinical Research Network. JAMA. 2017 May 16; 317(19): 1958–1966. doi: 10.1001/jama.2017.5427
30. Anker SD, Comin Colet J, Filippatos G, Willenheimer R, Dickstein K, et al. FAIR-HF Trial Investigators. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med 2009; 361:2436-2448. doi: 10.1056/NEJMoa0908355.
31. Veldhuisen DJ, Ponikowski P, van der Meer P, Metra M, Bohm M, et al. EFFECT-HF Investigators. Effect of ferric carboxymaltose on exercise capacity in patients with chronic heart failure and iron deficiency. Circulation 2017; 136:1374-1383. doi: 10.1161/CIRCULATIONAHA.117.027497.
32. Filippatos G, Farmakis D, Colet JC, Dickstein K, Luscher TF, et al. Intravenous ferric carboxymaltose in iron-deficient chronic heart failure patients with and without anaemia: a subanalysis of the FAIR-HF trial. Eur J Heart Fail 2013;15:12671276. doi: 10.1093/eurjhf/hft099.
33. Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency. Ponikowski P, van Veldhuisen DJ, Comin-Colet J, Ertl G, Komajda M, Mareev V et al.; CONFIRM-HF Investigators. Eur Heart J. 2015 Mar 14;36(11):657-68. doi: 10.1093/eurheartj/ehu385.
34. Anker SD, Kirwan BA, van Veldhuisen DJ, Filippatos G, Comin-Colet J, et al. Effects of ferric carboxymaltose on hospitalisations and mortality rates in iron-deficient heart failure patients: an individual patient data meta-analysis. Eur J Heart Fail 2018;20:125133. doi: 10.1002/ejhf.823.
35. Intravenous ferric derisomaltose in patients with heart failure and iron deficiency in the UK (IRONMAN): an investigator-initiated, prospective, randomised, open-label, blinded-endpoint trial. Kalra PR, Cleland JGF, Petrie MC, Thomson EA, Kalra PA et al.; IRONMAN Study Group. Lancet. 2022 Nov 4:S0140-6736(22)02083-9. doi: 10.1016/S0140-6736(22)02083-9.
36. Minhas AMK, Sagheer S, Shekhar R et al. Trends and Inpatient Outcomes of Primary Atrial Fibrillation Hospitalizations with Underlying Iron Deficiency Anemia: An Analysis of The National Inpatient Sample Database from 2004 -2018. Curr Probl Cardiol. 2021 Sep 24;101001. doi: 10.1016/j.cpcardiol.2021.101001.
37. Takabayashi, K., Unoki, T., Ogawa, H. et al. Clinical characteristics of atrial fibrillation patients with anemia: from the Fushimi AF registry. European Heart Journal. 2013;34(suppl 1):389–P389. doi:10.1093/eurheartj/eht307.p389.
38. Tu SJ, Hanna-Rivero N, Elliott AD et al. Associations of anemia with stroke, bleeding, and mortality in atrial fibrillation: a systematic review and meta-analysis. J Cardiovasc Electrophysiol. 2021;32:686–94. doi: 10.1111/jce.14898.
39. Lee WH, Hsu PC, Chu CY et al. Anemia as an Independent Predictor of Adverse Cardiac Outcomes in Patients with Atrial Fibrillation. International Journal of Medical Sciences. 2015;12:618-624.doi: 10.7150/ijms.11924.
40. An Y, Ogawa H, Esato M et al. Cardiovascular Events and Mortality in Patients With Atrial Fibrillation and Anemia (from the Fushimi AF Registry). Registry Investigators. Am J Cardiol. 2020 Nov 1;134:74-82. doi: 10.1016/j.amjcard.2020.08.009.
41. Anemia and iron deficiency in patients with atrial fibrillation. Hanna-Rivero N, Tu SJ, Elliott AD, Pitman BM, Gallagher C, Lau DH, Sanders P, Wong CX. BMC Cardiovasc Disord. 2022 May 4;22(1):204. doi: 10.1186/s12872-022-02633-6.
42. Keskin M, Ural D, Altay S et al. Iron deficiency and hematinic deficiencies in atrial fibrillation: A new insight into comorbidities. Turk Kardiyol Dern Ars. 2018 Mar;46(2):103-110. doi: 10.5543/tkda.2018.51001.
43. He S, Feng R, Xu Z et al. Digoxin-induced anemia among patients with atrial fibrillation and heart failure: clinical data analysis and drug-gene interaction network. Oncotarget. 2017 Jun 16;8(34):57003-57011. doi: 10.18632/oncotarget.18504.
44. Tu SJ, Elliott AD, Hanna-Rivero N et al. Rationale and design of the IRON-AF study: a double-blind, randomised, placebo-controlled study to assess the effect of intravenous ferric carboxymaltose in patients with atrial fibrillation and iron deficiency. BMJ Open. 2021 Aug 9;11(8):e047642. doi: 10.1136/bmjopen-2020-047642.
45. Rymer JA, Rao SV. Anemia and coronary artery disease: pathophysiology, prognosis, and treatment. Coron Artery Dis. 2018; 29:161–7. doi: 10.1097/MCA.0000000000000598.
46. Отчет о работе Экспертного совета «Актуальные вопросы железодефицита в Российской Федерации». Терапия. 2020; 5: 10-19. https://dx.doi.org/10.18565/therapy.2020.5.10-19.
47. Anker SD, Colet JC, Filippatos G, et al. FAIRHF committees and investigators. Rationale and design of Ferinject Assessment in patients with IRon deficiency and chronic Heart Failure (FAIRHF) study: a randomized, placebo-controlled study of intravenous iron supplementation in patients with and without anaemia. Eur J Heart Fail. 2009;11:1084–91.
48. Benedikt Schrage1,2, Nicole Rübsamen1, Francisco M. Ojeda et al. Association of iron deficiency with incidentcardiovascular diseases and mortality in the generalpopulation. ESC Heart Failure. 2021;8: 4584–4592]. doi:10.1002/ehf2.13589.
49. Collet JP, Thiele H, Barbato E et al. (ESC Scientific Document Group). 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: The Task Force for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J. 2020; ehaa575. doi: 10.1093/eurheartj/ehaa575.
50. Ye SD, Wang SJ, Wang GG et al. Association between anemia and outcome in patients hospitalized for acute heart failure syndromes: findings from Beijing Acute Heart Failure Registry (Beijing AHF Registry). Intern Emerg Med. 2021;16(1):183–92. doi: 10.1007/s11739-020-02343-x.
51. Huynh R, Hyun K, D’Souza M et al. Outcomes of anemic patients presenting with acute coronary syndrome: An analysis of the Cooperative National Registry of Acute Coronary Care, Guideline Adherence and Clinical Events. Clin Cardiol. 2019;42(9):791–96. doi: 10.1002/clc. 23219.
52. McKechnie RS, Smith D, Montoye C et al. Prognostic impLication of anemia on in-hospitaL outcomes after percutaneous coronary intervention. Circulation. 2004;110(3):271-277.https://doi.org/10.1161/01.CIR.0000134964.01697.C7.
53. Zeller T, Waldeyer C, Ojeda F et al. Adverse outcome prediction of iron deficiency in patients with acute coronary syndrome. Biomolecules. 2018;8(3):60. doi: 10.3390/biom8030060.
54. O. Meroño, M. Cladellas, N. Ribas-Barquet, et al.Iron Deficiency in patients with acute coronary syndrome: prevalence and predisposing factors. Rev Esp Cardiol. 2016; 69:615-617.
55. Будневский А.В., Овсянников Е.С., Редька А.В. Влияние анемии на течение сердечно-сосудистых заболеваний. Кардиоваскулярная терапия и профилактика, 2016; 15(1): 64–68 http://dx.doi.org/10.15829/1728-8800-2016-1-64-68
Об авторах
Н. Г. ВиноградоваРоссия
Виноградова Надежда Георгиевна, д. м. н., доцент кафедры терапии и кардиологии
Нижний Новгород
А. И. Чесникова
Россия
Чесникова Анна Ивановна, д. м. н., профессор кафедры внутренних болезней №1
Ростов-на-Дону
Дополнительные файлы
Рецензия
Для цитирования:
Виноградова Н.Г., Чесникова А.И. Железодефицитные состояния при сердечно-сосудистых заболеваниях: влияние на прогноз и особенности коррекции. Южно-Российский журнал терапевтической практики. 2023;4(1):7-18. https://doi.org/10.21886/2712-8156-2023-4-1-7-18
For citation:
Vinogradova N.G., Chesnikova A.I. Iron deficiency states in cardiovascular diseases: impact on prognosis and features of correction. South Russian Journal of Therapeutic Practice. 2023;4(1):7-18. (In Russ.) https://doi.org/10.21886/2712-8156-2023-4-1-7-18


























