Перейти к:
Взаимосвязь суммарной экспрессии трансформирующего фактора роста β1, моноцитарного хемоаттрактного протеина-1, сосудистого эндотелиального фактора роста-А в почечной ткани с клинико-морфологическими проявлениями при гломерулонефритах
https://doi.org/10.21886/2712-8156-2022-3-4-77-83
Аннотация
Цель: изучение влияния выраженности суммарной экспрессии сосудистого эндотелиального фактора роста А (VEGF А), тканевого фактора роста β1 (TGF-β1) и моноцитарного хемоаттрактантного фактора 1 (MCP-1) на течение гломерулонефритов.
Материалы и методы: исследование проспективное (12 мес.) открытое сравнительное клинико-морфологическое с включением 75 больных в возрасте от 18 до 75 лет (лиц мужского пола — 52, женского пола — 23) с гломерулонефритом в стадии обострения. Всем пациентам исходно проводилось обследование, включая оценку клинико-лабораторных и инструментальных показателей, в том числе пункционная нефробиопсия. В дополнение к стандарту срезы биоптатов окрашивались маркированными антителами к VEGF А, TGF-β1 и MCP-1 для оценки их экспрессии в ткани почек. Спустя 12 месяцев оценивалось развитие ремиссии гломерулонефрита, параметры общего анализа мочи, креатинина, мочевины, мочевой кислоты крови, расчет СКФ.
Результаты: установлено, что выраженность суммарной экспрессии MCP-1+VEGF-А+TGFβ1 наблюдается в большей мере при гематурических формах гломерулонефрита, протекающих без изменений уровня альбумина крови. Это же следует из результатов, демонстрирующих связь суммарной экспрессии MCP-1+VEGF-А+TGFβ1 с морфологическими проявлениями, в большей мере свойственными нефритическим формам гломерулонефрита (депозиты IgA, мезангиальная гиперклеточность). Повышение экспрессии изученных факторов доказало свое влияние на развитие фиброза и утолщение стенок почечных сосудов, фиброз клубочков и интерстиция, отражающих в целом комплекс репаративного ремоделирования почечной ткани в условиях воспалительного процесса. Выявлено влияние суммарной экспрессии MCP-1+VEGF-А+TGFβ1 на дальнейшее течение гломерулонефрита, сопровождающееся прогрессированием болезни в виде снижения СКФ спустя 12 мес. наблюдения за больными.
Выводы: повышение суммарной экспрессии MCP-1+VEGF-А+TGFβ1 при гематурических формах гломерулонефрита свидетельствует о роли данных факторов в развитии воспалительного процесса в большей степени при этих формах болезни. Установлено, что повышение выраженности суммарной экспрессии MCP-1+VEGF-А+TGFβ1 ассоциируется с проявлениями почечного ремоделирования при гломерулонефрите. Показано, что повышение выраженности суммарной экспрессии MCP-1+VEGF-А+TGFβ1 сопровождается повышением вероятности быстрого снижения почечной функции при гломерулонефрите при двенадцатимесячном наблюдении.
Ключевые слова
Для цитирования:
Батюшин М.М., Мухтарова А.В., Синельник Е.А. Взаимосвязь суммарной экспрессии трансформирующего фактора роста β1, моноцитарного хемоаттрактного протеина-1, сосудистого эндотелиального фактора роста-А в почечной ткани с клинико-морфологическими проявлениями при гломерулонефритах. Южно-Российский журнал терапевтической практики. 2022;3(4):77-83. https://doi.org/10.21886/2712-8156-2022-3-4-77-83
For citation:
Batiushin M.M., Mukhtarova A.V., Sinelnik E.A. The relationship of the total expression of transforming growth factor β1, monocytic chemoattractive protein-1, vascular endothelial growth factor-A in renal tissue with clinical and morphological manifestations in glomerulonephritis. South Russian Journal of Therapeutic Practice. 2022;3(4):77-83. (In Russ.) https://doi.org/10.21886/2712-8156-2022-3-4-77-83
Введение
На протяжении последних лет наблюдается обновление классификации гломерулонефритов с выделением как новых форм, в частности С3-доминатных, так и пересмотром критериев существующих форм. Большую роль в этом процессе играют новые знания в области патофизиологии данной группы болезней, неразрывно связанные с исследованиями в области патоморфологии гломерулонефритов. Оценка экспрессии молекул в почечной ткани, играющих важную роль в процессах развития альтерации, экссудации и пролиферации, формирует представление в процессах, происходящих при гломерулонефрите и создаёт предпосылки для оценки их роли в прогрессировании заболевания [1]. В частности, в последние годы широко изучается роль молекул, регулирующих межклеточные взаимодействия в условиях воспаления. Важным представляется изучение комплексного воздействия провоспалительных молекул на течение и прогрессирование гломерулонефритов [2]. В связи с этим целью нашего исследования явилось изучение влияния выраженности суммарной экспрессии сосудистого эндотелиального фактора роста А (VEGF А), тканевого фактора роста β1 (TGF-β1) и моноцитарного хемоаттрактантного фактора 1 (MCP-1) на течение гломерулонефритов.
Материалы и методы
Исследование проспективное (двенадцатимесячное) открытое сравнительное клинико-морфологическое, в которое было включено 75 больных в возрасте от 18 до 75 лет (52 мужчины, 23 женщины) с гломерулонефритом в стадии обострения и показаниями для проведения морфологического исследования почек. Пациенты с иными заболевания почек, а также коморбидными заболеваниями других систем в исследование не включались.
Всем пациентам исходно проводилось обследование, включая оценку клинико-лабораторных и инструментальных показателей в соответствии с действующими стандартами и рекомендациями (для дальнейшего анализа использованы данные общего анализа мочи, анализа крови на уровни креатинина, мочевины, мочевой кислоты, фибриногена, общего холестерина, общего белка и альбумина), в том числе пункционная нефробиопсия. В дополнение к стандарту срезы биоптатов окрашивались маркированными антителами к VEGF А, TGF-β1 и MCP-1 для оценки их экспрессии в ткани почек (Cloud-Clone Corp и система детекции для ручной методики иммуногистохимии окрашивания NovoLink Max Polymer Detection System на основе компактного полимера). Для морфологического анализа биоптатов применялся цифровой микроскоп «Leica DMD108». Скорость клубочковой фильтрации рассчитывалась по формуле СKD-EPI, определение стадии ХБП проводилось согласно рекомендациям Ассоциации нефрологов (2021). Спустя 12 мес. оценивалось развитие ремиссии гломерулонефрита, параметры общего анализа мочи, креатинина, мочевины, мочевой кислоты крови, расчет СКФ.
Гломерулонефрит проявлялся нефритическим синдромом в 41 (54,7%) случаях, нефротическим — в 34 (45,3%). У 52 пациентов наблюдался отечный синдром (69,3%). Артериальная гипертензия (АГ) наблюдалась у 49 пациентов (65,3%); АГ 1 степени — у 20 пациентов, 2 степени — у 24 пациентов, 3 степени — у 5 пациентов; АГ 1 стадии — у 11 пациентов, 2 стадии — у 26 пациентов, 3 стадия — у 12 пациентов.
Всем пациентам проводилась нефропротективная терапия, включающая иАПФ (76%), АРА II (24%), пентоксифиллин (49,3%), сулодексид (50,7%). Патогенетическая гормональная терапия (пульс-терапия метилпреднизолоном — 30 больным, терапия метипреднизолом — 23 пациентам и преднизолоном — 8 человек по класической схеме) проводилась в 45,3% случаев. Иммуносупрессивная терапия с применением алкилирующих препаратов (циклофосфан, эндоксан) использовалась у 16 пациентов, ингибитора кальцинейрина (циклоспорин) — у 10 человек. Помимо иАПФ, АРА II, с целью коррекции уровня артериального давления применялись блокаторы медленных кальциевых каналов (у 12,0% исследуемых), бета-адреноблокаторы (9,3%), диуретики (40,0% случаев). По результатам проведённой нефробиопсии, группа гломерулонефритов была представлена IgA-нефропатией в 42 случаях (56,0%), фокальносегментарным гломерулосклерозом — в 18,7% случаев, болезнью минимальных изменений — в 5,3% случаев, IgM-нефропатией — в 2,7% случаев, мембранозной нефропатией — в 17,3% случаев. Среди пациентов с нефротическим синдромом наступление полной ремиссии спустя 12 месяцев наблюдения отмечалось у 8,8% респондентов, частичной ремиссии — 32,3%. У исследуемых с нефритическим вариантом ХГН полная ремиссия зарегистрирована у 4,9% участников, частичная — у 39,0%.
Статистический анализ данных производился с использованием программ Mic. Off. Excel-2016 (MicrosoftCorp., USA) и Statistica-10.0 (StatSoft Inc., USA). С помощью критерия Колмогорова-Смирнова оценивалась нормальность распределения признаков, при ненормальном распределении определялись медиана, интерквартильный размах. Для изучения взаимосвязи двух переменных применялся коэффициент корреляции Спирмена. При помощи логистического регрессионного анализа определялась вероятность развития события. Нулевую гипотезу отвергали при р<0,05. ROC-анализ использовался для оценки диагностической значимости гипотезы.
Исследование было одобрено локальным этическим комитетом РостГМУ.
Результаты
В ходе анализа экспрессии MCP-1, VEGF-А и TGFβ1 была обнаружена корреляционная связь между ними у больных с гломерулонефритами. В частности, коэффициент корреляции Спирмена между MCP-1 и VEGF-А составил 0,43 (р<0,05), между MCP-1 и TGFβ1 — 0,30 (р<0,05), между VEGF-А и TGFβ1 — 0,39 (р<0,05), а между VEGF-А и TGFβ1 — 0,39 (р<0,05). Это объясняется синергизмом действия этих биологических субстанций в рамках воспалительного процесса в почке. Поскольку интенсивность экспрессии биологических факторов оценивалась в баллах, то суммирование баллов по всем трём факторам определяла выраженность экспрессии MCP-1+VEGF-А+TGFβ1. Нами был проведен анализ взаимосвязи MCP-1+VEGF-А+TGFβ1 с клиническими признаками при гломерулонефрите (табл. 1).
Таблица 1
Корреляционный матрикс, отражающий взаимосвязи выраженности суммарной экспрессии MCP-1+VEGF-А+TGFβ1 в почечной ткани с клиническими параметрами
Параметр | R | Параметр | R |
Мужской пол | -0,11 | Нефротический синдром | -0,23 |
Возраст, лет | 0,25* | Наличие отеков | 0,04 |
Продолжительность ХБП, лет | 0,13 | ИМТ, кг/м² | 0,11 |
Креатинин крови, мкмоль/л | 0,25* | ХБП, стадия | 0,17 |
Мочевина крови, ммоль/л | 0,19 | Протеинурия разовой порции, г/л | -0,04 |
СКФ, мл/мин/1,73м² | -0,30* | Суточная протеинурия, г/сут | -0,13 |
Общий белок крови, г/л | 0,21 | Эритроцитурия, кл. в п.зр. | 0,32* |
Альбумин крови, г/л | 0,31* | АГ | 0,17 |
Общий холестерин, ммоль/л | -0,14 | АГ, степень | 0,03 |
Глюкоза тощаковая, ммоль/л | 0,14 | АГ, стадия | -0,05 |
Мочевая кислота, мкмоль/л | -0,001 | ХСН | -0,11 |
Фибриноген, г/л | -0,12 |
Примечание: * — р<0,05
Согласно полученным данным, суммарная экспрессия MCP-1+VEGFА+TGFβ1 в почечной ткани имела положительную корреляционную связь с возрастом больных, с эритроцитурией уровнем и альбумина в сыворотке крови, что отражает некоторые клинические особенности течения гломерулонефрита. Также было показано, что повышение выраженности суммарной экспрессии MCP-1+VEGFА+TGFβ1 сопровождалось ростом уровня креатинина крови и снижением СКФ, что подтверждает роль изучаемых факторов в прогрессировании гломерулонефрита. Также был проведён анализ взаимосвязи выраженности суммарной экспрессии MCP-1+VEGFА+TGFβ1 исходно с клиническими факторами, оценка которых была произведена спустя 12 мес. от проведения нефробиопсии. В частности, высокая суммарная экспрессия изученных факторов сопровождалась сохранением эритроцитурии (R=0,30, р<0,05), а также снижением СКФ (R=-0,26, р<0,05) спустя год наблюдения. Связь экспрессии факторов с эритроцитурией вероятно обусловлена влиянием экспрессии MCP-1+VEGF-А+TGFβ1 на прогрессирование в большей степени именно нефритических форм гломерулонефритов, при которых эритроцитурия выявляется чаще.
С целью изучения вероятности вовлечения различных структур почечной ткани и развития патоморфологических изменений в зависимости от суммарной экспрессии MCP-1+VEGF-А+TGFβ1 нами был проведён корреляционный анализ с применением коэффициента Спирмена, а также логистический регрессионный анализ для определения диагностический значимости выявленных изменений.
Приведенные в таблице 2 результаты корреляционного анализа между экспрессией MCP-1+VEGF+TGFβ1 и морфологическими признаками демонстрируют взаимосвязь суммарной экспрессии данных факторов с развитием пролиферативных, атрофических и фиброзных изменений в ткани почек. В частности, выраженная суммарная экспрессия MCP-1+VEGF+TGFβ1 сопровождает процессы гипертрофии меганзия, поражения подоцитов, ремоделирования сосудов почечной ткани, а также иммунопатологические изменения в виде отложений иммунных комплексов и активации системы комплемента по альтернативному пути.
Таблица 2
Корреляционный матрикс, отражающий взаимосвязи выраженности суммарной экспрессии MCP-1+VEGF+TGFβ1 в почечной ткани с морфологическими параметрами (только статистически значимые данные, р<0,05)
Параметр | R | Параметр | R |
Мезангиальная гиперклеточность | 0,24 | Некроз подоцитов | 0,23 |
Выраженность атрофии канальцев | 0,34 | Очаговый фиброз интерстиция | 0,27 |
Гипертрофия медии сосудистой стенки | 0,32 | Депозиты парамезангиальные | 0,23 |
Депозиты IgA (суммарная оценка отложений) | 0,25 | Депозиты IgA в мезангии | 0,36 |
Демозиты IgM (суммарная оценка отложений) | 0,24 | Депозиты С3 | 0,25 |
Фиброз интимы артерий малого диаметра | 0,28 |
Проведённый логистический регрессионный анализ позволил выявить суммарное влияние выраженности экспрессии факторов MCP-1+VEGF+TGFβ1 на вероятность развития морфологических изменений (табл. 3).
Таблица 3
Результаты логистического регрессионного анализа вероятности морфологических изменений в зависимости от суммарной интенсивности экспрессии MCP-1+VEGF+TGFβ1
Параметр | В0 | Оценка | ОР (ед.) | ОР (ранг) | χ² | р |
Мезангиальная гиперклеточность | -0,65 | 0,36 | 1,43 | 12,2 | 4,51 | 0,033 |
Депозиты IgA (суммарная оценка отложений) | -1,05 | 0,34 | 1,41 | 10,9 | 4,85 | 0,028 |
Демозиты IgM (суммарная оценка отложений) | -3,86 | 0,43 | 1,54 | 20,4 | 4,12 | 0,042 |
Депозиты С3 | -0,44 | 0,47 | 1,61 | 27,5 | 5,27 | 0,022 |
Гипертрофия медии сосудистой стенки | -2,45 | 0,63 | 1,88 | 83,7 | 7,84 | 0,005 |
Некроз подоцитов | -12,2 | 1,41 | 4,10 | 1,90 | 4,84 | 0,028 |
ТИФ | -0,11 | 0,27 | 1,31 | 6,64 | 2,49 | 0,11 |
Гломерулосклероз | -0,77 | 0,19 | 1,31 | 3,89 | 1,75 | 0,19 |
Примечание: ОР — относительный риск
На рисунке 1 изображены графики вероятности развития ряда молрфологических изменений в зависимости от суммарной выраженности экспрессии MCP1+VEGF+TGFβ1.
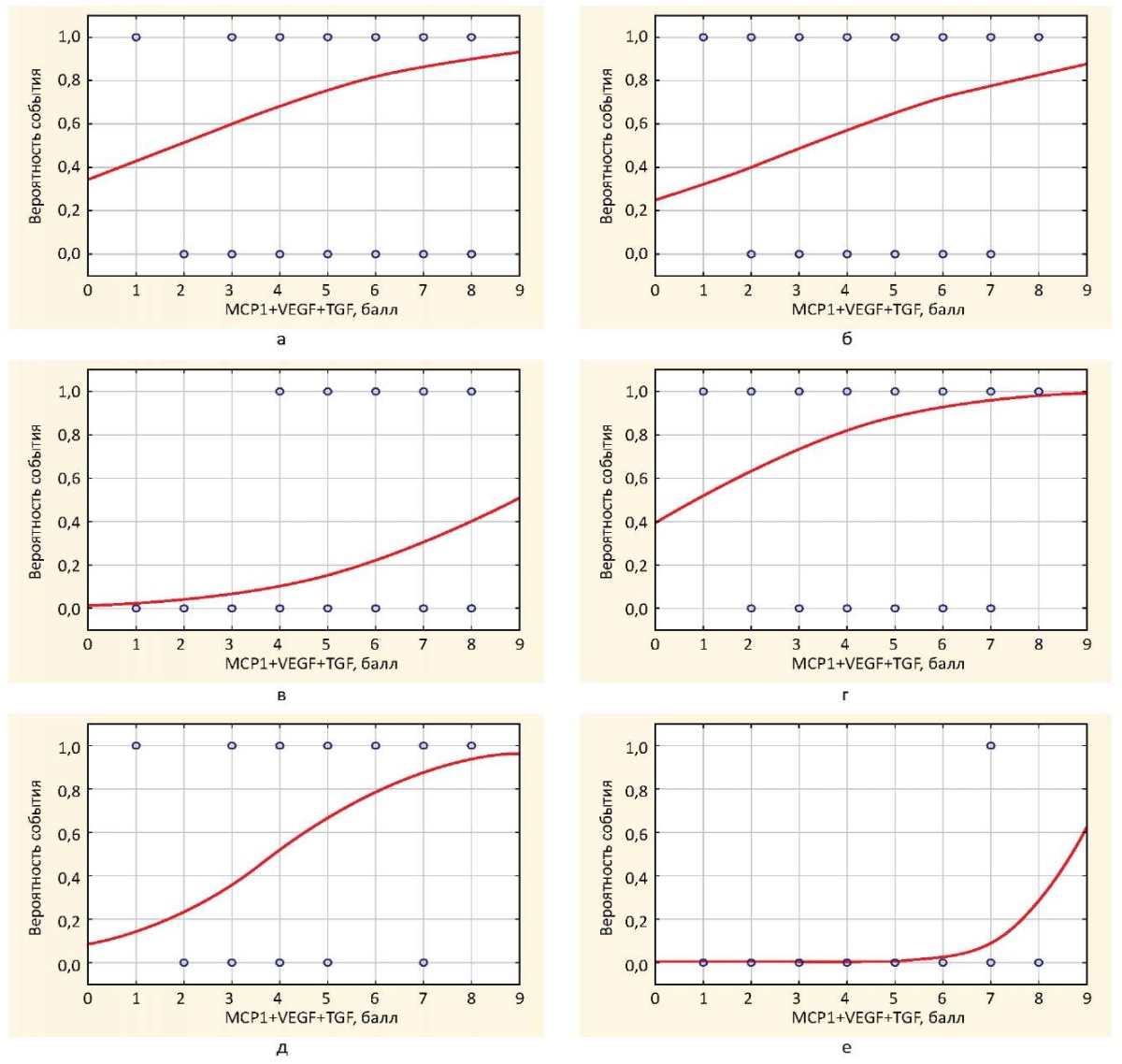
Рисунок 1. Графики вероятности выявления мезангиальной гиперклеточности (а), депозитов IgA (б), депозитов Ig М (в) и С3 комплемента (г), гипертрофии медии (д) и некроза подоцитов (е) в зависимости от выраженности суммарной экспрессии MCP-1+VEGF-А+TGFβ1
Далее были проведены исследования по оценке влияния суммарной выраженности экспрессии MCP-1+VEGF-А+TGFβ1 на прогрессирование гломерулонефрита. В частности, было показано, что по мере повышения выраженности суммарной экспрессии MCP-1+VEGF-А+TGFβ1 происходит повышение вероятности выраженного снижения СКФ (5 мл/мин./1,73м² /год) в процессе двенадцатимесячного наблюдения (ОР (ранг) 10,45, χ² — 4,32, р=0,048). Это позволило разработать номограмму прогнозирования риска снижения почечной функции в зависимости от суммарной экспрессии исследованных факторов (рис. 2).
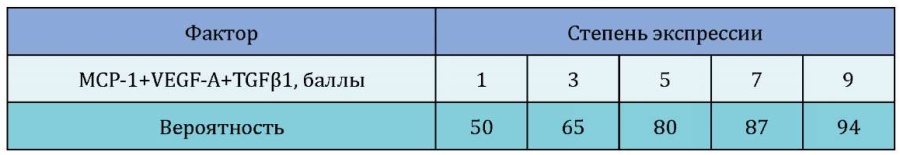
Рисунок 2. Номограмма оценки вероятности (%) выраженного снижения СКФ (5 мл/мин./1,73м² /год) в процессе двенадцатимесячного наблюдения в зависимости от суммарной выраженности экспрессии MCP-1+VEGF-А+TGFβ1
При проведении ROC-анализа было показано, что показатель площади под кривой в отношении экспрессии MCP-1+VEGF-А+TGFβ1 составил 0,73 (специфичность — 75%, чувствительность — 60%).
Обсуждение
В почечной ткани TGFβ1 сопровождает развитие многих патологических процессов, включая подоцитопатию, пролиферацию мезангиальных клеток, а также атрофию эпителиальных клеток проксимальных канальцев [2–5]. Также TGFβ1 дополнительно активирует синтез факторов адгезии: интерлейкина-8, МСР-1 в проксимальных клетках канальцев, эндоглин и интегрины [6]. Это в свою очередь определяет экспрессию TGFβ1 как фактор, отражающий тяжесть воспалительного процесса в почечной ткани и выраженность фибротических репаративных ответных реакций. Экспрессия МСР-1 в почечной ткани наблюдается в канальцевых, гладкомышечных, мезангиальных и подоцитарных клетках. [7–10]. Помимо хемотаксиса моноцитов, МСР-1 воздействует на мезангиальные клетки, обеспечивая приток таких воспалительных молекул, как ICAM-1 (внеклеточная молекула клеточной адгезии) и фибронектин [11]. В канальцевом эпителии под воздействием МСР-1 стимулируется секреция интерлейкина-6 и ICAM-1 [12]. При взаимодействии МСР-1 с СС2-24-рецептором происходит активация миграции подоцитов и экспрессии белка нефрина. [13][14]. Также МСР-1 способствует росту экспрессии TGFβ1 в очаге, тем самым ускоряя развитие интерстициального фиброза за счёт увеличения экстрацеллюлярного матрикса, клеточной инфильтрации и канальцевого апоптоза [15]. Чрезмерная и неконтролируемая секреция VEGF-А может приводить к образованию афункциональных сосудов в ходе неоангиогенеза, что способствует воспалению, привлечению макрофагов и фиброзу [16]. Также VEGF-А активирует синтез МСР-1 в эндотелиальных и гладкомышечных клетках, что ведёт к прогрессированию фибротических изменений межуточной ткани [17]. Таким образом, все три фактора активно участвуют в процессах воспаления и фиброза, происходящих при гломерулонефрите, однако работ, посвящённых комплексному анализу экспрессии всех трёх факторов в почечной ткани и её влиянию на течение гломерулонефрита, нам не встречалось.
В ходе исследования было установлено, что выраженность суммарной экспрессии MCP-1+VEGF-А+TGFβ1 наблюдается в большей мере при гематурических формах гломерулонефрита, протекающих без изменений уровня альбумина крови, что определённым образом определяет их роль в развитии и прогрессировании изменений в почечной ткани при нефритах, сопровождающихся развитием нефритического синдрома. Это же следует из результатов, демонстрирующих связь суммарной экспрессии MCP-1+VEGF-А+TGFβ1 с морфологическими проявлениями в большей мере свойственными нефритическим формам гломерулонефрита (депозиты IgA, мезангиальная гиперклеточность).
Повышение экспрессии изученных факторов показало своё влияние на развитие фиброза и утолщение стенок почечных сосудов, фиброз клубочков и интерстиция, отражающих в целом комплекс репаративного ремоделирования почечной ткани в условиях воспалительного процесса. Развитие фибротических изменений является известным фактором прогрессирования гломерулонефрита. Последнее позволило выявить влияние суммарной экспрессии MCP-1+VEGF-А+TGFβ1 на дальнейшее течение гломерулонефрита, сопровождающееся прогрессированием болезни в виде снижения СКФ спустя 12 мес. наблюдения за больными.
Выводы:
- Повышение суммарной экспрессии MCP-1+VEGF-А+TGFβ1 при гематурических формах гломерулонефрита свидетельствует о роли данных факторов в развитии воспалительного процесса в большей степени при этих формах болезни.
- Установлено, что повышение выраженности суммарной экспрессии MCP-1+VEGF-А+TGFβ1 ассоциируется с проявлениями почечного ремоделирования при гломерулонефрите (сосудистое ремоделирование, развитие гломерулосклероза, тубулоитнерстициального фиброза).
- Показано, что повышение выраженности суммарной экспрессии MCP-1+VEGF-А+TGFβ1 сопровождается повышением вероятности быстрого снижения почечной функции при гломерулонефрите при двенадцатимесячном наблюдении.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Бобкова И.Н., Чеботарева Н.В., Козловская Л.В., Непринцева Н.В. Система самозащиты почки: современный взгляд на механизмы, определяющие течение и исход гломерулонефрита (обзор литературы). Нефрология и диализ. 2013;15(3):174-183. eLIBRARY ID: 20401676
2. Чеботарева Н.В., Бобкова Н.И., Козловская Л.В., Варшавский В.А., Голицына Е.П. Определение экскреции с мочой моноцитарного хемотаксического протеина-1 (МСР-1) и трансформирующего фактора роста-β1 (TGF-β1) у больных ХГН как метод оценки процессов фиброгенеза в почке. Клиническая нефрология. 2010;3:51-55. eLIBRARY ID: 15126464
3. Huynh P, Chai Z. Transforming growth factor β (TGFβ1) and related molecules in chronic kidney disease (CKD). Clin Sci (Lond). 2019;133(2):287-313. doi: 10.1042/CS20180438
4. Cruz I, Ziyadeh MC, Isono FN, Kouahou M, Han D, Kalluri R. et al. Effects of high glucose and TGF-beta1 on the expression of collagen IV and vascular endothelial growth factor in mouse podocytes. Kidney Int. 2002;62:901–913. DOI:10.1046/J.1523-1755.2002.00528.X
5. Inoki K, Haneda M, Maeda S, Koya D, Kikkawa R. TGF-beta 1 stimulates glucose uptake by enhancing GLUT1 expression in mesangial cells. Kidney Int. 1999;55(5):1704-12. doi: 10.1046/j.1523-1755.1999.00438.x
6. Meng XM, Chung AC, Lan HY. Role of the TGF-β/BMP-7/Smad pathways in renal diseases. Clin Sci (Lond). 2013;124(4):243-54. doi: 10.1042/CS20120252
7. Qi W, Chen X, Polhill TS, Sumual S, Twigg S, Gilbert RE, et al. TGF-beta1 induces IL-8 and MCP-1 through a connective tissue growth factor-independent pathway. Am J Physiol Renal Physiol. 2006;290(3):F703-9. doi: 10.1152/ajprenal.00254.2005
8. Deshmane SL, Kremlev S, Amini S, Sawaya BE. Monocyte chemoattractant protein-1 (MCP-1): an overview. J Interferon Cytokine Res. 2009;29(6):313-26. doi: 10.1089/jir.2008.0027
9. Yadav A, Saini V, Arora S. MCP-1: chemoattractant with a role beyond immunity: a review. Clin Chim Acta. 2010;411(21-22):1570-9. doi: 10.1016/j.cca.2010.07.006
10. Sung FL, Zhu TY, Au-Yeung KK, Siow YL, O K. Enhanced MCP-1 expression during ischemia/reperfusion injury is mediated by oxidative stress and NF-kappaB. Kidney Int. 2002;62(4):1160-70. doi: 10.1111/j.1523-1755.2002.kid577.x
11. Ruiz-Ortega M, Lorenzo O, Egido J. Angiotensin III increases MCP-1 and activates NF-kappaB and AP-1 in cultured mesangial and mononuclear cells. Kidney Int. 2000;57(6):2285-98. doi: 10.1046/j.1523-1755.2000.00089.x
12. Haller H, Bertram A, Nadrowitz F, Menne J. Monocyte chemoattractant protein-1 and the kidney. Curr Opin Nephrol Hypertens. 2016;25(1):42-9. doi: 10.1097/MNH.0000000000000186
13. Viedt C, Dechend R, Fei J, Hänsch GM, Kreuzer J, Orth SR. MCP-1 induces inflammatory activation of human tubular epithelial cells: involvement of the transcription factors, nuclear factor-kappaB and activating protein-1. J Am Soc Nephrol. 2002;13(6):1534-47. doi: 10.1097/01.asn.0000015609.31253.7f
14. Burt D, Salvidio G, Tarabra E, Barutta F, Pinach S, Dentelli P, et al. The monocyte chemoattractant protein-1/cognate CC chemokine receptor 2 system affects cell motility in cultured human podocytes. Am J Pathol. 2007;171(6):1789-99. doi: 10.2353/ajpath.2007.070398
15. Tarabra E, Giunti S, Barutta F, Salvidio G, Burt D, Deferrari G, et al. Effect of the monocyte chemoattractant protein-1/ CC chemokine receptor 2 system on nephrin expression in streptozotocin-treated mice and human cultured podocytes. Diabetes. 2009;58(9):2109-18. doi: 10.2337/db08-0895
16. Worawichawong S, Worawichawong S, Radinahamed P, Muntham D, Sathirapongsasuti N, Nongnuch A, et al. Urine Epidermal Growth Factor, Monocyte Chemoattractant Protein-1 or Their Ratio as Biomarkers for Interstitial Fibrosis and Tubular Atrophy in Primary Glomerulonephritis. Kidney Blood Press Res. 2016;41(6):997-1007. doi: 10.1159/000452595
17. Afsar B, Afsar RE, Dagel T, Kaya E, Erus S, Ortiz A, et al. Capillary rarefaction from the kidney point of view. Clin Kidney J. 2018;11(3):295-301. doi: 10.1093/ckj/sfx133
Об авторах
М. М. БатюшинРоссия
Батюшин Михаил Михайлович, д.м.н., профессор, профессор кафедры внутренних болезней №2
Ростов-на-Дону
А. В. Мухтарова
Россия
Мухтарова Айтан Валик кызы, врач-терапевт поликлиники №1
Ростов-на-Дону
Е. А. Синельник
Россия
Синельник Елена Александровна, заведующая патологоанатомическим отделением
Ростов-на-Дону
Рецензия
Для цитирования:
Батюшин М.М., Мухтарова А.В., Синельник Е.А. Взаимосвязь суммарной экспрессии трансформирующего фактора роста β1, моноцитарного хемоаттрактного протеина-1, сосудистого эндотелиального фактора роста-А в почечной ткани с клинико-морфологическими проявлениями при гломерулонефритах. Южно-Российский журнал терапевтической практики. 2022;3(4):77-83. https://doi.org/10.21886/2712-8156-2022-3-4-77-83
For citation:
Batiushin M.M., Mukhtarova A.V., Sinelnik E.A. The relationship of the total expression of transforming growth factor β1, monocytic chemoattractive protein-1, vascular endothelial growth factor-A in renal tissue with clinical and morphological manifestations in glomerulonephritis. South Russian Journal of Therapeutic Practice. 2022;3(4):77-83. (In Russ.) https://doi.org/10.21886/2712-8156-2022-3-4-77-83
JATS XML


























