Перейти к:
Сравнительная антигипертензивная эффективность комбинаций азилсартана медоксомила или олмесартана медоксомила с амлодипином у пациентов с артериальной гипертонией, сахарным диабетом 2 типа и неалкогольной жировой болезнью печени
https://doi.org/10.21886/2712-8156-2023-4-1-68-74
Аннотация
Цель: сравнить эффективность влияния двух вариантов комбинированной терапии на показатели офисного артериального давления (АД), параметры суточного мониторирования артериального давления (СМАД) и суточного профиля АД (СПАД) у пациентов с артериальной гипертонией (АГ), сочетанной с сахарным диабетом 2 типа (СД2) и неалкогольной жировой болезнью печени (НАЖБП). Материалы и методы: обследовано 137 пациентов с неконтролируемой АГ, сочетанной с СД2 и НАЖБП. После рандомизации методом «конвертов» больным I группы была назначена комбинация азилсартана медоксомила (Аз-М) с амлодипином (Амл), II — комбинация олмесартана медоксомила (Ол-М) с Амл. Исходно, через 4, 8, 12 и 24 недели измерялись показатели офисного АД, анализ параметров СМАД и СПАД проводился исходно и через 24 недели исследования. Результаты: уже через 12 недель в I и II группах 86,8% и 84,1% больных соответственно достигли целевого уровня (ЦУ) АД, который удерживался до конца исследования. Через 24 недели в обеих группах регистрировалось статистически значимое улучшение параметров СМАД и оптимизация профилей СПАД. В то же время приём комбинации Ол-М/Амл сопровождался более выраженной позитивной динамикой некоторых прогностически важных показателей СМАД. Заключение: несмотря на значимый антигипертензивный эффект на фоне применения обеих комбинаций, влияние на отдельные параметры СМАД Ол-М/Амл оказалось более выраженным.
Ключевые слова
Для цитирования:
Луконин И.А., Скибицкий В.В., Фендрикова А.В., Скибицкий А.В., Антипов И.А. Сравнительная антигипертензивная эффективность комбинаций азилсартана медоксомила или олмесартана медоксомила с амлодипином у пациентов с артериальной гипертонией, сахарным диабетом 2 типа и неалкогольной жировой болезнью печени. Южно-Российский журнал терапевтической практики. 2023;4(1):68-74. https://doi.org/10.21886/2712-8156-2023-4-1-68-74
For citation:
Lukonin I.А., Skibitsky V.V., Fendrikova A.V., Skibitsky A.V., Antipov I.A. Comparative antihypertensive efficacy of combinations of azilsartan medoxomil or olmesartan medoxomil with amlodipine in patients with arterial hypertension, type 2 diabetes mellitus and non-alcoholic fatty liver disease. South Russian Journal of Therapeutic Practice. 2023;4(1):68-74. (In Russ.) https://doi.org/10.21886/2712-8156-2023-4-1-68-74
Введение
АГ встречается более чем у половины больных с СД2, что вносит существенный вклад в увеличение риска сердечно-сосудистых осложнений и ухудшение прогноза [1]. Кроме того, у 70 –95% пациентов с СД2 диагностируется НАЖБП, что также существенно повышает шансы развития кардиоваскулярных событий [2]. Можно полагать, что ряд сложных и взаимодополняющих механизмов, таких как гиперактивация ренин-ангиотензин-альдостероновой и симпато-адреналовой систем (РААС и САС), окислительный стресс, инсулинорезистентность, хроническая гипергликемия и вялотекущее воспаление, способствует более тяжёлому течению АГ у пациентов с СД2 и НАЖБП и значительно затруднят достижение ЦУ АД [3][4].
Согласно действующим клиническим рекомендациям, больные с АГ и сочетанным СД2, как правило, относятся к категории высокого/очень высокого риска, что диктует необходимость назначения уже на старте лечения комбинации антигипертензивных препаратов [5][6]. Обязательным компонентом терапии в данном случае являются блокаторы РААС, в частности блокаторы рецепторов ангиотензина II (БРА). Учитывая необходимость применения достаточно большого количества лекарственных препаратов у больных АГ с СД2 и НАЖБП, целесообразно назначение длительно действующих и эффективных БРА, например, Аз-М и Ол-М, которые в ряде исследований продемонстрировали не только выраженный антигипертензивный, но и позитивный метаболический эффекты [7][8].
Оптимальным «компаньоном» для БРА у лиц с АГ, СД2 и НАЖБП можно считать блокаторы кальциевых каналов (БКК), в частности Амл. Вместе с тем прямого сравнения эффективности комбинаций Аз-М/Амл и Ол-М/Амл у данной категории больных ранее не проводилось.
Цель исследования — сравнение эффективности влияния двух вариантов комбинированной антигипертензивной терапии (Аз-М/Амл и Ол-М/Амл) на показатели офисного АД, параметры СМАД и СПАД у пациентов с АГ, сочетанной с СД2 и НАЖБП.
Материалы и методы
Обследовано 137 жителей Краснодарского края с АГ, сочетанной с СД2 и НАЖБП (увеличение линейных размеров печени при ультразвуковом исследовании, FLI (Fatty Liver Index)>60) [9][10], получавших недостаточно эффективную антигипертензивную терапию и не достигших ЦУ АД (АД≥130/80 мм рт. ст.) [5][6].
Всем участникам исследования был разъяснён дизайн, после чего они подписали форму информированного добровольного согласия. Критерии включения и исключения пациентов представлены в таблице 1. Настоящее исследование было утверждено на заседании локального этического комитета ФГБОУ ВО КубГМУ Минздрава России (протокол № 67 от 05.10.2018 г.) и проводилось на клинических базах ГБУЗ ГКБ №1 г. Краснодара МЗ КК и ГБУЗ ККБСМП.
Таблица 1
Критерии включения и исключения пациентов из исследования
Критерии включения | Критерии исключения |
Неконтролируемая АГ (уровень офисного АД≥130/80 мм рт.ст.), компенсированный СД2 (уровень гликированного гемоглобина не более 7,5%) и НАЖБП Получаемая не менее 3 месяцев антигипертензивная терапия Подписанное информированное согласие пациента | Индивидуальная непереносимость Аз-М, Ол-М или Амл а также противопоказания к их приему Вторичная АГ, нестабильная стенокардия, сердечная недостаточность II-IV функционального класса по NYHA и хроническая болезнь почек 3Б-5 стадии, острые и хронические заболевания, негативно влияющие на исследуемые показатели |
Включённым в исследование больным проводилось клиническое обследование: сбор жалоб, анамнеза, выполнена антропометрия, оценены показатели общего анализа крови и мочи, биохимического анализа крови. Инструментальное обследование включало электрокардиографию, эхокардиографию, ультразвуковое исследование органов брюшной полости и забрюшинного пространства. Показатели офисного АД и данные дневников самоконтроля анализировались при первичном визите, через 4, 8, 12 и 24 недели от начала лечения. СМАД и анализ СПАД проводились исходно и спустя 24 недели приёма антигипертензивных препаратов с использованием аппаратного комплекса BPLab Vasotens (ООО «Петр Телегин», Россия), интервал измерений — 30 минут днём и 60 минут во время сна. Оценивалась динамика следующих параметров: среднесуточное, дневное, ночное систолическое и диастолическое АД (САД24 и ДАД24, САДд и ДАДд, САДн и ДАДн), индекс времени систолического и диастолического АД днём и ночью (ИВ САДд и ИВ ДАДд, ИВ САДн и ИВ ДАДн), вариабельность систолического АД и диастолического АД днём и ночью (ВарСАДд и ВарДАДд, ВарСАДн и ВарДАДн), величина утреннего подъёма и скорость утреннего подъёма систолического и диастолического АД (ВУП САД и ВУП ДАД, СУП САД и СУП ДАД).
После получения информированного согласия больным на 2–3 суток отменялась предшествующая антигипертензивная терапия, а по истечении «отмывочного» периода пациенты рандомизированы методом «конвертов» на две группы: включённым в I группу (n=68) была назначена комбинация Аз-М (Эдарби) с Амл (Нормодипин) в стартовой дозе 40/5 мг/сут., больным II группы (n=69) — фиксированная комбинация Ол-М/Амл (Аттенто) в дозе 20/5 мг/сут. При недостижении ЦУ АД дозы препаратов увеличивались до 80/10 мг/сут. и 40/10 мг/сут. соответственно. Всем пациентам, не достигшим ЦУ АД через 12 недель лечения, проводилась коррекция комбинированной фармакотерапии, и они исключались из исследования. Для коррекции углеводного обмена пациенты получали инсулин (средней продолжительности или длительного действия либо в сочетании с инсулином короткого действия) и Метформин 1000-2000 мг/сут.
Статистическая обработка результатов выполнена при помощи программы Statistica 10 (StatSoftInc., США). Количественные признаки на предмет соответствия нормальному распределению оценивались при помощи критерия Шапиро-Уилка, в случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Сравнение двух связанных групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна-Уитни, для внутригруппового анализа использовался критерий Вилкоксона, а статистическая значимость качественных переменных определялась посредством χ2-критерия в модификации Пирсона. Различия считались статистически значимыми при p<0,05.
Результаты
При сравнении исходных клинико-демографических характеристик обе группы оказались сопоставимы (табл. 2).
Таблица 2
Клинико- демографические показатели включенных в исследование пациентов
Показатель | Значение | p | |
I группа | II группа |
| |
Возраст, лет | 55 (50-57) | 56 (51-58) | 0,5 |
Длительность АГ, лет | 7 (6-11) | 8 (7-11) | 0,4 |
Количество мужчин, n (%) | 28 (52,8) | 26 (50) | 0,3 |
Количество женщин, n (%) | 25 (47,2) | 26 (50) | 0,8 |
Офисное САД, мм рт. ст. | 156 (148-165) | 154,5 (143-163) | 0,3 |
Офисное ДАД, мм рт. ст. | 95 (93-98) | 93 (91-97) | 0,7 |
ЧCC, уд./мин. | 95 (89-102) | 92 (87-100) | 0,1 |
ИMT, кг/м2 | 33,1 (29,5- 35,3) | 31,9 (27,8- 34,7) | 0,2 |
FLI, ед. | 79 (69- 88) | 81 (70- 92) | 0,3 |
Примечание: ИМТ — индекс массы тела, p — для различий между группами
Анализ результатов показал, что ЦУ офисного АД (АД<130/80 мм рт. ст.) регистрировался у большинства пациентов обеих групп уже через 12 недель от начала лечения и сохранялся до окончания исследования (рис. 1).
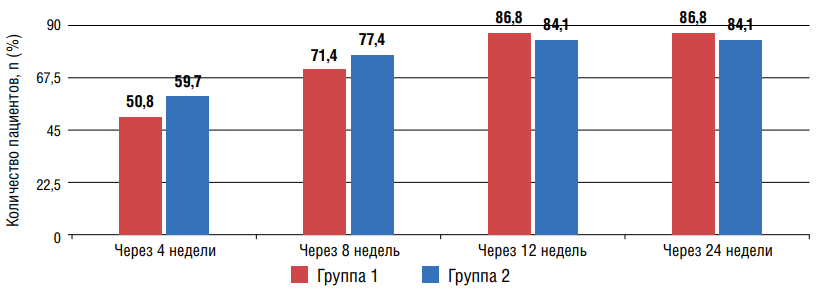
Рисунок 1. Количество пациентов, достигших ЦУ АД через 4 и 8 недель терапии
С учётом лиц, не достигших ЦУ АД и выбывших из исследования, через 24 недели лечения влияние исследуемых комбинаций на показатели СМАД оценивалось у 59 и 58 больных в I и II группах соответственно (табл. 3).
Так, в обеих группах установлено статистически значимое улучшение всех показателей СМАД спустя 24 недели лечения. Однако выраженность изменений в зависимости от выбранной комбинации препаратов оказалась неодинаковой. При сравнении степени изменения показателей СМАД на фоне применения комбинации Ол-М/Амл отмечалась более выраженная позитивная динамика ДАДн, ИВ САДд, ИВ САДн, ИВ ДАДд, ИВ ДАДн, ВарСАДн, ВарДАДн, ВУП ДАД (см. табл. 3).
Таблица 3
Сравнительная эффективность влияния различных вариантов комбинированной фармакотерапии на параметры СМАД
| I группа (n=59) | II группа (n=58) |
| ||||||
| ∆1,% | p1 |
| ∆2,% | p1 | p2 | |||
Показатель | До лечения | Через 24 недели | До лечения | Через 24 недели | |||||
САД24, мм рт. ст. | 154 (148-166) | 126 (123-127) | -19 | < 0,001 | 156 (149-161) | 127 (123-129) | -18 | < 0,001 | 0,159 |
САДд, мм рт. ст. | 156 (149-166) | 126 (123-127) | -20 | < 0,001 | 158 (153-164) | 127 (126-128) | -19 | < 0,001 | 0,208 |
САДн, мм рт. ст. | 155 (150-170) | 125 (123-127) | -20 | < 0,001 | 154 (147-167) | 124 (122-124) | -20 | < 0,001 | 0,452 |
ДАД24, мм рт. ст. | 95 (94-98) | 76 (74-77) | -20 | < 0,001 | 96 (93-99) | 77 (75-79) | -19 | < 0,001 | 0,141 |
ДАДд, мм рт. ст. | 95 (95-97) | 75 (73-76) | -21 | < 0,001 | 96 (95-98) | 77 (75-79) | -20 | < 0,001 | 0,206 |
ДАДн, мм рт. ст. | 95 (92-97) | 75 (73-77) | -21 | < 0,001 | 95 (93-97) | 73 (73-75) | -23 | < 0,001 | 0,022 |
ИВ САДд,% | 80 (68-69) | 36 (33-40) | -52 | < 0,001 | 78 (72-85) | 32 (29-37) | -58 | < 0,001 | 0,044 |
ИВ САДн,% | 78 (70-87) | 41 (37-45) | -46 | < 0,001 | 74 (69-79) | 33 (30-38) | -56 | < 0,001 | 0,006 |
ИВ ДАДд,% | 75 (71-82) | 37 (34-41) | -52 | < 0,001 | 75 (70-83) | 28 (27-30) | -63 | < 0,001 | < 0,001 |
ИВ ДАДн,% | 82 (78-88) | 40 (36-41) | -52 | < 0,001 | 74 (68-78) | 27 (26-29) | -61 | < 0,001 | < 0,001 |
ВарСАДд, мм рт.ст. | 15 (14-16) | 12 (10-13) | -24 | < 0,001 | 15 (14-17) | 11 (10-12) | -26 | < 0,001 | 0,421 |
ВарСАДн, мм рт.ст. | 14 (13-15) | 11 (9-12) | -22 | < 0,001 | 16 (14-17) | 10 (9-12) | -33 | < 0,001 | 0,003 |
ВарДАДд, мм рт.ст. | 12 (12-15) | 10 (9-11) | -25 | < 0,001 | 14 (13-15) | 10 (9-11) | -27 | < 0,001 | 0,114 |
ВарДАДн, мм рт. ст. | 12 (11-12) | 9 (8-11) | -19 | < 0,001 | 13 (13-16) | 9 (8-10) | -36 | < 0,001 | 0,006 |
ВУП САД, мм рт. ст. | 52 (48-59) | 40 (38-44) | -22 | < 0,001 | 50 (47-54) | 38 (36-41) | -22 | < 0,001 | 0,319 |
ВУП ДАД, мм рт. ст. | 42 (40-44) | 36 (33-38) | -16 | < 0,001 | 46 (41-50) | 31 (30-32) | -32 | < 0,001 | < 0,001 |
СУП САД, мм рт. ст./ч | 21 (18-23) | 16 (15-18) | -24 | <0,001 | 18 (17-21) | 15 (13-17) | -21 | < 0,001 | 0,973 |
СУП ДАД, мм рт. ст./ч | 18 (16-20) | 14 (13-16) | -24 | < 0,001 | 17 (14-19) | 12 (11-14) | -24 | < 0,001 | 0,758 |
Примечание: ∆1 и ∆2 — разница параметров СМАД в % по сравнению с исходными для I и II групп соответственно; p1 — для различий параметров СМАД исходно и через 24 недели лечения; p2 — для различий между ∆1 и ∆2.
Независимо от варианта назначенной терапии, в обеих группах отмечалась нормализация профиля у большинства больных и статистически значимое уменьшение количества пациентов с типом суточной кривой «non-dipper» (рис. 2,3). В то же время значимых различий регистрации как оптимального профиля, так и с недостаточным снижением в ночные часы через 24 недели в группах не отмечалось.
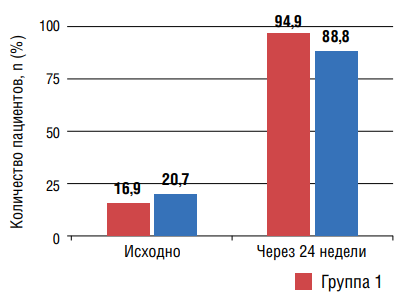
Рисунок 2. Количество пациентов с профилем «dipper» до и через 24 недели лечения
Примечание: * — статистическая значимость для различий исходно и через 24 недели лечения
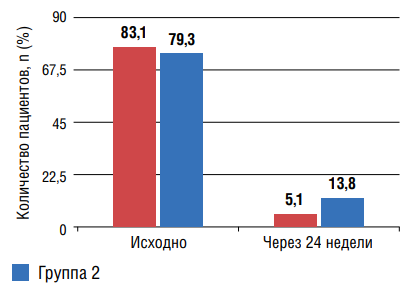
Рисунок 3. Количество пациентов с профилем «non-dipper» до и через 24 недели лечения
Примечание: * — статистическая значимость для различий исходно и через 24 недели лечения
Обсуждение
В нашем исследовании сравнивалась антигипертензивная эффективность комбинаций АЗ-М/Амл и Ол-М/Амл у пациентов с неконтролируемой АГ, сочетанной с СД 2 и НАЖБП. Установлено, что применение обеих комбинаций сопровождалось достижением ЦУ АД у 86,8% и 84,1% больных соответственно, а также улучшением большинства показателей СМАД и СПАД. Значительный антигипертензивный эффект Аз-М в комбинации с амлодипином в данной клинической ситуации можно объяснить дополнительным воздействием азилсартана на ряд патогенетических механизмов кардио-метаболического континуума, поддерживающих высокий уровень АД: усиление секреции адипонектина, снижение количества адипоцитов и более выраженная утилизация глюкозы [11-13]. Результаты нашего исследования сопоставимы с работами других авторов [14-16].
В свою очередь более значимое по сравнению с применением Аз-М/Амл позитивное влияние на исследуемые параметры СМАД комбинации Ол-М/Амл может объясняться ключевыми особенностями Ол-М, имеющими клиническое значение: способность вызывать выраженное накопление ангиотензина 1-7 в периферической крови и тканях, взаимодействующего с MAS-рецепторами, что потенцирует антигипертензивный, органопротективный и антиатеросклеротический эффекты [17][18]. Кроме того, для Ол-М характерно наличие двойной связи с рецептором к ангиотензину II, что может объяснять выраженность и длительность его эффектов [19].
В отношении эффективности двух представителей класса БРА Азил-М и Ол-М данные противоречивы: работа G.L. Bakris отразила превосходство 80 мг/сут. Азил-М над 40 мг/сут. Ол-М в снижении САД [20], W.B. White продемонстрировал большее снижение САД при использовании Аз-М 80 мг/сут. в сравнении с Ол-М 40 мг и валсартаном 320 мг/сут. [21], но исследование CHAOS показало, что при прямом сопоставлении Ол-М и Аз-М в группе Ол-М для удержания ЦУ АД добавление второго антигипертензивного препарата понадобилось в 3 раза меньшему количеству пациентов [22]. В сравнительном исследовании CANZONE оценены дополнительные антигипертензивные свойства Ол-М и Аз-М у пациентов с неудовлетворительным контролем АД при применении иных представителей БРА (телмисартана, ирбесартана, кандесартана, валсартана и лозартана): при переходе с других сартанов за 12 недель терапии выявлено дополнительное снижение как САД, так и ДАД, однако статистически значимой разницы не отмечалось [23].
Несмотря на то, что Аз-М и Ол-М являются хорошо изученными препаратами, возможности их применения у больных АГ, сочетанной с СД2 и НАЖБП, в том числе и в комбинации с Амл, практически не исследованы. Некоторые различия в эффективности данных БРА, полученные в нашей работе, можно объяснить в том числе и нюансами метаболизма в печени, что крайне важно при наличии патологии печени, в частности НАЖБП. Так, для Аз-М характерна активная биотрансформация в печени с участием изофермента CYP2C9. В свою очередь Ол-М быстро превращается из пролекарства в фармакологически активный метаболит в слизистой кишечника и в портальной крови. Внутрипеченочная циркуляция олмесартана минимальна, для его метаболизма не требуется участие системы цитохромов Р450. Вероятно, изменения функции печени, наблюдающиеся при НАЖБП, могут сопровождаться некоторым снижением эффективности Аз-М. В этой связи представляется перспективным сравнение антигипертензивного действия Аз-М и Ол-М у данной категории больных с учётом полиморфизмов генов детоксикации ксенобиотиков [16][24].
Явлений непереносимости какого-либо из препаратов выявлено не было. Основное ограничение исследования может заключаться в относительно малой выборке.
Заключение
В исследовании продемонстрирована высокая антигипертензивная эффективность комбинаций Аз-М/Амл и Ол-м/Амл у пациентов с АГ, СД2 и НАЖБП: при применении обоих вариантов комбинированной фармакотерапии отмечалось достижение ЦУ АД у 86,8% и 84,1% пациентов соответственно, статистически значимое улучшение параметров СМАД и оптимизация профилей СПАД. В свою очередь применение Ол-М/Амл сопровождалось более выраженным снижением отдельных прогностически важных показателей СМАД. Полученные результаты могут быть использованы при подборе антигипертензивной терапии больным АГ, сочетанной с СД2 и НАЖБП и обеспечении более эффективного контроля АД.
Благодарность. Авторы выражают благодарность главному врачу ГБУЗ ГКБ №1 г. Краснодара МЗ КК Курносенкову В.В. и главному врачу ГБУЗ ККБСМП Босаку Н.В. за предоставленные клинические базы для проведения исследования.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Petrie JR, Guzik TJ, Touyz RM. Diabetes, Hypertension, and Cardiovascular Disease: Clinical Insights and Vascular Mechanisms. Can J Cardiol. 2018 May;34(5):575-584. DOI: 10.1016/j.cjca.2017.12.005.
2. Kim KS, Lee BW, Kim YJ, Lee DH, Cha BS, Park CY. Nonalcoholic Fatty Liver Disease and Diabetes: Part II: Treatment. Diabetes Metab J. 2019 Apr;43(2):127-143. DOI: 10.4093/dmj.2019.0034/
3. Kasper P, Martin A, Lang S, Kütting F, Goeser T, Demir M, Steffen HM. NAFLD and cardiovascular diseases: a clinical review. Clin Res Cardiol. 2021 Jul;110(7):921-937. DOI: 10.1007/s00392-020-01709-7. Epub 2020 Jul 21.
4. Vaduganathan M, Claggett BL, Juraschek SP, Solomon SD. Assessment of Long-term Benefit of Intensive Blood Pressure Control on Residual Life Span: Secondary Analysis of the Systolic Blood Pressure Intervention Trial (SPRINT). JAMA Cardiol. 2020 May 1;5(5):576-581. DOI: 10.1001/jamacardio.2019.6192.
5. Williams B, Mancia G, Spiering W, Agabiti Rosei E, Azizi M, Burnier M et al. 2018 Practice Guidelines for the management of arterial hypertension of the European Society of Hypertension and the European Society of Cardiology: ESH/ESC Task Force for the Management of Arterial Hypertension. J Hypertens. 2018 Dec;36(12):2284-2309. DOI: 10.1097/HJH.0000000000001961.
6. Кобалава Ж.Д., Конради А.О., Недогода С.В., Шляхто Е.В., Арутюнов Г.П., Баранова Е.И., и др. Артериальная гипертензия у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(3):3786. https://doi.org/10.15829/1560-4071-2020-3-3786.
7. Скибицкий В.В., Фендрикова А.В., Сиротенко Д.В., Скибицкий А.В. Хронотерапевтические аспекты эффективности азилсартана медоксомила в составе комбинированной терапии у пациентов с артериальной гипертонией и метаболическим синдромом. Кардиология. 2016;56(10):35-40. DOI: 10.18565/cardio.2016.10.35-40.
8. Redon J, Weber MA, Reimitz PE, Wang JG. Comparative effectiveness of an angiotensin receptor blocker, olmesartan medoxomil, in older hypertensive patients. J Clin Hypertens (Greenwich). 2018 Feb;20(2):356-365. DOI: 10.1111/jch.13183.
9. Маевская М.В., Котовская Ю.В., Ивашкин В.Т., Ткачева О.Н., Трошина Е.А., Шестакова М.В. и др. Национальный Консенсус для врачей по ведению взрослых пациентов с неалкогольной жировой болезнью печени и ее основными коморбидными состояниями. Терапевтический архив.2022;94(2):216–253. DOI: 10.26442/00403660.2022.02.201363.
10. Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под редакцией И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. – 9-й выпуск (дополненный). – М.; 2019. DOI: 10.14341/DM221S1.
11. Tarikuz Zaman A, McLean D, Sobel B. The efficacy and tolerability of azilsartan in obese insulin-resistant mice with left ventricular pressure overload. J. Cardiovasc. Pharmacol. 2013; 62 (4): 381-7.
12. Iwai M, Chen R, Imura Y, Horiuchi M. TAK-536, a new AT1 receptor blocker, improves glucose intolerance and adipocyte differentiation. Am J Hypertens. 2007 May;20(5):579-86. DOI: 10.1016/j.amjhyper.2006.12.010.
13. Georgiopoulos G, Katsi V, Oikonomou D, et al. Azilsartan as a potent antihypertensive drug with possible pleiotropic cardiometabolic effects: a review study. Front Pharmacol. 2016;7:235-9. DOI:10.3389/fphar.2016.00235.
14. Троицкая Е.А., Старостина Е.С., Кобалава Ж.Д. Эффективность азилсартана медоксомила в отношении суточного профиля периферического и центрального артериального давления и артериальной ригидности у пациентов с артериальной гипертонией и сахарным диабетом 2 типа. Кардиоваскулярная терапия и профилактика. 2017;16(1):74-81. DOI: 10.15829/1728-8800-2017-1-74-81.
15. Скибицкий В. В., Фендрикова А. В., Сиротенко Д. В., Скибицкий А. В. Хронотерапевтические аспекты эффективности азилсартана медоксомила в составе комбинированной терапии у пациентов с артериальной гипертонией и метаболическим синдромом. Кардиология. 2016;56(10):35-40. DOI: 10.18565/cardio.2016.10.35-40.
16. Луконин И.А., Скибицкий В.В., Фендрикова А.В., Павлюченко И.И., Лазарев К.Ю., Коваленко Ф.А. Эффективность комбинированной антигипертензивной фармакотерапии у пациентов с артериальной гипертонией, сочетанной с сахарным диабетом 2 типа и неалкогольной жировой болезнью печени. Системные гипертензии. 2022;19(1):31-38. https://doi.org/10.38109/2075-082X-2022-1-31-38.
17. Furuhashi M, Moniwa N, Mita T, Fuseya T, Ishimura S, Ohno K et al. Urinary angiotensin-converting enzyme 2 in hypertensive patients may be increased by olmesartan, an angiotensin II receptor blocker. Am J Hypertens. 2015 Jan;28(1):15-21. DOI: 10.1093/ajh/hpu086.
18. Agata J, Ura N, Yoshida H, Shinshi Y, Sasaki H, Hyakkoku M et al. Olmesartan is an angiotensin II receptor blocker with an inhibitory effect on angiotensin-converting enzyme. Hypertens Res. 2006 Nov;29(11):865-74. DOI: 10.1291/hypres.29.865.
19. Kiya Y, Miura S, Fujino M, Imaizumi S, Karnik SS, Saku K. Clinical and pharmacotherapeutic relevance of the double-chain domain of the angiotensin II type 1 receptor blocker olmesartan. Clin Exp Hypertens. 2010 Jan;32(2):129-36. DOI: 10.3109/10641960903254430.
20. Bakris GL, Sica D, Weber M, White WB, Roberts A, Perez A et al. The comparative effects of azilsartan medoxomil and olmesartan on ambulatory and clinic blood pressure. J Clin Hypertens (Greenwich). 2011 Feb;13(2):81-8. DOI: 10.1111/j.1751-7176.2010.00425.x.
21. White WB, Weber MA, Sica D, Bakris GL, Perez A, Cao C et al. Effects of the angiotensin receptor blocker azilsartan medoxomil versus olmesartan and valsartan on ambulatory and clinic blood pressure in patients with stages 1 and 2 hypertension. Hypertension. 2011 Mar;57(3):413-20. DOI: 10.1161/HYPERTENSIONAHA.110.163402.
22. Sezai A, Osaka S, Yaoita H, Arimoto M, Hata H, Shiono M et al. Changeover Trial of Azilsartan and Olmesartan Comparing Effects on the Renin-Angiotensin-Aldosterone System in Patients with Essential Hypertension after Cardiac Surgery (CHAOS Study). Ann Thorac Cardiovasc Surg. 2016 Jun 20;22(3):161-7. DOI: 10.5761/atcs.oa.16-00054.
23. Shiga Y, Miura SI, Motozato K, Norimatsu K, Yano M, Hitaka Y et al. Comparison of Efficacy and Safety of Azilsartan and Olmesartan in Patients With Essential Hypertension. Int Heart J. 2017 May 31;58(3):416-421. DOI: 10.1536/ihj.16-285.
24. Свидетельство о государственной регистрации базы данных № 2022623028 Российская Федерация. База данных исходов лечения больных артериальной гипертонией, сочетанной с Е11 и К76.0, в зависимости от полиморфизмов гена CYP2C9 : № 2022622909 : заявл. 10.11.2022 : опубл. 22.11.2022 / И. А. Луконин, И. А. Антипов, В. В. Скибицкий. – EDN YJMSWW
Об авторах
И. А. ЛуконинРоссия
Луконин Илья Андреевич, ассистент кафедры госпитальной терапии
Краснодар
В. В. Скибицкий
Скибицкий Виталий Викентьевич, д.м.н., проф., заведующий кафедрой госпитальной терапии
Краснодар
А. В. Фендрикова
Фендрикова Александра Вадимовна, к.м.н., доцент кафедры госпитальной терапии
Краснодар
А. В. Скибицкий
Скибицкий Александр Витальевич, к.м.н., доцент кафедры госпитальной терапии
Краснодар
И. А. Антипов
Антипов Иван Андреевич, студент
Краснодар
Рецензия
Для цитирования:
Луконин И.А., Скибицкий В.В., Фендрикова А.В., Скибицкий А.В., Антипов И.А. Сравнительная антигипертензивная эффективность комбинаций азилсартана медоксомила или олмесартана медоксомила с амлодипином у пациентов с артериальной гипертонией, сахарным диабетом 2 типа и неалкогольной жировой болезнью печени. Южно-Российский журнал терапевтической практики. 2023;4(1):68-74. https://doi.org/10.21886/2712-8156-2023-4-1-68-74
For citation:
Lukonin I.А., Skibitsky V.V., Fendrikova A.V., Skibitsky A.V., Antipov I.A. Comparative antihypertensive efficacy of combinations of azilsartan medoxomil or olmesartan medoxomil with amlodipine in patients with arterial hypertension, type 2 diabetes mellitus and non-alcoholic fatty liver disease. South Russian Journal of Therapeutic Practice. 2023;4(1):68-74. (In Russ.) https://doi.org/10.21886/2712-8156-2023-4-1-68-74


























