Перейти к:
Изменение активности маркеров про/антиоксидантной систем ткани печени животных-носителей меланомы В16 при введении бис-(3,5-ди-трет-бутил-4-гидроксифенил)тиолата диметилолова на разных этапах развития опухолевого процесса
https://doi.org/10.21886/2712-8156-2023-4-3-70-75
Аннотация
Цель: оценка изменения активности маркеров про/антиоксидантной систем ткани печени животных-носителей меланомы В16 при введении бис-(3,5-ди-трет-бутил-4-гидроксифенил)тиолат диметилолова (Ме-3) на разных этапах развития опухолевого процесса.
Материалы и методы: исследование проведено на мышах линии C57Bl/6 (самки). Через 48 часов после перевивки опухолевых клеток мышам-самкам линии С57Вl/6 исследуемые соединения вводили внутрибрюшинно 1 раз в сутки в течение 5 дней по классической методике, используемой для скрининга соединений с предполагаемым противоопухолевым действием. Тестируемые соединения вводили в суммарной дозе 375 мг/кг. Животных выводили из эксперимента на 7-е и 18-е сутки после перевивки опухолевых клеток.
Результаты: при введении Ме-3 отмечено снижение малонового диальдегида как основного показателя активности перекисного окисления липидов на всех этапах развития опухолевого процесса.
Выводы: разнонаправленное влияние Ме-3 на ферментативную активность антиоксидантной системы 7-е и 18-е сутки развития меланомы В16 позволяет предположить некоторую селективность действия в зависимости от исходного про/антиоксидантного статуса клетки, а также целесообразность изучения данной группы соединений в качестве субстрата для нанозимов с про/антиоксидантной активностью.
Ключевые слова
Для цитирования:
Алхусейн-Кулягинова М.С., Додохова М.А., Власова Н.Д., Антонян Б.Г., Алашева М.Х., Гречина Д.А., Васильев И.В., Гулян М.В., Котиева И.М. Изменение активности маркеров про/антиоксидантной систем ткани печени животных-носителей меланомы В16 при введении бис-(3,5-ди-трет-бутил-4-гидроксифенил)тиолата диметилолова на разных этапах развития опухолевого процесса. Южно-Российский журнал терапевтической практики. 2023;4(3):70-75. https://doi.org/10.21886/2712-8156-2023-4-3-70-75
For citation:
Alkhusein-Kulyaginova M.S., Dodokhova M.A., Vlasova N.D., Antonyan B.G., Alasheva M.H., Grechina D.A., Vasiliev I.V., Gulyan M.V., Kotieva I.M. Changes in the activity of markers of pro/antioxidant systems of liver tissue of animals carrying melanoma B16 with the introduction of dimethyltin bis(3,5-di-tert-butyl-4-hydroxyphenylthiolate) (Me-3) at different stages of the development of the tumor process. South Russian Journal of Therapeutic Practice. 2023;4(3):70-75. (In Russ.) https://doi.org/10.21886/2712-8156-2023-4-3-70-75
Введение
Оловоорганические производные (IV) привлекли большое внимание в течение последних двух десятилетий благодаря своей потенциальной биологической активности, в том числе противоопухолевой, противовоспалительной, противомикробной, противогрибковой, антинематоцидной и антиинсектицидной [1][2]. Среди всех субстанций, не содержащих платину, оловоорганические соединения (IV) могут быть наиболее многообещающими металлолекарствами, поскольку в некоторых случаях они проявляют лучшие эффекты, чем цисплатин [3][4].
Нами протестирован ряд гибридных оловоорганических соединений на моделях перевиваемых опухолей мышей [5][6] и выявлены два соединения-лидеры: бис-(3,5-ди-трет-бутил-4-гидроксифенил)тиолат диметилолова (Ме-3) и (3,5-ди-трет-бутил-4-гидроксифенил)тиолат трифенилолова (Ме-5). На обеих моделях злокачественного роста для Ме-3 и Ме-5 была выявлена высокая антиметастатическая и умеренная противоопухолевая активность в максимальной точке эффективности [5][6].
Исходя из строения тестируемых соединений, литературных данных и результатов собственных исследований можно предположить, что одним из механизмов в реализации антиметастатической активности гибридных оловоорганических соединений, содержащих фрагмент 2,6-ди-трет-бутилфенола, является изменение окислительного гомеостаза условно здоровой и атипичной клеток.
Активные формы кислорода (АФК) играют противоречивую роль в заболеваемости и прогрессировании рака. Антиоксиданты могут ингибировать канцерогенез путём подавления уровня АФК, а также могут при определённых условиях вызывать чрезмерный окислительный стресс, что может вызывать гибель злокачественных клеток [7]. Чрезмерный клеточный окислительный стресс широко воспринимается как ключевой фактор патофизиологических состояний и развития рака [8]. Здоровые клетки используют несколько механизмов для поддержания внутриклеточных уровней активных форм кислорода (АФК) и общего окислительно-восстановительного гомеостаза, чтобы избежать повреждения ДНК, белков и липидов. Атипичные клетки, напротив, демонстрируют повышенный уровень АФК и усиленную регуляцию защитных антиоксидантных путей [9].
Сочетание в одной молекуле оловосодержащего и фенольного фрагмента открывают терапевтические возможности для разработки препаратов с различными противоопухолевыми механизмами действия
Цель исследования — оценка изменения активности маркеров про/антиоксидантной систем ткани печени животных-носителей меланомы В16 при введении бис-(3,5-ди-трет-бутил-4-гидроксифенил)тиолат диметилолова (Ме-3) на разных этапах развития опухолевого процесса.
Материалы и методы
Тестируемое соединение (рис. 1) бис(3,5-ди-трет-бутил-4-гидроксифенилтиолат) диметилолова (Ме-3) вводили в суммарной дозе 375 мг/кг.
Исследование проведено на мышах линии C57Bl/6 (самки). Через 48 часов после перевивки опухолевых клеток мышам-самкам линии С57Вl/6 Ме-3 вводили внутрибрюшинно 1 раз в сутки в течение 5 дней по классической методике, используемой для скрининга соединений с предполагаемым противоопухолевым действием. Животных выводили из эксперимента на 7-е и 18-е сутки после перевивки опухолевых клеток.
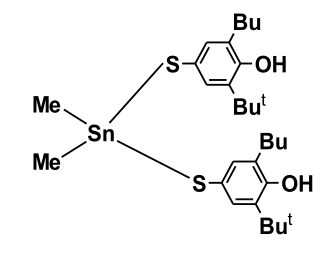
Рисунок 1. Структурная формула бис(3,5-ди-трет-бутил-4-гидроксифенилтиолат) диметилолова.
Примечание: обозначение радикалов: tBu – трет-бутил, Ме – метил.
В гомогенатах печени животных-носителей меланомы В16 определяли некоторые маркеры активности ПОЛ и антиоксидантной защиты (АОЗ) стандартными методами иммуноферментного анализа (ИФА): малоновый диальдегид (МДА), глутатион восстановленный (GSH), супероксиддисмутаза (СОД) (EC 1.15.1.1), каталаза (EC 1.11.1.6), глутатионпероксидаза (ГП) (EC 1.11.1.9) и глутатионредуктаза (ГР) (EC 1.8.1.7).
Экспериментальная часть работы проводилась в соответствии с принципами Хельсинкской декларации, дизайн исследования одобрен локальным независимым этическим комитетом федерального государственного бюджетного образовательного учреждения высшего образования «Ростовский государственный медицинский университет» Министерства здравоохранения Российской Федерации (протокол № 15/22 от 06 октября 2022).
Для анализа всех результатов применяли описательную статистику. Статистическую обработку полученных данных проводили с использованием пакета компьютерных программ версии «Statistica 6.0». Нормальность распределения оценивали с помощью модифицированной версии метода Колмогорова-Смирнова, а именно по методике Андерсона-Дарлинга. Оценка достоверности различий между сравниваемыми параметрами проведена помощью t-критерия Стьюдента. Различия считали статистически значимыми при p≤0,05. Сравнение групп производили попарно.
Результаты
По истечении срока наблюдения (7-е и 18-е сутки) произведена оценка изменения МДА и ферментов антиоксидантной защиты (рис. 2, 3, 4).
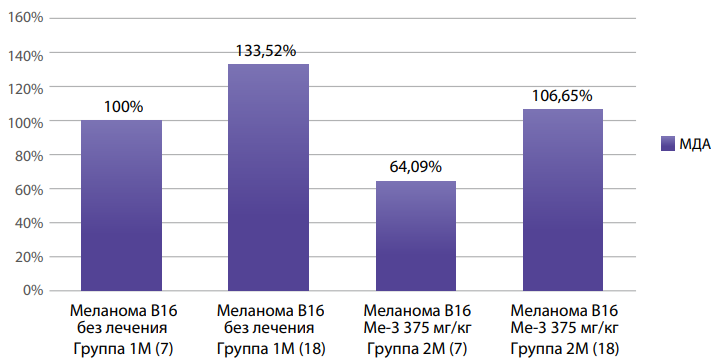
Рисунок 2. Динамика изменения МДА в гомогенате печени животных-носителей меланомы В16 в зависимости от стадии развития опухолевого процесса и введения Ме-3.
Уровень МДА оценивается нами как основной показатель активности ПОЛ, как его наиболее повреждающий побочный продукт [10]. При прогрессировании меланомы В16 и при отсутствии лечения уровень МДА повышается, что может являться косвенным показателем повышенного фона кислородных радикалов, что способствует процессам пролиферации и метастазирования [11]. При введении Ме-3 отмечено снижение МДА на всех этапах развития опухолевого процесса.
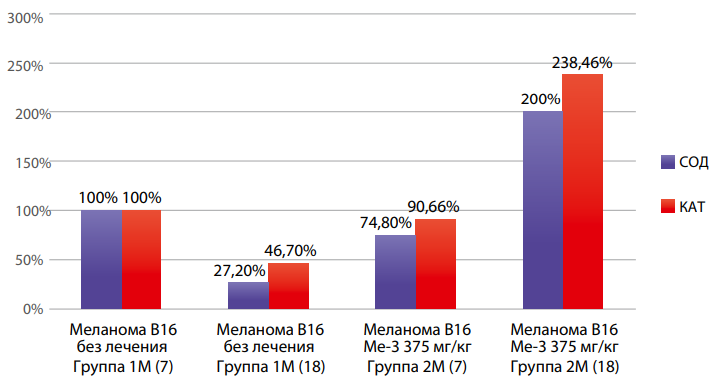
Рисунок 3. Динамика изменения СОД и КАТ в гомогенате печени животных-носителей меланомы В16 в зависимости от стадии развития опухолевого процесса и введения Ме-3.
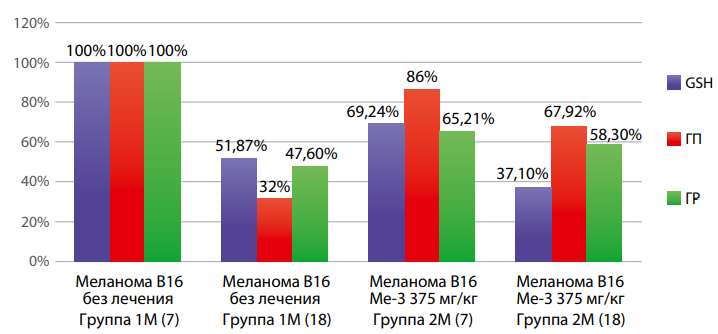
Рисунок 4. Динамика изменения восстановленного глутатиона, глутатионперокидазы и глутатион редуктазы в гомогенате печени животных-носителей меланомы В16 в зависимости от стадии развития опухолевого процесса и введения Ме-3.
Разнонаправленное влияние Ме-3 на ферментативную активность антиоксидантной системы 7-е и 18-е сутки развития меланомы В16 позволяет предположить некоторую селективность действия в зависимости от исходного про/антиоксидантного статуса клетки. Редокс-активные металлы (в том числе и олово) могут участвовать в реакциях переноса электрона, их гомеостаз.
Обсуждение
Более инвазивные стадии злокачественных новообразований с большим потенциалом прогрессирования связаны с увеличением ферментативной антиоксидантной активности и снижением неферментативной антиоксидантной способности [12-14]. Повышенные уровни АФК вызывают экспрессию антиоксидантных ферментов, таких как каталаза и супероксиддисмутаза, которые защищают клетки против окислительного стресса.
В организме возможным способом биотрансформации для соединений Ме-3 может являться гидролиз с накоплением в среде биоцидного фрагмента, содержащего Sn (IV), и свободной антиоксидантной группы. Противоопухолевая и антиметастатическая активности Ме-3 обусловлены как прямым биоцидным воздействием оловоорганического фрагмента, так и изменением про/антиоксидантного равновесия с нарушением клеточного метаболизма в целом.
Считается, что большинство фармакологических эффектов полифенолов является результатом их способности улавливать кислородные радикалы, образующиеся эндогенно [15]. Однако антиоксидантные свойства полифенольных веществ не могут полностью объяснить их химиопрофилактические свойства с учётом того, что подобные соединения обладают как антиоксидантными, так и прооксидантными свойствами [16][17].
В последнее время в биомедицинских целях широко исследуются нанозимы, наноструктуры с активностью, имитирующей ферменты. В частности нанозимы, способные регулировать окислительно-восстановительный статус клеток, имитируя антиоксидантные ферменты в клетках млекопитающих, имеют большое терапевтическое значение при нарушениях, опосредованных окислительным стрессом [18]. Поскольку различие между физиологическим окислительным стрессом (окислительный эустресс) и патологическим окислительным стрессом (окислительный дистресс) находится на тонкой границе, создание нанозимов, которые могут по-разному воспринимать две крайности в клетках, тканях и органах и опосредовать соответствующие окислительно-восстановительные процессы, представляет собой важнейшую задачу для специалистов в области биомедицинских исследований [19]. Выявив способность переходных металлов и их соединений поглощать АФК, можно легко сконструировать антиоксидантные нанозимы с одним активным центром [20].
В проведённом нами исследовании при введении гибридного оловоорганического соединения, содержащих фрагмент 2,6-ди-трет-бутилфенола: Ме-3, получены результаты, позволяющие предположить целесообразность изучения данной группы соединений в качестве субстрата для нанозимов с про/антиоксидантной активностью.
Заключение
По результатам нашего исследования бис-(3,5-ди-трет-бутил-4-гидроксифенил)тиолат диметилолова (Ме-3) обладает некоторой селективностью действия в зависимости от исходного фона про/антиоксидантной активности в клетке, что обусловливает целесообразность дальнейшей разработки гибридных оловоорганических соединений, содержащих фрагмент 2,6-ди-трет-бутилфенола, в качестве субстрата для нанозимов с про/антиоксидантной активностью.
Список литературы
1. Syed Annuar SN, Kamaludin NF, Awang N, Chan KM. Cellular Basis of Organotin(IV) Derivatives as Anticancer Metallodrugs: A Review. Front Chem. 2021;9:657599. doi: 10.3389/fchem.2021.657599.
2. Додохова М.А., Сафроненко А.В., Котиева И.М., Сухорукова Н.В., Ганцгорн Е.В., Алхусейн-Кулягинова М.С., и др. Оценка фармакотерапевтического потенциала оловоорганических соединений in vivo. Биофармацевтический журнал. 2021;13(3):30-34. DOI: 10.30906/2073-8099-2021-13-3-11-15
3. Attanzio A, D'Agostino S, Busà R, Frazzitta A, Rubino S, Girasolo MA, et al. Cytotoxic Activity of Organotin(IV) Derivatives with Triazolopyrimidine Containing Exocyclic Oxygen Atoms. Molecules. 2020;25(4):859. doi: 10.3390/molecules25040859
4. Tabassum S, Pettinari C. Chemical and Biotechnological Developments in Organotin Cancer Chemotherapy. J. Organomet. Chem. 2006;691:1761–1766. doi: 10.1016/j.jorganchem.2005.12.033
5. Dodokhova MA, Safronenko AV, Kotieva IМ, Alkhuseyn-Kulyaginova MS, Shpakovsky DB, Milaev ER. Evaluation of the pharmacological activity of hybrid organotin compounds in a B16 melanoma model in the classical and metronomic administration modes. Research Results in Pharmacology. 2022;8(1):85–93. Doi: 10.3897/rrpharmacology.8.76363
6. Dodokhova MA, Safronenko AV, Kotieva IM, Alkhuseyn-Kulyaginova MS, Shpakovsky DB, Milaeva ER. Impact of organotin compounds on the growth of epidermoid Lewis carcinoma. Research Results in Pharmacology. 2021;7(4):81–88. Doi: 10.3897/rrpharmacology.7.71455
7. Slika H, Mansour H, Wehbe N, Nasser SA, Iratni R, Nasrallah G, et al. Therapeutic potential of flavonoids in cancer: ROS-mediated mechanisms. Biomed Pharmacother. 2022;146:112442. doi: 10.1016/j.biopha.2021.112442.
8. Ogata FT, Simões Sato AY, Coppo L, Arai RJ, Stern AI, Pequeno Monteiro H. Thiol-Based Antioxidants and the Epithelial/Mesenchymal Transition in Cancer. Antioxid Redox Signal. 2022;36(13-15):1037-1050. doi: 10.1089/ars.2021.0199.
9. Azmanova M, Pitto-Barry A. Oxidative Stress in Cancer Therapy: Friend or Enemy? Chembiochem. 2022;23(10):e202100641. doi: 10.1002/cbic.202100641.
10. Li Y, Zhao T, Li J, Xia M, Li Y, Wang X, Liu C, Zheng T, Chen R, Kan D, Xie Y, Song J, Feng Y, Yu T, Sun P. Oxidative Stress and 4-hydroxy-2-nonenal (4-HNE): Implications in the Pathogenesis and Treatment of Aging-related Diseases. J Immunol Res. 2022 Mar 23;2022:2233906. doi: 10.1155/2022/2233906.
11. Вострикова С.М., Гринев А.Б., Гогвадзе В.Г. Активные формы кислорода и антиоксиданты в канцерогенезе и терапии опухолей. Биохимия. 2020;85(10):1474-1488. DOI: 10.31857/S0320972520100139
12. Tossetta G, Fantone S, Montanari E, Marzioni D, Goteri G. Role of NRF2 in Ovarian Cancer. Antioxidants (Basel). 2022;11(4):663. doi: 10.3390/antiox11040663.
13. Lepara Z, Alić J, Lepara O, Spahović H, Fajkić A. Antioxidant status in patients with bladder cancer regarding cancer stage and grade. Asian J Urol. 2023;10(2):182-188. doi: 10.1016/j.ajur.2021.12.008.
14. Baseggio AM, Kido LA, Viganó J, Carneiro MJ, Lamas CA, Martínez J, et al. Systemic antioxidant and anti-inflammatory effects of yellow passion fruit bagasse extract during prostate cancer progression. J Food Biochem. 2022;46(3):e13885. doi: 10.1111/jfbc.13885.
15. Alhasawi MAI, Aatif M, Muteeb G, Alam MW, Oirdi ME, Farhan M. Curcumin and Its Derivatives Induce Apoptosis in Human Cancer Cells by Mobilizing and Redox Cycling Genomic Copper Ions. Molecules. 2022;27(21):7410. doi: 10.3390/molecules27217410.
16. Farhan M, Rizvi A, Ahmad A, Aatif M, Alam MW, Hadi SM. Structure of Some Green Tea Catechins and the Availability of Intracellular Copper Influence Their Ability to Cause Selective Oxidative DNA Damage in Malignant Cells. Biomedicines. 2022;10(3):664. doi: 10.3390/biomedicines10030664
17. Farhan M, Rizvi A, Ali F, Ahmad A, Aatif M, Malik A, et al. Pomegranate juice anthocyanidins induce cell death in human cancer cells by mobilizing intracellular copper ions and producing reactive oxygen species. Front Oncol. 2022;12:998346. doi: 10.3389/fonc.2022.998346.
18. Wang Y, Jia X, An S, Yin W, Huang J, Jiang X. Nanozyme-Based Regulation of Cellular Metabolism and their Applications. Adv Mater. 2023:e2301810. doi: 10.1002/adma.202301810.
19. Singh N, Sherin GR, Mugesh G. Antioxidant and Prooxidant Nanozymes: From Cellular Redox Regulation to Next-Generation Therapeutics. Angew Chem Int Ed Engl. 2023;62(33):e202301232. doi: 10.1002/anie.202301232
20. Zhao J, Guo F, Hou L, Zhao Y, Sun P. Electron transfer-based antioxidant nanozymes: Emerging therapeutics for inflammatory diseases. J Control Release. 2023;355:273-291. doi: 10.1016/j.jconrel.2023.01.068
Об авторах
М. С. Алхусейн-КулягиноваРоссия
Алхусейн–Кулягинова Маргарита Стефановна - ассистент кафедры патологической физиологии.
Ростов–на–Дону
М. А. Додохова
Россия
Додохова Маргарита Авдеевна - кандидат медицинских наук, доцент кафедры патологической физиологии.
Ростов–на–Дону
Н. Д. Власова
Россия
Власова Надежда Дмитриевна - младший научный сотрудник центральной научно-исследовательской лаборатории.
Ростов–на–Дону
Б. Г. Антонян
Россия
Антонян Борис Гагикович - обучающийся лечебно-профилактического факультета.
Ростов–на–Дону
М. Х. Алашева
Россия
Алашева Милана-Мариат Хайдаровна - обучающийся педиатрического факультета.
Ростов–на–Дону
Д. А. Гречина
Россия
Гречина Дарья Александровна - обучающийся лечебно-профилактического факультета.
Ростов–на–Дону
И. В. Васильев
Россия
Васильев Игорь Вячеславович - обучающийся лечебно-профилактического факультета.
Ростов–на–Дону
М. В. Гулян
Россия
Гулян Марина Владимировна - кандидат медицинских наук, доцент кафедры патологической физиологии.
Ростов–на–Дону
И. М. Котиева
Россия
Котиева Инга Мовлиевна - доктор медицинских наук, профессор кафедры патологической физиологии, проректор по научной работе.
Ростов–на–Дону
Рецензия
Для цитирования:
Алхусейн-Кулягинова М.С., Додохова М.А., Власова Н.Д., Антонян Б.Г., Алашева М.Х., Гречина Д.А., Васильев И.В., Гулян М.В., Котиева И.М. Изменение активности маркеров про/антиоксидантной систем ткани печени животных-носителей меланомы В16 при введении бис-(3,5-ди-трет-бутил-4-гидроксифенил)тиолата диметилолова на разных этапах развития опухолевого процесса. Южно-Российский журнал терапевтической практики. 2023;4(3):70-75. https://doi.org/10.21886/2712-8156-2023-4-3-70-75
For citation:
Alkhusein-Kulyaginova M.S., Dodokhova M.A., Vlasova N.D., Antonyan B.G., Alasheva M.H., Grechina D.A., Vasiliev I.V., Gulyan M.V., Kotieva I.M. Changes in the activity of markers of pro/antioxidant systems of liver tissue of animals carrying melanoma B16 with the introduction of dimethyltin bis(3,5-di-tert-butyl-4-hydroxyphenylthiolate) (Me-3) at different stages of the development of the tumor process. South Russian Journal of Therapeutic Practice. 2023;4(3):70-75. (In Russ.) https://doi.org/10.21886/2712-8156-2023-4-3-70-75
JATS XML


























