Перейти к:
Апикальная гипертрофическая кардиомиопатия
https://doi.org/10.21886/2712-8156-2024-5-2-6-16
Аннотация
Обзор посвящёен апикальной гипертрофической кардиомиопатии (ГКМП), представляющей относительно редкий её фенотип. Ранее считалось, что апикальная ГКМП имеет благоприятный прогноз, но недавние исследования продемонстрировали повышенный риск развития фатальных аритмий и внезапной сердечной смерти, особенно среди пожилых пациентов, женщин и имеющих сопутствующиеую патологиию, такиеую как артериальнаяую гипертензияю и сахарный диабет. Апикальная ГКМП чаще регистрируется в странах Азии, хотя тяжёелое течение и неблагоприятные исходы нередко наблюдаются у пациентов стран Европы и Северной Америки. Данный фенотип характеризуется гипертрофией миокарда верхушки сердца, что приводит к уменьшению полости левого желудочка, снижению ударного объёма и диастолической дисфункции. Больные с апикальной ГКМП обычно предъявляют жалобы на боль в грудной клетке, одышку и сердцебиение. Диагноз основывается на данных различных методов исследования, среди которых решающее значение отводится методам визуализации, таким как эхокардиография и магнитно-резонансная томография сердца. Для апикальной ГКМП характерным признаком считается выявление конфигурации полости левого желудочка в конце систолы по типу карточной масти «пики». Лечение включает фармакотерапию с использованием β-адреноблокаторов, блокаторов кальциевых каналов, ингибиторов кардиального миозина и хирургические вмешательства. Недостаточность информации о неблагоприятных прогностических факторах, отсутствие специфических клинических данных и сложности инструментальной диагностики подчеркивают актуальность изучения проблемы апикальной ГКМП.
Ключевые слова
Для цитирования:
Тарадин Г.Г., Игнатенко Г.А., Куглер Т.Е., Марушкин Н.С., Ефанов К.И. Апикальная гипертрофическая кардиомиопатия. Южно-Российский журнал терапевтической практики. 2024;5(2):6-16. https://doi.org/10.21886/2712-8156-2024-5-2-6-16
For citation:
Taradin G.G., Ignatenko G.A., Kugler T.E., Marushkin N.S., Yefanov K.I. Apical hypertrophic cardiomyopathy. South Russian Journal of Therapeutic Practice. 2024;5(2):6-16. (In Russ.) https://doi.org/10.21886/2712-8156-2024-5-2-6-16
Введение
Гипертрофическая кардиомиопатия (ГКМП) — генетически обусловленное заболевание миокарда, характеризующееся гипертрофией миокарда левого желудочка (ЛЖ) и/или правого желудочка (ПЖ) чаще асимметрического характера за счёт утолщения межжелудочковой перегородки (МЖП), что не может объясняться исключительно повышением нагрузки давлением, и возникающее при отсутствии другого сердечного или системного заболевания, метаболического или полиорганного синдрома, связанного с гипертрофией ЛЖ (ГЛЖ) [1–3].
ГКМП характеризуется различными фенотипами гипертрофической экспрессии [3–5], одним из которых является апикальная ГКМП (АГКМП) или синдром Yamaguchi. При АГКМП гипертрофия охватывает миокард верхушки ЛЖ, при этом уменьшается полость ЛЖ с формированием её по типу карточной масти «пики», по данным визуализационных методов исследования [6]. Данный фенотип, как правило, не сопровождается обструкцией выносящего тракта ЛЖ (ВТЛЖ) и ассоциируется с риском развития миокардиального фиброза, верхушечных аневризм и апикального тромбоза [4][7][8]. Своевременная диагностика АГКМП затруднена в виду недостаточной осведомлённости врачей, неспецифических клинических проявлений и нередко неинформативностью данных трансторакальной эхокардиографии (ЭхоКГ) [7][9]. В отечественной литературе имеются единичные публикации, посвящённые АГКМП, описывающие в основном клинические случаи [7][10][11]. Целью обзора является освещение вопросов эпидемиологии, патогенеза, клиники, диагностики, стратификации риска и лечения АГКМП.
Эпидемиология
Наиболее часто АГКМП регистрируется в странах Восточной Азии, на которую приходится 35–40 % случаев ГКМП. Считается, что этот фенотип менее распространён в странах Европы и Северной Америки: у 3–10 % больных ГКМП [7][12][13]. По нашим данным, полученным при ЭхоКГ-исследовании 295 пациентов с ГКМП, апикальный фенотип встречался в 9 случаях (3,1 %) [4]. АГКМП чаще наблюдается у мужчин, чем у женщин (в соотношении от 1,6 до 2,8:1), и, как правило, диагностируется в среднем возрасте [14]. В нашем исследовании соотношение мужчин к женщинам с АГКМП составило 2,33:1.
Генетические изменения ГКМП
ГКМП — заболевание, наследуемое по аутосомно-доминантному типу с широкой возрастной пенетрантностью. На сегодняшний день зарегистрировано более 1500 мутаций в более чем 15 генах, кодирующих функциональные и структурные белки саркомера [15]. Наиболее распространёнными являются мутации генов тяжёлой цепи β-миозина (MYH7) и миозин-связывающего белка С (MYBPC3), которые определяют до 70 % наследственных мутаций, выявляемых при ГКМП [16].
Генетические анализы, основанные на исследованиях небольшой популяции с АГКМП, выявили склонность к мутациям ACTC1, однако в самой крупной на сегодняшний день когорте пациентов с генетическим тестированием на ГКМП, апикальная форма чаще всего ассоциировалась с мутациями в MYBPC3 и MYH7 (по 33 %), что характерно для пациентов с ГКМП в целом [14].
При выявлении ГКМП рекомендуют проводить генетический анализ у пациента и родственников первой линии. Лица с положительным результатом генетического тестирования, но без структурных изменений сердца, нуждаются в постоянном мониторинге, который включает электрокардиографический и ЭхоКГ-скрининг каждые 3–4 года для взрослых и каждые 12–18 месяцев — для детей. Лица с отрицательным результатом не требуют дальнейшего наблюдения [17][18].
Патофизиологические особенности
Морфологические и функциональные изменения, связанные с АГКМП, приводят к сложным взаимосвязанным патофизиологическим событиям (рис. 1).
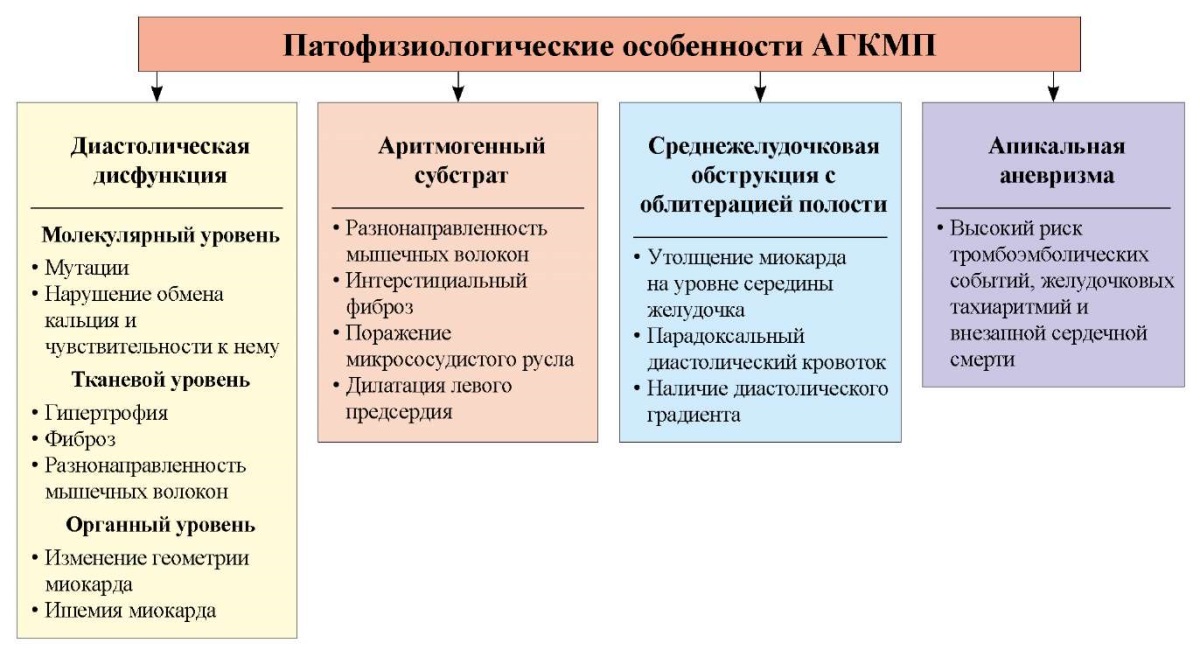
Рисунок 1. Патофизиологические особенности апикальной гипертрофической кардиомиопатии (АГКМП) (адаптировано из M.F. Jan et al. [18]). АГКМП — апикальная гипертрофическая кардиомиопатия.
Figure 1. Pathophysiological features of apical hypertrophic cardiomyopathy (adapted from M.F. Jan et al. [18]).
Как правило, для АГКМП не характерны обструкция ВТЛЖ и митральная регургитация. Утолщение стенок верхушки ЛЖ приводит к уменьшению диастолического объёма ЛЖ и, как следствие, к уменьшению сердечного выброса, что обусловливает снижение толерантности к физической нагрузке и появление одышки. ГЛЖ приводит к ишемии миокарда наряду с формированием интерстициального фиброза, ответственного за увеличение жёсткости миокарда. Отмеченные изменения в ЛЖ приводят к диастолической дисфункции, помимо повышения давления наполнения ЛЖ. Изменение давления наполнения ЛЖ может привести к дилатации левого предсердия (ЛП), что увеличивает риск возникновения фибрилляции предсердий. Увеличение толщины апикальных стенок может создавать градиент давления на уровне середины ЛЖ, способствуя формированию характерной для АГКМП апикальной аневризмы [13][19].
Значения фракции выброса (ФВ) ЛЖ как основного параметра глобальной систолической функции обычно нормальные или повышенные. Регионарные нарушения движения апикальных сегментов ЛЖ характеризуются гипокинезом, акинезом и даже дискинезом особенно при наличии апикальных аневризм [18]. Кроме того, отмечается значительное снижение апикальной ротации и скручивания ЛЖ с утратой раннего диастолического присасывающего эффекта. Среднежелудочковая обструкция (СЖО) наряду с облитерацией полости ЛЖ являются уникальными феноменами, характерными для АГКМП. В тяжёлых случаях облитерация полости продолжается в фазу диастолы и ассоциируется с появлением парадоксального диастолического тока (ПДТ), апикальных аневризм и худшим прогнозом [18][20]. ПДТ при АГКМП обусловлен внутрижелудочковым градиентом и выглядит как струя, ориентированная от верхушки к основанию ЛЖ, во время фазы раннего диастолического наполнения. Полагают, что наличие ПДТ сопряжено с повышенным риском системных эмболий, нарушением миокардиальной перфузии и желудочковыми аритмиями, чем просто облитерация полости ЛЖ [18].
В патогенезе формирования апикальной аневризмы принято выделять несколько стадий. В первую стадию происходит облитерация апикальной части полости ЛЖ в систолу за счёт гипертрофии стенок миокарда. В дальнейшем апикальная щель расширяется в систолу, что обусловлено с одной стороны проксимальной обструкцией гипертрофированных сегментов, с другой — снижением сократимости дистальных отделов гипертрофированного миокарда. И наконец, в третью стадию отмечается трансформация апикальной щели в выпячивание, что в конечном итоге приводит к развитию апикальной аневризмы [14]. Апикальная аневризма формируется более 10 лет и приводит к ухудшению клинического течения заболевания, обусловленного ПДТ [21].
Клинические проявления
К наиболее распространённым клиническим симптомам АГКМП следует отнести боль в груди, одышку при нагрузке, учащенное сердцебиение, обмороки, общую слабость. Эти жалобы связаны с такими факторами как сужение просвета интрамиокардиальных артерий, уменьшение количества капилляров и прохождение коронарных артерий в толще миокарда (coronary artery bridging) [22]. Ишемия миокарда при АГКМП может наступать без признаков атеросклеротического поражения коронарных артерий, что обусловлено микрососудистым поражением. В ретроспективном исследовании, включавшем 208 пациентов с АГКМП, дискомфорт или боль в грудной клетке отмечались у 91,8 % пациентов, учащенное сердцебиение — у 30,8 %, одышка при физической нагрузке — у 10,6 %, предобмороки/обмороки — у 7,2 % [23].
Как для больных с ГКМП в целом, так и для её апикального фенотипа наиболее опасными осложнениями являются тромбоэмболические события, желудочковые тахиаритмии и внезапная сердечная смерть (ВСС) [24]. Жизнеугрожающие осложнения АГКМП развиваются приблизительно у трети пациентов, в связи с чем, своевременная диагностика играет важную роль в тактике ведения таких больных [25].
Диагностика
Данные объективного осмотра пациента, пальпации, перкуссии обычно не позволяют заподозрить АГКМП. При аускультации может выслушиваться для АГКМП четвёртый тон, который отражает нарушение диастолической релаксации [12][25].
Электрокардиография. Электрокардиографической особенностью АГКМП являются вольтажные признаки ГЛЖ с гигантскими отрицательными зубцами Т (≥10 мм), особенно в левых грудных отведениях. По данным исследований, примерно у 90 % больных АГКМП обнаруживаются отрицательные зубцы Т, при этом гигантские зубцы Т в 11–47% случаев [26][27]. Считается, что степень инверсии зубца Т коррелирует с выраженностью апикальной гипертрофии [28]. L. Kang et al. [26] обнаружили гигантские отрицательные Т за несколько лет до обнаружения гипертрофии в апикальной области. Авторы полагают, что применительно к АГКМП электрофизиологические изменения возникают задолго до гипертрофического ремоделирования миокарда.
Имеются данные, свидетельствующие об удлинении сегмента QT у пациентов с АГКМП и верхушечными аневризмами. Таким пациентам следует с большой осторожностью назначать препараты, влияющие на продолжительность QT и скорость проведения возбуждения из-за вероятности развития аритмий по типу re-entry [29].
Эхокардиография и допплерография. В современной клинической практике трансторакальная ЭхоКГ является основным методом диагностики АГКМП в силу её информативности, неинвазивности, широкой доступности и низкой стоимости (рис. 2). Комплексное ЭхоКГ-обследование должно включать оценку (1) распространённости и выраженности ГЛЖ; (2) наличия облитерации полости и апикальной аневризмы; (3) обструкции на любом уровне ЛЖ; (4) систолической и диастолической функции; (5) особенностей митрального клапана и папиллярных мышц [30][31].
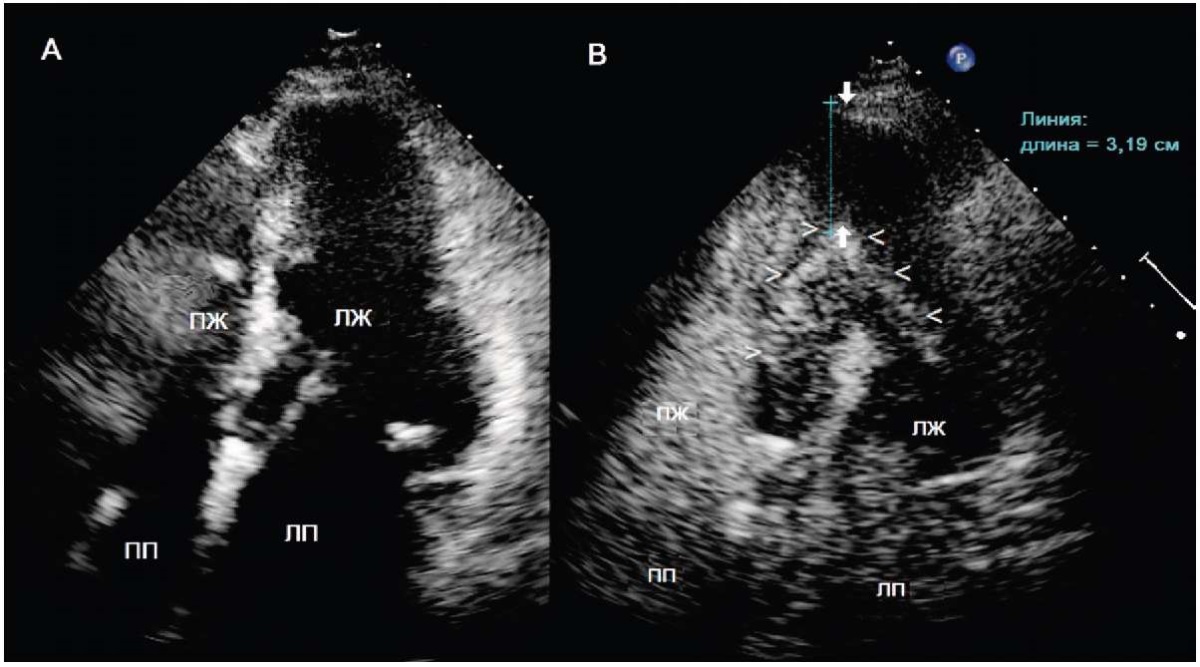
Рисунок 2. Апикальная гипертрофическая кардиомиопатия. А. В области верхушки левого желудочка (ЛЖ) отмечается плохое разграничение эндокарда и полости сердца. В. После введения контрастного вещества четко видны очертания эндокарда верхушки (отмечено стрелками). Выраженная гипертрофия апикальной стенки ЛЖ (толщина 3,19 см). ПЖ — правый желудочек; ПП — правое предсердие; ЛП — левое предсердие. Адаптирован из C. Caiati et al. [9].
Figure 2. Apical hypertrophic cardiomyopathy. A. In the area of the apex of the left ventricle there is poor delineation of the endocardium and the heart cavity. B. After administration of the contrast agent, the outlines of the apical endocardium are clearly visible (marked by arrows). Severe hypertrophy of the apical wall of the left ventricle (thickness 3.19 cm). Adapted from C. Caiati et al. [9].
При ЭхоКГ АГКМ определяется как ГЛЖ, преимущественно ограниченная верхушкой ЛЖ, с максимальной толщиной апикальной стенки ≥15 мм или соотношением максимальной толщины апикальной к заднедиафрагмальной стенке ЛЖ ≥1,3 на конец диастолы, независимо от наличия у исследуемого артериальной гипертензии [32]. Пороговая толщина апикальной стенки может быть понижена до 13–14 мм при наличии других убедительных данных заболевания, таких как семейный анамнез ГКМП и/или позитивные результаты генетического исследования на выявление мутаций [17]. При выполнении ЭхоКГ возможно обнаружение формы ЛЖ по типу карточной масти «пики», патогномоничной для данного фенотипа ГКМП.
Для оценки толщины стенки ЛЖ во время ЭхоКГ-исследования необходимо определить границы эндокарда, особенно апикальной области. Врачи-функционалисты нередко сталкиваются с тем, что эндокардиальная граница в области верхушки ЛЖ не всегда чётко визуализируется, особенно при плохом ЭхоКГ-окне, поскольку в апикальной области ультразвуковой луч ориентирован параллельно эндокарду и недостаточно отражается при переходе зон тканевой плотности [9][11]. Во время сканирования быстрая последовательность кадров может создать ложное впечатление о наличии границы эндокарда. Таким образом, при неадекватной визуализации границ эндокарда и клиническом подозрении на наличие апикальной ГЛЖ, следует провести контрастную ЭхоКГ [9]. L. Yan et al. [23] обнаружили АГКМП по данным магнитно-резонансной томографии (МРТ) сердца в 31,7 % случаев, когда при ранее выполненной ЭхоКГ не удалось выявить апикальную ГЛЖ.
Важным представляется измерение объёма ЛП, так как этот показатель служит не только индикатором диастолической дисфункции, но также независимым прогностическим фактором неблагоприятных сердечно-сосудистых событий и инсульта. Пациенты с увеличенным объёмом ЛП обычно имеют более выраженную ГЛЖ, тяжелую диастолическую дисфункцию и высокое давление наполнения ЛЖ [33].
Необходимо выполнять допплеровскую оценку скоростей и градиентов внутри полости ЛЖ для выявления СЖО, обструкции ВТЛЖ и ПДТ, которые в значительной степени влияют на клинические проявления, течение и прогноз заболевания [34].
Магнитно-резонансная томография сердца. МРТ позволяет выявить АГКМП на раннем этапе [13]. Преимуществом метода является получение ортогональных срезов с полным, неограниченным охватом всего ЛЖ в нескольких плоскостях, что позволяет точно определить локализацию и степень ГЛЖ, наличие апикальной аневризмы [35]. Конфигурация полости ЛЖ в форме карточной «пики» в конце диастолы, которая лучше визуализируется из продольной проекции, указывает на АГКМП [36]. В настоящее время использование МРТ является стандартным методом комплексного обследования пациентов с ГКМП, особенно при подозрении на АГКМП [14].
Использование позднего усиления гадолиния (late gadolinium enhancement, LGE) обеспечивает определение участков фиброза миокарда in vivo, что обнаруживается у 65–80% больных АГКМП [31][37][38]. Считается, что наличие LGE тесно связано с клинической тяжестью и прогрессированием заболевания [37]. K. Yang et al. показали, что пациенты с обширными зонами LGE (≥15 % массы ЛЖ), как правило, имели тенденцию к худшему прогнозу выживаемости по сравнению с пациентами с очагами LGE <15 % (p = 0,071) [38]. МРТ обладает более высокими возможностями в идентификации апикальных аневризм. M. Maron et al. при выполнении ЭхоКГ обнаружили апикальные аневризмы у 16 из 28 пациентов (57 %), в то же время МРТ позволило выявить аневризмы у оставшихся 12 с отрицательными результатами ЭхоКГ [39]. Апикальные аневризмы обычно проявляются в виде участков дискинезии или акинезии тонкостенных участков миокарда верхушки ЛЖ, как правило, с трансмуральным рубцеванием по данным выявления LGE. Кроме того, с помощью МРТ могут быть выявлены верхушечные тромбы, пропущенные при ЭхоКГ [14][18].
Компьютерная томография и ангиография. Компьютерная томография (КТ) сердца, хотя широко и не используется, может рассматриваться для постановки диагноза, если МРТ противопоказана или недоступна. КТ сердца обеспечивает хорошее пространственное разрешение с чётким определением структур сердца [40]. Более того, пациентам с АГКМП с симптомами или признаками ишемии миокарда рекомендуется проведение коронарографии, что позволяет выявить стеноз коронарных артерий. Коронарография обычно проводится пациентам, которым запланирована апикальная миоэктомия и имеющим факторы риска коронарного атеросклероза. При наличии обширной ишемии хирургическая стратегия предусматривает выполнение апикальной миоэктомии в сочетании с аортокоронарным шунтированием [41].
Однофотонная эмиссионная компьютерная томография. Особенности миокардиального кровотока у пациентов с АГКМ могут варьироваться от нормальной перфузии до обратимых или устойчивых дефектов перфузии области верхушки ЛЖ, даже при наличии нормальных эпикардиальных коронарных артерий, что указывает на апикальную ишемию [25][42].
Например, у пациентов с АГКМП отмечается повышенное поглощение в зоне верхушки технеция-99м тетрофосмина при выполнении однофотонной эмиссионной компьютерной томографии (ОФЭКТ) в состоянии покоя [43]. Такой паттерн свечения изотопа на полярных картах (Solar Polar) в покое характеризуется интенсивным ярким пятном точек в апикальной области, окружённым периферическим кругом более тусклого накапливания [44]. В исследовании 20 больных с АГКМП T.F. Cianciulli et al. [45] идентифицировали три характерных паттерна миокардиальной перфузии при проведении ОФЭКТ: повышенный захват изотопа верхушкой, конфигурация полости ЛЖ по типу «пики» и вариант Solar Polar.
Сывороточные биомаркеры. При ГКМП могут повышаться тропонины сыворотки крови, однако их уровень обычно не достигает значений, характерных для острого повреждения миокарда. Частота повышения высокочувствительного тропонина-T имела различия между фенотипами ГКМП: в 14% случаев при АГКМП, в 47% при необструктивной и в 57% при обструктивной ГКМП. При рассмотрении всех фенотипов ГКМП уровни высокочувствительного тропонина-Т коррелировали с возрастом, площадью ЛП и максимальной толщиной стенки ЛЖ [46].
Лечение
Медикаментозная терапия. При отсутствии крупных рандомизированных исследований лечение больных с АГКМП в основном предполагает терапию «классической» ГКМП для улучшения самочувствия, функционального состояния, уменьшения выраженности симптомов и превентирования прогрессирования заболевания [14]. Рекомендуется назначение β-адреноблокаторов (β-АБ) в качестве препаратов первой линии. Их применение позволяет (1) снизить частоту сердечных сокращений; (2) улучшить диастолическую функцию; (3) уменьшить дискомфорт в груди и одышку за счёт снижения потребности миокарда в кислороде; (4) уменьшить значение градиента при СЖО и (5) выраженность нарушений ритма сердца [14][47]. Обычно предпочтение отдаётся β-АБ без вазодилатирующего эффекта во избежание нарастания градиента при СЖО.
В случае непереносимости или противопоказаний β-АБ, препаратами второй линии являются недигидропиридиновые блокаторы кальциевых каналов [48]. Действие верапамила и дилтиазема опосредовано их отрицательными инотропным и хронотропным эффектами, что приводит к уменьшению боли в груди, увеличению времени диастолического наполнения ЛЖ и улучшению миокардиальной перфузии.
Подходы, нацеленные на антифибротический и антигипертрофический эффекты благодаря влиянию на ренин–ангиотензин–альдостероновую систему (РААС), предоставляют дополнительные возможности лечения АГКМП. Предполагается, что ингибирование РААС благоприятно влияет на выраженность симптомов и показатели смертности, поэтому пациентам с хронической сердечной недостаточностью и сниженной ФВ ЛЖ рекомендуется лечение ингибиторами ангиотензин-превращающего фермента или блокаторами рецепторов ангиотензина II [47][49].
Низкие дозы петлевых или тиазидных диуретиков могут быть использованы для уменьшения как выраженности одышки, так и перегрузки объёмом у пациентов с АГКМП. Для предотвращения гиповолемии, артериальной гипотензии и нарастания обструкции диуретики следует применять с осторожностью [14].
В последние годы активный интерес адресован группе ингибиторов кардиального миозина — мавакамтену и афикамтену. Механизм действия этих препаратов основан на ингибировании миозиновой АТФ-азы, за счёт чего происходит уменьшение количества «актин-миозин» поперечных мостиков, что приводит к снижению состояния гиперконтрактильности и улучшению энергетической регуляции миокарда [47].
Кроме лечения клинических проявлений, обусловленных выраженной гипертрофией миокарда, гиперконтрактильностью, СЖО и обструкцией ВТЛЖ, необходима терапия сопутствующих состояний, таких как артериальная гипертензия, нарушения ритма, для предотвращения дальнейшей ГЛЖ, а также профилактика тромбоэмболических осложнений [50].
Хирургическое лечение. Если септальная миоэктомия является «золотым стандартом» хирургического лечения ГКМП с обструкцией ВТЛЖ, предпочтительным методом лечения АГКМП является апикальная миоэктомия, эффективность и безопасность которой определяется главным образом опытом кардиохирургов [51]. В соответствии с рекомендациями Американской ассоциации сердца и Американской коллегии кардиологов 2020 г. [2], апикальная миоэктомия может выполняться опытными кардиохирургами в специализированных центрах тщательно отобранным больным с АГКМП, имеющим выраженные симптомы и ограничения в повседневной активности (диастолическая сердечная недостаточность, класс III-IV по NYHA), несмотря на проводимую медикаментозную терапию, с сохранной ФВ и маленькую полость ЛЖ (<50 мл/м²).
При АКГМП верхушка ЛЖ обычно облитерируется гипертрофированным миокардом, а сосочковые мышцы смещаются в апикальном направлении. Миоэктомия направлена на увеличение объёма ЛЖ путём удаления гипертрофированной части миокарда. При выполнении процедуры основное внимание уделяется дистальным (апикальным) отделам МЖП, в то же время удаляется лишь незначительная часть миокарда свободной стенки ЛЖ [52][53].
Гипертрофированные сосочковые мышцы также подлежат удалению с целью дополнительного увеличения объёма полости ЛЖ и снижения риска СЖО [52]. В случаях массивной гипертрофии миокарда и для достижения оптимального доступа к сосочковым мышцам, хордам и митральному клапану может потребоваться комбинированный доступ (трансапикальный с трансаортальным) [51]. Выполнение расширенной миоэктомии позволяет добиться оптимальных значений объёма полости ЛЖ и, соответственно, ударного объёма [51][53].
Свой собственный опыт и обобщенные результаты апикальной миоэктомии в лечении больных с АГКМП представлены в работе новосибирских коллег A. Afanasyev et al. [53].
Дополнительные меры ведения пациентов с АГКМП включают установку имплантируемого кардиовертера-дефибриллятора (ИКД) для первичной профилактики ВСС у пациентов высокого риска [14]. M.S. Maron и соавт. [54] предложили новые критерии высокого сердечно-сосудистого риска для пациентов с ГКМП, которые включают систолическую дисфункцию (ФВ <50 %), LGE ≥15 % массы ЛЖ, по данным МРТ, и апикальную аневризму ЛЖ любого размера. Такая стратификация риска представляется более чувствительной, чем Европейские рекомендации 2014 г. [1], в прогнозировании ВСС у пациентов с АГКМП.
Современные факторы риска ВСС, полученные при изучении анамнеза заболевания и семейного анамнеза, а также по данным инструментальных методов исследования (включая холтеровское мониторирование ЭКГ, ЭхоКГ и МРТ), могут использоваться для оценки уровня риска и определения когорты пациентов, которым показаны ИКД для первичной профилактики ВСС (табл.) [14]. Установку ИКД следует обсуждать пациентам с АГКМП, имеющим ≥ 1 основной фактор риска ВСС.
Таблица
Основные факторы риска внезапной сердечной смерти
у пациентов с апикальной гипертрофической кардиомиопатией
Major risk factors for sudden cardiac death
in patients with apical hypertrophic cardiomyopathy
Основные факторы риска | Описание |
Наличие ВСС в семейном анамнезе | ≥1 случаев ВСС у близкого родственника младше 50 лет, связанных с ГКМП |
Выраженная ГЛЖ | Наличие максимальной толщины любого сегмента миокарда ЛЖ ≥30 мм, выявленной при ЭхоКГ или МРТ (может учитываться толщина ≥28 мм) |
Необъяснимое синкопе | ≥1 необъяснимого эпизода потери сознания нейро-кардиогенной природы |
Неустойчивая желудочковая тахикардия | ≥3 последовательных желудочковых сокращений со скоростью ≥120 уд/мин в течение <30 сек. во время амбулаторной ЭКГ, особенно в сочетании с другим фактором риска, например, LGE |
Систолическая дисфункция ЛЖ | ФВ <50 % по данным ЭхоКГ или МРТ |
Обширное LGE | Диффузное и обширное LGE, отражающее миокардиальный фиброз, с охватом ≥15 % массы ЛЖ (количественно или путем визуальной оценки) |
Апикальная аневризма ЛЖ | Дискретный, тонкостенный, дискинетический/акинетический сегмент самой дистальной части ЛЖ, независимо от размера, с соответствующим прилегающим региональным рубцеванием |
Примечания: ВСС — внезапная сердечная смерть, ГКМП — гипертрофическая кардиомиопатия, ГЛЖ — гипертрофия левого желудочка, ЛЖ — левый желудочек, ЭхоКГ — эхокардиография, МРТ — магнитно-резонансная томография, ЭКГ — электрокардиограмма, ФВ — фракция выброса, LGE — позднее усиление гадолиния (late gadolinium enhancement) (адаптировано из J. Li et al. [14]).
В случае прогрессирования симптомов и ухудшения качества жизни пациента, несмотря на проводимую терапию, необходимо рассмотреть трансплантацию сердца.
Заключение
АГКМП имеет свои патофизиологические особенности, что определяет дифференцированные подходы к диагностике и лечению. Представление об АГКМП, как заболевании с благоприятным долгосрочным прогнозом, претерпело в последнее время изменения с установлением повышенного риска развития фатальных аритмий и ВСС, особенно среди пожилых пациентов и женщин.
Хотя АГКМП встречается относительно редко, пациентам с неспецифическими симптомами, такими как боль в грудной клетке, одышка при физической нагрузке или обморок, следует проводить всестороннее обследование на предмет АГКМП, особенно если в семейном анамнезе имеются эпизоды остановки сердца, ВСС или ГКМП. Для подтверждения диагноза требуется проведение ЭхоКГ, включая контрастный режим, и МРТ сердца.
Пациенты с АГКМП должны пройти оценку риска ВСС и обсуждение необходимости установки ИКД. При отсутствии крупных рандомизированных исследований, терапия пациентов с АГКМП в значительной степени основана на общих подходах лечения ГКМП с целью уменьшения выраженности симптомов, предотвращения осложнений и прогрессирования заболевания. Среди хирургических методов лечения АГКМП предпочтение отдаётся апикальной миоэктомии, выполняемой в специализированных центрах опытными кардиохирургами.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Elliott PM, Anastasakis A, Borger MA, Borggrefe M, Cecchi F, Charron P, et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy. European Heart Journal. 2014;35(39):2733-2779. DOI: 10.1093/eurheartj/ehu284
2. Ommen SR, Mital S, Burke MA, Day SM, Deswal A, Elliott P, et al. 2020 AHA/ACC guideline for the diagnosis and treatment of patients with hypertrophic cardiomyopathy. Circulation. 2020;142(25):e533-e557. DOI: 10.1161/CIR.0000000000000938
3. Габрусенко С. А., Гудкова А. Я., Козиолова Н. А., Александрова С. А., Берсенева М. И., Гордеев М. Л., и др. Гипертрофическая кардиомиопатия. Клинические рекомендации. РКЖ. 2021; 26(5):4541. DOI: 10.15829/1560-4071-2021-4541
4. Игнатенко Г.А., Тарадин Г.Г., Куглер Т.Е. Особенности гипертрофии левого желудочка и характеристика фенотипических вариантов у больных гипертрофической кардиомиопатией. Архивъ внутренней медицины. 2023;13(4):282-293. DOI: 10.20514/2226-6704-2023-13-4-282-293
5. Parato VM, Antoncecchi V, Sozzi F, Marazia S, Zito A, Maiello M, et al. Echocardiographic diagnosis of the different phenotypes of hypertrophic cardiomyopathy. Cardiovasc Ultrasound. 2016;14(1):30. DOI: 10.1186/s12947-016-0072-5.
6. Стрельцова А.А., Гудкова А.Я. Апикальная гипертрофическая кардиомиопатия: современные представления о распространенности, клинической картине, диагностике и лечении (обзор литературы). Учёные записки Первого Санкт-Петербургского государственного медицинского университета имени академика И. П. Павлова. 2021;28(1):17-22. DOI: 10.24884/1607-4181-2021-28-1-17-22
7. Гончарова Д.Ю., Бикбаева Г.Р., Тухбатова А.А., Муллова И.С., Дупляков Д.В. Апикальная гипертрофическая кардиомиопатия как маска острого коронарного синдрома. Клинические наблюдения. Российский кардиологический журнал. 2022;27(4S):5262. DOI: 10.15829/1560-4071-2022-5262
8. Raza N, Burnette S, Joolhar FS, Ghandforoush A, Win TT. A giant left intraventricular thrombus associated with apical hypertrophic cardiomyopathy mimics cancer. Cureus. 2021 Jun 9;13(6):e15554. DOI: 10.7759/cureus.15554.
9. Caiati C, Stanca A, Lepera ME. Case report: Diagnosis of apical hypertrophic cardiomyopathy that escaped clinical and echocardiographic investigations for twenty years: Reasons and clinical implications. Front Cardiovasc Med. 2023 Apr 24;10:1157599. DOI: 10.3389/fcvm.2023.1157599.
10. Скопецкая С.А., Леонтьева Т.В., Мусуривская Т.В., Серебрянникова О.С. Диагностика и лечение апикальной гипертрофической кардиомиопатии левого желудочка. Кардиология. 2022;62(2):42–46. DOI: 10.18087/cardio.2022.2.n1590
11. Чанахчян Ф.Н., Гуляев Н.И., Сливинский Д.В., Клочкова И.В., Шутова Е.В., Демченкова А.Ю. Мультимодальная визуализация в диагностике апикальной гипертрофической кардиомиопатии: клинический случай. Лучевая диагностика и терапия. 2023; 14(3):93–98. DOI: 10.22328/2079-5343-2023-14-3-93-98.
12. Huang G, Fadl SA, Sukhotski S, Matesan M. Apical variant hypertrophic cardiomyopathy “multimodality imaging evaluation”. Int J Cardiovasc Imaging. 2020;36(3):553-561. DOI: 10.1007/s10554-019-01739-x
13. Hughes RK, Knott KD, Malcolmson J, Augusto JB, Mohiddin SA, Kellman P, et al. 2020 Apical hypertrophic cardiomyopathy: the variant less known. J Am Heart Assoc. 2020;9(5):e015294. DOI: 10.1161/JAHA.119.01529414.
14. Li J., Fang J., Liu Y., Wei X. Apical hypertrophic cardiomyopathy: pathophysiology, diagnosis and management. Clin Res Cardiol. 2024;113(5):680-693. DOI: 10.1007/s00392-023-02328-8 Clin Res Cardiol. 2023 Nov 20. doi: 10.1007/s00392-023-02328-8.
15. Teekakirikul P, Zhu W, Huang HC, Fung E. hypertrophic cardiomyopathy: an overview of genetics and management. Biomolecules. 2019 Dec 16;9(12):878. DOI: 10.3390/biom9120878.
16. Viswanathan SK, Sanders HK, McNamara JW, Jagadeesan A, Jahangir A, Tajik AJ, et al. Hypertrophic cardiomyopathy clinical phenotype is independent of gene mutation and mutation dosage. PLoS One. 2017;12(11):e0187948. DOI: 10.1371/journal.pone.0187948
17. Gersh B.J., Maron B.J., Bonow R.O., Dearani J.A., Fifer M.A., Link M.S., et al. 2011 ACCF/AHA Guideline for the diagnosis and treatment of hypertrophic cardiomyopathy. J Am Coll Cardiol. 2011; 58(25): e212-e260. DOI: 10.1016/j.jacc.2011.06.011
18. Jan MF, Todaro MC, Oreto L, Tajik AJ. Apical hypertrophic cardiomyopathy: Present status. Int J Cardiol. 2016;222:745-759. DOI: 10.1016/j.ijcard.2016.07.154
19. Paluszkiewicz J, Krasinska B, Milting H, Gummert J, Pyda M. Apical hypertrophic cardiomyopathy: diagnosis, medical and surgical treatment. Kardiochir Torakochirurgia Pol. 2018;15(4):246-253. DOI: 10.5114/kitp.2018.80922
20. Hughes RK, Knott KD, Malcolmson J, Augusto JB, Kellman P, Moon JC, Captur Get al. Advanced imaging insights in apical hypertrophic cardiomyopathy. JACC Cardiovasc Imaging. 2020 Feb;13(2 Pt 2):624-630. DOI: 10.1016/j.jcmg.2019.09.010.
21. Ünlü S, Özden Tok Ö, Avcı Demir F, Papadopoulos K, Monaghan MJ. Differential diagnosis of apical hypertrophic cardiomyopathy and apical displacement of the papillary muscles: a multimodality imaging point of view. Echocardiography. 2021;38(1):103-113. DOI: 10.1111/echo.14895
22. Foucault A, Hilpert L, Hédoire F, Saloux E, Gomes S, Pellissier A, et al. Apical aneurysm and myocardial bridging in a patient with hypertrophic cardiomyopathy: association or consequence of the myocardial bridging? Cardiol J. 2012;19(6):643-645. DOI: 10.5603/cj.2012.0119.
23. Yan L, Wang Z, Xu Z, Li Y, Tao Y, Fan C. Two hundred eight patients with apical hypertrophic cardiomyopathy in China: clinical feature, prognosis, and comparison of pure and mixed forms. Clin Cardiol. 2012 Feb;35(2):101-106. DOI: 10.1002/clc.20995.
24. Maron BJ, Desai MY, Nishimura RA, Spirito P, Rakowski H, Towbin JA, et al. Management of hypertrophic cardiomyopathy: JACC State-of-the-Art Review. J Am Coll Cardiol. 2022 Feb 1;79(4):390-414. DOI: 10.1016/j.jacc.2021.11.021.
25. Huang W, Guan L, Liu L, Mu Y. Apical hypertrophic cardiomyopathy with apical endomyocardial fibrosis and calcification: Two case reports. Medicine (Baltimore). 2019;98(27):e16183. DOI: 10.1097/MD.0000000000016183
26. Kang L, Li YH, Li R, Chu QM. Predicting apical hypertrophic cardiomyopathy using T-wave inversion: Three case reports. World J Clin Cases. 2023 Sep 6;11(25):5970-5976. DOI: 10.12998/wjcc.v11.i25.5970.
27. Klarich KW, Attenhofer Jost CH, Binder J, Connolly HM, Scott CG, Freeman WK et al. Risk of death in long-term follow-up of patients with apical hypertrophic cardiomyopathy. Am J Cardiol. 2013 Jun 15;111(12):1784-1791. DOI: 10.1016/j.amjcard.2013.02.040.
28. Khanna S, Sreedharan R, Maheshwari K, Ruetzler K. Giant T-wave Inversions in Apical Hypertrophic Cardiomyopathy. Anesthesiology. 2019;131(2):398-399. DOI: 10.1097/ALN.0000000000002732
29. Sanghvi NK, Tracy CM. Sustained ventricular tachycardia in apical hypertrophic cardiomyopathy, midcavitary obstruction, and apical aneurysm. Pacing Clin Electrophysiol. 2007;30(6):799-803. DOI: 10.1111/j.1540-8159.2007.00753.x
30. Nagueh SF, Phelan D, Abraham T, Armour A, Desai MY, Dragulescu A et al. Recommendations for multimodality cardiovascular imaging of patients with hypertrophic cardiomyopathy. J Am Soc Echocardiogr. 2022 Jun;35(6):533-569. DOI: 10.1016/j.echo.2022.03.012.
31. Игнатенко Г.А., Тарадин Г.Г., Ракитская И.В. Методы визуализации в диагностике гипертрофической кардиомиопатии. Актуальные проблемы медицины. 2023; 46(4): 351–367. DOI: 10.52575/2687-0940-2023-46-4-351-367
32. Kim E.K., Lee S.C., Hwang J.W., Chang S. A., Park S.J., On Y.K., et al. Differences in apical and non-apical types of hypertrophic cardiomyopathy: a prospective analysis of clinical, echocardiographic, and cardiac magnetic resonance findings and outcome from 350 patients. Eur Heart J Cardiovasc Imaging. 2016;17(6):678-686. DOI: 10.1093/ehjci/jev192
33. Yang H, Woo A, Monakier D, Jamorski M, Fedwick K, Wigle ED, et al. Enlarged left atrial volume in hypertrophic cardiomyopathy: a marker for disease severity. J Am Soc Echocardiogr. 2005;18(10):1074-1082. DOI: 10.1016/j.echo.2005.06.011
34. Nakamura T., Matsubara K., Furukawa K., Azuma A., Sugihara H., Katsume H., et al. Diastolic paradoxic jet flow in patients with hypertrophic cardiomyopathy: evidence of concealed apical asynergy with cavity obliteration. J Am Coll Cardiol. 1992;19(3):516-524. DOI: 10.1016/s0735-1097(10)80264-5
35. Amano Y, Kitamura M, Takano H, Yanagisawa F, Tachi M, Suzuki Y et al. Cardiac MR imaging of hypertrophic cardiomyopathy: techniques, findings, and clinical relevance. Magn Reson Med Sci. 2018;17(2):120–131. DOI: 10.2463/mrms.rev.2017-0145
36. Baxi A.J., Restrepo C.S., Vargas D., Marmol-Velez A., Ocazionez D., Murillo H. Hypertrophic cardiomyopathy from A to Z: genetics, pathophysiology, imaging, and management. Radiographics. 2016;36(2):335-354. DOI: 10.1148/rg.2016150137
37. Yin Y, Hu W, Zhang L, Wu D, Yang C, Ye X. Clinical, echocardiographic and cardiac MRI predictors of outcomes in patients with apical hypertrophic cardiomyopathy. Int J Cardiovasc Imaging. 2022 Mar;38(3):643-651. DOI: 10.1007/s10554-021-02430-w.
38. Yang K, Song YY, Chen XY, Wang JX, Li L, Yin G et al. Apical hypertrophic cardiomyopathy with left ventricular apical aneurysm: prevalence, cardiac magnetic resonance characteristics, and prognosis. Eur Heart J Cardiovasc Imaging. 2020 Dec 1;21(12):1341-1350. DOI: 10.1093/ehjci/jeaa246.
39. Maron MS, Finley JJ, Bos JM, Hauser TH, Manning WJ, Haas TS et al. Prevalence, clinical significance, and natural history of left ventricular apical aneurysms in hypertrophic cardiomyopathy. Circulation. 2008;118(15):1541-9. DOI: 10.1161/CIRCULATIONAHA.108.781401.
40. Narula J, Chandrashekhar Y, Ahmadi A, Abbara S, Berman DS, Blankstein R et al. SCCT 2021 Expert Consensus Document on coronary computed tomographic angiography. J Cardiovasc Comput Tomogr .2021;15(3):192–217. DOI: 10.1016/j.jcct.2020.11.001
41. Mowatt G, Cook JA, Hillis GS, Walker S, Fraser C, Jia X et al. 64-Slice computed tomography angiography in the diagnosis and assessment of coronary artery disease: systematic review and meta-analysis. Heart. 2008; 94(11):1386–1393. DOI: 10.1136/hrt.2008.145292
42. Parisi R., Mirabella F., Secco G.G, Fattori R. Multimodality imaging in apical hypertrophic cardiomyopathy. World J Cardiol. 2014;6(9):916-923. DOI: 10.4330/wjc.v6.i9.916
43. Morishita S., Kondo Y., Nomura M., Miyajima H., Nada T., Ito S., et al. Impaired retention of technetium-99m tetrofosmin in hypertrophic cardiomyopathy. Am J Cardiol. 2001;87(6):743-747. DOI: 10.1016/s0002-9149(00)01494-6
44. Ward R.P., Pokharna H.K., Lang R.M., Williams K.A. Resting "Solar Polar" map pattern and reduced apical flow reserve: characteristics of apical hypertrophic cardiomyopathy on SPECT myocardial perfusion imaging. J Nucl Cardiol. 2003;10(5):506-512. DOI: 10.1016/s1071-3581(03)00455-0
45. Cianciulli TF, Saccheri MC, Masoli OH, Redruello MF, Lax JA, Morita LA, et al. Myocardial perfusion SPECT in the diagnosis of apical hypertrophic cardiomyopathy. J Nucl Cardiol. 2009 May-Jun;16(3):391-395. DOI: 10.1007/s12350-008-9045-x.
46. Jenab Y, Pourjafari M, Darabi F, Boroumand MA, Zoroufian A, Jalali A. Prevalence and determinants of elevated high-sensitivity cardiac troponin T in hypertrophic cardiomyopathy. J Cardiol. 2014 Feb;63(2):140-144. DOI: 10.1016/j.jjcc.2013.07.008.
47. Игнатенко Г.А., Тарадин Г.Г., Кононенко Л.В. Фармакотерапия гипертрофической кардиомиопатии. Южно-Российский журнал терапевтической практики. 2023;4(4):6-13. DOI: 10.21886/2712-8156-2023-4-4-6-13
48. Doctorian T., Mosley W.J., Do B. Apical hypertrophic cardiomyopathy: case report and literature review. Am J Case Rep. 2017 May 12;18:525-528. DOI: 10.12659/ajcr.902774.
49. Force M, McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure: developed by the Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure of the ESC. Eur J Heart Fail. 2016;18(8):891-975. DOI: 10.1002/ejhf.592.
50. Samak M., Fatullayev J., Sabashnikov A., Zeriouh M., Schmack B., Farag M., et al. Cardiac hypertrophy: An introduction to molecular and cellular basis. Medical science monitor basic research. 2016;22:75-79. DOI: 10.12659/MSMBR.900437
51. Saitoh D., Saji M., Takanashi S. Extended myectomy for apical hypertrophic cardiomyopathy: a case report. J Cardiothorac Surg. 2021;16(1):360. DOI: 10.1186/s13019-021-01745-y
52. Kotkar K.D., Said S.M., Schaff H.V. Transapical approach for myectomy in hypertrophic cardiomyopathy. Ann Cardiothorac Surg. 2017;6(4):419-422. DOI: 10.21037/acs.2017.06.02
53. Afanasyev A, Bogachev-Prokophiev A, Zheleznev S, Ovcharov M, Zalesov A, Sharifulin R, et al. Transapical approach to septal myectomy for hypertrophic cardiomyopathy. Life (Basel). 2024 Jan 15;14(1):125. DOI: 10.3390/life14010125.
54. Maron MS, Rowin EJ, Wessler BS, Mooney PJ, Fatima A, Patel P, et al. Enhanced American College of Cardiology/American Heart Association Strategy for prevention of sudden cardiac death in high-risk patients with hypertrophic cardiomyopathy. JAMA Cardiol. 2019 Jul 1;4(7):644-657. DOI: 10.1001/jamacardio.2019.1391.
Об авторах
Г. Г. ТарадинРоссия
Тарадин Геннадий Геннадьевич - кандидат мед.наукк.м.н., доцент, заведующий кафедрой терапии им. проф. А.И. Дядыка.
Донецк
Г. А. Игнатенко
Россия
ректор, кафедра пропедевтики
Игнатенко Григорий Анатольевич, д.м.н., профессор, член-корреспондент НАМНУ, ректор.
Донецк
внутренних болезней, заведующий
Т. Е. Куглер
Россия
Куглер Татьяна Евгеньевна - к.м.н., доцент кафедры терапии им. проф. А.И. Дядыка.
Донецк
Н. С. Марушкин
Россия
Марушкин Никита Сергеевич - врач-ординатор кафедры терапии им. проф. А.И. Дядыка.
Донецк
К. И. Ефанов
Россия
Ефанов Кирилл Игоревич, врач-ординатор кафедры терапии им. проф. А.И. Дядыка.
Донецк
Дополнительные файлы
Рецензия
Для цитирования:
Тарадин Г.Г., Игнатенко Г.А., Куглер Т.Е., Марушкин Н.С., Ефанов К.И. Апикальная гипертрофическая кардиомиопатия. Южно-Российский журнал терапевтической практики. 2024;5(2):6-16. https://doi.org/10.21886/2712-8156-2024-5-2-6-16
For citation:
Taradin G.G., Ignatenko G.A., Kugler T.E., Marushkin N.S., Yefanov K.I. Apical hypertrophic cardiomyopathy. South Russian Journal of Therapeutic Practice. 2024;5(2):6-16. (In Russ.) https://doi.org/10.21886/2712-8156-2024-5-2-6-16
JATS XML


























